El aumento de la supervivencia que se ha logrado con el tratamiento antirretroviral de gran actividad ha permitido a los clínicos y a los investigadores analizar nuevos problemas que surgen a largo plazo en los pacientes con infección por el virus de la inmunodeficiencia humana (VIH). Así como otras complicaciones de origen cardiovascular han sido ampliamente descritas, una de las entidades más complejas y temidas, dado que ensombrece el pronóstico y la calidad de vida de estos enfermos, es la hipertensión arterial pulmonar, cuya patogenia es aún hoy poco conocida.
En este artículo se revisan los aspectos más novedosos en relación a la etiopatogenia, la clínica, el diagnóstico y el tratamiento de esta enfermedad.
The increase in survival that has been achieved with the new treatments in the era of highly active antiretroviral therapy, has enabled clinicians and researchers to analyze issues that emerge in the long term in patients with HIV infection. Although the majority of cardiovascular complications have been widely described, the pathogenesis of pulmonary arterial hypertension is still poorly understood, and is one of the more complex and feared complications as it worsens the prognosis and quality of life of these patients
This article reviews newer aspects related to the aetiology, symptoms, diagnosis and treatment of this disease.
Desde la identificación del virus de la inmunodeficiencia humana (VIH) hace ya más de 20 años, hemos asistido a un gran progreso en la comprensión de la patogénesis y de las consecuencias clínicas de su infección1. Estos avances han permitido el desarrollo de múltiples terapias para la infección por VIH, y han supuesto un importantísimo incremento en la supervivencia de los pacientes infectados, así como una mejoría sustancial de su calidad de vida2. La era de la terapia antirretroviral (TARGA) y el aumento de la supervivencia que se ha logrado con la introducción de estos fármacos han permitido a los clínicos y a los investigadores analizar la aparición de nuevos problemas a largo plazo debidos a la inmunodepresión subclínica y la activación inmune. Este aumento en la supervivencia, unido a un mejor control de las infecciones secundarias a la inmunodepresión, han favorecido la emergencia de otro tipo de complicaciones como las vasculares, que han pasado a cobrar gran importancia en términos de morbimortalidad en estos pacientes3. Así como la propia infección por el virus y probablemente su tratamiento pueden producir, con el tiempo, un riesgo elevado de aparición de enfermedad cardiovascular de origen isquémico, otra complicación cuya patogénesis es aún hoy oscura es la hipertensión arterial pulmonar (HAP)1. Se han descrito otras complicaciones de origen vascular, como los tumores miocárdicos y pericárdicos, la endocarditis trombótica no infecciosa, la miocardiopatía, la aterosclerosis acelerada y la vasculopatía periférica4.
La hipertensión pulmonar (HP) es una enfermedad progresiva cuya definición es hemodinámica: aumento de la presión arterial pulmonar media (PAPm) mayor o igual a 25mmHg en reposo determinada por cateterismo cardiaco derecho5. Por mecanismos aún desconocidos se produce una proliferación celular en la pared de las arterias pulmonares de pequeño calibre, proceso que se denomina remodelado vascular, lo cual reduce la luz de estos vasos y condiciona un aumento de la presión arterial pulmonar y de la resistencia vascular pulmonar, que puede progresar a insuficiencia cardiaca derecha y muerte prematura por fracaso del ventrículo derecho3.
Dentro de las clasificaciones propuestas para agrupar y a la vez diferenciar los distintos tipos de HP, se encuentra la HAP; se trata de una entidad nosológica que hace referencia a un conjunto de procesos que cursan con HP precapilar, que no es debida a enfermedad respiratoria ni tromboembólica. Este es el tipo de HP que se asocia, entre otras patologías, a la infección por VIH.
Aunque es una entidad no muy frecuente, es significativamente más frecuente en los pacientes con infección por VIH que en la población general6,7, con una prevalencia actual estimada de alrededor del 0,46%7. Además, el desarrollo de HP se asocia a un peor pronóstico en los pacientes infectados y a un importante compromiso en su calidad de vida, similar a los efectos de la insuficiencia renal crónica terminal o de la insuficiencia cardiaca. De hecho, varios estudios demuestran que la supervivencia en pacientes con infección por VIH con HAP asociada es menor si se compara con pacientes infectados sin HAP8; dos tercios de las muertes en el primer grupo se producen en relación a la HAP y son secundarias a shock cardiogénico o muerte súbita9.
El diagnóstico de la enfermedad en sus etapas iniciales es difícil, debido fundamentalmente a la escasa especificidad de sus síntomas y signos clínicos así como al bajo índice de sospecha por parte de los clínicos que habitualmente atienden a estos pacientes. Su diagnóstico precoz supone un reto, ya que en la actualidad existen tratamientos que, instaurados de forma óptima en los estadios iniciales, mejoran claramente el pronóstico10. La mayor morbimortalidad que supone la presencia de HAP en pacientes con VIH, junto a esta posibilidad de tratamiento, hace que, como ya señalan algunos autores en otros países como Suiza o Francia7,11, sea necesaria una herramienta de cribado para lograr un diagnóstico precoz. Este hecho es especialmente relevante dado el beneficio que supone la instauración en estos enfermos de las terapias específicas que se han utilizado en la HAP idiopática con prometedores resultados12.
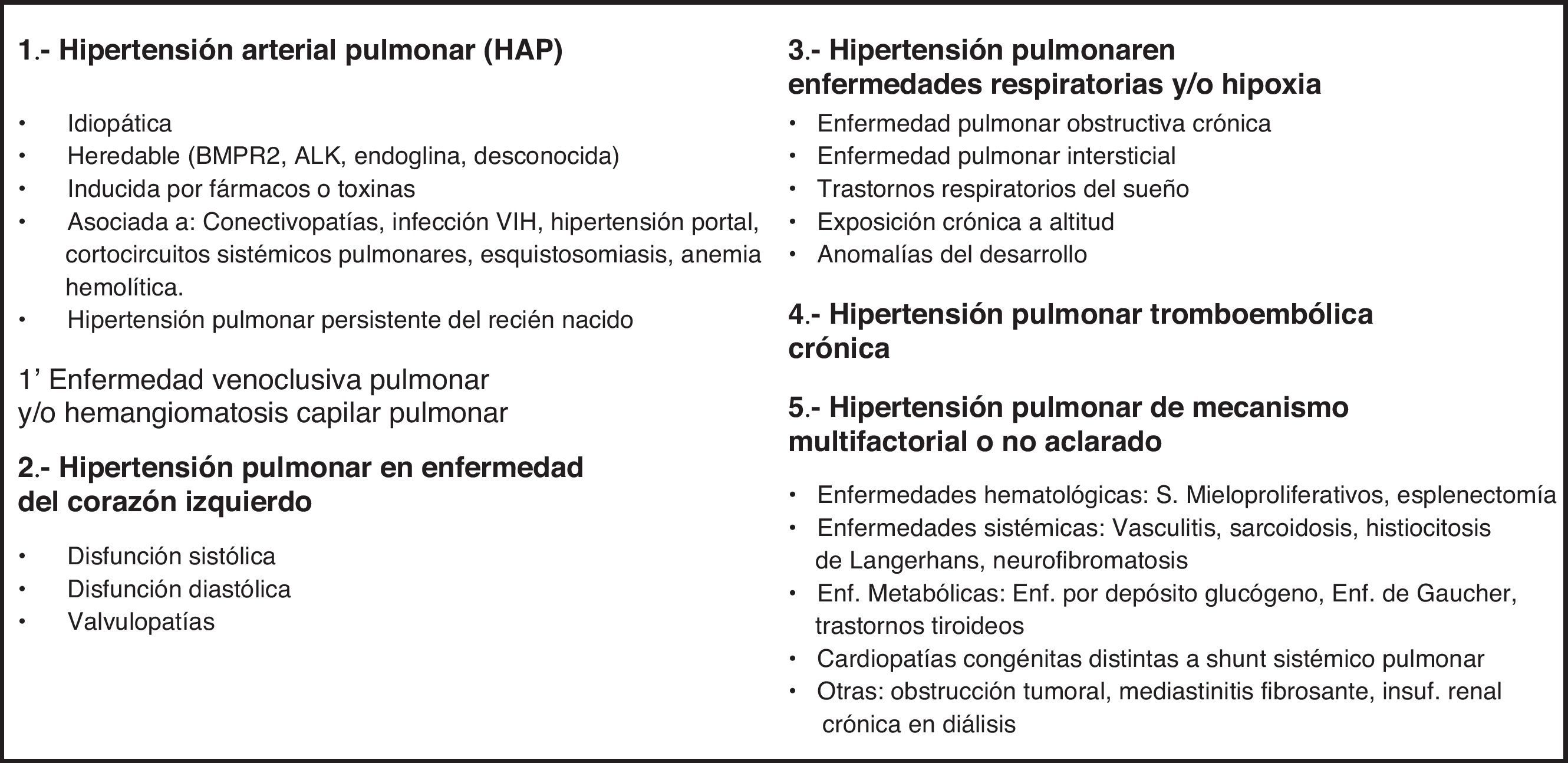
ClasificaciónExisten múltiples enfermedades que se asocian a HP. Estas entidades han sido categorizadas en los diferentes grupos de la clasificación vigente de Dana Point propuesta en 200813 (fig. 1). La clasificación diferencia 5 grupos principales, entre los cuales la HAP se sitúa en el grupo114. La HAP asociada a algunas enfermedades concretas, y por lo tanto fuera del grupo de la idiopática y la familiar, supone el subgrupo más extenso de pacientes e incluye, entre otras, la asociación con la infección por VIH1.
Prevalencia y epidemiologíaLa HAP asociada a la infección por VIH es una entidad poco frecuente. En la era previa a la aparición del TARGA, en el año 1997, la prevalencia de la HAP se estimaba aproximadamente en el 0,5% de los pacientes infectados8. Este dato supone que la prevalencia de la enfermedad es 25 veces superior en pacientes con infección por VIH respecto a la población general no infectada15. En el año 2008 se llevó a cabo el estudio prospectivo con la cohorte más extensa estudiada (7.648 pacientes con infección por VIH), realizado por Sitbon et al.7, que demostró una prevalencia similar del 0,46%, ya en la era moderna de la terapia para el VIH, lo cual sugiere que el TARGA no ha supuesto un impacto significativo en términos de prevención de la HAP asociada a infección por el virus3. Sin embargo, es posible que estos estudios infraestimen la verdadera prevalencia de HAP en la población con VIH, dado que no incluyen los estadios asintomáticos, y esta enfermedad comienza a desarrollarse meses antes de la aparición de sus síntomas típicos y, por tanto, de su diagnóstico.
Respecto a las características epidemiológicas de los pacientes infectados por VIH con HAP, un estudio de revisión reciente del año 2010 realizado por Janda et al.3 analizó un total de 154 casos, 23 cohortes, una serie de casos y 2 estudios caso-control en la literatura publicada hasta la fecha (85 publicaciones). La mayoría de los pacientes (66%) procedían de Estados Unidos y Francia, y las características más importantes de estos sujetos infectados por VIH diagnosticados de HAP fueron las siguientes: la media de edad fue de 35±9,6 años, el 59% eran varones, los principales factores de riesgo para contraer la infección por VIH fueron el uso de drogas por vía parenteral (49%) y la práctica sexual entre varones (21%), la media de recuento de CD4 en el momento del diagnóstico de HAP fue de 252±304 células/μl, el porcentaje de pacientes en estadio de sida al diagnóstico fue del 53%, la infección por el VHB y el VHC estaba presente en el 12 y el 14%, respectivamente, y la media de tiempo entre el diagnóstico de la infección por VIH y el diagnóstico de HAP fue de 4,3±4 años.
Un factor predisponente para la aparición de esta enfermedad es la adquisición del virus mediante el uso de drogas por vía parenteral9,16. Esta práctica ha sido más prevalente como forma de transmisión en España en comparación con otros países europeos. Este dato se correlaciona con los estudios epidemiológicos que recogen una incidencia anual de infección por VIH entre adictos a drogas por vía parenteral (ADVP) mucho mayor en nuestro país que en otros europeos17.
PatogénesisLa causa última de la HAP asociada a la infección por el VIH es incierta. La ausencia de partículas virales en las lesiones plexiformes complejas de estos pacientes indica que una acción indirecta de la infección viral sobre factores de inflamación y crecimiento puede actuar como un desencadenante en un paciente predispuesto7. Por tanto, está claro que existe un papel fundamental del propio virus, pero también parecen jugar un papel clave algunos factores propios del hospedador. El conocimiento de cuál es la contribución relativa de cada uno es complejo, ya que en los pacientes con infección por VIH coexisten otras condiciones que se asocian de forma independiente a la HAP, como el uso de drogas por vía parenteral y la infección por VHC y VHB16,18.
Factores relacionados con el virus de la inmunodeficiencia humanaExiste la hipótesis de que la infección latente por algunos virus puede asociarse a la aparición de HP. Es conocida la asociación del virus de Epstein-Barr con la enfermedad de Hodgkin, así como el parvovirus y el citomegalovirus se asocian también con el síndrome de Sjögren. Ambas enfermedades pueden cursar con HP19. Las partículas virales pueden afectar directamente a la circulación pulmonar obliterando los vasos o, de forma indirecta, produciendo una inflamación mantenida. En el pulmón, el VIH infecta de forma primaria a los macrófagos, por lo que se genera un potencial reservorio para transmitirse a los linfocitos T circulantes, y condiciona también una acumulación de proteínas virales como Nef, Tat y gp120, que pudieran tener un papel directo o indirecto sobre el endotelio vascular pulmonar. La exposición crónica a estos productos virales, así como la deficiencia producida en la regulación de las células T y la producción alterada de quimiocinas y citocinas, podría contribuir a la disfunción vascular pulmonar19.
- •
Nef. El denominado «negative factor» es una proteína que originalmente fue identificada de forma errónea como reguladora negativa para la replicación viral. Desde entonces, ha sido ya reconocida como una molécula crítica en el mantenimiento de las altas cargas virales durante el curso de infección por VIH y como acelerador de la evolución clínica a sida en humanos infectados por el virus así como en macacos Rhesus. Junto a las proteínas Tat y Rev, se expresa de forma cuantiosa durante la infección viral precoz. El Nef participa mediante diferentes vías en el inicio y la persistencia de la infección por VIH, incluyendo el aumento en la virulencia del agente, la disregulación de las moléculas involucradas en la respuesta inmune como el complejo mayor de histocompatibilidad tipo I y los CD4, así como de otras moléculas como Fas y el receptor mediado por apoptosis del TNF20. En el artículo de Voelkel publicado en AIDS en 200821 se recogen distintos estudios realizados en macacos y en humanos que relacionan esta proteína viral con el desarrollo de HP. La hipótesis propuesta que implica a Nef en el desarrollo de la vasculopatía pulmonar sería la siguiente: esta proteína, que tiene la capacidad de entrar dentro de los linfocitos mediante receptor CXCR4, también puede penetrar mediante el mismo receptor en las células endoteliales induciendo la apoptosis en ellas. El inicio de la fagocitosis de estos cuerpos apoptóticos por las células de la vecindad podría iniciar la cascada inflamatoria que incluye una mayor producción de factores de crecimiento y citocinas como el factor de crecimiento vascular endotelial (VEGF), que resultaría en una emergente producción de células endoteliales resistentes a la apoptosis, ocasionando así una proliferación endotelial descontrolada con la subsiguiente selección de estas células resistentes a la apoptosis con un fenotipo angioproliferativo22.
El hecho de que las lesiones vasculares complejas presentes en los pacientes con HAP e HAP asociada a infección por VIH solo se observen en macacos infectados con el virus SIV (similar al VIH) que contienen la proteína quimérica Nef23, junto a la presencia de esta proteína en la lesiones vasculares de pacientes con VIH e HAP, apoya la hipótesis de que la proteína juegue un papel en el desarrollo de la enfermedad arterial pulmonar.
- •
Tat. Esta proteína, denominada factor transactivador del VIH-1, presente en las células infectadas por el VIH e indispensable para la replicación viral, es capaz de interaccionar mediante al menos 3 tipos distintos de receptores con la célula endotelial y produce diferentes tipos de respuesta biológica en el endotelio24. A nivel genético-molecular, se conoce que esta proteína inhibe la expresión del receptor tipoII de la proteína morfogenética ósea (BMPR2), cuya función principal es inducir la apoptosis en varios tipos celulares25. La insuficiente función de BMPR2 produciría un excesivo crecimiento y proliferación de las células endoteliales, lo cual podría contribuir al desarrollo de HP26. A pesar de la plausibilidad de esta teoría, algunos estudios realizados en pacientes con VIH-HAP (una cohorte de 19 pacientes procedentes de Estados Unidos y Francia9 y otra de 50 pacientes27) no han logrado demostrar mutación alguna en el gen que codifica para BMPR2 en ninguno de ellos. Este hecho sugiere que la disregulación de esta proteína en estos casos no esté producida por una mutación, como lo está en los casos de HAP familiar, sino por otros factores como la propia infección viral y la interacción con proteínas propias del virus, como ya se ha señalado.
- •
gp120. Se trata de una proteína de superficie viral que facilita la unión del VIH a los linfocitos CD4. En estudios in vitro se ha comprobado que esta proteína es capaz de estimular la secreción de endotelina-1 (ET-1) por algunas células como los macrófagos1. La ET-1 induce la vasoconstricción y la proliferación de las células musculares lisas del endotelio en pacientes con HAP idiopática, y se ha visto específicamente involucrada también en el desarrollo de la HAP en pacientes con infección por VIH27. Se ha comprobado la existencia de niveles aumentados de ET-1 en monocitos circulantes de estos pacientes infectados, a diferencia de controles sanos en los que no se ha evidenciado la expresión aumentada de esta molécula. Este descubrimiento, junto a otros, apoya la teoría de un papel indirecto del virus mediado por las proteínas virales en la patogénesis de la enfermedad27.
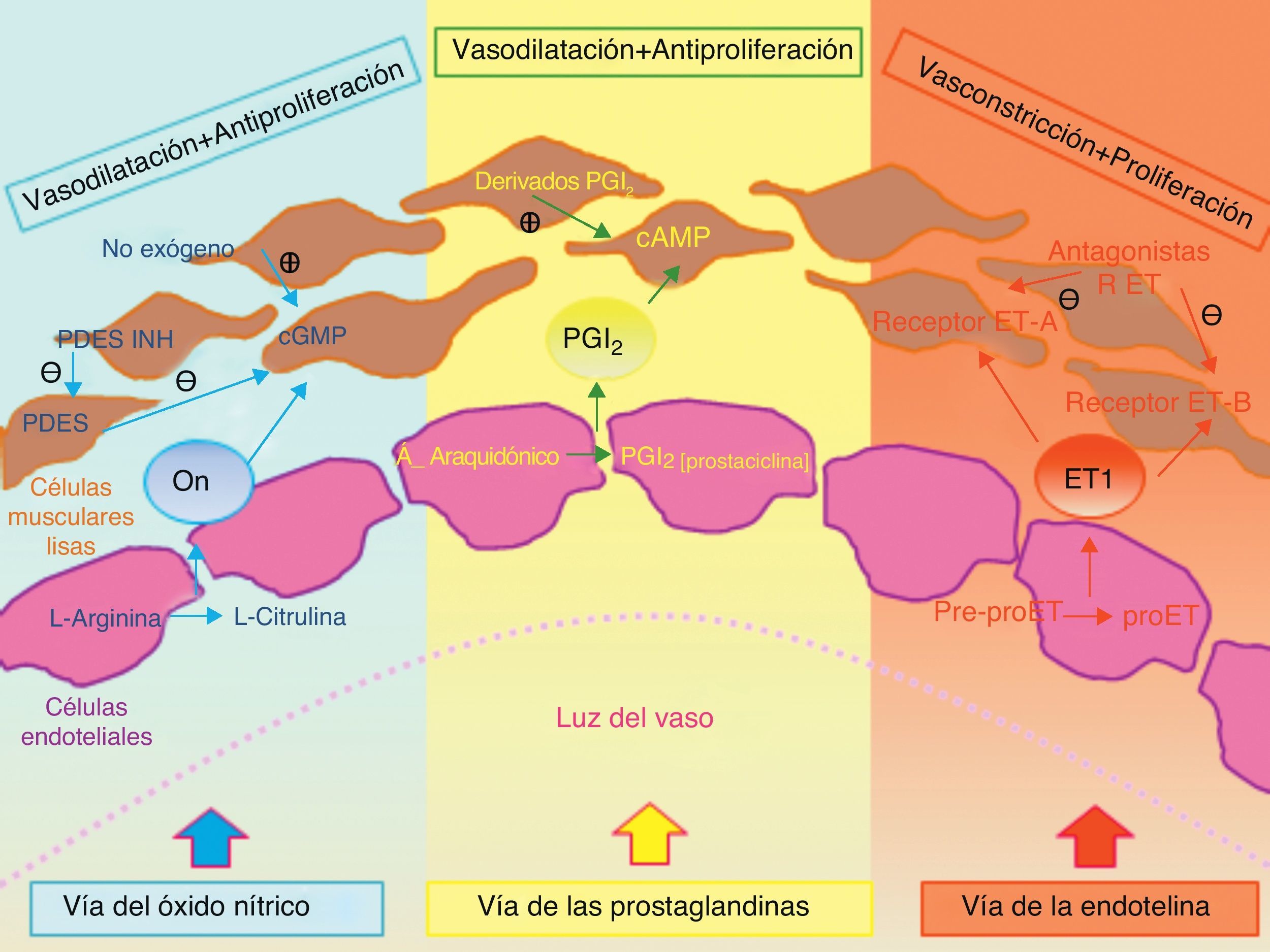
Existen varias y distintas anormalidades en la función vascular pulmonar que se han implicado en la patogénesis de la HP. La participación de ciertos mediadores clave, como son la excesiva producción de la ET-1 y la insuficiente producción de otras como el óxido nítrico y la prostaciclina, ha orientado la investigación al desarrollo de nuevas estrategias terapéuticas dirigidas hacia estos marcadores de disfunción endotelial. Todo ello ha supuesto una mejora importante en el manejo de esta enfermedad28.
Coinfecciones por otros virusAlgunos otros agentes, con frecuencia asociados a la infección por VIH, podrían contribuir a la patogenia de la HP, ya que son causa también de inflamación mantenida en el tiempo en estos enfermos. Sin embargo, se conoce muy poco acerca de la historia natural de cualquier forma de HP relacionada con infección viral y los mecanismos moleculares que están implicados de forma concreta en su patogénesis. Estudios de biología molecular realizados con proteínas virales o con viriones clónicos podrán arrojar más luz en el futuro sobre los potenciales mecanismos moleculares mediante los cuales parece que las proteínas virales inducen la angioproliferación19.
- •
Virus herpes 8 (HHV8). Este virus, conocido por su asociación con el sarcoma de Kaposi y la enfermedad de Castleman multicéntrica, está incuestionablemente ligado a trastornos proliferativos y angioproliferativos29. De hecho, el virus contiene en su material genético algunos genes homólogos a los humanos que participan en la angiogénesis, pero también en la proliferación celular y en mecanismos anti-apoptosis. Existen algunos casos en los que se ha evidenciado la presencia del virus en las lesiones plexiformes de pacientes con HAP, lo que apoya que el virus podría participar en la patogenia30. Sin embargo, varios investigadores han intentado sin éxito encontrar evidencia de infección latente por el virus HHV8 en secciones del tejido pulmonar de pacientes con HAP idiopática mediante técnicas de inmunohistoquímica y reacción en cadena de la polimerasa (PCR), por lo que en la actualidad, su papel es controvertido31. Existe un estudio que, sin aportar datos estadísticamente significativos, sugiere que el HHV8 pudiera tener un peso mayor en los pacientes infectados por VIH sin infección por VHC32.
- •
Virus de la hepatitis B (VHB). La coinfección VIH-VHB es frecuente. La proteína X del virus de la hepatitis B ha sido implicada en la inducción de la expresión de la sintetasa inducible del óxido nítrico y del VEGF, así como en la estabilización del factor 1α inducible por hipoxia y la inducción de la expresión de la angiopoyetina2. Todos estos mecanismos están implicados de forma activa en la angiogénesis21. En el contexto de la infección por el VHB, todos estos efectos pueden contribuir en las rutas fisiopatológicas involucradas en la progresión al daño hepático crónico, incluso en sus últimos estadios, como la cirrosis y el desarrollo de carcinoma hepatocelular. Este daño hepático puede conducir asimismo a la angiogénesis pulmonar21.
- •
Virus de la hepatitis C (VHC). Es controvertido el papel que pueda jugar el VHC en la patogenia de la HP en el grupo de pacientes coinfectados. El desarrollo de esta se ha asociado en la mayor parte de los casos a la presencia de cirrosis e hipertensión portal5,33, y en estos pacientes la existencia de cirrosis por la coinfección con el VHC es frecuente, sobre todo en los ADVP. Este hecho debería suponer una mayor prevalencia de HAP en los pacientes coinfectados; no obstante, parece que es la hepatopatía inmune la que más se ha asociado a la HP34, y existen más dudas sobre la contribución del VHC en el desarrollo de hipertensión portopulmonar.
La prevalencia de la HAP como complicación extrahepática en pacientes con infección por el VHC es del 1 al 5%35. No está bien establecido si las lesiones pulmonares son secundarias a la producción incrementada de citocinas inflamatorias, a la replicación viral directa o a la presencia de productos virales en el propio pulmón19. La implicación del VHC en el pronóstico de la infección por VIH es un tema controvertido: en un estudio observacional de 823 pacientes coinfectados publicado en el año 2003 se demostró que la coinfección por VHC no suponía un factor significativo en términos de supervivencia36. No obstante, sí se reconoce la infección por este virus como un trigger o desencadenante de la angiogénesis intrapulmonar descontrolada19. Sin embargo, en un metaanálisis publicado en el año 2009 se concluye que en la era pre-TARGA la coinfección con el VHC no suponía un incremento en la mortalidad en los pacientes con VIH, en contraste con la era TARGA, en la que sí se demuestra un aumento de mortalidad en los pacientes coinfectados en relación a los que solo presentan infección por VIH37.
Factores dependientes del hospedador- •
Citocinas y factores de crecimiento. Numerosas citocinas se han visto incrementadas en pacientes con infección por VIH, algunas de las cuales se conoce que tienen efectos que contribuyen al desarrollo de la HP. IL-1β, IL-6 y el factor de necrosis tumoral alfa aumentan sus niveles durante la infección por el virus, y concretamente estas moléculas han sido implicadas en la patogénesis de la HP38. Algunas citocinas son potentes factores de crecimiento para las células musculares lisas, los fibroblastos y las células endoteliales, y de esta forma participan en los cambios estructurales característicos observados en todas las formas de HAP, incluida la ligada a la infección por el VIH. Además de estas acciones, la IL-1β produce factor de crecimiento derivado de plaquetas, una molécula de crecimiento implicada en el remodelado vascular que se produce en la HP y que ha sido encontrada en cantidades elevadas en biopsias pulmonares de pacientes con HAP idiopática e HAP asociada al VIH39. Para definir exactamente cuál es el papel etiológico de estos condicionantes, es necesario un mejor conocimiento de los efectos en la vasculatura pulmonar de estas citocinas y factores de crecimiento durante la infección por el virus y el papel que juegan en la activación inmune y en la patogénesis de la HP1. A pesar de la innegable participación de estos mediadores inflamatorios dada la existencia de marcados infiltrados inflamatorios en los vasos pulmonares de pacientes con VIH e HAP27, es poco probable que supongan la única causa en el desarrollo de la enfermedad, ya que se ha demostrado su presencia en pacientes con infección por VIH de los cuales solo algunos infectados desarrollan HAP.
- •
HLA. Ya en un estudio realizado por Morse et al. en el año 199640 se sugirió que los individuos con un determinado alelo del antígeno del sistema mayor de histocompatibilidad podrían estar predispuestos a presentar HAP en el seno de la infección por VIH. Se trataba de un estudio caso-control en el cual se evidenció que la frecuencia de HLA claseII DR52 y DR6 estaba incrementada de forma significativa en los pacientes con VIH e HAP en comparación con un grupo control de sujetos sanos y otro grupo de pacientes con infección por VIH sin HAP40.
Para concluir este apartado, únicamente señalar que los hallazgos histopatológicos de la HAP asociada a infección por VIH son similares los observados en la HAP idiopática. En una revisión de 131 casos de HAP en pacientes con VIH, la mayor parte de ellos presentaban arteriopatía pulmonar con hipertrofia de la media, proliferación de la íntima y/o lesiones plexiformes (89%) con enfermedad venooclusiva en el 7% de los casos y arteriopatía pulmonar trombótica en el 4%16.
Presentación clínicaLa mayoría de los síntomas de HP que se presentan en pacientes con infección por VIH son resultado de una disfunción del ventrículo derecho y son similares a los que presentan los pacientes con HAP idiopática41. Estos síntomas son inespecíficos y pueden ser explicados algunas veces por otras condiciones concomitantes en estos enfermos41. La mayoría —hasta en el 93% en algunas series, como la de Janda3— presentan como síntoma predominante disnea progresiva (85%). Otros síntomas frecuentes son tos no productiva (19%), astenia (13%), síncope o presíncope (12%) y dolor torácico (7%)16. En el examen físico, los signos más característicos son el refuerzo del segundo tono, tercer ruido de galope, soplo de regurgitación tricuspídea, ingurgitación yugular y edema periférico16. Aunque la clínica que presentan los pacientes con HAP y VIH es similar a la descrita en pacientes con HAP idiopática, el intervalo de tiempo entre el inicio de los síntomas y el establecimiento del diagnóstico de HP es más corto en los pacientes con infección por VIH en relación a los pacientes con HAP idiopática (6 meses versus 2,5 años, respectivamente). Es muy posible que estos datos reflejen la estrecha monitorización de los pacientes con infección por VIH tras el diagnóstico inicial de la infección16.
DiagnósticoEl diagnóstico requiere la confirmación de HP, de la infección por VIH y la exclusión de otras causas alternativas de HP, representadas en el resto de grupos de la clasificación. Sin embargo, no se considera necesario excluir causas alternativas contenidas en el grupo1, HAP, que coexisten frecuentemente. En una revisión sistemática de 131 pacientes con HAP e infección por VIH, el 18% presentaban otra condición asociada, como la ADVP, la infección por VHC o la infección por VHB16.
La realización de un buen test de cribado de HP es fundamental en los pacientes con infección ya conocida por VIH, al ser un colectivo de riesgo para desarrollar esta enfermedad que ensombrece claramente su pronóstico vital y su calidad de vida. Varios estudios alertan sobre el hecho de que el diagnóstico de HP se realiza demasiado tarde en el curso de la enfermedad42, en clase funcional avanzada. Por eso, lograr un diagnóstico en fases iniciales permitiría instaurar un tratamiento también de forma precoz y mejorar así el pronóstico vital. Existe un estudio realizado en la cohorte francesa cuyos objetivos principales fueron: determinar la prevalencia de HP en pacientes con VIH en la era TARGA en dicha cohorte, y proponer un algoritmo de cribado de esta enfermedad43. Se trata del primer estudio prospectivo, nacional y multicéntrico realizado en pacientes con HAP e infección por VIH en la era TARGA, y la mayor cohorte estudiada hasta la fecha, con 7.648 pacientes. En él se confirmó la prevalencia de enfermedad en este colectivo (0,46%), similar a la de la era pre-TARGA. Se establece un algoritmo de diagnóstico basado en un test clínico para disnea, un ecocardiograma y un cateterismo cardiaco derecho, aplicable en la práctica clínica.
Respecto a las pruebas complementarias que se utilizan clásicamente en el diagnóstico de esta enfermedad, el ecocardiograma doppler transtorácico representa la herramienta principal y debe ser siempre utilizado cuando hay una sospecha clínica de HP. El ecocardiograma estima la presión arterial pulmonar sistólica (PAPS) basándose en la medición de la velocidad del flujo de la regurgitación tricuspídea, y es capaz de identificar posibles causas cardiacas de la enfermedad, así como su repercusión funcional a nivel del ventrículo derecho. Se asume la presencia de HP cuando la velocidad de regurgitación tricuspídea excede los 2,8m/s, un valor equivalente a una PAPS >36mmHg. El ecocardiograma detecta la posible presencia de HP pero no constituye la prueba diagnóstica definitiva. Se requiere la realización de un estudio hemodinámico, es decir, de un cateterismo cardiaco derecho que es, en la actualidad, la prueba gold standard. Cuando se detecta en el ecocardiograma una PAPS elevada, debe remitirse al paciente a una unidad experta en esta patología, tal y como establecen las guías clínicas. Será en dicha unidad donde se realice el cateterismo cardiaco derecho, prueba diagnóstica que, al tratarse de una exploración invasiva, está indicada solo en los siguientes casos: grupos1 (HAP, grupo en el que se encuadra la infección por VIH) y 4 (tromboembólica), y en los casos en que esté justificado porque los hallazgos puedan suponer un cambio en el tratamiento del enfermo. En los casos con PAPS en el ecocardiograma <50mmHg la decisión de realizar cateterismo o no debe basarse de forma individualizada en la edad, en el grado de sospecha y en la comorbilidad de cada paciente.
Además de diagnosticar la enfermedad, una correcta evaluación de este tipo de pacientes requiere una valoración de la gravedad. Para ello se han utilizado: la clase funcional de la NYHA (New York Heart Association Clasification of patients with cardiac disease) modificada, la tolerancia al ejercicio mediante la prueba de la marcha de los 6min y la ergoespirometría de esfuerzo, los hallazgos de ECG y hemodinámicos y los estudios biológicos. Las pruebas de función respiratoria se realizan como parte del estudio que identifica otras posibles causas de la HP10, es decir, para definir si se trata de un grupo3, debida a enfermedad pulmonar e hipoxia. Sin embargo, estudios recientes sugieren que la capacidad de difusión del monóxido de carbono está disminuida en estadios precoces de esta enfermedad, la HP, independientemente de la etiología de la misma.
Clase funcional de la New York Heart AssociationPara definir la clase funcional en la que se encuentra cada paciente al inicio del diagnóstico y para su evaluación a lo largo del tiempo, se utiliza una clasificación funcional modificada a partir de la NYHA44. De hecho, va a ser el grado funcional del enfermo el que sentará la indicación del inicio del tratamiento y la elección concreta del mismo. Por tanto, es fundamental clasificar bien a los individuos en el inicio, así como evaluar en el tiempo si cambian de escalón en la clasificación, ya que el estadio funcional se relaciona directamente con el pronóstico.
Tolerancia al ejercicioSe recomienda la realización de la prueba de la marcha de los 6min al diagnóstico, puesto que supone otra manera de establecer la situación funcional basal de tolerancia al ejercicio, se considera un buen parámetro para medir de forma evolutiva la respuesta al tratamiento y se relaciona también con el pronóstico44. La distancia recorrida durante esos 6min se correlaciona con la severidad en la clase funcional de la NYHA en estos pacientes con HP.
Hallazgos en el electrocardiograma y hemodinámicosAdemás de ser el gold standard en el diagnóstico de la HP, el cateterismo cardiaco derecho es una herramienta fundamental que sirve al clínico para evaluar la gravedad de la enfermedad, predecir el pronóstico, identificar otras causas de HP, evaluar la función del ventrículo derecho y valorar la vasorreactividad de la circulación pulmonar.
Estudios biológicosEl N-terminal-proBNP, un péptido natriurético plasmático, ya tenía un papel bien definido en cuanto al diagnóstico y estadificación de los pacientes con insuficiencia cardiaca congestiva. En los últimos tiempos, la medición de la región N-terminal de este péptido ha demostrado su utilidad como herramienta pronóstica en pacientes con HAP idiopática45 así como en patología pulmonar crónica. Sus niveles en plasma se asocian con la presión en la arteria pulmonar y la resistencia vascular pulmonar. Incluso podría establecerse una relación con los parámetros funcionales o de ejercicio44 (clase funcional/prueba de los 6min). Además, las alteraciones en sus niveles reflejan cambios en la estructura del ventrículo derecho y su función durante el tratamiento.
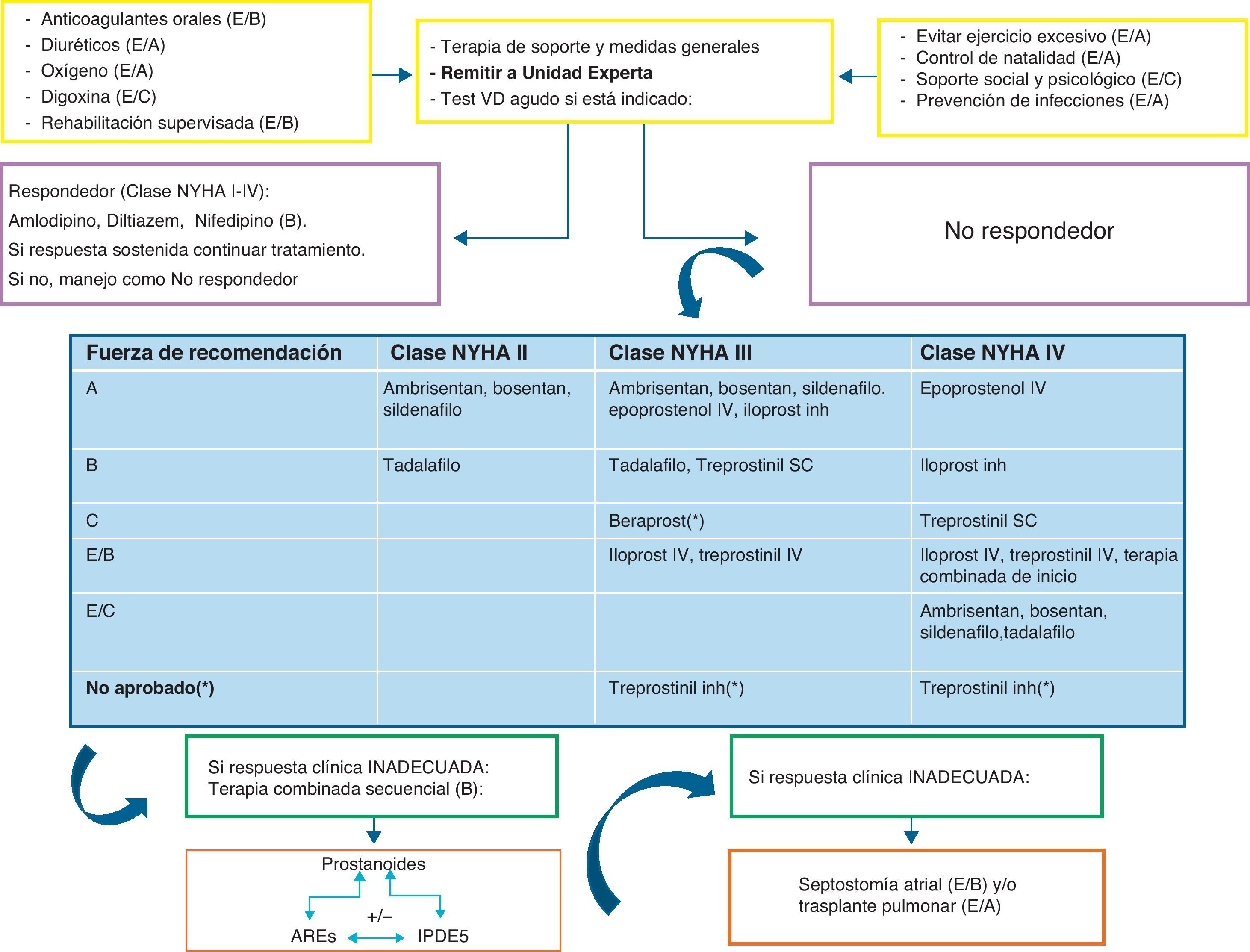
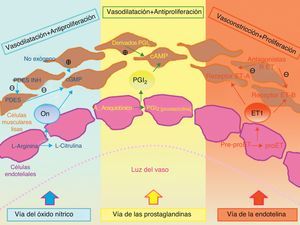
TratamientoLos avances más significativos en relación al tratamiento de la HP se han producido durante los últimos 15años. Los mayores progresos se han basado en diseñar fármacos dirigidos contra distintas dianas terapéuticas: la vía de las prostaciclinas, la del óxido nítrico y la de la endotelina46. El objetivo último del tratamiento, que hoy por hoy aún no es curativo, consiste en mejorar la clase funcional del enfermo. Por ello, el arsenal terapéutico disponible debe utilizarse de forma individualizada en cada caso, y la estrategia a seguir debe basarse en la evidencia científica (figs. 2 y 3).
Podemos dividir la terapia en: tratamiento convencional, tratamiento específico, TARGA y manejo quirúrgico.
Tratamiento convencionalEl tratamiento convencional va dirigido fundamentalmente a tratar de controlar las consecuencias derivadas de la HP y es similar para todas las formas de HP. La restricción hídrica y de sodio, así como la aplicación de diuréticos, se utilizan para el tratamiento de la descompensación cardiaca derecha47 (edema periférico, ascitis, congestión hepática), siempre con precaución para no disminuir el volumen intravascular. También se utilizan agentes inotrópicos en los pacientes que lo requieran, así como terapia con oxígeno domiciliario en pacientes con hipoxemia crónica. La anticoagulación ha demostrado beneficios en cuanto a supervivencia47 en otros pacientes con HAP, hecho que se ve apoyado por la demostración histológica de trombosis vasculares in situ en los pacientes con HP por cualquier causa. Sin embargo, el tratamiento anticoagulante no está recomendado de forma sistemática en pacientes con infección por VIH debido al riesgo más elevado de hemorragia y a la interacción entre fármacos.
En cuanto a los bloqueantes de canales de calcio, solo son utilizados hoy en día en los enfermos con HP que responden al test vasodilatador, es decir, que cuya PAPm disminuya al menos 10mmHg o caiga por debajo de 40mmHg, manteniendo el gasto cardiaco tras la perfusión del vasodilatador47. Se utilizan el nifedipino, el diltiazem o el amlodipino. El verapamil está contraindicado por su efecto inotrópico negativo.
Tratamiento específicoRespecto al tratamiento específico o avanzado, dirigido a disminuir la vasoconstricción así como la proliferación de la célula vascular endotelial y la del músculo liso, puede dividirse en 3 grupos según la vía de actuación (fig. 4). Existen pocos ensayos clínicos realizados en pacientes con HAP e infección por VIH con tratamiento específico. En esta revisión describiremos los resultados más importantes en este grupo de enfermos.
Análogos de la prostaciclinaDado que en los pacientes con HP existe una deficiencia en la función de las prostaciclinas, el uso de análogos produce una potente vasodilatación así como una inhibición de la agregación plaquetaria. El epoprostenol intravenoso, el iloprost inhalado o intravenoso y el teprostinil subcutáneo o intravenoso son algunos de los fármacos que han sido evaluados en distintos ensayos clínicos y han demostrado mejorar la capacidad de ejercicio, la calidad de vida, los parámetros hemodinámicos y la supervivencia.
- •
Epoprostenol. Los efectos del epoprostenol intravenoso fueron evaluados en un pequeño ensayo clínico no controlado realizado en pacientes con HAP e infección por VIH48. La perfusión de este fármaco disminuyó la presión media en la arteria pulmonar y las resistencias vasculares pulmonares y mejoró el gasto cardiaco y el índice cardiaco. Un nuevo cateterismo en 5pacientes tras un año del tratamiento demostró persistencia de la mejoría de los parámetros hemodinámicos, persistencia que fue también observada después de 2años tras el tratamiento en 3 de los 6pacientes y después de 4años en 2 de los 6pacientes. En todos ellos se observó una mejoría de la clase funcional de la NYHA y los efectos adversos observados fueron similares a los producidos comparativamente en otros pacientes con HAP idiopática. Un dato interesante es que aunque 5 de los 6pacientes fallecieron, ninguno de ellos lo hizo por causa de la HAP. A pesar de los resultados, existe cierta resistencia al uso de prostaciclina intravenosa en pacientes con infección por VIH, sobre todo en aquellos con inmunodepresión profunda, por el riesgo de infecciones asociadas al catéter49, así como la posible aparición de efectos secundarios a nivel sistémico por la falta de selectividad pulmonar del fármaco y el desarrollo de tolerancia que obliga al aumento progresivo de la dosis. Por tanto, parece razonable buscar otros métodos de administración que no requieran la colocación de un catéter central.
- •
Treprostinil. La eficacia del treprostinil subcutáneo ha sido demostrada por Simonneau50 en un estudio multicéntrico doble ciego en el que se objetivó una mejoría de la clase funcional, la prueba de los 6min y los parámetros hemodinámicos tras 12semanas de tratamiento. Sin embargo, este estudio —que incluía pacientes con enfermedad del tejido conectivo y cardiopatías congénitas— excluía a los pacientes con infección por VIH, por lo cual hasta la fecha existe poca evidencia en estos enfermos. Sí se dispone de un pequeño estudio realizado en el Hospital Universitario 12 de Octubre en el año 200351, en el cual se incluyeron 3pacientes con infección por VIH e HAP en tratamiento con treprostinil subcutáneo a dosis crecientes. Los 3 pacientes mejoraron clínicamente según la clase funcional NYHA y la distancia recorrida en la prueba de los 6min (aumento de al menos 75m), y se demostró supervivencia de todos ellos tras un año de seguimiento. En 2pacientes disminuyó la presión pulmonar sistólica estimada por ecocardiografía. No se observaron complicaciones graves asociadas.
- •
Iloprost. La administración de esta prostaciclina inhalada ha demostrado ser efectiva y bien tolerada como terapia para pacientes con HAP idiopática y otras formas de HP en varios estudios. En el año 2004 se realizó un estudio no controlado en el que 4pacientes con infección por VIH e HAP recibieron tratamiento compasivo con iloprost inhalado. Tras un periodo de 6meses, se observó mejoría en la capacidad de ejercicio que se evaluó mediante la prueba de la marcha de los 6min y disminución de la resistencia vascular pulmonar52. Los propios autores reconocen el limitado número de pacientes y proponen realizar en el futuro estudios controlados con un mayor número de pacientes para demostrar este beneficio en la capacidad de ejercicio y la hemodinámica pulmonar en estos pacientes.
La endotelina-1 produce vasoconstricción de los vasos pulmonares y proliferación de las células musculares lisas y los fibroblastos. Los fármacos dirigidos a bloquear sus receptores contrarrestan estos efectos. El fármaco pionero, el bosentán, fue aprobado por la FDA en el año 2001 para pacientes en clase funcionalIII y IV, y desde entonces otros fármacos, también de administración oral, se han desarrollado y se han ido ampliando las indicaciones de todos ellos. Otro antagonista selectivo de los receptores de la endotelina, como el ambrisentán, es un ejemplo más de estos nuevos fármacos, pero no ha sido estudiado específicamente en pacientes con infección por VIH. Únicamente existen 2ensayos clínicos (ARIES-1 y ARIES-2) aleatorizados, doble ciego, controlados con placebo y multicéntricos, que valoran los efectos de ambrisentán en pacientes con HAP e incluyen un total de 11pacientes con infección por VIH54. Aunque el fármaco demuestra mejorar la capacidad de ejercicio así como otras variables secundarias, no se dispone de datos concretos en este subgrupo de pacientes.
- •
Bosentán. Este fármaco de administración oral ha demostrado mejorar los síntomas y los parámetros hemodinámicos en pacientes con HAP e infección por VIH. En un ensayo clínico no controlado realizado en 16pacientes que recibieron bosentán se observó mejoría en la prueba de los 6min, la clase funcional de la NYHA, los parámetros hemodinámicos (PAPm, resistencia vascular pulmonar, índice cardiaco), el tamaño y la función del ventrículo derecho por ecografía doppler y la calidad de vida a las 16semanas12. El fármaco no tuvo un impacto negativo en el control de infección por VIH.
- •
Un estudio retrospectivo publicado en 200955 analizó los datos de 50 pacientes con HAP e infección por VIH en clase funcionalII-IV de la NYHA que recibieron primera línea de tratamiento con bosentán. Se midieron las características hemodinámicas y el recorrido la prueba de la marcha de los 6min a los 4, a los 6 y a los 12meses tras el inicio del tratamiento. A los 4meses se observó mejoría en el tiempo recorrido en el test de los 6min, así como una disminución de las resistencias vasculares pulmonares. De hecho, los parámetros hemodinámicos se normalizaron en 10pacientes, en los cuales se observó también una mejoría de la clase funcional hasta claseI. El tratamiento con bosentán fue seguro en combinación con el TARGA, sin ningún impacto negativo en el control de la infección. Tras una media de 29±18meses, un total de 44pacientes sobrevivieron, incluyendo 36 con bosentán en monoterapia y 5 con bosentán en combinación con epoprostenol, iloprost o sildenafilo. De los 15 pacientes fallecidos, únicamente 4 lo hicieron a causa de fallo ventricular derecho. En este estudio, teniendo en cuenta la limitación de su carácter retrospectivo, se demuestra el potencial beneficio a largo plazo de la terapia con bosentán en estos pacientes en términos clínicos y hemodinámicos, así como su seguridad en combinación con TARGA55.
Los fármacos como el sildenafilo son drogas potentes que inhiben específicamente la 5-fosfodiesterasa (PDE5), con lo que mejoran los síntomas y la funcionalidad de los pacientes con HP47.
- •
Sildenafilo. Únicamente se han publicado algunos casos de pacientes con HAP e infección por VIH en tratamiento con sildenafilo. En ellos se observa mejoría de los síntomas, la clase funcional y los parámetros hemodinámicos tras el tratamiento56. Sin embargo, las interacciones potenciales con el TARGA, más concretamente con los inhibidores de la proteasa (IP), hacen que esta opción terapéutica deba ser tomada en cuenta con precaución, dado que los IP puede incrementar los niveles de sildenafilo y este fármaco puede disminuir significativamente los niveles de IP55. No se han publicado efectos adversos directos derivados de sildenafilo en estos enfermos. Otros inhibidores PDE5, el tadalafilo y el vardenafilo, que han demostrado mejorar el perfil de episodios clínicos en otros pacientes con HP46, no han sido aún estudiados en estos pacientes.
Durante varios años ha sido sobradamente demostrada la eficacia del TARGA para suprimir la replicación viral y restaurar la inmunidad en pacientes con infección por VIH. Sin embargo, existen datos contradictorios acerca de la efectividad de este tratamiento en el caso de la HAP53. En un estudio retrospectivo de 35 pacientes con infección por VIH e HAP se realizó un seguimiento ecocardiográfico de las presiones pulmonares. En los 9 que no recibieron TARGA se observó empeoramiento, mientras que en los 12 que recibieron análogos de nucleósidos y en los 14 que recibieron TARGA se observó, sin embargo, una disminución (solo significativa en el grupo TARGA) de las presiones pulmonares. La mediana de supervivencia de todos los pacientes tras el diagnóstico de HAP fue de 2,7 años. Se demostró una disminución significativa de la mortalidad en los pacientes que recibieron TARGA57. Existen otros trabajos58 que comunican series o casos con impacto positivo del TARGA sobre la HAP, que no solo logran alcanzar una carga viral indetectable sino una mejoría clínica respiratoria y también disminución de las cifras de presión en la arterial pulmonar evidenciadas hasta 6años después del inicio del tratamiento, sin tratamiento vasodilatador.
Por el contrario, en un estudio realizado en 2003 en una cohorte de 82 pacientes con infección por VIH e HAP, donde la causa directa de muerte fue la HP en el 72% de los casos, se observaron los siguientes datos: la supervivencia fue peor en pacientes en clase funcional NYHAIII-IV que recibieron únicamente TARGA en ausencia de epoprostenol, comparados con los pacientes que recibieron TARGA y epoprostenol a pesar del hecho de que estos últimos pacientes tenían peores datos hemodinámicos. En el grupo que recibió tratamiento vasodilatador específico se observó mejoría de la clase funcional, la distancia el test de los 6min y los parámetros hemodinámicos, datos que permanecieron sin cambios en los pacientes que recibieron solo TARGA9.
Un estudio abierto prospectivo de 6meses de duración realizado en pacientes con infección por VIH sin TARGA y con PAH, comparó el efecto de la introducción de TARGA solo frente a la combinación de TARGA y bosentán: en la semana 24 del estudio se observó una disminución significativa de la presión media en la arteria pulmonar en el grupo de tratamiento combinado que no se observó en el subgrupo que recibía TARGA solo59. Este estudio apoya el uso de terapia combinada, especialmente en los pacientes con PAPm mayor de 50mm Hg y distancia menor de 200m en el test de los 6min, ya que es este el grupo diana de pacientes donde la terapia combinada parece mostrar mayor beneficio.
En este aspecto, cabe destacar el artículo publicado en 2010 por Degano et al.53 en el que, de forma retrospectiva, se analiza qué factores influyen en el pronóstico de los pacientes con HAP en la «era TARGA». Se estudiaron 77 pacientes procedentes de un centro francés de referencia en HP, todos ellos con VIH-HAP sin otras causas añadidas de vasculopatía pulmonar. Según sus resultados, el TARGA por sí solo, a pesar de mejorar parámetros como la distancia recorrida en el test de los 6min o, en algunos casos, retrasar la aparición de la HAP, no es capaz de mejorar los parámetros hemodinámicos si no se acompaña de terapia vasodilatadora. Por otra parte, señalan como factores pronósticos independientes la cifra de linfocitos CD4 y la función cardiaca en estos pacientes.
A modo de conclusión, si se resumen los puntos clave derivados de un análisis comparativo entre la «era pre y post-TARGA», habría que señalar los siguientes datos: la presencia de HAP en pacientes con infección por VIH supone un factor predictor de muerte independiente53; en la era «pre-TARGA» estos pacientes fallecían por causas asociadas a la infección viral y la inmunodepresión, pero una vez controlados estos procesos con el TARGA, la muerte por causa cardiovascular, incluyendo la HAP, ha pasado a jugar un papel primordial, como ya se ha señalado en la introducción de este texto. Por otra parte, y como se recoge en los diversos estudios aquí resumidos, cada tratamiento dirigido repercute positivamente en su diana. Esto supone que el TARGA es capaz de mejorar la supervivencia de los pacientes por el control que ejerce sobre la carga viral y la inmunidad y la terapia vasodilatadora introducida en la última década, funciona de igual manera mejorando significativamente la clase funcional y los parámetros hemodinámicos de la HAP. Sin embargo, todos estos estudios no han sido capaces de dilucidar el efecto propiamente dicho del TARGA en la evolución de la HAP53. El debate que plantean todos estos autores acerca el efecto del TARGA sobre la HAP en estos pacientes con infección por VIH justifica la realización en el futuro de nuevos estudios de carácter prospectivo y con un mayor número de pacientes.
Tratamiento quirúrgicoA pesar de que el trasplante pulmonar o el cardiopulmonar estén indicados en pacientes seleccionados con HAP en clase funcionalIV cuando ha fracasado el tratamiento farmacológico, por lo general se considera que la infección por el VIH es un criterio de exclusión para su realización en la mayoría de los centros5.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.