Los helmintos presentes en el suelo, Ascaris lumbricoides, Trichuris trichiura, uncinarias (Ancylostoma duodenale y Necator americanus) y Strongyloides stercoralis, infestan a millones de personas que habitan sobre todo en áreas rurales y deprimidas de regiones tropicales y subtropicales. Los grandes flujos migratorios han facilitado su extensión a todo el mundo. Además de ser debilitantes y causar una mortalidad significativa, conllevan una alta morbilidad y afectan al desarrollo físico e intelectual de millones de niños que viven en áreas deprimidas. Junto con los benzimidazoles albendazol y mebendazol, las campañas internacionales de prevención y tratamiento a gran escala, han conseguido disminuir el número de afectados, pero la reinfestación y la resistencia a los benzimidazoles son frecuentes, por lo que es muy aconsejable mantener la atención sobre estos parásitos olvidados.
Millions of people in in rural areas and deprived tropical and subtropical regions are infected by soil-transmitted helminths: Ascaris lumbricoides, Trichuris trichiura, hookworms (Ancylostoma duodenale and Necator americanus), and Strongyloides stercoralis. Large migratory flows have made their worldwide distribution easier. Besides being debilitating and producing a significant mortality, they cause high morbidity, leading to physical and intellectual impairment in millions of children who live in poverty. Along with the use of benzimidazoles (albendazole and mebendazole), large-scale international campaigns for treatment and prevention have decreased the number of affected individuals. However, re-infestations and benzimidazole-resistance are frequent, so there needs to be awareness about the importance and consequences of these neglected parasites.
Los helmintos (G. helmins-helminthos, gusano) son invertebrados eucarióticos con morfología aplanada o cilíndrica. Estos gusanos parasitarios comprenden dos fila principales: a) platelmintos, a su vez subdivididos en cestodos (Tenias) y trematodos (Fasciola, Esquistosoma y Paragonimus), y b) nematodos o nematelmintos (G. nema-nematos, hilo)1.
Circunscribiéndonos a los helmintos transmitidos por el suelo —geohelmintos—, estos son nematodos que afectan al hombre a través de la ingesta de huevos parasitarios por vía fecal-oral o alimentaria, o por penetración a través de la piel de sus larvas infestantes presentes en tierras húmedas y cálidas. Los geohelmintos con trascendencia medicosanitaria son el Ascaris lumbricoides, el tricocéfalo o Trichuris trichiura, los uncinaria Ancylostoma duodenale y Necator americanus, y el Strongyloides stercoralis.
Fue el parasitólogo Norman R. Stoll quien, en 1947, «descubrió» la enorme carga que los nematodos intestinales representan para ciertas poblaciones de la Tierra2. Así, se calcula que 2.000millones de personas, de ellos unos 300millones de niños en edad preescolar, sobre todo residentes en áreas rurales y deprimidas del África subsahariana, sudeste de Asia y Centro y Sudamérica, están infestadas por geohelmintos; infestación facilitada por la pobreza, el analfabetismo, la falta de agua potable y de hábitos higiénicos, así como de letrinas y medios de eliminación y tratamiento de excretas3,4.
Estos nematodos son debilitantes y responsables de una alta morbilidad (prematuridad, bajo peso del neonato, retraso en el crecimiento y desarrollo intelectual, emaciación, diarrea, anemia, malnutrición y malabsorción intestinal), causando anualmente miles de muertes.
Si, además, consideramos la frecuente coincidencia en un mismo individuo de geohelmintos diferentes junto con otros parásitos como el plasmodio, bacterias como el Mycobacterium tuberculosis o virus como el VIH, se deduce su repercusión sobre la salud a través de ese círculo vicioso que constituyen pobreza, higiene deficiente, enfermedades prevenibles y subdesarrollo5-11. Igualmente, por los flujos migratorios, su diagnóstico debe recordarse en países receptores de personas procedentes de áreas endémicas12-15.
Por otra parte, se ha avanzado poco en el desarrollo de fármacos nuevos ante las resistencias cada vez más frecuentes y, a pesar de los programas para su tratamiento a gran escala, los geohelmintos siguen siendo la causa de un grupo significativo de «enfermedades tropicales olvidadas»16.
Seguidamente se recuerdan las características de estos parásitos, la epidemiología y clínica de las enfermedades que causan, su diagnóstico y tratamiento, y la respuesta inmunológica del parasitado.
Ascaris lumbricoidesLa ascariasis es la más frecuente de las parasitosis intestinales humanas. Se calcula que hoy hay unos 800millones de habitantes de regiones tropicales y subtropicales y, en general, áreas con mala infraestructura sanitaria, infestados por este nematodo, siendo los niños los más afectados6,17,18.
El áscaris macho mide de 15 a 30cm de largo, y la hembra de 25 a 40cm. Esta pone unos 200.000huevos al día en el intestino delgado del anfitrión, huevos que contienen larvas infestantes y son eliminados con las heces. La infestación se produce por la ingestión de los huevos presentes en las manos, los alimentos y el agua. Una vez ingeridos, se adhieren a la mucosa del duodeno donde liberan las larvas; estas atraviesan la mucosa, por vía venosa llegan al hígado, donde pueden inducir la formación de granulomas eosinófilos19 y, por las venas suprahepáticas y cava inferior, alcanzan las cavidades derechas del corazón y las arterias pulmonares. Las larvas tienen 2mudas en los pulmones y sus antígenos causan una respuesta inflamatoria con infiltrados de eosinófilos visibles como focos de condensación radiológica y síntomas como disnea, fiebre y tos seca. Las larvas pueden romper los capilares y penetrar en los alvéolos, desplazándose a la laringe, tráquea y árbol respiratorio, siendo expulsadas con la tos o deglutidas. Llegan así al intestino delgado, donde tienen la última muda y maduran sexualmente para convertirse en gusanos adultos productores de huevos a las 9-11semanas tras la infestación6 (fig. 1).
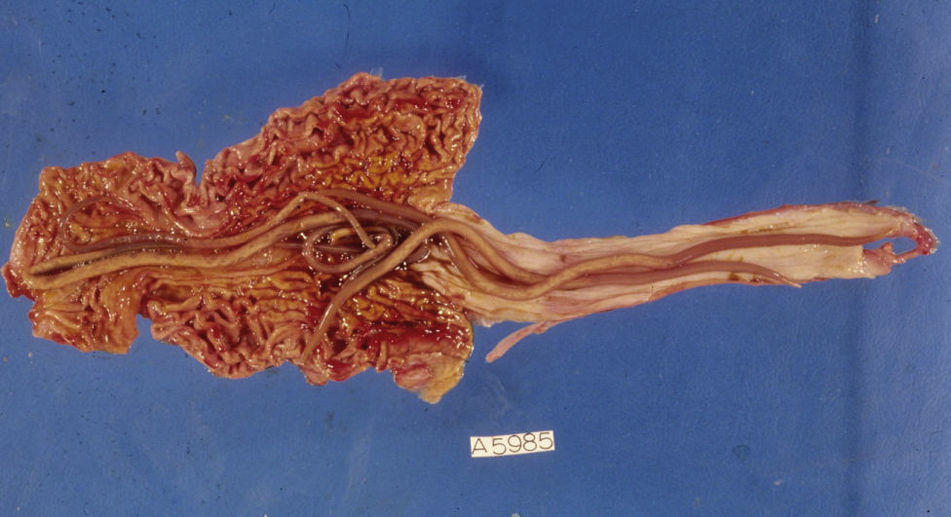
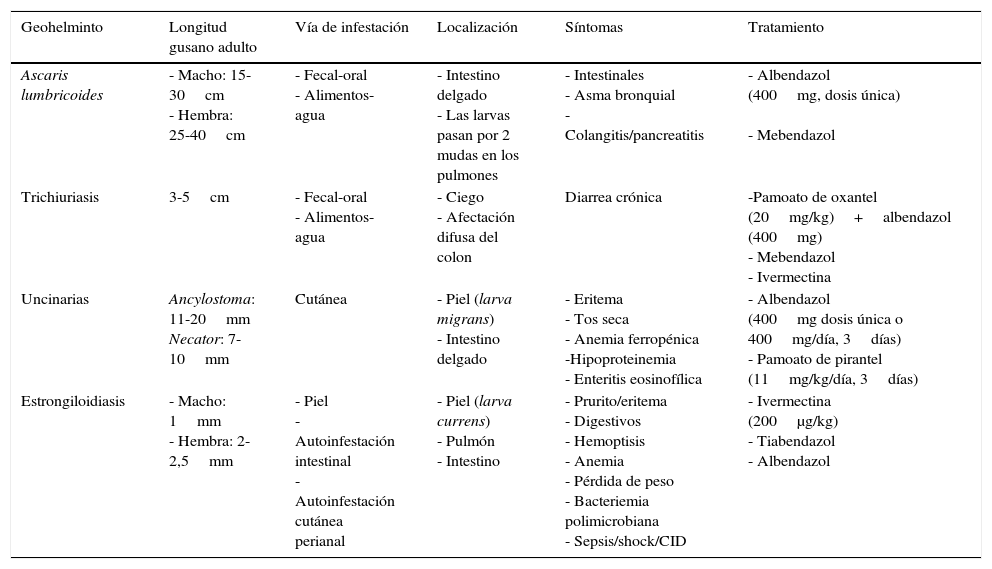
Junto a los síntomas de asma bronquial producidos por las larvas en su migración pulmonar, los gusanos adultos pueden desplazarse en el intestino y penetrar en la ampolla de Vater, obstruyendo el colédoco y causando dolor abdominal agudo por colangitis y pancreatitis, posibles abscesos hepáticos por las bacterias que portan o, incluso, semejar un tumor pancreático20,21. Aunque la fase intestinal suele ser asintomática, una gran carga de áscaris puede producir malabsorción intestinal y afectar al desarrollo físico e intelectual del niño22. Además, «marañas» de lombrices pueden causar obstrucción intestinal, vólvulo, perforación, intususcepción y muerte23,24, así como otras complicaciones graves en traumatizados (obstrucción de la vía aérea, diseminación peritoneal o fistulización a través de la pared torácica o abdominal)25 (fig. 2).
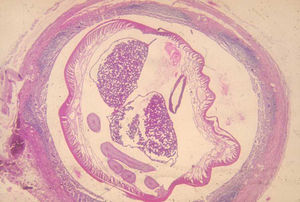
Aunque en ocasiones pueden verse áscaris adultos en las heces, e incluso que emerjan por la nariz o sean vomitadas o expectoradas, el diagnóstico de A. lumbricoides suele hacerse identificando sus huevos en heces mediante técnicas de concentración26.
En cuanto a las técnicas moleculares y de PCR, aunque sensibles y específicas, son caras y precisan personal cualificado, lo que limita su aplicación en países con pocos recursos27. Además, suele haber anemia moderada y eosinofilia, así como cristales de Charcot-Leyden en esputo y heces9.
El tratamiento debe hacerse con albendazol (400mg en dosis única) o mebendazol (dosis única de 500mg). Estas moléculas, al combinarse con la β-tubulina de los microtúbulos de las células intestinales del parásito, producen su degeneración, lo que impide la producción de ATP, con la consiguiente parálisis y muerte al cabo de unos días6,28.
Ambos benzimidazoles pueden ser utilizados en niños y suelen ser bien tolerados, pero son teratogénicos, por lo que en embarazadas debe utilizarse el pamoato de pirantel (11mg/kg y día durante 3días hasta un máximo de 1g). Este fármaco actúa combinándose con el receptor nicotínico de acetilcolina en el músculo del nematodo inhibiendo la colinesterasa y produciendo su parálisis espástica29.
Se calcula que al año del tratamiento un 55% de los tratados están reinfestados, si bien el tratamiento convencional puede seguir siendo eficaz6.
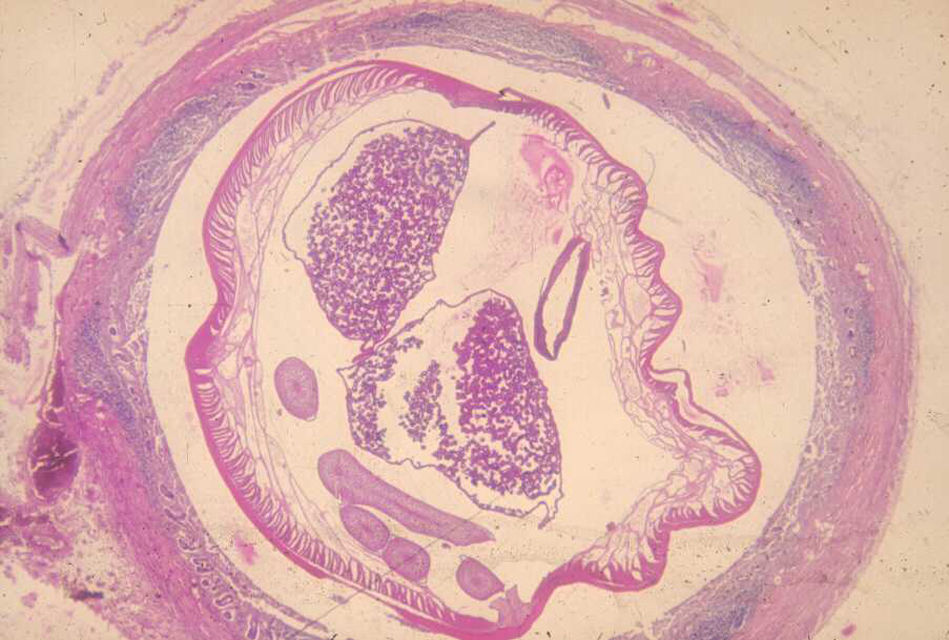
Trichuriasis (o tricocefalosis)El tricocéfalo (G. trichos: pelo) o T. trichiura es un nematodo intestinal que en estadio adulto mide de 3 a 5cm de largo y cuya distribución y prevalencia es similar a la del A. lumbricoides. Se localiza con preferencia en el ciego del parasitado, aunque en casos graves puede hallarse en todo el colon.
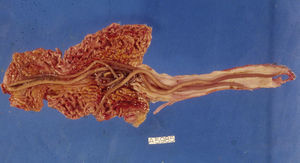
Si la persona infestada defeca en el suelo, o las heces son utilizadas como abono, los huevos puestos por las hembras en el colon caen en la tierra. Esos huevos aún en estadio no embrionario pasan por 2 etapas antes de convertirse en embrionarios que, una vez ingeridos con los alimentos o el agua, dan lugar a las larvas en el intestino delgado. A continuación, estas emigran hasta el ciego, penetran en la mucosa y maduran hasta convertirse en gusanos adultos con una cabeza o porción anterior en forma de látigo inmersa en túneles epiteliales horadados en la mucosa intestinal, y una porción posterior, más gruesa, con el intestino y aparato reproductor, visible en la luz intestinal. Unos 3meses después de la ingesta de los huevos, las hembras fertilizadas ponen de 3.000 a 30.000huevos diarios que, eliminados con las heces, maduran en el suelo y 3semanas después han adquirido poder infestante30.
Aunque la mayoría de los afectados pueden permanecer asintomáticos, muchos, sobre todo los niños con gran carga de Trichuris, sufren un cuadro disenteriforme de diarrea mucosa crónica con prolapso rectal, malnutrición, anorexia, retraso en el crecimiento, acropaquias y anemia ferropénica9,31,32.
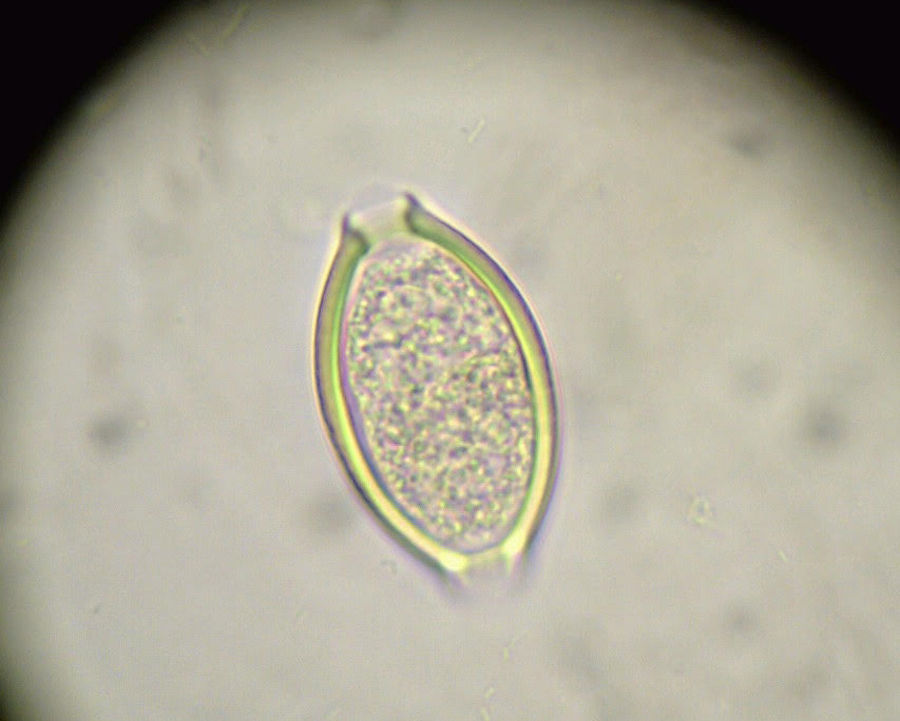
Como en la ascariasis, el diagnóstico se hace por la sospecha clínica (epidemiología del lugar) y el examen de los huevos en las heces de los afectados (fig. 3).
En cuanto al tratamiento, el albendazol posee una eficacia limitada, incluso 400mg/día durante 3días seguidos; algo similar ocurre con el mebendazol, aun a dosis de 100mg/12h durante 3días. Este último se absorbe mal con tránsito intestinal normal y mucho peor en los cuadros disenteriformes33. Por ello se aconseja una dosis de pamoato de oxantel (20mg/kg) y una dosis de 400mg de albendazol en días consecutivos34. Otra opción es la ivermectina a dosis de 200μg/kg/día durante 3días asociada a albendazol, aunque posee un efecto limitado y está contraindicada en mujeres gestantes o que lactan35.
Uncinariasis: Ancylostoma duodenale y Necator americanusLos uncinaria (G. Uncinos: gancho) A. duodenale (G. Ankylos: ancla; curvado) y N. americanus (G. Necator: asesino) son geohelmintos hematófagos que afectan a unos 600millones de personas en todo el mundo, sobre todo en regiones rurales tropicales y subtropicales36.
Ambos poseen una morfología cilíndrica similar, siendo el anquilostoma algo más largo (11-20mm) que el necátor (7-10mm). A diferencia de áscaris y tricocéfalos, cuya incidencia es mayor en la infancia, la infestación por uncinaria lo es en la edad adulta.
Las hembras maduras del anquilostoma producen al día unos 30.000huevos, y las del necátor de 5.000 a 10.000 en el intestino delgado, siendo vertidos con las heces. Bajo condiciones favorables de humedad y temperatura, maduran en el suelo a estadio embrionario, eclosionan y dan lugar a larvas que pasan por 2 etapas aún no infestantes: L1 (larvas rabditiformes), y L2 (segunda etapa juvenil) antes de alcanzar al cabo de 7-10días la tercera etapa, L3, o larvas filariformes ya infestantes al ser capaces de penetrar en la piel del anfitrión (fig. 4). Tal penetración está mediada por enzimas proteolíticos como hialuronidasa y metaloproteasas que interrumpen la adhesión de las células de la dermis y degradan el colágeno, fibronectina, laminina y elastina de la matriz extracelular de la piel, permitiendo la migración de la larva por ella (larva migrans).
Seguidamente, las larvas filariformes llegan a los vasos de la dermis, por vía venosa alcanzan los pulmones antes de 10días y penetran en los alvéolos desde donde son llevadas hacia la glotis por los cilios del aparato respiratorio. Desde ahí son deglutidas para alcanzar el intestino delgado y durante esa migración tienen otras 2 mudas: desarrollan una cápsula bucal (con 4 «dientes» en el caso del anquilostoma y 2 placas cortantes en el necátor) y maduran a estadio adulto.
Los gusanos adultos se enganchan mediante la cápsula bucal a la mucosa del intestino delgado y la capacidad de succión de su esófago muscular. Además, liberan hialuronidasa —con la que laceran la mucosa y la pared de los vasos— e inhibidores de factores de la coagulación (complejo factor VIIa y factor tisular, y factor Xa). El anquilostoma ingiere de 0,15 a 0,2ml diarios de sangre, y 0,03ml el necátor, bastando de 40 a 160uncinaria para causar una pérdida de 9ml diarios de sangre, con la consiguiente anemia ferropénica37,38.
Los uncinaria adultos son maduros sexualmente al cabo de 3-5semanas, momento en que las hembras empiezan a producir los huevos que aparecen en heces.
Aunque el necátor infesta solo por vía cutánea, el anquilostoma también puede hacerlo por ingestión de larvas L3.
Clínica, diagnóstico y tratamientoDurante la primera semana tras la infestación, el paciente sufre un cuadro de eritema pruriginoso en los pies y/o manos proporcional a la cantidad de larvas, seguido de tos no productiva en la migración alveolar, fase en la que suele observarse eosinofilia. A continuación, y según la gravedad de la infestación, se produce anemia ferropénica frecuentemente grave e hipoproteinemia por ingestión de proteínas (hemoglobina, albúmina y globulinas) sanguíneas por los uncinaria. Ello repercute en el estado general con adelgazamiento, afectación del desarrollo físico e intelectual, edemas e inmunodepresión.
Asimismo, en casos de infestación grave puede observarse dolor abdominal por enteritis eosinofílica (que responde a mebendazol) con leucocitosis y eosinofilia en sangre periférica e, incluso, hemorragia digestiva aguda grave.
El diagnóstico se hace por la clínica y el examen de las heces mediante la técnica de Kato-Katz o métodos de flotación.
Como en las otras infestaciones por geohelmintos, la prevención se basa en la educación y la mejora de las condiciones ambientales e higienicosanitarias básicas: calzado, alimentación, acceso al agua potable, alcantarillado, etcétera (tabla 1).
Comparativa entre las diferentes geohelmintiasis
| Geohelminto | Longitud gusano adulto | Vía de infestación | Localización | Síntomas | Tratamiento |
|---|---|---|---|---|---|
| Ascaris lumbricoides | - Macho: 15-30cm - Hembra: 25-40cm | - Fecal-oral - Alimentos-agua | - Intestino delgado - Las larvas pasan por 2 mudas en los pulmones | - Intestinales - Asma bronquial - Colangitis/pancreatitis | - Albendazol (400mg, dosis única) - Mebendazol |
| Trichiuriasis | 3-5cm | - Fecal-oral - Alimentos-agua | - Ciego - Afectación difusa del colon | Diarrea crónica | -Pamoato de oxantel (20mg/kg)+albendazol (400mg) - Mebendazol - Ivermectina |
| Uncinarias | Ancylostoma: 11-20mm Necator: 7-10mm | Cutánea | - Piel (larva migrans) - Intestino delgado | - Eritema - Tos seca - Anemia ferropénica -Hipoproteinemia - Enteritis eosinofílica | - Albendazol (400mg dosis única o 400mg/día, 3días) - Pamoato de pirantel (11mg/kg/día, 3días) |
| Estrongiloidiasis | - Macho: 1mm - Hembra: 2-2,5mm | - Piel - Autoinfestación intestinal - Autoinfestación cutánea perianal | - Piel (larva currens) - Pulmón - Intestino | - Prurito/eritema - Digestivos - Hemoptisis - Anemia - Pérdida de peso - Bacteriemia polimicrobiana - Sepsis/shock/CID | - Ivermectina (200μg/kg) - Tiabendazol - Albendazol |
En cuanto al tratamiento, además de la ferroterapia y la reposición de ácido fólico y vitaminas, el albendazol (dosis única de 400mg, o 400mg/día, 3días seguidos; mitad de dosis en menores de 2años) es el fármaco de elección. El pamoato de pirantel (11mg/kg y día, 3días seguidos) es una buena alternativa, mientras que el mebendazol es menos eficaz39.
La reinfestación es frecuente en áreas endémicas por la contaminación del suelo, lo que facilita la resistencia a los fármacos. Ello plantea la necesidad de desarrollar nuevos antihelmínticos y vacunas40,41, aún en etapas incipientes. Así, moléculas inhibidoras de metaloproteasas42 o la tribendimidina (400mg/día en adultos y 200mg en niños) puede ser útil en áscaris y uncinaria43.
EstrongiloidiasisAunque el S. stercoralis (G. Strongilos: redondo; L. Stercus: excremento) es un nematodo con una vía de infestación semejante a otros geohelmintos, no suele figurar en las revisiones de geohelmintiasis. Ello, además de convertirle en especialmente olvidado, es grave sobre todo si se considera que por autoinfestación produce una enfermedad crónica que puede agravarse especialmente en situaciones de inmunodepresión44.
El S. stercoralis es un parásito cosmopolita con prevalencia especial en áreas tropicales y subtropicales, incluido el sudeste de EE.UU. y regiones tropicales de Australia. La infestación se produce por la exposición al suelo contaminado con heces humanas y por autoinfestación.
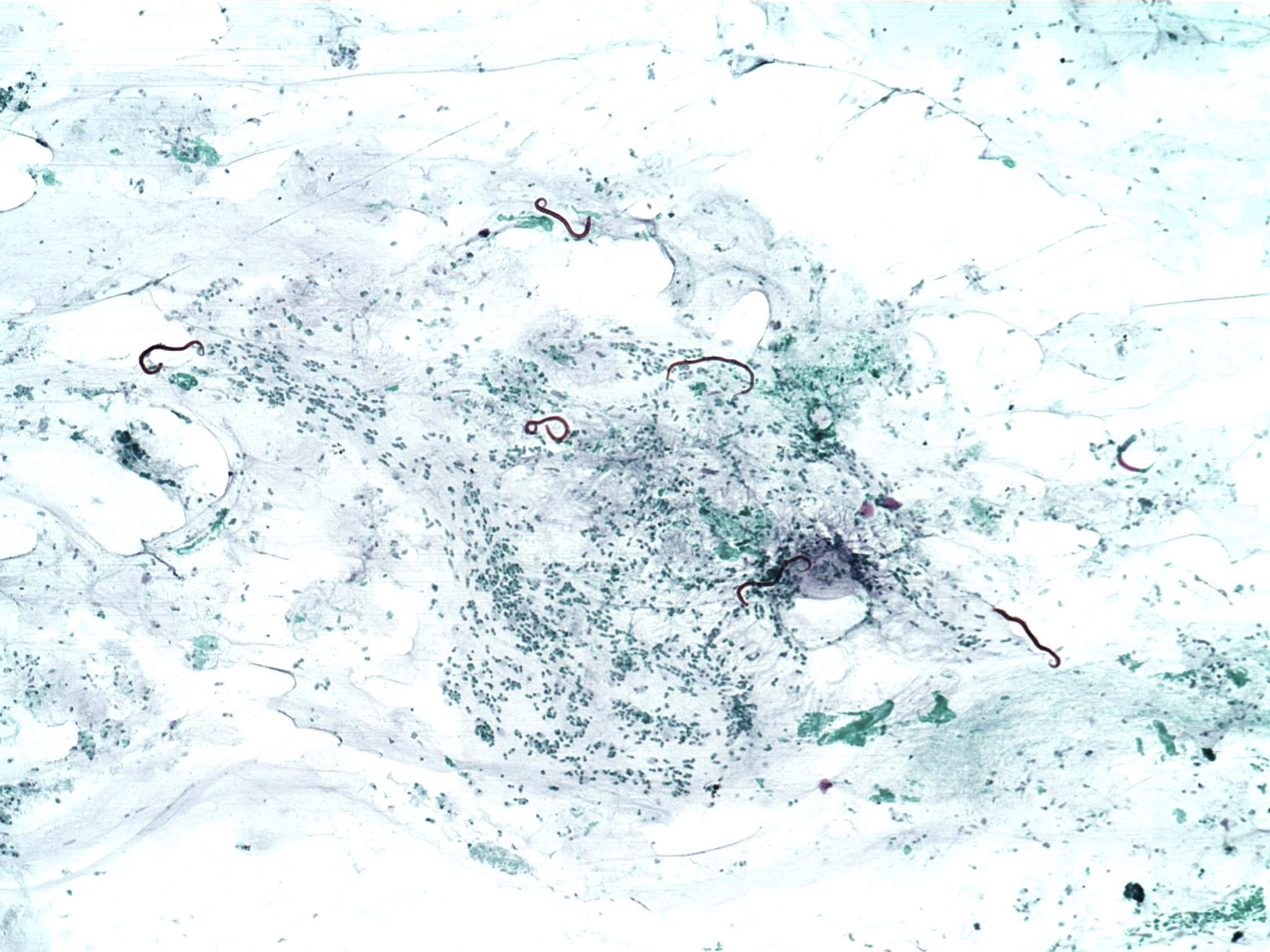
Las larvas rabditiformes eliminadas con las heces maduran en el suelo a larvas filariformes ya infestantes al ser capaces de penetrar en la piel humana íntegra, momento en el que producen una erupción lineal con prurito local que indica el paso de la larva por la piel (larva currens). Las larvas filariformes (0,6mm de longitud) progresan hasta las venas de la dermis, llegan a las cavidades derechas del corazón y alcanzan los pulmones, donde rompen los capilares alveolares causando una pequeña hemorragia local y una neumonitis eosinofílica.
Desde los alvéolos y bronquiolos emigran hacia la laringe y la tráquea, pero muchas son deglutidas, llegando al estómago e intestino delgado. Una vez ahí, las larvas filariformes maduran a gusano adulto. Las hembras, de 2-2,5mm de largo, se incrustan en túneles que horadan en la mucosa del intestino delgado y producen los huevos que dan lugar a las larvas rabditiformes que son eliminadas con las heces. No obstante, un número pequeño de las larvas no infestantes maduran en el intestino grueso a filariformes y estas a gusanos adultos que atraviesan su pared (endo-autoinfestación), o penetran a través de la piel perianal (exo-autoinfestación). Tanto las larvas como los gusanos adultos autoinfestantes suelen llevar bacterias entéricas y causar un foco séptico en cualquier órgano45.
Igualmente, manos, uñas o alimentos contaminados, pueden llevar larvas filariformes que penetran por vía oral, accediendo así directamente al intestino y haciendo que los parásitos puedan permanecer allí durante toda la vida del portador.
ClínicaAdemás de síntomas inespecíficos (malestar general, urticaria, náuseas, dolor abdominal, diarrea, pérdidas hemáticas, adelgazamiento, tos irritativa, hemoptisis), la estrongiloidiasis posee el signo cutáneo patognomónico de la larva currens.
Pero sobre todo, aunque no solo, en inmunodeprimidos puede producir 2 cuadros graves: a) hiperinfestación por aceleración de su ciclo madurativo que conduce a una gran carga de parásitos, y b) estrongiloidiasis diseminada con siembra de larvas filariformes en hígado, corazón, cerebro o riñones. Como, además, las larvas transportan bacterias intestinales, suele haber bacteriemia polimicrobiana y en especial por Escherichia coli y Streptococcus bovis, de manera que esta puede deberse a estrongiloides y no a una neoplasia de colon45-50.
Los pacientes con hiperinfestación o con estrongiloidiasis diseminada sufren con frecuencia un cuadro muy grave de neumonía, shock, meningitis con grampositivos o gramnegativos en el LCR, coagulación intravascular diseminada, peritonitis y fracaso multiorgánico. De ahí que deba buscarse este parásito ante tales situaciones en pacientes inmunodeprimidos y con eosinofilia.
Diagnóstico y tratamientoEl examen directo de las heces solo demuestra las larvas de estrongiloides en un tercio de los infestados. La tinción con auramina, aunque laboriosa (dura 2-3días), es mucho más sensible, al igual que el inmunoanálisis enzimático en suero51. De ahí que, si existe sospecha clínica, deba buscarse el parásito en el esputo, lavado bronquial, biopsias transbronquiales, contenido duodenal y en biopsias digestivas altas y bajas en pacientes con clínica digestiva y signos endoscópicos de inflamación. Igualmente, en pacientes con gastroenteritis eosinofílica «idiopática» debe pensarse en el estrongiloides como etiología, ya que si, como es frecuente, las larvas no se ven en las heces, el tratamiento con glucocorticoides puede producir una hiperinfestación fatal48 (fig. 5).
En cuanto al tratamiento, la ivermectina (dosis única de 200μg/kg), es el fármaco de elección. También son eficaces, aunque en menor medida, el tiabendazol (con notorios efectos secundarios) y el albendazol (400mg/día, 3días). Frecuentemente no basta con un solo ciclo, por lo que si persisten los síntomas se aconseja repetirlo a la semana, y si no cedieran se deben buscar estrongiloides en heces, esputo y biopsias52.
Respuesta inmune a los geohelmintosLa exposición del feto a antígenos de geohelmintos transmitidos por la madre a través de la placenta, o la del neonato a los parásitos, pueden inducir tolerancia a los mismos9. Sin embargo, más adelante, salvo el tricocéfalo, que produce una respuesta inmune mixta, los geohelmintos provocan una respuesta del tipo 2 caracterizada por la inducción de: a) células Th2 CD4+ productoras de las citoquinas IL-4, IL-5 e IL-13; b) células B, productoras de IgE, y c) incremento del número y actividad de las células epiteliales intestinales y de las células especializadas de la inmunidad innata: basófilos, eosinófilos y células cebadas.
El proceso se inicia por el reconocimiento de antígenos de los helmintos por las células epiteliales intestinales (CEI) productoras de las citoquinas IL-25 e IL-33 y linfopoyetina del estroma tímico (LPET), citoquina dependiente de NF-κB y específica de las CEI, con acción directa sobre las células dendríticas y esencial para la respuesta de adaptación celular mediada por linfocitos Th CD4+53,54. Además, la IL-25 y la LPET provocan la diferenciación de las células progenitoras multipotenciales tipo 2 y la hematopoyesis de basófilos. Estos granulocitos son claves en la presentación de antígenos de helmintos, responden a estímulos dependientes de IgE y generan grandes cantidades de citoquinas (IL-4, IL-13, LPET) activadoras de Th255. A su vez, los Th CD4+ producen IL-4, IL-5 e IL-13 mediadoras de la respuesta a antígenos de helmintos e inductoras de la formación de eosinófilos y basófilos.
Por otro lado, las células cebadas del epitelio intestinal, prototipo de células de la inmunidad innata, estimulan la producción de IL-25, IL-33 y LPET por las CEI y, tras ser activadas por IgE, se degranulan para, por un lado, producir IL-4, IL-5 e IL-6 (a su vez estimuladoras de la producción de IgE por los linfocitos B) y, por otro, IL-3 e IL-4 que activan la producción de mediadores de la inflamación como GM-CSF, TNFα, IL-8 e IL-956.
Expulsión de los helmintosLas «células linfoides innatas», semejantes a los linfocitos pero sin receptores de antígenos, son esenciales en la expulsión de los helmintos: a) por su respuesta inflamatoria a IL-25, y b) por producir gran cantidad de IL-13 (estimulada por IL-4)57. A su vez, IL-4/IL-13 estimulan la permeabilidad y la secreción de fluido intestinal y la contractilidad de las células musculares lisas del intestino.
Además, la IL-9, producida por Th, estimula la síntesis de IgE, incrementa la actividad de las células cebadas intestinales y la contractilidad de la musculatura intestinal58. Finalmente, este mecanismo es facilitado por la mucina (Muc5ac) producida por las células caliciformes y cuya secreción aumenta con la infestación intestinal por geohelmintos58.
En suma, respuesta inmune, inflamación y peristaltismo intestinal son vías por las que se consigue mantener a raya a los geohelmintos; pero que con frecuencia no impiden su cronicidad, sus efectos negativos sobre el parasitado e, incluso, su muerte. Como en tantas ocasiones, educación, ingeniería civil, agua potable, nuevos fármacos y vacunas son caminos a recorrer ante estas y otras enfermedades «olvidadas».
FinanciaciónNo se ha recibido financiación para la elaboración de este texto.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.elsevier.es/eimc/formacion