La bacteriemia por Staphylococcus aureus (SA) adquirida en la comunidad representa una causa frecuente de ingreso en niños. La aparición de focos secundarios (FS) condiciona una mayor morbimortalidad.
ObjetivosIdentificar factores de riesgo de aparición de FS de infección en niños con bacteriemia por SA de la comunidad.
Material y métodosCohorte prospectiva. Desde enero de 2010 a diciembre de 2016 se incluyeron todos los niños (de 30 días a 16 años), hospitalizados en un hospital pediátrico de derivación por infecciones adquiridas en la comunidad, con aislamiento de SA en hemocultivos. Se compararon características microbiológicas, demográficas y clínicas según presentaran o no FS de infección tras 72h de hospitalización.
ResultadosSe incluyeron 283 niños, el 65% varones (n=184), con una mediana de edad de 60 meses (RIC: 30-132). El 17% (n=48) tenían alguna enfermedad de base y el 97% (n=275) un foco clínico de infección, siendo los más frecuentes: osteoarticular el 55% (n=156) y abscesos de partes blandas el 27% (n=79). El 65% (n=185) eran SA resistentes a meticilina. Presentaron FS el 16% de los pacientes (n=44): neumonía el 73% (n=32), osteoarticular el 11% (n=5), partes blandas el 11% (n=5) y sistema nervioso central el 5% (n=2). En el análisis multivariado fueron predictores de FS la persistencia de hemocultivos positivos tras el quinto día (OR: 2,40; IC95%: 1,07-5,37; p<0,001) y la sepsis (OR: 17,23; IC95%: 5,21-56,9; p<0,001). No hubo asociación con la sensibilidad a la meticilina.
ConclusionesEn esta cohorte predominaron las infecciones por SA resistente a la meticilina. La aparición de FS se asoció con la persistencia de la bacteriemia después del quinto día y la sepsis al ingreso.
Community-acquired Staphylococcus aureus (SA) bacteraemia is a common cause of hospitalisation in children. The occurrence of secondary foci (SF) of SA infection is associated with higher morbidity and mortality.
ObjectivesTo identify risk factors for SF of infection in children with community-acquired SA bacteraemia.
Material and methodsProspective cohort. All children aged from 30 days to 16 years admitted to a paediatric referral hospital between January 2010 and December 2016 for community-acquired infections, with SA isolated in blood cultures, were included. Microbiological, demographic and clinical characteristics were compared, with or without SF infection after 72hours of hospitalisation.
ResultsA total of 283 patients were included, 65% male (n=184), with a median age of 60 months (IQR: 30-132). Seventeen per cent (n=48) had at least one underlying disease and 97% (n=275) had some clinical focus of infection, the most common being: osteoarticular 55% (n=156) and soft tissue abscesses 27% (n=79). A total of 65% (n=185) were resistant to methicillin. A SF of infection was found in 16% of patients (n=44). The SF identified were pneumonia 73% (n=32), osteoarticular 11% (n=5), soft tissue 11% (n=5) and central nervous system 5% (n=2). In the multivariate analysis, the persistence of positive blood cultures after the fifth day (OR: 2.40, 95%CI: 1.07–5.37, P<0.001) and sepsis (OR: 17.23, 95%CI 5.21-56.9, P<0.001) were predictors of SF. There was no association with methicillin sensitivity.
ConclusionsIn this cohort, methicillin-resistant SA infections predominated. The occurrence of SF of infection was associated with the persistence of bacteraemia after the fifth day and sepsis on admission.
Las infecciones por Staphylococcus aureus (SA) presentan una alta incidencia en pediatría. Habitualmente son infecciones leves de piel y partes blandas, pero a veces producen cuadros graves, como neumonía y sepsis1. En las formas graves se suele identificar el patógeno en los hemocultivos. La duración de la bacteriemia suele ser mayor y asociarse a mayor morbilidad respecto a otros patógenos. SA produce en forma variable proteínas citotóxicas como la alfa-toxina y la leucocidina de Panton-Valentine (LPV) que se asocian con formas clínicas más graves. Se ha descrito mayor duración de los hemocultivos positivos en los pacientes con focos supurados no drenados, tratamiento inadecuado y en aquellos pacientes con SA resistente a meticilina (SAMR) adquirido en la comunidad2,3. En estos pacientes con bacteriemia prolongada por SA, la aparición de focos secundarios de infección no es infrecuente y se asocia con mayor morbimortalidad4,5 y prolongación del tiempo de tratamiento antibiótico intravenoso6.
Los objetivos de este estudio son describir las características epidemiológicas y la frecuencia de aparición de focos secundarios de infección en una cohorte de niños con bacteriemia por SA adquirido en la comunidad e identificar los factores de riesgo que se asocian con la aparición de estos focos secundarios.
Material y métodosDesde el 1 de enero de 2010 al 31 de diciembre de 2016 se incluyeron prospectivamente todos los pacientes con bacteriemia por SA. Fueron criterios de inclusión ser mayor de 30 días y menor de 16 años, haber sido hospitalizado en el Hospital de Pediatría Prof. Dr. Juan P. Garrahan por infecciones adquiridas en la comunidad, con al menos, un hemocultivo tomado dentro de las primeras 48h de ingreso con crecimiento de SA. Se excluyeron los pacientes que hubiesen permanecido ingresados al menos 24h durante los últimos 6 meses, los que acudieran, al menos semanalmente, a un centro relacionado con los cuidados de la salud, y los que tuvieran catéter de larga permanencia o que vivieran en comunidades cerradas. El hospital donde se realizó el estudio es un centro de atención de tercer nivel en la ciudad de Buenos Aires, Argentina. Este centro atiende a pacientes que consultan en forma espontánea o derivados de otras instituciones de todo el país. Para el procesamiento de hemocultivos se utilizó el sistema automatizado Bact/Alert 3D. La identificación y tipificado de SA se realizó mediante pruebas microbiológicas convencionales y automatizadas, siguiendo los protocolos de trabajo vigentes en el laboratorio de Microbiología. La resistencia a la meticilina se determinó por el método de difusión con discos de cefoxitina de 30μg, así como la resistencia a la rifampicina (5μg), a la gentamicina (10μg), al trimetoprim-sulfametoxazol (25μg), a la eritromicina (15μg) y a la clindamicina (2μg) realizando, para todos los casos, antibiogramas por difusión en agar Müeller-Hinton, incubando a 37°C durante 24h. Los antibiogramas se interpretaron según las normas del Clinical and Laboratory Standards Institute vigentes5. La resistencia inducible a la clindamicina se identificó colocando el disco de este antibiótico a una distancia de 25mm del disco de eritromicina en el antibiograma. La concentración inhibitoria mínima de la vancomicina se determinó por el método de gradiente de difusión utilizando tiras de Etest®.
Se registraron en una base de datos los antecedentes y las características clínicas y evolutivas de los pacientes. Los pacientes ingresaron a la cohorte el día de su ingreso hospitalario y permanecieron en seguimiento hasta el alta médica. Se compararon características microbiológicas (resistencia a la meticilina, número de hemocultivos positivos) y clínicas de los pacientes según presentaran o no foco secundario de infección tras 72h de documentación de la bacteriemia. Las características clínicas evaluadas fueron el sexo, la edad en meses, el antecedente de uso de antibióticos o inmunosupresores en el último mes, la presencia de comorbilidades, el foco clínico de infección y su localización, la documentación de fiebre, sepsis o shock séptico al ingreso, la aparición de trombosis venosa profunda, los requerimientos de cirugía o drenaje quirúrgico y los días transcurridos hasta el procedimiento, ingreso a unidades de cuidados intensivos o asistencia respiratoria mecánica, la aparición de un foco secundario de infección y el tipo de foco, los días transcurridos hasta la negativización de los hemocultivos, el tratamiento empírico y definitivo indicado, su duración parenteral y oral. Se registraron, también, la duración del ingreso y la mortalidad relacionada con la infección. Se evaluaron la mediana de glóbulos blancos, hemoglobina y plaquetas al ingreso de los pacientes, y el valor de proteína C reactiva al ingreso.
DefinicionesFoco secundario de infección: cualquier foco clínico de infección que no estuviera presente en el momento de la hospitalización del paciente y que se manifestara tras 72h de la fecha de los hemocultivos positivos.
Duración de la bacteriemia: tiempo en días transcurrido desde el inicio del tratamiento antibiótico adecuado y la fecha de los primeros hemocultivos negativos.
Tratamiento empírico: tratamiento antibiótico indicado sin información sobre los resultados de hemocultivos.
Tratamiento definitivo: tratamiento antibiótico indicado tras del informe de sensibilidad antibiótica de Microbiología.
Bacteriemia persistente: presencia de hemocultivos positivos tras el quinto día de tratamiento antibiótico adecuado.
Sepsis: disfunción de órganos que pone en riesgo la vida, provocada por una respuesta desmedida del huésped a una infección, con hipotensión arterial que revierte con la administración de fluidos intravenosos7.
Las variables categóricas se expresaron en porcentaje y las variables continuas en medianas y rango intercuartílico (RIC). El análisis de las variables continuas se realizó con test de T o Wilcoxon Rank-sum Test según su distribución. Para comparar variables categóricas, se utilizó el test de chi2. Se calculó el odds ratio (OR), su intervalo de confianza del 95% (IC95%) y el valor de p para cada grupo, para medir la fuerza de la asociación con la aparición de foco secundario de infección. Se consideró significativo un valor de p<0,05. Se incorporaron al modelo multivariado las variables que en el análisis bivariado tuvieran una p<0,2 y aquellas que por su relevancia clínica requirieran ser probadas en el modelo múltiple. Para el análisis se utilizó el programa Stata versión 10.0.
Consideraciones éticas: al inicio del seguimiento, se informó a los pacientes de la existencia del estudio, se les invitó a participar y se garantizó la confidencialidad de los datos y la absoluta reserva respecto a la identificación de los pacientes. Se les explicó a los pacientes y a sus familias las características del estudio. La práctica habitual indicada en cada caso no fue modificada por el desarrollo de este protocolo.
ResultadosEn el periodo de estudio se incluyeron 283 pacientes con crecimiento de SA en los hemocultivos. La mediana de edad fue 60 meses (RIC: 30-132), y el 65% (n=184) eran varones. El 17% (n=48) tenían alguna enfermedad de base. Las enfermedades de base subyacentes fueron dermatitis atópica en el 11% (n=30), antecedentes de broncobstrucción de repetición en el 5% (n=13) y otros en el 1% (n=5).
En el momento del ingreso tenían algún foco clínico de infección el 97% (n=275). Los focos de infección más frecuentemente diagnosticados al ingreso fueron: osteoarticular el 56% (n=156), abscesos de partes blandas el 28% (n=79), neumonía con derrame el 7% (n=21) y el 2% endocarditis (n=7). Todos los pacientes recibieron tratamiento empírico adecuado. Recibieron vancomicina empírica el 28% (n=79), clindamicina empírica el 67% (n=191), vancomicina y clindamicina el 5% (n=13). Se combinó el tratamiento empírico con cefalosporinas de tercera generación en el 41% de los casos (n=117).
Se identificó SAMR en el 65% (n=185). La resistencia a clindamicina se documentó en el 8% de los pacientes (n=22). La mediana de duración de la bacteriemia fue 5 días (RIC: 3-5 días). Requirieron algún tipo de cirugía el 64% de los pacientes de la cohorte (n=180). Ingresaron en unidades de cuidados intensivos el 20% (n=56). Fallecieron en relación con la infección el 5% (n=13). La mediana de días de ingreso fue 15 días (RIC: 11-28).
Se identificó algún foco secundario de infección en el 16% de los pacientes de la cohorte (n=44). Los más frecuentes fueron neumonía en el 73% (n=32), infección osteoarticular en el 11% (n=5), de partes blandas en el 11% (n=5) y del sistema nervioso central en el 5% (n=2).
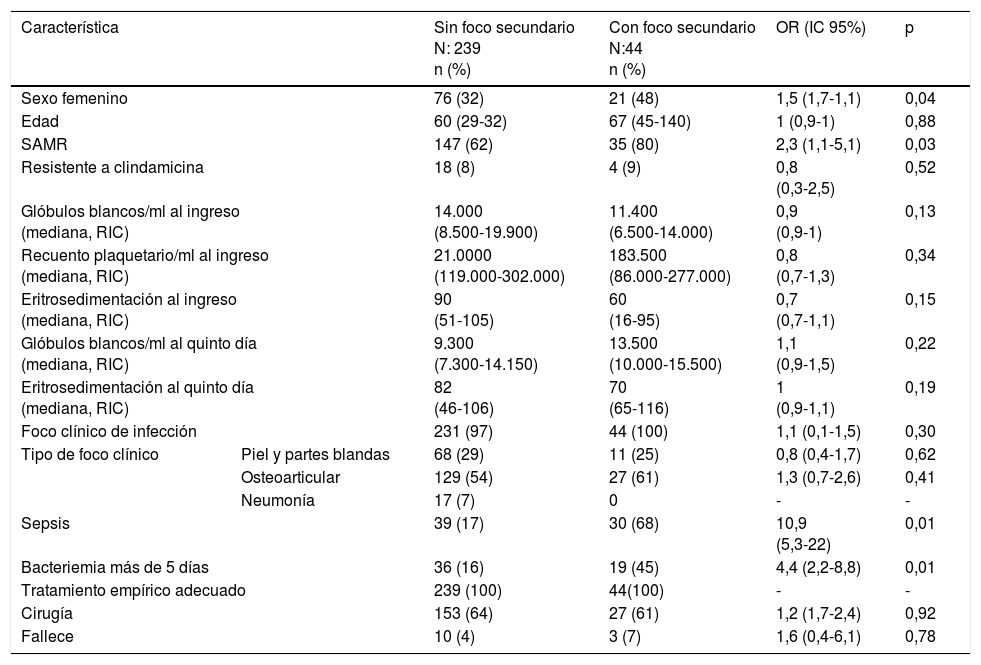
En el análisis bivariado (tabla 1), se asociaron con la aparición de focos secundarios de infección: el sexo femenino (OR: 1,5; IC95%: 1,7-1,1; p=0,04), la bacteriemia por SAMR (OR: 2,3; IC95%: 1,1-5,1; p=0,03), el mayor número de hemocultivos positivos (OR: 1,7; IC95%: 1,4-2,1; p<0,01), la persistencia de la bacteriemia después del quinto día de tratamiento adecuado (OR: 4,4; IC95%: 2,2-8,8; p<0,01) y la sepsis (OR: 10,9; IC95%: 5,3-22,6; p<0,1). No se encontró asociación con la edad, la sensibilidad a la clindamicina, ni el tipo de foco clínico al ingreso en el análisis bivariado.
Características clínicas. Análisis bivariado
| Característica | Sin foco secundario N: 239 n (%) | Con foco secundario N:44 n (%) | OR (IC 95%) | p | |
|---|---|---|---|---|---|
| Sexo femenino | 76 (32) | 21 (48) | 1,5 (1,7-1,1) | 0,04 | |
| Edad | 60 (29-32) | 67 (45-140) | 1 (0,9-1) | 0,88 | |
| SAMR | 147 (62) | 35 (80) | 2,3 (1,1-5,1) | 0,03 | |
| Resistente a clindamicina | 18 (8) | 4 (9) | 0,8 (0,3-2,5) | 0,52 | |
| Glóbulos blancos/ml al ingreso (mediana, RIC) | 14.000 (8.500-19.900) | 11.400 (6.500-14.000) | 0,9 (0,9-1) | 0,13 | |
| Recuento plaquetario/ml al ingreso (mediana, RIC) | 21.0000 (119.000-302.000) | 183.500 (86.000-277.000) | 0,8 (0,7-1,3) | 0,34 | |
| Eritrosedimentación al ingreso (mediana, RIC) | 90 (51-105) | 60 (16-95) | 0,7 (0,7-1,1) | 0,15 | |
| Glóbulos blancos/ml al quinto día (mediana, RIC) | 9.300 (7.300-14.150) | 13.500 (10.000-15.500) | 1,1 (0,9-1,5) | 0,22 | |
| Eritrosedimentación al quinto día (mediana, RIC) | 82 (46-106) | 70 (65-116) | 1 (0,9-1,1) | 0,19 | |
| Foco clínico de infección | 231 (97) | 44 (100) | 1,1 (0,1-1,5) | 0,30 | |
| Tipo de foco clínico | Piel y partes blandas | 68 (29) | 11 (25) | 0,8 (0,4-1,7) | 0,62 |
| Osteoarticular | 129 (54) | 27 (61) | 1,3 (0,7-2,6) | 0,41 | |
| Neumonía | 17 (7) | 0 | - | - | |
| Sepsis | 39 (17) | 30 (68) | 10,9 (5,3-22) | 0,01 | |
| Bacteriemia más de 5 días | 36 (16) | 19 (45) | 4,4 (2,2-8,8) | 0,01 | |
| Tratamiento empírico adecuado | 239 (100) | 44(100) | - | - | |
| Cirugía | 153 (64) | 27 (61) | 1,2 (1,7-2,4) | 0,92 | |
| Fallece | 10 (4) | 3 (7) | 1,6 (0,4-6,1) | 0,78 | |
IC: intervalo de confianza del 95%; OR: odds ratio; RIC: rango intercuartílico; SAMR: Staphylococcus aureus resistente a la meticilina.
En el modelo multivariado se identificaron como predictores de aparición de un foco secundario de infección la persistencia de hemocultivos positivos después del quinto día (OR: 2,40; IC95%: 1,07-5,37; p<0,001) y la sepsis (OR: 17,2; IC95%: 5,2-56,9; p<0,001). Ajustando por las otras variables del modelo, no se encontró asociación entre la resistencia a la meticilina y la aparición de focos secundarios.
DiscusiónLas infecciones por SA representan una causa frecuente de consulta pediátrica. Suelen presentarse como infecciones leves de piel y partes blandas, pero en ocasiones requieren ingreso, tratamiento antibiótico intravenoso y procedimientos quirúrgicos8.
Las formas clínicas más graves de infección pueden presentarse con bacteriemia. Los hemocultivos son positivos en el 5% de los niños con infecciones por SA adquiridas en la comunidad9. Al igual que en el estudio realizado, la mediana de duración de la bacteriemia por SA descrita en la literatura es de 3 a 5 días10. La prolongación de la bacteriemia se relaciona con el drenaje tardío de los focos supurados, con el tratamiento antibiótico inadecuado y con la presencia de dispositivos intravasculares no retirados (catéteres, prótesis)11. La mayor duración de la bacteriemia condiciona la prolongación de la internación y del uso de antibióticos12.
En este estudio las infecciones por SA se presentaron en niños sin los factores de riesgo descritos en adultos con infecciones estafilocócicas13. Tampoco la resistencia a la meticilina se asoció a enfermedades subyacentes. Al igual que en otras publicaciones predominaron los aislamientos de SAMR. En nuestro medio la resistencia a la meticilina de SA adquirido en la comunidad comunicada es del 65%14. La frecuencia de aparición de focos secundarios de infección en pacientes con bacteriemia por SA descrita en otros estudios es del 2-25%15,16. En un estudio realizado por Praino et al.17 la frecuencia de focos metastásicos de infección en niños con hemocultivos positivos para SA fue del 15%. Coincidentemente con la literatura, en este trabajo fue del 16%. En un estudio de cohorte de 186 pacientes con bacteriemia por SA, se asociaron la presencia de focos secundarios de infección y la baja dosis de antibiótico con la persistencia de hemocultivos positivos5. Otro estudio realizado en niños también encontró asociación entre el foco secundario y la bacteriemia persistente15. En la cohorte presentada, la aparición de focos secundarios de infección se asoció estadísticamente a la mayor duración de la bacteriemia y al compromiso hemodinámico como forma de presentación.
Se discute en la literatura cuáles son los verdaderos factores de virulencia de SA. Algunos autores proponen a la LPV como principal factor de virulencia18,19. Sicot et al. evaluaron en Francia la asociación entre mortalidad y la resistencia a la meticilina en pacientes con neumonía por SA productor de LPV. No se encontró asociación entre la resistencia a la meticilina y la mortalidad20. En las cepas de SA de esta cohorte no se evaluaron en forma sistemática la presencia de LPV. Sin embargo, se reporta en Argentina el predominio de los clones ST5-IV y ST30-IV, ambos productores de LPV en infecciones por SA adquiridas en la comunidad21.
Otros factores asociados al peor pronóstico en los pacientes con infecciones por SA son la resistencia antibiótica22, la concentración inhibitoria mínima más elevada23,24 y otras toxinas sintetizadas por SA25. Al igual que en otras publicaciones4,15, no se encontró en la cohorte presentada asociación estadística entre la resistencia a la meticilina y la aparición de focos secundarios de infección.
La asociación del antibiótico empírico adecuado y el pronóstico de la bacteriemia por SA ha sido ampliamente debatida en la literatura26,27. En una cohorte de 510 pacientes con bacteriemia por SA, Paul et al.28 reportan asociación estadística entre la mortalidad a los 30 días y tratamiento empírico inadecuado. La presencia de algoritmos de diagnóstico y tratamiento de las infecciones de piel, partes blandas y osteoarticulares en la institución y el manejo multidisciplinario con Infectología permitió que todos los pacientes de esta cohorte tuvieran tratamiento empírico adecuado. Es por ello que esta variable no pudo ser explorada como factor pronóstico. La implementación de paquetes de medidas que incluyan guías de práctica clínica y consulta precoz al infectólogo han demostrado mejorar el pronóstico y reducir la mortalidad de los pacientes con bacteriemia por SA29.
Este estudio permitió identificar en una cohorte de niños sanos provenientes de la comunidad a aquellos con más riesgo de aparición de focos secundarios. En los pacientes con bacteriemia por SA con sepsis como forma de presentación y mayor duración de la bacteriemia se deberían buscar en forma exhaustiva otros focos de infección, independientemente de la sensibilidad antibiótica. La neumonía fue en esta cohorte el principal foco metastásico de infección por SA. Si bien esta evidencia surge de un modelo multivariado aplicado en una cohorte prospectiva de pacientes, la asociación estadística no permite inferir causalidad. La principal debilidad del estudio es el riesgo de causalidad inversa: este estudio no permite dilucidar si es la mayor duración de la bacteriemia y la sepsis la que determina la aparición de un foco secundario, o viceversa.
En conclusión, en esta cohorte predominaron las infecciones por SAMR. Los focos secundarios de infección se presentaron en el 16% de los niños con bacteriemia por SA. El foco secundario más frecuente fue la neumonía. La aparición de focos secundarios de infección se asoció con la persistencia de la bacteriemia después del quinto día y la sepsis al ingreso.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.