Analizar y comparar los factores predictivos de meningitis bacteriana (MB) en los pacientes que acuden al servicio de urgencias (SU) por un episodio de meningitis aguda (MA).
MétodosEstudio observacional y prospectivo de pacientes adultos (≥15años) diagnosticados de MA en un SU desde agosto de 2009 hasta noviembre de 2015. Se analizaron 32 variables (epidemiológicas, de comorbilidad, clínicas y analíticas) que pudieran predecir etiología bacteriana. Se realizó un estudio multivariable mediante regresión logística.
ResultadosSe incluyó a 154 pacientes, de los que 53 (34,4%) fueron MB. Cuatro variables se asociaron de forma significativa como predictores de etiología bacteriana: lactato en líquido cefalorraquídeo (LCR) ≥33mg/dl (odds ratio [OR]: 50,84; intervalo de confianza [IC] al 95%: 21,63-119,47; p<0,001); procalcitonina (PCT) sérica ≥0,8ng/ml (OR: 46,34; IC95%: 19,71-108,89; p<0,001), glucorraquia <60% de la glucemia (OR: 20,82; IC95%: 8,86-48,96; p=0,001), proporción de polimorfonucleares (PMN) en LCR >50% (OR: 20,19; IC 95%: 8,31-49,09; p=0,002). El área bajo la curva-ROC del modelo (PCT≥0,8ng/ml+lactato en LCR ≥33mg/dl) fue 0,992 (IC95%: 0,979-1; p<0,001) y consigue una sensibilidad del 99% y una especificidad del 98% para predecir MB.
ConclusionesLa PCT sérica, junto con la valoración del lactato, glucorraquia y proporción de PMN del LCR en la evaluación inicial del paciente con sospecha de MA en el SU, tienen un excelente rendimiento diagnóstico para predecir la MB.
To analyse and compare predictive factors of bacterial meningitis in the patients seen in the Emergency Departments (ED) due to an episode of acute meningitis (AM).
MethodsA prospective, observational study was carried out in patients aged 15 years and older seen in ED due to AM between August 2009 and November 2015. Thirty-two variables for predicting bacterial meningitis were assessed. They covered epidemiological, comorbidity, clinical and analytical factors. Multivariate logistic regression analysis was performed.
ResultsThe study included 154 patients. The diagnosis was bacterial meningitis in 53 (34.4%) patients. Four variables were significantly associated with bacterial aetiology: cerebrospinal fluid (CSF) lactate concentration ≥33mg/dl (odds ratio [OR] 50.84; 95% confidence interval [CI]: 21.63-119.47, P<.001), serum procalcitonin (PCT) ≥0.8ng/ml (OR 46.34; 95%CI: 19.71-108.89; P<.001), CSF glucose <60% of blood value (OR 20.82; 95%CI: 8.86-48.96; P=.001), CSF polymorphonuclears greater than 50% (OR 20.19; 95%CI: 8.31-49.09; P=.002]. The area under the curve for the model serum PCT≥0.8ng/ml plus CSF lactate ≥33mg/dl was 0.992 (95%CI: 0.979-1; P<.001), and achieved 99% sensitivity and 98% specificity for predicting bacterial meningitis.
ConclusionsSerum PCT with CSF lactate, CSF glucose and CSF polymorphonuclears evaluated in an initial assessment in the ED for patients with AM, achieved an excellent diagnostic usefulness for predicting bacterial meningitis.
La meningitis bacteriana (MB) es un proceso inflamatorio de las leptomeninges que suele mostrar hallazgos típicos en el líquido cefalorraquídeo (LCR) del paciente: una intensa pleocitosis con predominio de polimorfonucleares (PMN) junto con un aumento de la proteinorraquia y disminución de la glucorraquia1. Aunque cuantitativamente no representa ninguno de los 10 procesos infecciosos más frecuentes atendidos en pacientes adultos en los servicios de urgencias (SU)2, sí supone el tipo de infección que con mayor frecuencia cumple criterios de sepsis, sepsis grave y shock séptico, lo que, unido a su importancia clínica, refleja su gravedad2,3. Asimismo, las complicaciones y la mortalidad que origina, incluso en el propio SU o en las primeras 24h de estancia hospitalaria, continúan siendo muy importantes proporcionalmente en relación con su escasa incidencia, aunque tampoco, en números absolutos, se sitúe entre las 10 primeras causas de fallecimiento en el SU4. Por todo ello, la sospecha de un posible origen bacteriano en una meningitis aguda (MA) continúa siendo un reto y adquiere una gran trascendencia en el SU hasta que los cultivos y técnicas de confirmación microbiológica nos determinen su origen, viral o bacteriano5. Incluso, desde la primera valoración o triaje del paciente se debería detectar y activar una prioridad de atención para los pacientes con sospecha de MA6, y el objetivo en estos dispositivos debería ser conseguir la máxima fiabilidad en la predicción de sospecha de una MB únicamente con las herramientas de que habitualmente se dispone (anamnesis, exploración física y pruebas complementarias) en estos dispositivos7, hasta que las pruebas de confirmación microbiológica determinen su verdadera etiología.
La anamnesis y las manifestaciones clínicas de la MB no la diferencian de la meningitis viral (MV)1,8. Estas manifestaciones son más inespecíficas en las edades extremas de la vida (neonatos y ancianos), en inmunodeprimidos, en diabéticos y en otros enfermos especialmente susceptibles de padecer infecciones graves, en los cuales los signos y síntomas habituales no proporcionan una sensibilidad ni especificidad óptimas para sospechar una MA primero, ni distinguir posteriormente una posible MB de una MV8-10.
Además, en estos pacientes la administración adecuada y precoz del antibiótico es muy importante para la evolución y supervivencia del paciente11,12. Por ello se justifica el interés de disponer desde el SU de herramientas útiles e inmediatas para sospechar y distinguir los casos de MB de los de MV. Entre ellas se encuentran los biomarcadores de inflamación e infección, y especialmente destaca por su mayor rendimiento diagnóstico la procalcitonina (PCT) en las determinaciones de la analítica en sangre13-16. Por su parte, en el análisis del LCR, recientes publicaciones otorgan al lactato el mayor poder diagnóstico predictivo de MB, frente al recuento celular (pleocitosis), a la proporción de PMN o a la glucorraquia existente17,18.
Por todo ello, el objetivo de este trabajo fue determinar qué factores identificables de los utilizados en la primera valoración en el SU, incluyendo anamnesis y exploración clínica, determinación de biomarcadores en sangre y análisis del LCR, se relacionan con el diagnóstico microbiológico bacteriano en los pacientes con sospecha de MA. Y secundariamente, explorar el rendimiento diagnóstico individual y combinado de los factores encontrados con mayor rendimiento diagnóstico.
Pacientes y métodoDiseñoSe elaboró un estudio observacional, prospectivo, de pacientes diagnosticados de MA en el SU. Se mantuvo un seguimiento de ellos hasta el fallecimiento del paciente en el hospital o durante los 30días posteriores al ingreso en el SU.
Sitio del estudioSe realizó en un centro de tercer nivel (Complejo Hospitalario de Toledo) de 786 camas con un área de referencia de unas 437.000 personas. Durante el periodo que duró el estudio se atendieron una media de 448 urgencias/día.
Periodos del estudio y población estudiadaDesde el 15 agosto de 2009 hasta 15 de noviembre de 2015 se incluyeron de forma consecutiva todos los pacientes con 15 o más años de edad diagnosticados de MA en el SU a los que se les realizó punción lumbar; se extrajeron hemocultivos y muestras para analítica sanguínea en la que se analizaron biomarcadores de infección (proteínaC reactiva [PCR] y PCT) y los demás valores analíticos analizados en el estudio.
Para todos los casos registrados se consideraron 6 grupos en función del diagnóstico final confirmado:
- 1.
MB ante el aislamiento del patógeno o sus antígenos capsulares en el LCR (en este caso, además, se comprobó la existencia concomitante o no de bacteriemia).
- 2.
MV cuando se confirmó por amplificación de reacción en cadena de la polimerasa para virus de las familias herpes (ADN) y enterovirus (ARN) en el LCR.
- 3.
Probable MV, con cultivo bacteriano negativo tanto en el LCR como en los hemocultivos.
- 4.
Posible MB decapitada cuando existió un perfil bacteriano en el LCR y el antecedente de toma de antibióticos en las 72h previas, y los cultivos de LCR y hemocultivos fueron negativos.
- 5.
Posible MA con perfil bacteriano sin toma de antibióticos previamente y con cultivos de LCR y hemocultivos negativos.
- 6.
MA con confirmación microbiológica posterior de meningitis tuberculosa.
No se incluyeron pacientes con sospecha de otro posible foco bacteriano primario no relacionado con el episodio de MA (salvo faringitis, sinusitis u otitis) para evitar posibles falsos positivos de los biomarcadores14, ni a los pacientes que fueron diagnosticados de un segundo caso de MA durante el periodo del estudio o de meningitis autoinmune durante el seguimiento, ni a los pacientes con antecedentes neuroquirúrgicos ni con infecciones relacionadas con dispositivos intraventriculares y derivaciones del LCR.
El estudio cumplía las normas éticas de nuestro hospital. Todos los datos codificados se manejaron con confidencialidad y con el único conocimiento del equipo investigador. El seguimiento de todos los pacientes se realizó a través de la historia clínica informatizada hospitalaria y de atención primaria. El estudio no supuso ninguna intervención terapéutica ni tuvo ninguna implicación clínica.
Variables recogidasSe registraron variables sociodemográficas (edad, sexo) y comorbilidades (existencia de enfermedad tumoral sólida u oncohematológica, hepatopatía, nefropatía, diabetes, enfermedad cardiaca crónica o cerebrovascular), infección por el virus de la inmunodeficiencia humana (VIH), estado de inmunodepresión (pacientes con trasplante de órgano sólido, esplenectomía, tratados con 10mg o más de prednisona al día o equivalentes durante más de 30días, o tratados con otros agentes inmunosupresores en el último año). Se calculó el índice de Charlson19. Se recogieron variables clínicas (fiebre con una temperatura ≥38°C, alteración de la consciencia, cefalea, rigidez de nuca y signos de irritación meníngea —Kernig y Brudzinski— y el hallazgo de exantema) y de gravedad incluidas en los criterios de definición de síndrome de respuesta inflamatoria sistémica, sepsis, sepsis grave y shock séptico según la conferencia internacional de expertos de sepsis de 200120. A estas variables se añadieron la toma de tratamiento antibiótico en las 72h previas a su visita al SU, el tiempo desde el inicio de la sintomatología, el tiempo de estancia hospitalaria y la mortalidad (hasta el fallecimiento del paciente en el hospital o durante los 30 días posteriores al ingreso).
En relación con las variables analíticas que se realizaron a todos los pacientes, además del hemograma, el estudio de coagulación y la bioquímica básica, se analizaron las concentraciones en suero de PCR y PCT y las características del LCR (pleocitosis y proporción de PMN, proteinorraquia, glucorraquia y su proporción en relación con la glucemia simultánea y concentración de lactato). Los valores elegidos como referencia en las determinaciones, y las dicotomizaciones realizadas, se definieron por los autores de forma arbitraria. Esto se hizo atendiendo a los valores definidos como normales por nuestro laboratorio (que se muestran posteriormente), que además son utilizados en algunos estudios recientemente publicados que se han tomado de ejemplo14,16-18. Los estudios microbiológicos realizados fueron hemocultivos, tinciones de Gram y Ziehl-Neelsen, cultivo de LCR, detección de antígenos capsulares y detección por amplificación de reacción en cadena de la polimerasa de ADN (familias herpes) y ARN (familia enterovirus).
Definiciones, técnicas y métodos establecidos para las muestrasSe adoptaron los valores de referencia normales de nuestro laboratorio: PCR: 0-8mg/l y PCT<0,5ng/ml. La PCR se determinó por inmunoanálisis enzimático cuantitativo (Slides Vitros CRP®) con una sensibilidad de 1mg/l. Y la PCT por inmunoanálisis cuantitativo de electroquimioluminiscencia (Elecsys Brahms PCT®) con una sensibilidad de 0,02ng/ml.
Para el estudio del LCR se consideró este como normal (según los valores de referencia de nuestro laboratorio) ante la existencia de pleocitosis menor de 10 leucocitos/mm3, glucorraquia entre el 60-80% del valor de glucosa en suero, proteinorraquia de 15-45mg/dl y lactato <35mg/dl16-18. Y tal y como se ha comentado, se dicotomizaron algunas variables de forma arbitraria14,16-18: concentración de lactato en LCR dicotomizando cuando era >35mg/dl; recuento de leucocitos en sangre (mm3) dicotomizando cuando >12.000 o <4.000 o >10% de cayados; concentración de PCR (mg/l) tras dicotomizar si >8mg/l y si >54mg/l, y concentración de PCT sérica (ng/ml) tras dicotomizar cuando esta era >0,5 y en >1ng/ml.
Cuando el LCR fue patológico se definió: 1)un perfil bacteriano (con aumento de células con predominio de PMN y de la proteinorraquia y con disminución de glucorraquia); 2)un perfil linfocitario (con predominio de mononucleares con glucorraquia normal o disminuida), y 3)un perfil indeterminado (cuando no se cumplían las definiciones anteriores). Hemocultivos: 2 frascos aeróbicos y 2 anaerobios (BD Bactec®) procesados mediante el sistema automático Bactec/Alert® (BioMérieux, Durham, N.C, EE.UU.).
Análisis estadísticoPara el análisis estadístico se utilizaron medias y sus desviaciones estándar (DE) para variables cuantitativas y porcentajes para las cualitativas. Para investigar la relación entre el diagnóstico de MB y las variables independientes (características demográficas y comorbilidades, clínicas, de gravedad, de evolución y analíticas, y aquellas que se dicotomizaron) se utilizaron las pruebas de ji al cuadrado o exacta de Fisher, la t de Student y la U de Mann-Whitney, según fueran aplicables.
El estudio multivariante se realizó por un modelo de regresión logística (se eligió el método «introducir», que fuerza la inclusión de todas las variables elegidas del modelo que fueron aquellas que tuvieron significación estadística en el análisis univariable). Los resultados de las comparaciones se expresaron por los valores de p y las odds ratio (OR) con su intervalo de confianza del 95% (IC95%), aceptándose como significativo un valor de p<0,05 o el IC95% de la OR excluye el valor 1.
La eficacia y la capacidad para la predicción de MB se estudió mediante el análisis de las curvas receiver operating characteristic (ROC) con el IC95% del área bajo la curva (ABC) de la curva ROC, y se comparó frente al valor neutro (0,5). Los errores estándar de las ABC se calcularon por métodos no paramétricos.
Para las variables que obtuvieron el mayor rendimiento diagnóstico (ABC-ROC) en suero (PCT) y LCR (lactato) se determinaron los puntos de corte (PC) con mayor capacidad diagnóstica que maximizaba la diferencia entre la tasa de verdaderos positivos y falsos positivos mediante el índice de Youden. De los PC escogidos se hallaron la sensibilidad (S), la especificidad (E), el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN), el coeficiente de probabilidad positivo (CP+) y el negativo (CP−) para los resultados estudiados, así como sus IC95% por métodos binomiales exactos y por el de Taylor para los CP.
Para el estudio de la capacidad predictiva de MB de las combinaciones estudiadas (PCT sérica y lactato en LCR, PMN y glucorraquia en LCR, y la combinación de la suma de estos 2 modelos) se utilizó el modelo de ajuste por regresión logística diferenciado en cada variable independiente. Las probabilidades así calculadas fueron sometidas a un análisis de las curvas ROC y a los mismos procedimientos que los marcadores individuales.
Se consideró como significativo un valor de p<0,05 y todos los contrastes fueron bilaterales. Se utilizó el programa IMB-SPSS® Statistics 19 para Windows.
ResultadosDurante el periodo de estudio se incluyeron 154 pacientes que cumplían los criterios de inclusión y de seguimiento, manteniendo el diagnóstico de MA dado en el SU a los 30días. La edad media (desviación estándar [DE]) fue de 44 (22) años, con el 59,7% varones (92 casos).
En la tabla 1 se describen los diagnósticos microbiológicos finales de todos los pacientes incluidos en el estudio. De ellos, 53 fueron MB confirmadas por cultivo en el LCR y/o hemocultivo, 35 casos de MV, 42 clasificados como «probable MV» con cultivos negativos (LCR y hemocultivos) y un perfil linfocitario del LCR, 12 posibles MA bacterianas decapitadas (con antecedente de toma de antibióticos y cultivos negativos), 10 MA sin diagnóstico microbiológico pero con perfil de LCR bacteriano y 2 casos de meningitis tuberculosa confirmados. En 32 pacientes con MB (60,4%) existió bacteriemia asociada.
Diagnósticos microbiológicos definitivos
| Diagnóstico microbiológico | n=154 |
|---|---|
| Meningitis bacteriana | 53 |
| Streptococcus pneumoniae | 27 (17 con HC+) |
| Neisseria meningitidis | 9 (6 con HC+) |
| Listeria monocytogenes | 7 (4 con HC+) |
| Haemophilus influenzae | 4 (1 con HC+) |
| Escherichia coli | 4 (2 con HC+) |
| Streptococcus milleri | 1 (1 con HC+) |
| Proteus mirabilis | 1 (1 con HC+) |
| Meningitis viral confirmada en LCRa | 35 |
| Enterovirus | 32 |
| Virus herpes simplex | 3 |
| Meningitis viral probableb | 42 |
| Posible meningitis bacteriana decapitadac | 12 |
| Meningitis sin diagnóstico microbiológico con perfil bacteriano o indeterminadod | 10 |
| Mycobacterium tuberculosise | 2 |
HC+: hemocultivos positivos; LCR: líquido cefalorraquídeo; n: número de casos.
Diagnóstico microbiológico viral realizado por amplificación (reacción en cadena de la polimerasa) del ARN para enterovirus y ADN para virus herpes simplex.
Perfil bacteriano del LCR con antecedente de toma de antibióticos en las 72h anteriores con cultivo negativo en LCR y hemocultivos negativos.
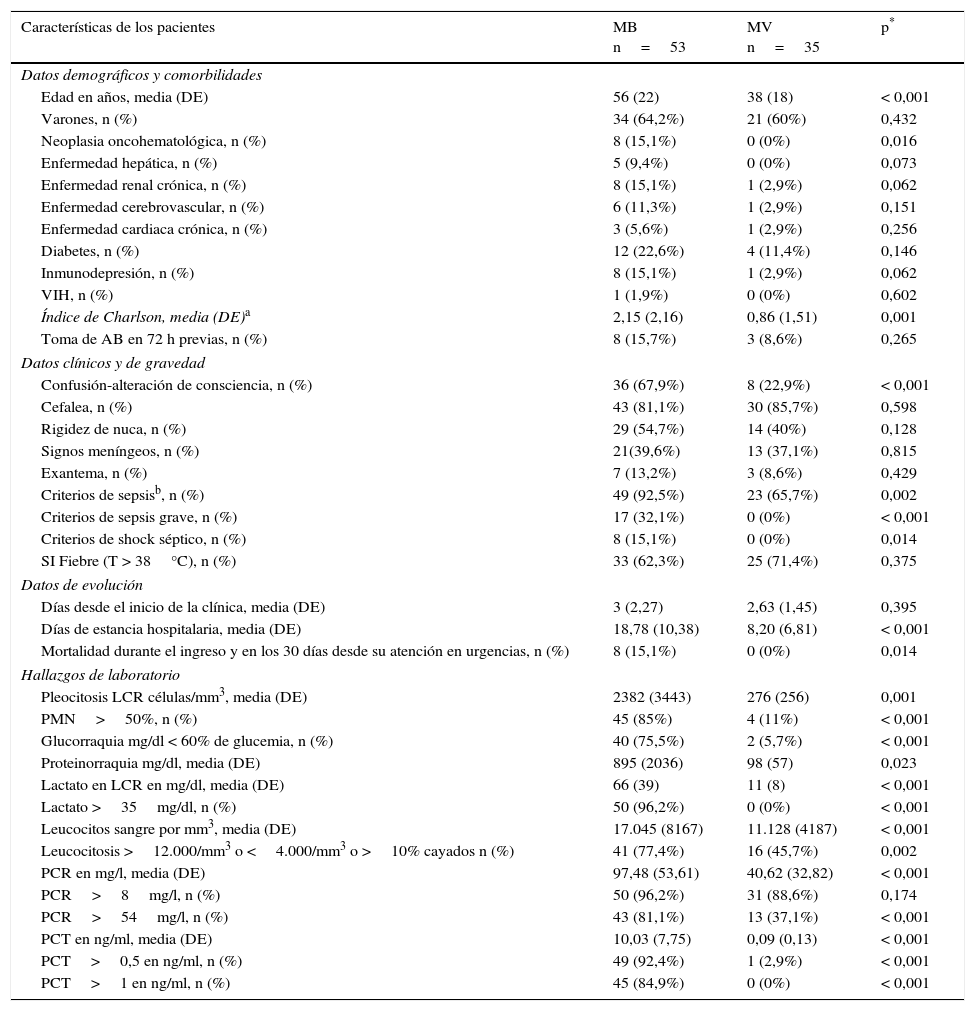
En la tabla 2 se muestran las características sociodemográficas, las comorbilidades, el cálculo del índice de Charlson, los datos clínicos, de gravedad y de evolución, y los resultados de las pruebas de laboratorio urgentes de los pacientes atendidos en el SU y con diagnóstico final de MB, así como del grupo de pacientes con el diagnóstico confirmado de MV, y el análisis univariable comparativo de ambos grupos. Se encontraron diferencias significativas entre los 2 grupos en la edad, en varias comorbilidades, así como en el índice de Charlson. En la presentación clínica hubo mayor incidencia de alteración de la consciencia en el grupo de MB respecto al grupo de MV (67,9% vs 22,9%, p<0,001), pero ni en la existencia de fiebre, cefalea, rigidez de nuca, signos de irritación meníngea ni presencia de exantema se encontraron diferencias entre las MB confirmadas y las MV. Tampoco existieron diferencias en cuanto a la toma previa de antimicrobianos, ni al tiempo de evolución desde el inicio de la sintomatología hasta acudir al SU. Por otro lado, sí hubo diferencias significativas en cuanto a la frecuencia de casos con criterios de sepsis (p=0,002), sepsis grave y shock séptico (p<0,001) a favor del grupo de MB frente a las MV. Así como se registraron una mayor estancia media en el ingreso hospitalario y una mayor mortalidad durante los 30días posteriores al ingreso a favor de las MB.
Características clinicoepidemiológicas, analíticas y de evolución de los pacientes atendidos en el servicio de urgencias con diagnóstico final de meningitis bacterianas y meningitis virales confirmadas (análisis univariable)
| Características de los pacientes | MB n=53 | MV n=35 | p* |
|---|---|---|---|
| Datos demográficos y comorbilidades | |||
| Edad en años, media (DE) | 56 (22) | 38 (18) | < 0,001 |
| Varones, n (%) | 34 (64,2%) | 21 (60%) | 0,432 |
| Neoplasia oncohematológica, n (%) | 8 (15,1%) | 0 (0%) | 0,016 |
| Enfermedad hepática, n (%) | 5 (9,4%) | 0 (0%) | 0,073 |
| Enfermedad renal crónica, n (%) | 8 (15,1%) | 1 (2,9%) | 0,062 |
| Enfermedad cerebrovascular, n (%) | 6 (11,3%) | 1 (2,9%) | 0,151 |
| Enfermedad cardiaca crónica, n (%) | 3 (5,6%) | 1 (2,9%) | 0,256 |
| Diabetes, n (%) | 12 (22,6%) | 4 (11,4%) | 0,146 |
| Inmunodepresión, n (%) | 8 (15,1%) | 1 (2,9%) | 0,062 |
| VIH, n (%) | 1 (1,9%) | 0 (0%) | 0,602 |
| Índice de Charlson, media (DE)a | 2,15 (2,16) | 0,86 (1,51) | 0,001 |
| Toma de AB en 72 h previas, n (%) | 8 (15,7%) | 3 (8,6%) | 0,265 |
| Datos clínicos y de gravedad | |||
| Confusión-alteración de consciencia, n (%) | 36 (67,9%) | 8 (22,9%) | < 0,001 |
| Cefalea, n (%) | 43 (81,1%) | 30 (85,7%) | 0,598 |
| Rigidez de nuca, n (%) | 29 (54,7%) | 14 (40%) | 0,128 |
| Signos meníngeos, n (%) | 21(39,6%) | 13 (37,1%) | 0,815 |
| Exantema, n (%) | 7 (13,2%) | 3 (8,6%) | 0,429 |
| Criterios de sepsisb, n (%) | 49 (92,5%) | 23 (65,7%) | 0,002 |
| Criterios de sepsis grave, n (%) | 17 (32,1%) | 0 (0%) | < 0,001 |
| Criterios de shock séptico, n (%) | 8 (15,1%) | 0 (0%) | 0,014 |
| SI Fiebre (T > 38°C), n (%) | 33 (62,3%) | 25 (71,4%) | 0,375 |
| Datos de evolución | |||
| Días desde el inicio de la clínica, media (DE) | 3 (2,27) | 2,63 (1,45) | 0,395 |
| Días de estancia hospitalaria, media (DE) | 18,78 (10,38) | 8,20 (6,81) | < 0,001 |
| Mortalidad durante el ingreso y en los 30 días desde su atención en urgencias, n (%) | 8 (15,1%) | 0 (0%) | 0,014 |
| Hallazgos de laboratorio | |||
| Pleocitosis LCR células/mm3, media (DE) | 2382 (3443) | 276 (256) | 0,001 |
| PMN>50%, n (%) | 45 (85%) | 4 (11%) | < 0,001 |
| Glucorraquia mg/dl < 60% de glucemia, n (%) | 40 (75,5%) | 2 (5,7%) | < 0,001 |
| Proteinorraquia mg/dl, media (DE) | 895 (2036) | 98 (57) | 0,023 |
| Lactato en LCR en mg/dl, media (DE) | 66 (39) | 11 (8) | < 0,001 |
| Lactato >35mg/dl, n (%) | 50 (96,2%) | 0 (0%) | < 0,001 |
| Leucocitos sangre por mm3, media (DE) | 17.045 (8167) | 11.128 (4187) | < 0,001 |
| Leucocitosis >12.000/mm3 o <4.000/mm3 o >10% cayados n (%) | 41 (77,4%) | 16 (45,7%) | 0,002 |
| PCR en mg/l, media (DE) | 97,48 (53,61) | 40,62 (32,82) | < 0,001 |
| PCR>8mg/l, n (%) | 50 (96,2%) | 31 (88,6%) | 0,174 |
| PCR>54mg/l, n (%) | 43 (81,1%) | 13 (37,1%) | < 0,001 |
| PCT en ng/ml, media (DE) | 10,03 (7,75) | 0,09 (0,13) | < 0,001 |
| PCT>0,5 en ng/ml, n (%) | 49 (92,4%) | 1 (2,9%) | < 0,001 |
| PCT>1 en ng/ml, n (%) | 45 (84,9%) | 0 (0%) | < 0,001 |
AB: antibiótico; DE: desviación estándar; LCR: líquido cefalorraquídeo; MA: meningitis aguda; MB: meningitis bacterianas confirmadas por microbiología; n: número de casos; PCR: proteína C reactiva; PCT: procalcitonina; PMN: polimorfonucleares; SU: servicio de urgencias; T: temperatura; VIH: virus de la inmunodeficiencia humana.
En relación con las pruebas urgentes de laboratorio, el estudio univariable (tabla 2) mostró que el diagnóstico de MB se relacionaba de forma directa con 8 variables: grado de pleocitosis (células/mm3); proporción de PMN>50%; glucorraquia (mg/dl)<60% de glucemia simultánea; valor de proteinorraquia (mg/dl); concentración de lactato en LCR (mg/dl) (y dicotomizando cuando era >35mg/dl); recuento de leucocitos en sangre (mm3) (y dicotomizando cuando >12.000 o <4.000 o>10% de cayados); concentración de PCR (mg/l) (y tras dicotomizar si >54mg/l), y concentración de PCT sérica (ng/ml) (y tras dicotomizar cuando esta era >0,5 y >1ng/ml).
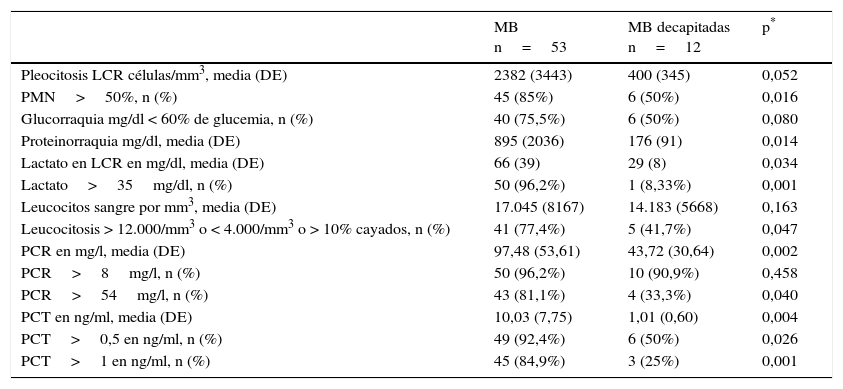
De la misma forma se muestra en la tabla 3 la comparación de las variables de laboratorio específicamente entre los casos confirmados de MB y en los posibles casos de MB decapitadas. En ella se comprueba que solo se encuentran diferencias significativas en la proporción mayor del 50% de PMN, la proteinorraquia, la concentración de lactato en LCR (y cuando este es >35mg/dl), la de PCR en suero (y cuando esta es >54mg/l) y la PCT (tanto si >0,5 como en >1ng/ml). Pero todas las diferencias son menores que las encontradas entre las MB y las MV (tabla 2).
Comparación de valores de las pruebas urgentes de laboratorio en suero y LCR entre los pacientes con MB confirmadas microbiológicamente y las posibles MB decapitadas
| MB n=53 | MB decapitadas n=12 | p* | |
|---|---|---|---|
| Pleocitosis LCR células/mm3, media (DE) | 2382 (3443) | 400 (345) | 0,052 |
| PMN>50%, n (%) | 45 (85%) | 6 (50%) | 0,016 |
| Glucorraquia mg/dl < 60% de glucemia, n (%) | 40 (75,5%) | 6 (50%) | 0,080 |
| Proteinorraquia mg/dl, media (DE) | 895 (2036) | 176 (91) | 0,014 |
| Lactato en LCR en mg/dl, media (DE) | 66 (39) | 29 (8) | 0,034 |
| Lactato>35mg/dl, n (%) | 50 (96,2%) | 1 (8,33%) | 0,001 |
| Leucocitos sangre por mm3, media (DE) | 17.045 (8167) | 14.183 (5668) | 0,163 |
| Leucocitosis > 12.000/mm3 o < 4.000/mm3 o > 10% cayados, n (%) | 41 (77,4%) | 5 (41,7%) | 0,047 |
| PCR en mg/l, media (DE) | 97,48 (53,61) | 43,72 (30,64) | 0,002 |
| PCR>8mg/l, n (%) | 50 (96,2%) | 10 (90,9%) | 0,458 |
| PCR>54mg/l, n (%) | 43 (81,1%) | 4 (33,3%) | 0,040 |
| PCT en ng/ml, media (DE) | 10,03 (7,75) | 1,01 (0,60) | 0,004 |
| PCT>0,5 en ng/ml, n (%) | 49 (92,4%) | 6 (50%) | 0,026 |
| PCT>1 en ng/ml, n (%) | 45 (84,9%) | 3 (25%) | 0,001 |
DE: desviación estándar; LCR: líquido cefalorraquídeo; MB: meningitis bacterianas; n=número de casos; PCR: proteína C reactiva; PCT: procalcitonina; PMN: polimorfonucleares.
Aunque en el estudio univariable (tabla 2) se encontraron diferencias significativas en distintas variables, tras realizar el estudio multivariante con el modelo de regresión solo 4 de ellas mantuvieron significación estadística como predictores de etiología bacteriana en la MA: lactato en LCR ≥33mg/dl (OR: 50,84; IC95%: 21,63-119,47; p<0,001); PCT ≥0,8ng/ml (OR: 46,34; IC95%: 19,71-108,89; p<0,001); glucorraquia <60% de la glucemia (OR: 20,82; IC95%: 8,86-48,96; p=0,001], y la proporción de PMN en LCR >50% (OR: 20,19; IC95%: 8,31-49,09; p=0,002).
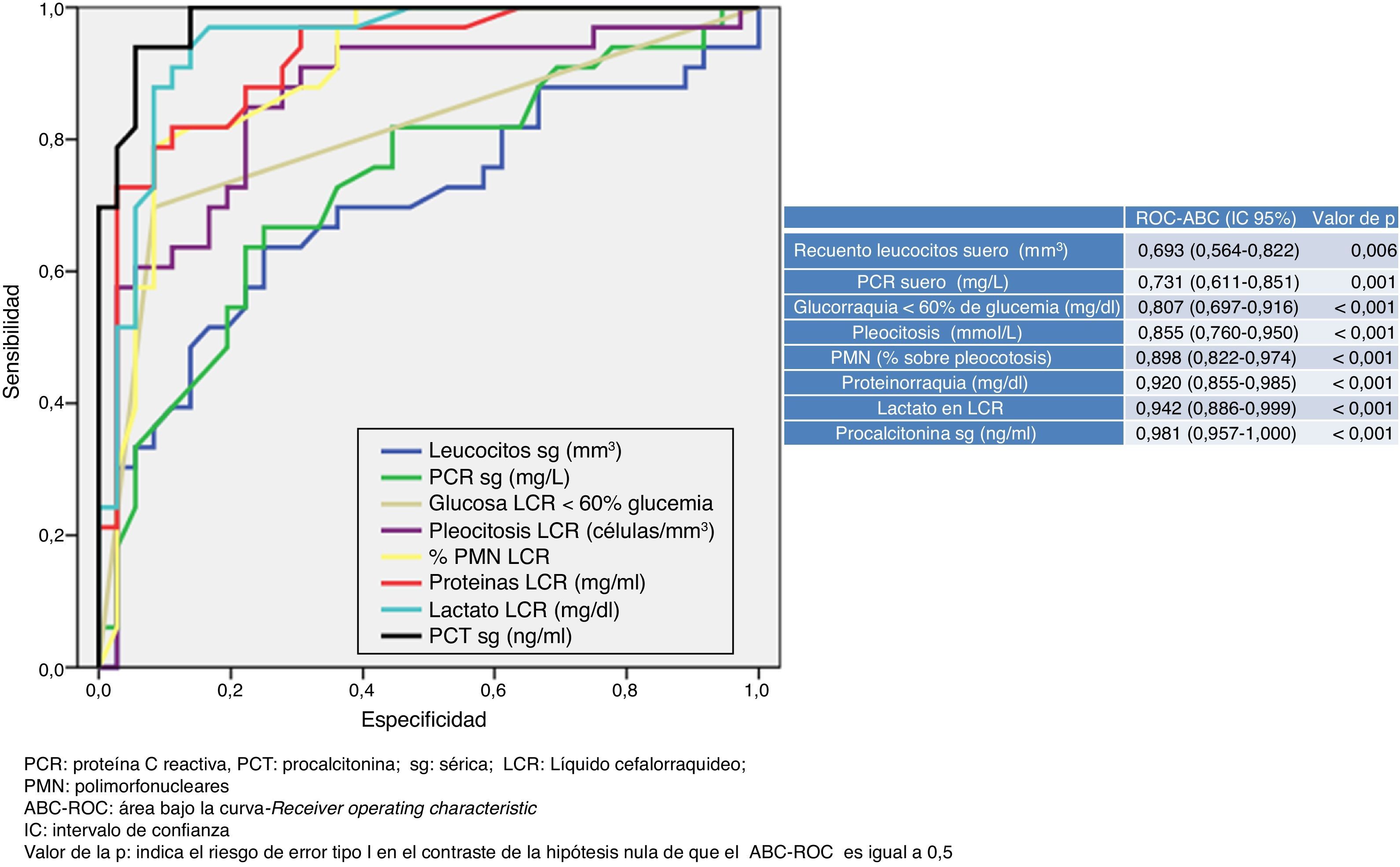
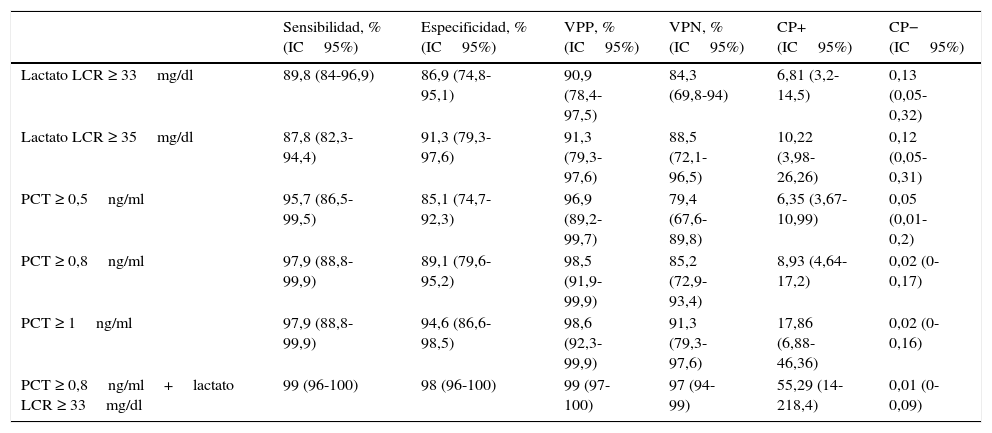
En la figura 1 se describen los valores del ABC-ROC obtenidos por las determinaciones de laboratorio urgentes para predecir la existencia de MB en el global de pacientes del estudio. De las variables analizadas en suero, la PCT es la que consigue un mayor rendimiento diagnóstico y la mejor ABC-ROC de 0,981 (IC95%: 0,957-1; p<0,001). Para la PCT el PC encontrado con mayor capacidad diagnóstica fue de 0,8ng/ml. En la tabla 4 se describen los valores de S, E, VPP, VPN, CP+ y CP− de dicho PC≥0,8ng/ml, así como de los PC≥0,5ng/ml y ≥1ng/ml, al ser considerados de gran interés clínico14,16. Del estudio del LCR, la concentración de lactato es la variable individual con mejor ABC-ROC, con 0,942 (IC95%: 0,886-0,999; p<0,001). Y el PC más rentable encontrado es la concentración ≥33mg/dl (todos los valores de rendimiento diagnóstico se muestran en la tabla 4 así como para el PC ≥35mg/dl, que es considerado como referencia para la mayoría de autores).
Puntos de corte y rendimiento diagnóstico para la predicción de meningitis bacteriana en todos los pacientes del estudio
| Sensibilidad, % (IC95%) | Especificidad, % (IC95%) | VPP, % (IC95%) | VPN, % (IC95%) | CP+ (IC95%) | CP− (IC95%) | |
|---|---|---|---|---|---|---|
| Lactato LCR ≥ 33mg/dl | 89,8 (84-96,9) | 86,9 (74,8-95,1) | 90,9 (78,4-97,5) | 84,3 (69,8-94) | 6,81 (3,2-14,5) | 0,13 (0,05-0,32) |
| Lactato LCR ≥ 35mg/dl | 87,8 (82,3-94,4) | 91,3 (79,3-97,6) | 91,3 (79,3-97,6) | 88,5 (72,1-96,5) | 10,22 (3,98-26,26) | 0,12 (0,05-0,31) |
| PCT ≥ 0,5ng/ml | 95,7 (86,5-99,5) | 85,1 (74,7-92,3) | 96,9 (89,2-99,7) | 79,4 (67,6-89,8) | 6,35 (3,67-10,99) | 0,05 (0,01-0,2) |
| PCT ≥ 0,8ng/ml | 97,9 (88,8-99,9) | 89,1 (79,6-95,2) | 98,5 (91,9-99,9) | 85,2 (72,9-93,4) | 8,93 (4,64-17,2) | 0,02 (0-0,17) |
| PCT ≥ 1ng/ml | 97,9 (88,8-99,9) | 94,6 (86,6-98,5) | 98,6 (92,3-99,9) | 91,3 (79,3-97,6) | 17,86 (6,88-46,36) | 0,02 (0-0,16) |
| PCT ≥ 0,8ng/ml+lactato LCR ≥ 33mg/dl | 99 (96-100) | 98 (96-100) | 99 (97-100) | 97 (94-99) | 55,29 (14-218,4) | 0,01 (0-0,09) |
CP+: cociente de probabilidad positivo; CP−: cociente de probabilidad negativo; IC: intervalo de confianza; LCR: líquido cefalorraquídeo; PCT: procalcitonina; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Se han utilizado los puntos de corte con mayor rendimiento diagnóstico encontrados (lactato LCR≥33mg/l y PCT≥0,8ng/ml para la detección de meningitis bacteriana), así como otros puntos de corte elegidos por los autores (valores definidos por el laboratorio como normales o significativos) para poder realizar comparativas con otros estudios.
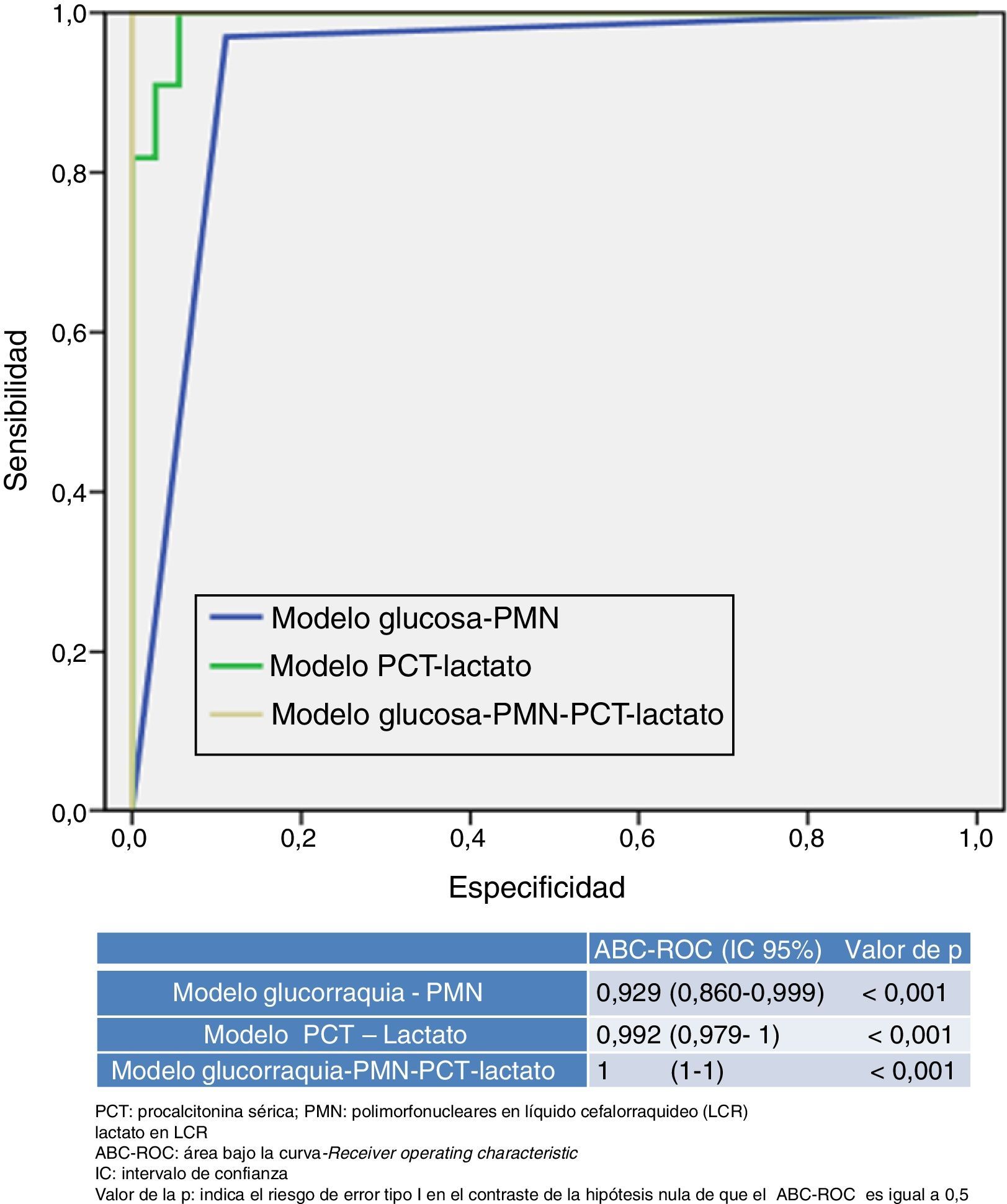
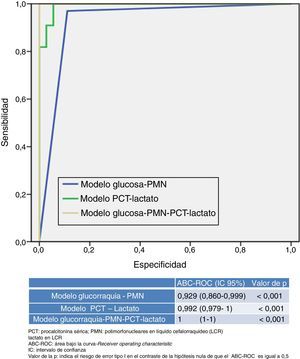
En la figura 2 se presentan y comparan varios modelos que combinan distintas variables utilizadas o disponibles en los SU. Por una parte, el nuevo modelo que resulta de combinar una PCT ≥0,8ng/ml más lactato en LCR ≥33mg/dl consigue un ABC-ROC de 0,992 (IC95%: 0,979-1; p<0,001) y una S de 99%, una E de 98%, un VPP 99%, un VPN 97%, un CP+ 55,29 y un CP− de 0,01, incrementando el rendimiento de cada variable individual (fig. 1). En la tabla 4 se describen los valores de S, E, VPP, VPN, CP+ y CP− de dicho nuevo modelo.
Por otra parte, el modelo habitualmente utilizado por los clínicos, que combina la proporción de PMN>50% en LCR con la glucorraquia (mg/dl) <60% de glucemia simultánea, obtiene un rendimiento menor (ABC-ROC de 0,929 [IC95%: 0,860-0,999]; p<0,001) que el nuevo modelo referido anteriormente (PCT más lactato). Y cuando se combinan ambos modelos (PCT≥0,8ng/ml más lactato en LCR≥33mg/dl junto con PMN>50% en LCR y glucorraquia [mg/dl] <60% de glucemia simultánea) se obtiene un ABC-ROC de 1, con una S del 100% y una E del 100% para predecir MB, incrementando el rendimiento de cada variable individual y de ambos modelos.
DiscusiónSegún los resultados de nuestro estudio, podemos confirmar que tras la valoración urgente realizada a los pacientes con MA, el lactato, la proporción de PMN y la glucorraquia en LCR, así como las concentraciones de PCT séricas, son los factores independientes relacionados significativamente y, además, con mayor capacidad predictiva de etiología bacteriana21,22. Estos 4 factores, cuyo análisis está disponible habitualmente en los SU23, constituyen una evidente aproximación diagnóstica cuya valoración debería ser clave, y obligada, para establecer la sospecha de MB y así orientar hacia los recursos y el destino más adecuados que precisen estos pacientes de forma inmediata.
Las manifestaciones clínicas y los síntomas habituales no proporcionan una sensibilidad ni especificidad óptimas para distinguir una posible MB8,9, y además son más inespecíficas en neonatos10,24, en ancianos25, en inmunodeprimidos, en diabéticos y en otros enfermos especialmente susceptibles de padecer infecciones graves26. Tampoco en nuestro estudio ni la fiebre, ni la existencia de cefalea, ni los signos de irritación meníngea ni la rigidez de nuca nos orientan a un origen bacteriano en el SU. Solo la existencia de alteración de la consciencia (también con frecuencia presente en los casos de meningoencefalitis viral) fue superior (67,9% vs 22,9%, p<0,001) en los casos de MB frente a los de MV. También encontramos diferencias significativas al comparar la existencia de criterios de sepsis, sepsis grave y shock séptico (92,5% vs 65,7%, 32% vs 0% y 15% vs 0%, respectivamente), datos que coinciden con recientes estudios epidemiológicos de infecciones2, y específicamente de infecciones del sistema nervioso central3, en los SU.
Así se justifica el interés de disponer desde el SU de herramientas objetivas e inmediatas para sospechar y distinguir los casos de MB de los de MV. De esta manera se pueden orientar las decisiones que son trascendentales para el pronóstico y la evolución de estos pacientes desde el primer contacto o triaje del paciente con el centro hospitalario6, al activar el «código sepsis» o «código meningitis»: extracción de cultivos y muestras para microbiología, administración precoz y adecuada de la pauta antibiótica, ingreso en el lugar apropiado, etc. Entre ellas se encuentran los biomarcadores de inflamación y de infección13,14,27, y especialmente destaca por su mayor rendimiento diagnóstico la PCT en las determinaciones de la analítica en sangre15,16,24,25,28-30. Por su parte, en el análisis del LCR, recientes publicaciones otorgan al lactato el mayor poder diagnóstico predictivo de MB, frente al recuento celular (pleocitosis), la proporción de PMN o la glucorraquia existente17,18.
Nuestro estudio confirma, como ya habían apuntado otros autores15,16,24,25,28-30, que la PCT posee una muy elevada capacidad predictiva de MB cuando se sospecha esta al diagnosticar posibles casos de MA en el SU. Su poder diagnóstico es superior de forma significativa al obtenido por el recuento de leucocitos o la concentración de PCR y, por otra parte, se conoce que esta capacidad disminuye para la PCR en relación con la edad del paciente (es mucho menor en ancianos), mientras que la PCT mantiene en todos los grupos etarios un excelente rendimiento30. Este hecho se debe tener en cuenta al valorar e interpretar las concentraciones de los biomarcadores, entre otras cosas porque la edad de los pacientes con MB, como en nuestra muestra (56años [DE 22]), es superior a la edad de los casos de MV (37años [DE 20]). En la actualidad continúa la controversia al intentar establecer el PC óptimo, muy variable en función del estudio (sobre todo por el tamaño muestral y la técnica utilizada para la PCT), que varía de 0,2 hasta 5ng/ml (para obtener resultados de S y E mayores del 90% en todos ellos)15,16,24,25,28-30. Uno de los estudios más importantes, realizado por Viallon et al.29 sobre 254 pacientes con MA (35 MB y 181 MV), concluyó que el mayor poder diagnóstico se obtenía con la PCT con un punto de corte ≥0,28ng/ml, con una S del 95%, una E del 100%, un VPP del 100% y un VPN del 97%, y definiendo un ABC-ROC de 0,99 (IC95%: 0,99-1), resultados muy superponibles a los de nuestro estudio, salvo que nuestro PC hallado fue superior (PCT≥0,8ng/ml), para obtener una S, E, VPP y VPN similares. Un metaanálisis16 recientemente publicado confirma los excelentes resultados de nuestro estudio, obteniendo una S del 90%, una E del 98% y un OR de 287 (IC95%: 55-1.409) para la PCT. A la vista de estos resultados, creemos que por seguridad para el paciente se debería considerar, siempre que no se hubiera sospechado antes, la posibilidad de una MB en los SU cuando la PCT inicial sea >0,25-0,5ng/ml y así obtener las pruebas microbiológicas pertinentes5 y administrar la cobertura antibiótica adecuada de forma inmediata11,31. En este sentido es importante recordar que, ante la sospecha de MB, la realización o espera de los resultados de cualquier exploración complementaria no debe ser motivo del retraso de la administración del antimicrobiano8.
Un aspecto novedoso encontrado en nuestro estudio se refiere a las diferencias significativas encontradas al comparar las MB confirmadas con las posibles MB decapitadas, aunque, como se ha mostrado, las diferencias son menores y no significativas en algunas variables en este caso de las encontradas al comparar MB con MV. De forma que ante la duda diagnóstica de estar ante la posibilidad de una MB decapitada, la ayuda y la orientación etiológica de la PCT se ven limitadas, pudiéndose encontrar (sobre todo si el antimicrobiano es adecuado)14 unas concentraciones de PCT menores de 0,8ng/ml, y en realidad ser una MB. Se ha señalado que cuando un enfermo es tratado las concentraciones de PCT séricas pueden disminuir a las 8-12h14. Esta situación es relevante y hay que tenerla en cuenta para no dejar de administrar el tratamiento adecuado y necesario, ya que la fiabilidad de las determinaciones en sangre y LCR disminuyen si se ha administrado antimicrobianos previamente16,32.
Por otro lado, aunque se han elaborado algunos estudios para valorar y comparar la utilidad de la PCT en el LCR respecto a las muestras sanguíneas, estos tienen una potencia muy pequeña y además han conseguido resultados inferiores a los obtenidos por la PCT en sangre en los mismos estudios33-36, por lo que en la actualidad no se recomienda evaluar la PCT en el LCR.
En cuanto a la evaluación del lactato en LCR, 2 recientes metaanálisis17,18 señalan su utilidad y fiabilidad para predecir la etiología bacteriana en los pacientes con sospecha de MB. Ambos trabajos concluyen que dicha determinación tiene una mayor precisión diagnóstica que el recuento de leucocitos, glucosa o proteínas en LCR para diferenciar MB de otras etiologías, de forma que obtienen un ABC-ROC de 0,945-0,984, muy similar a la obtenida en nuestro estudio, con una S del 93%, una E del 96%, un CP+ de 22,9 y un OR de 313 (IC95%: 141-698) para un PC≥35mg/dl. Es decir, prácticamente superponibles a nuestros resultados, aunque con mayor rango de variación e IC95% más amplios al evaluar 25 estudios17 y 33 estudios18, respectivamente. Y en cuanto al PC, el señalado por ambos es de 35mg/dl, mientras que nosotros encontramos 33mg/dl como el de mayor rendimiento. Por ello se debería considerar una MB en los SU cuando el lactato en LCR sea >33-35mg/dl.
Paralelamente, el lactato sérico, mejor marcador de hipoperfusión-hipoxia tisular, está incluido en las recomendaciones de valoración pronóstica y de gravedad clínica de los pacientes con sepsis, sepsis grave/shock séptico en los SU20, pero no se relaciona con la etiología bacteriana14.
Hemos comparado el rendimiento diagnóstico de infección bacteriana de los biomarcadores y las determinaciones urgentes de laboratorio que se analizan en el LCR, aspecto novedoso de nuestro estudio, ya que creemos útil para la práctica clínica conocer tanto la capacidad individual de cada prueba como el excelente rendimiento conseguido al combinar PCT sérica con el lactato en LCR, tal y como sugerían Viallon et al.29 en su estudio, para mejorar más aún la capacidad predictiva de ambas variables. De esta forma, y con gran precisión, tanto si disponemos y conseguimos obtener LCR y la analítica sanguínea, como si solo obtenemos muestra sérica, porque no consigamos realizar una punción lumbar (lo que ocurre entre el 10-30% de las ocasiones por estar contraindicada o por fallo en la técnica)5, la capacidad predictiva de MB con las herramientas disponibles es excelente. La PCT consigue un ABC-ROC 0,981, con un OR: 46 y para un PC ≥0,8ng/ml con S del 97% y VPP del 89%, por lo que si no se hubiera hecho o pensado previamente, nos «indicaría la realización de una punción lumbar», y si esta no fuera posible llevarla a cabo, tal y como se ha comentado, nos obligaría a tener en el SU una elevadísima sospecha de MB. Y por otro lado, cuando se conozcan, en los resultados del LCR tanto el lactato, como la proporción de PMN y la glucorraquia, son las determinaciones que individualmente poseen capacidad discriminativa de MB.
Creemos que el principal punto fuerte que aporta nuestro estudio es el incremento de la valoración predictiva al combinar en un modelo sencillo las determinaciones más rentables en sangre y en LCR. Así, podremos aumentar la precisión diagnóstica y con ello favorecer la administración precoz y adecuada del antimicrobiano, la solicitud de cultivos microbiológicos y la decisión de ingreso en el lugar apropiado8,14. En este sentido, es relevante la mejor y mayor capacidad de predicción diagnóstica que consigue este nuevo modelo combinado (PCR sérica más lactato en LCR) frente a la obtenida clásicamente (proporción de PMN y glucorraquia) y la posibilidad de llegar a una S y una E del 100% si se consideran las 4 variables.
Por ello, de cara al lugar adecuado de ingreso, y siempre que la situación clínica lo permita —es decir, en pacientes sin criterios de sepsis grave—, los casos con MA con PCT<0,5ng/ml y lactato en LCR<33mg/dl podrían ser ingresados en una unidad de corta estancia o en planta hasta confirmar el diagnóstico microbiológico (sin descartar, como se ha dicho antes, la posibilidad de MB decapitada), en función de los recursos y de la situación basal de cada paciente. Y los pacientes con PCT≥0,5ng/ml y/o lactato ≥33mg/dl deberían ser ingresados en unidades donde sea posible una vigilancia más intensiva y monitorización clínica y analítica continua37,38.
Nuestro estudio tiene distintas limitaciones, como son su carácter unicéntrico y el reducido tamaño de la muestra (no se puede excluir algún error tipo beta), que para algunas comparaciones resultó escasa y seguramente haya podido determinar que los PC y el rendimiento obtenidos hayan podido maximizarse o minimizarse. Otra limitación de nuestro estudio es que no contó con un grupo control libre de enfermedad, lo que hubiese conferido un grado de validez interna superior. Además, la selección de variables podría haber sido más completa, ya que no se incluyó la presión de apertura del LCR por falta de datos registrados. En este sentido, en relación con las variables analizadas en el LCR, los PC y los valores adoptados como normales y las dicotomizaciones elegidas son arbitrarios, tal y como se explicó en la metodología, por lo que habrá que tener en cuenta este aspecto a la hora de inferir los resultados y compararlos con otros estudios. Tampoco se ha tenido en cuenta el análisis de las complicaciones (encefalitis, crisis comiciales, etc.), que hubiese podido quizás aportar más información al estudio.
A pesar de estas limitaciones, creemos que nuestro estudio refleja la realidad clínica ante la sospecha y confirmación de MA en nuestros SU, y muestra el papel que pueden jugar la determinación de la PCT sérica y las determinaciones de lactato, glucorraquia y proporción de PMN en el LCR como ayuda para predecir MB. Aunque son necesarios futuros estudios de validación externa, con una potencia y muestra mayores.
En conclusión, la inclusión de la PCT sérica en la analítica solicitada, junto con la valoración del lactato, glucorraquia y PMN del LCR en la evaluación inicial del paciente con sospecha de MA en el SU, tienen una utilidad evidente como herramientas de ayuda para predecir la MB frente a la MV.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.
A la Dra. Eva Heredero Gálvez y al Servicio de Microbiología del Complejo Hospitalario de Toledo por su ayuda al facilitar la información de las pruebas complementarias y cultivos microbiológicos. Al Servicio de Análisis Clínicos y Bioquímica por su colaboración en la recogida y análisis de las muestras de los biomarcadores y líquido cefalorraquídeo.