El objetivo del presente trabajo fue medir la expresión de interferón gamma en la infección por VPH y por Chlamydia trachomatis en pacientes con lesión intraepitelial escamosa.
MétodoSe incluyeron 100 muestras de pacientes diagnosticadas por colposcopía, con y sin lesión intraepitelial escamosa, en quienes se efectuó el diagnóstico de infección por VPH y/o C.trachomatis. Se cuantificó la expresión relativa de interferón gamma con la prueba de transcriptasa reversa-PCR en tiempo real (RT-PCR).
ResultadosLas unidades relativas de la expresión de interferón gamma fueron de 13, 1,8 y 0,3 en la coinfección por VPH y C.trachomatis, en la infección por VPH y en la infección por C.trachomatis, respectivamente.
ConclusiónLa infección por VPH y por C.trachomatis puede constituir un factor estimulante de la expresión de interferón gamma.
The aim of this study was to mesure the expression of gamma interferon in HPV and Chlamydia trachomatis infection in squamous intraepithelial lesions.
MethodSamples from 100 patients diagnosed by colposcopy with or without squamous intraepithelial lesions were used in the present study. Each patient was found to be infected by HPV and C.trachomatis. Relative gamma interferon mRNA expression was assessed using a real-time reverse transcriptase PCR assay (RT-PCR).
ResultsThe relative units of expression of gamma interferon mRNA were 13, 1.8 and 0.3, for HPV and C.trachomatis co-infection, or HPV or C.trachomatis infection, respectively.
ConclusionHPV and C.trachomatis could overstimulate the expression of gamma interferon.
Las infecciones de transmisión sexual (ITS) se han asociado a infertilidad y oncogénesis. El virus del papiloma humano (VPH) y la bacteria Chlamydia trachomatis son patógenos intracelulares que inhiben la apoptosis de las células que infectan favoreciendo el daño celular1-3. Estos patógenos se asocian al desarrollo de lesiones intraepiteliales escamosas (LIE) y cáncer cervicouterino (CaCu)4-6.
Se han llevado a cabo diversos estudios cuyos resultados son contradictorios en cuanto a si la infección por VPH y por C.trachomatis se asocia o no con el desarrollo de lesiones cancerosas y precancerosas, pues mientras en algunos se ha observado que C.trachomatis puede participar como cofactor5-7, otros demuestran que es un factor independiente4,8.
Entre los agentes patógenos que con mayor frecuencia se aíslan de las infecciones cervicales se han identificado los genotipos D, E, F, G, H, I, J y K de C.trachomatis9 y se han registrado 40 genotipos del VPH, entre ellos el 16 y el 18, considerados de alto riesgo10-12.
Los interferones son citoquinas que participan en la defensa contra agentes patógenos. El interferón gamma (IFN-γ), secretado principalmente por célulasT y por células asesinas naturales, es un agente antiviral que participa en la estimulación de los fagocitos en su actividad bactericida. Se ha sugerido que la expresión de IFN-γ aumenta en tejidos con neoplasias intraepiteliales, observándose que cuanto más severa sea la lesión, más aumenta su expresión13, mientras que en el CaCu disminuye14. Se ha demostrado también in vitro que el IFN-γ inhibe el crecimiento de C.trachomatis15 y que la infección por VPH aumenta su expresión16. Sin embargo, se precisan estudios que permitan comprender el efecto de la coinfección de ambos patógenos sobre la expresión de IFN-γ.
Basado en las observaciones anteriores, el objetivo del presente estudio fue identificar el patrón de expresión de IFN-γ en la infección por VPH y por C.trachomatis en pacientes con LIE. Los resultados de esta investigación sugieren que la coinfección de estos patógenos podría tener un efecto aditivo a la expresión de IFN-γ.
MétodosPacientes a estudioSe realizó un estudio transversal descriptivo con 77 mujeres con LIE, siguiendo las instrucciones del comité de bioética del Centro de Investigación en Ciencias Médicas (Universidad Autónoma del Estado de México) de aprobación (carta de consentimiento informado) y privacidad de las pacientes participantes en estudios científicos. Las pacientes fueron atendidas en los servicios de colposcopia del Hospital Materno Perinatal (Instituto de Salud del Estado de México), en la clínica 221 (Instituto Mexicano del Seguro Social) y en el Centro de Investigación en Ciencias Médicas (Universidad Autónoma del Estado de México) de la ciudad de Toluca, estado de México. Los criterios de inclusión fueron: a)diagnóstico clínico de LIE, b)no estar sujetas a tratamiento farmacológico o antiinflamatorio, y c)que no hubiese embarazo. Como controles de la expresión de IFN-γ se incluyeron 23 mujeres sin LIE que acudieron al consultorio para revisión médica sin presentar ninguna enfermedad ni síntomas específicos y que aceptaron participar en el estudio.
Se obtuvieron muestras de células de raspado cervical con un cepillo endocervical (Cervex-brush®, Países Bajos) y se colocaron en 20ml en una solución de «transporte y conservación» (ThinPrep® PreservCyt® Solution HologicTM Marlborough, Massachusetts, EE.UU.), como se ha descrito en estudios previos17,18, y se guardaron a –70°C hasta que fueron analizadas.
Diagnóstico de virus del papiloma humanoLa genotipificación del VPH se realizó con el sistema Linear Array HPV Genotyping Assay (Roche®, Mannheim, Alemania) como se ha descrito previamente. Esta prueba emplea cebadores biotinados para identificar una secuencia de nucleótidos dentro de la región L1 polimórfica del VPH, por medio de extracción del ADN viral, reacción en cadena de la polimerasa (PCR) e hibridación19. Los genotipos identificados en esta prueba son 37 (6, 11, 16, 18, 26, 31, 33, 35, 39, 40, 42, 45, 51, 52, 53, 54, 56, 57, 58, 59, 61, 62, 64, 66, 67, 68, 69, 70, 71, 72, 73, 81, 82, 83, 84, IS39 y CP6108)19,20.
Diagnóstico de Chlamydia trachomatisEl ADN de la muestra de raspado cervical fue extraído con el ensayo Magna Pure LC DNA isolation (Roche® Mannheim, Alemania) en el sistema MagNA Pure LC 2.0 (Roche® Penzberg, Alemania). La pureza y la concentración del ADN se midió a 260/280nm con un NanoPhotometer™ UV/Vis Spectrophotometer (Implen® Schatzbogen, Alemania). La amplificación del ADN se llevó a cabo por PCR en tiempo real con sondas TaqMan, con el ensayo Chlamydia trachomatis-Real Time (Genekam Biotechnology®, Alemania) usando un termociclador Applied Biosystems 7500 fast real time PCR systems® (Foster City, EE.UU.). Cada ciclo de amplificación del PCR en tiempo real consistió en 15s a 95°C y 6s a 60°C. Se llevaron a cabo 45 ciclos, siguiendo las instrucciones del fabricante21.
Cuantificación del interferón gammaLa extracción de ARN se efectuó con el ensayo Magna Pure LC RNA Isolation Kit III (Roche®, Mannheim, Alemania) usando el sistema MagNA Pure LC 2.0 (Roche® Penzberg, Alemania). Se midieron la pureza y la concentración del ARN con el NanoPhotometer™ UV/Vis Spectrophotometer (Implen® Schatzbogen, Alemania), siguiendo las instrucciones del fabricante.
Se utilizaron 20ng de ARN para obtener el ADNc utilizando Transcriptor High Fidelity (Roche® Mannheim, Alemania), usando el termociclador Applied Biosystems® GeneAmp® PCR Systems 9700 (Life Technologies Corporation, EE.UU.). Se usaron 5μl de ADNc para la amplificación por PCR en tiempo real con sondas TaqMan y los cebadores correspondientes (tabla 1).
Diseño de cebadores y sondas TaqMan para la expresión de IFN-γ
| Cebador | Secuencia | Tamaño cebador | Tamaño amplicón | Número acceso GenBank |
|---|---|---|---|---|
| IFN-γ S | TGGAGACCATCAAGGAAGACA | 21 | ||
| IFN-γ A | GTTTTAGCTGGCTGGCGAC | 18 | 169 | NM_000619 |
| IFN-γ TM | FAM-AGTTCATGTATTGCTTTGCGTTGGACA-BBQ | 27 | ||
| HBB S | GGATCTGTCCACTCCTGATGC | 21 | ||
| HBB A | GTTGCCCAGGAGCCTGA | 17 | 187 | NM_000518 |
| HBB TM | YAK-TCAGGATCCACGTGCACTTGTCA-BBQ | 24 |
HBB A: cebador antisentido de β-globina; HBB S: cebador sentido de β-globina; HBB TM: sonda TaqMan de β-globina; IFN-γ A: cebador antisentido de interferón gamma; IFN-γ S: cebador sentido de interferón gamma; IFN-γ TM: sonda TaqMan de interferón gamma.
Todas las secuencias están escritas en dirección 5¿ a 3¿.
La amplificación fue llevada a cabo en el termociclador LightCycler 2.0 Real-Time PCR (Roche® Penzberg, Alemania), analizando la expresión simultánea de IFN-γ y β-globina (usada como control positivo). Las condiciones de amplificación utilizadas fueron un paso inicial de desnaturalización a 95°C por 10min, seguido por 45 ciclos de desnaturalización por 10s a 95°C, alineamiento por 10s a 63°C y extensión por 30s a 72°C.
Cálculos para la cuantificación relativa de expresión de interferón gammaEn las muestras positivas para la expresión de IFN-γ se midió la expresión relativa con el método de 2−ΔΔCT. De acuerdo con este método, el primer paso fue obtener el promedio del valor del CT, el cual corresponde al primer ciclo del PCR en el que se detecta el producto amplificado. El CT se obtuvo tanto para el gen constitutivo (β-globina) como para el gen de IFN-γ. El segundo paso fue comparar las muestras negativas de la infección por VPH y C.trachomatis contra las que presentaron infección de VPH y/o C.trachomatis. Lo anterior se realizó calculando con el CT, lo siguiente: ΔCT=CT del gen de IFN-γ menos CT del gen de β-globina; ΔΔCT=ΔCT de pacientes con expresión IFN-γ, menos el ΔCT de los controles con expresión de IFN-γ. Finalmente se calculó: 2^(-ΔΔCT). A este último dato se le conoce como unidades relativas de expresión (URE)22,23.
Análisis estadístico de los datos:Los datos fueron analizados con Microsoft Excel 2010 y Statistical Package for Social Sciences (SPSS) para Windows, versión 20.0. Las muestras se dividieron en 4 grupos: a)sin infección; b)infección por VPH; c)infección por C.trachomatis, y d)coinfección por VPH y C.trachomatis. Se realizó el análisis descriptivo para cada grupo para conocer el número de pacientes para la infección, LIE y expresión de IFN-γ. Se usó la prueba de chi-cuadrado (χ2) para identificar la asociación de LIE con la infección por VPH y/o C.trachomatis. La predicción de la asociación de las variables se estableció mediante regresión logística binaria, tomando a la expresión de IFN-γ (negativas y positivas) como variable dependiente y a la infección por VPH y/o C.trachomatis, LIE, genotipos de VPH considerados de alto riesgo como variables independientes.
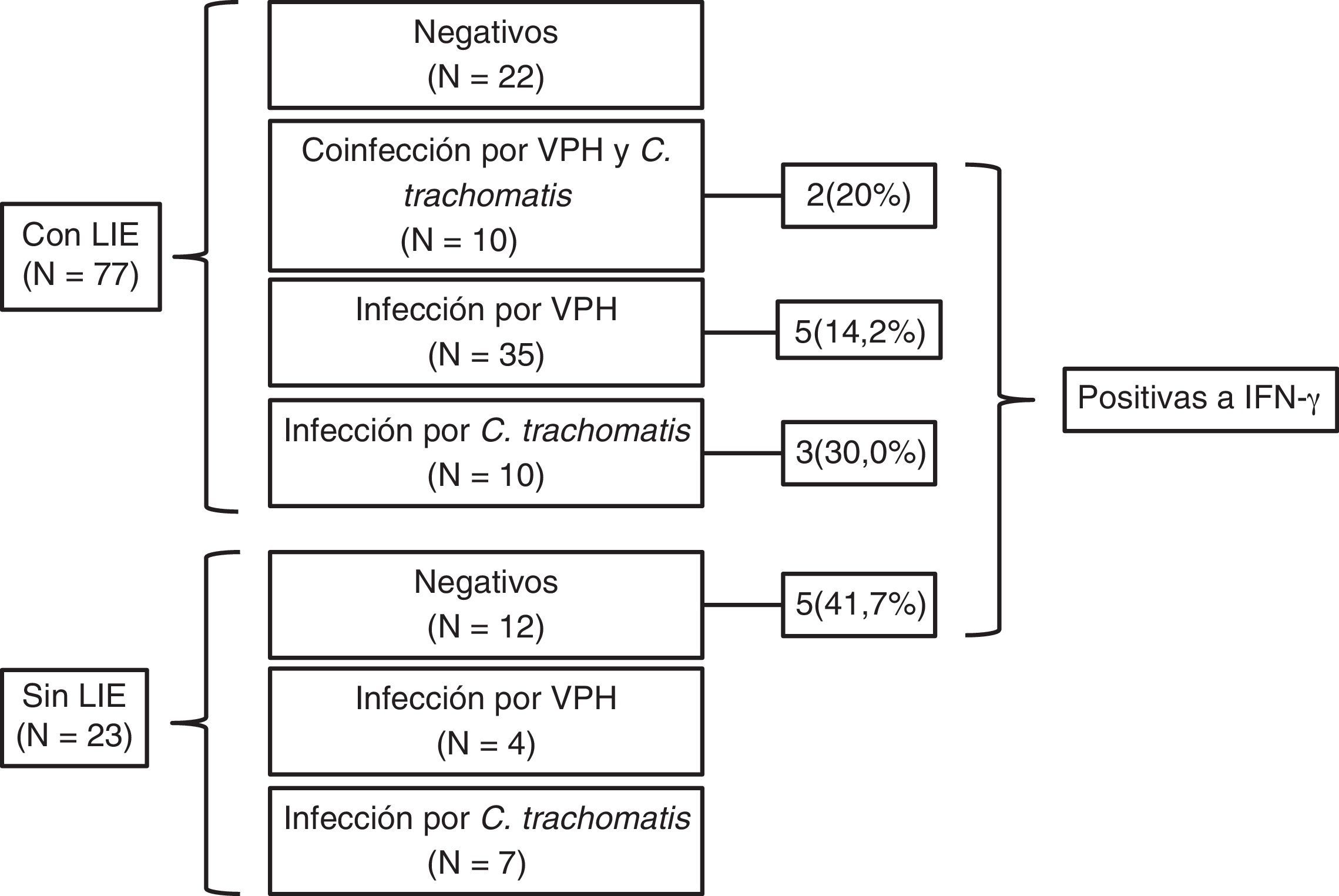
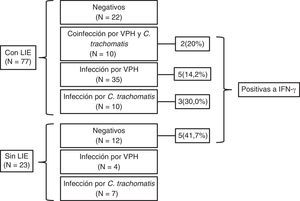
ResultadosEn el presente estudio se incluyeron 77 pacientes con LIE y 23 que no presentaban síntomas de LIE. La edad promedio de las pacientes con LIE fue de 37,9±11,8años y la de las pacientes sin LIE, de 38,0±11,7años. De las 77 pacientes diagnosticadas con LIE, 10 (13%) presentaron coinfección por VPH y C.trachomatis; 35 (45,5%), solo infección por VPH; 10 (12,9%) únicamente infección por C.trachomatis, y 12 (15,6%) no presentaron ninguno de estos patógenos (fig. 1).
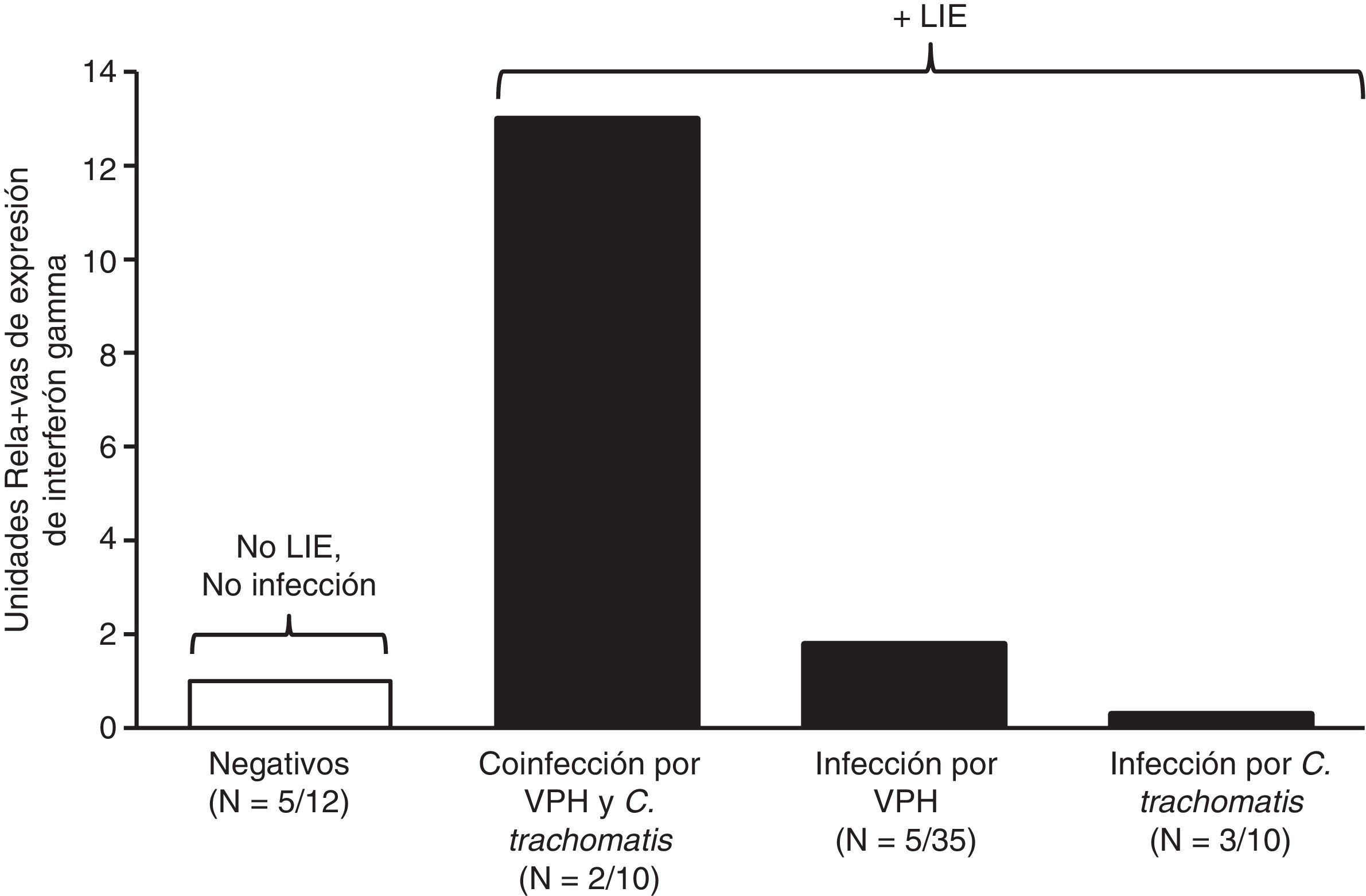
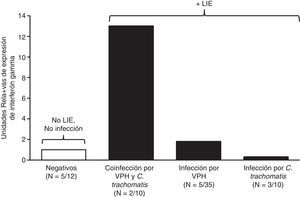
En cuanto a la expresión del gen de IFN-γ, 15 (15%) de las 100 muestras fueron las que lo expresaron. En la cuantificación relativa de la expresión de IFN-γ, la mayor expresión se observó en casos de coinfección por VPH y C.trachomatis (13URE), seguida por el grupo con infección por VPH (1,8URE), mientras que para la infección por C.trachomatis fue menor (0,3URE) (fig. 2).
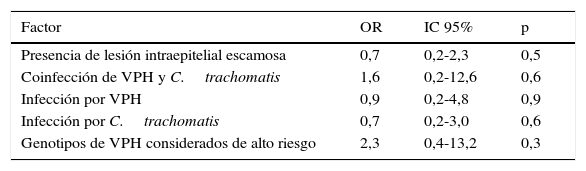
El análisis de regresión logística binaria sugiere que la expresión de IFN-γ tuvo una asociación con la coinfección por VPH y C.trachomatis (OR=1,6; IC95%: 0,2-12,6) y con los genotipos de VPH de alto riesgo (OR=2,3; IC95%: 0,4-13,2); sin embargo, ninguno de estos valores tuvo significación estadística (tabla 2).
Regresión logística de la expresión de interferón gamma en la presencia de LIE, infección por VPH y/o Chlamydia trachomatis y genotipos considerados de alto riesgo
| Factor | OR | IC 95% | p |
|---|---|---|---|
| Presencia de lesión intraepitelial escamosa | 0,7 | 0,2-2,3 | 0,5 |
| Coinfección de VPH y C.trachomatis | 1,6 | 0,2-12,6 | 0,6 |
| Infección por VPH | 0,9 | 0,2-4,8 | 0,9 |
| Infección por C.trachomatis | 0,7 | 0,2-3,0 | 0,6 |
| Genotipos de VPH considerados de alto riesgo | 2,3 | 0,4-13,2 | 0,3 |
IC: intervalo de confianza; OR: odds ratio; VPH: virus del papiloma humano.
En la infección por VPH se encontraron 21 genotipos (6, 16, 31, 33, 39, 45, 51, 52, 53, 54, 56, 58, 59, 61, 62, 66, 67, 71, 81, 83 y 84), de los cuales 11 son considerados de alto riesgo (16, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59). En las pacientes con coinfección por VPH y C.trachomatis se encontraron 12 genotipos de VPH (11, 16, 18, 51, 52, 53, 58, 59, 62, 71, 84 y CP6108), de los cuales 6 son considerados de alto riesgo (16, 18, 51, 52, 58 y 59). No se encontró asociación entre la presencia de genotipos de alto riesgo y la infección por C.trachomatis (χ2=1,9; p=0,2).
Se observó asociación de la coinfección por VPH y C.trachomatis con la presencia de LIE (p=0,03). Es importante resaltar que las 10 pacientes que manifestaron coinfección por VPH y C.trachomatis, presentaron LIE. En cuanto a la infección por VPH, también se asoció con la presencia de LIE (p=0,0). No se encontró asociación entre la infección con C.trachomatis y evidencia de LIE (p=0,2).
DiscusiónVPH y C.trachomatis son agentes que se presentan frecuentemente asociados con las ITS y en todas ellas la respuesta inmune es crucial para la prognosis de la enfermedad. El IFN-γ puede ser parte de la respuesta, por lo que es importante conocer el efecto que VPH y C.trachomatis ejercen sobre el patrón de expresión de esta citoquina.
En los resultados de esta investigación se observó una mayor expresión de mensajero para IFN-γ cuando se presentaba coinfección con VPH y C.trachomatis. No se han descrito estudios anteriores que permitan corroborar este resultado en la coinfección con estos patógenos, y una limitación importante de este estudio es el tamaño de la muestra. Nuestras observaciones concuerdan con estudios anteriores, llevados a cabo in vitro, que demostraron que el género Chlamydia induce la expresión de IFN-γ24, causando la inhibición del crecimiento de C.trachomatis25,26; otro estudio demostró aumento de expresión de IFN-γ en pacientes con infección por VPH13. De las observaciones anteriores, se esperaría que la coinfección con VPH y con C.trachomatis tuviera un efecto aditivo sobre la expresión de IFN-γ, hipótesis confirmada con los resultados de este estudio.
La variación individual en este estudio pudiera haber permitido observar un alto porcentaje (85,7%) de pacientes que no expresan IFN-γ. Lo anterior podría explicarse debido a que los patógenos, particularmente el VPH, podrían activar diferentes mecanismos de evasión de la respuesta inmune12,27, permitiendo que el gen de IFN-γ no se eleve a nivel transcripcional, lo que sería un factor que posibilite el desarrollo de LIE y CaCu.
Otros investigadores han demostrado que en tejidos con neoplasias intraepiteliales cervicales la expresión de IFN-γ aumenta13. En nuestro estudio no se observó asociación entre la expresión de IFN-γ y la presencia de LIE. Sin embargo, sería importante dar seguimiento a las pacientes para investigar si las que expresaron IFN-γ pudieran tener una mejor prognosis comparada con las pacientes que no lo expresaron. También se observó que la coinfección por VPH y C.trachomatis se asocia con LIE. Esta asociación encontrada coincide con lo demostrado en diferentes estudios, tanto en lesiones precancerosas como en cancerosas5-7,28. De acuerdo con los resultados de este estudio, LIE aumenta cuando hay infección por VPH, no así cuando hay infección por C.trachomatis. El estudio de los patógenos que se encuentran en las ITS es muy importante, debido a que su asociación con el desarrollo de lesiones precancerosas y cancerosas se puede relacionar con un incremento del CaCu y, en consecuencia, con la mortalidad de la mujer.
Se ha demostrado una asociación de la infección por C.trachomatis con genotipos considerados de alto riesgo de VPH29,30; en los resultados de la presente investigación se encontró que 6 (16, 18, 51, 52, 58 y 59) de los 12 genotipos identificados en la coinfección por VPH y C.trachomatis son genotipos considerados de alto riesgo; sin embargo, durante el estudio no se observó significación estadística a esta asociación. En estudios anteriores también se han observado los genotipos VPH 6, 11, 16, 18, 33, 35 y 45 en la coinfección por VPH y C.trachomatis, siendo el genotipo VPH 16 el más frecuente29-31, que coincide con los resultados del presente estudio
Los resultados de este estudio sugieren que es importante continuar con investigaciones respecto a la coinfección por VPH y C.trachomatis que permitan dilucidar cómo se ven afectadas las vías de señalización intracelular, así como genes y proteínas de la respuesta inflamatoria y antiinflamatoria. Así mismo, sería importante confirmar las observaciones de este estudio con técnicas de proteómica, para valorar con mayor exactitud si el efecto de la coinfección por VPH y C.trachomatis sobre IFN-γ se limita a nivel transcripcional o se extiende a nivel translacional.
La importancia de este estudio radica en que los estudios en investigación básica se hacen con modelos experimentales en condiciones muy controladas (temperatura constante, comida controlada, ciclos de luz-oscuridad controlada, minimización de las diferencias genética, etc.). Estas condiciones contribuyen a disminuir la variación individual. Desafortunadamente este control es imposible en estudios realizados con humanos, y las diferencias individuales e infecciones sufridas en el pasado pueden contribuir a aumentar la dispersión de los datos. A pesar de las limitaciones descritas para realizar investigación en humanos, nuestros estudios demuestran una tendencia a aumentar la respuesta de IFN-γ en las pacientes presentando coinfección con VPH y C.trachomatis.
En conclusión, los resultados del presente trabajo siguieren que la coinfección por VPH y C.trachomatis puede estimular la expresión de IFN-γ y favorecer la prognosis de la enfermedad.
FinanciaciónEste trabajo fue financiado por la Secretaría de Investigación y estudios avanzados Universidad Autónoma del Estado de México (número de proyecto 3097).
Conflicto de interesesTodos los autores manifiestan no tener ningún conflicto de intereses.
Agrademos las instituciones participantes en este estudio CICMED, Hospital Mónica Pretelini, IMSS por su apoyo.
Los autores agradecen a Juan Codina por su revisión al manuscrito.