Estudio de consistencia de un método de obtención y cuantificación de ácidos nucleicos del virus de la inmunodeficiencia humana (VIH) en secreciones vaginales.
MétodosMuestras vaginales emparejadas en 52 mujeres con infección del VIH obtenidas por aspiración directa. Cuantificación de ácidos nucleicos mediante Cobas Amplicor HIV-1 Monitor versión 1.5 (Roche Diagnostics, Branchburg, NJ, EE.UU). Monitor modificado con extracción QIAamp Viral RNA kit (Qiagen, Alemania).
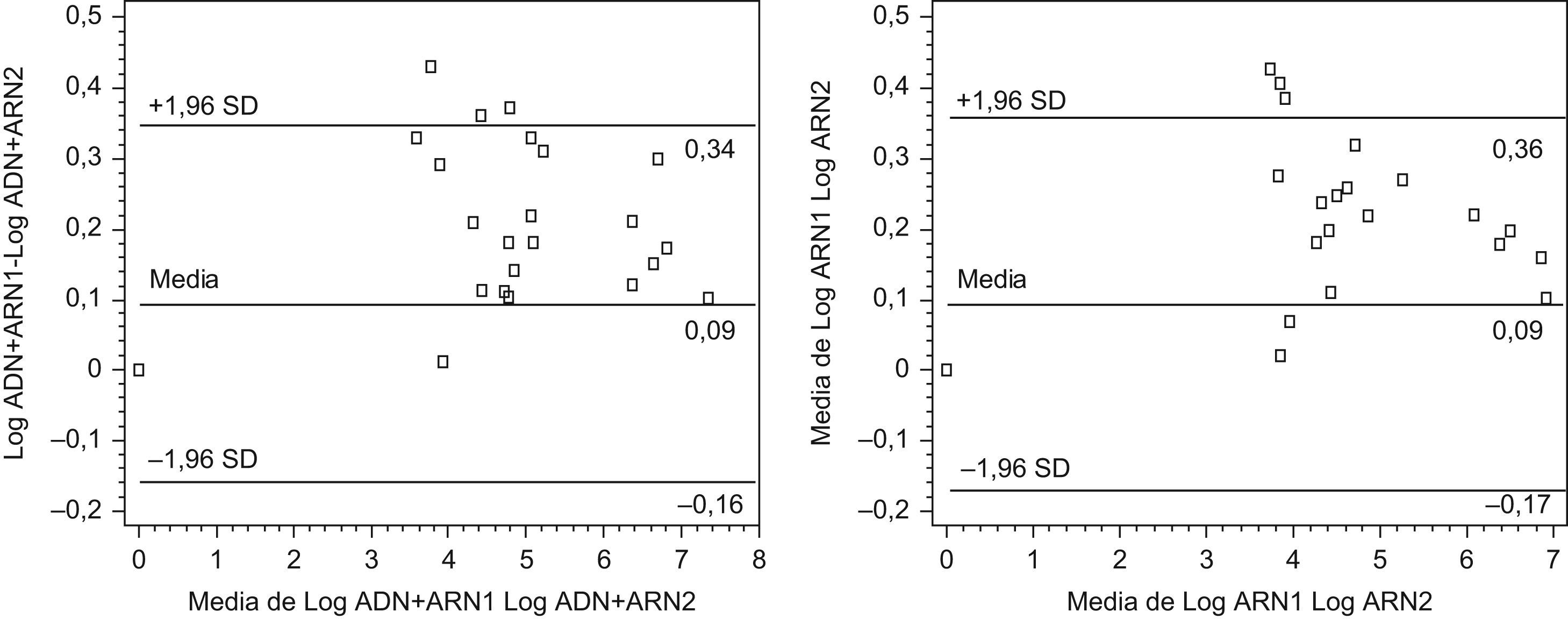
ResultadosÍndice de correlación intraclase entre muestras emparejadas: 0,99. Diferencia inferior a 0,40uLog en la cuantificación de ácidos nucleicos totales (ARN+ADN) y ARN viral en el 95% de las muestras (método Bland-Altman).
ConclusionesEl método utilizado es un procedimiento estandarizado y reproducible que permite cuantificar la carga vaginal de VIH.
To assess the reproducibility of a method to collect and quantify HIV nucleic acids in vaginal secretions.
MethodsWe analysed two consecutive vaginal samples collected by direct aspiration from 52 HIV infected women. Nucleic acids were extracted by QIAamp RNA-viral and quantified with a modified Cobas Amplicor HIV-1 Monitor.
ResultsIntra-class correlation coefficient between matched samples: 0.99. Differences of pooled HIV DNA+RNa and RNA were <0.40uLog for 95% of all samples (Bland-Altman plots).
ConclusionsThis method is a standard and reproducible assay to detect and measure HIV vaginal viral load.
La transmisión sexual y vertical del virus de la inmunodeficiencia humana (VIH) se ha relacionado con la carga viral plasmática (CVP)1,2, aunque es más probable que esté en relación directa con la concentración del VIH en el tracto genital. No existe una técnica estandarizada sobre la toma y el procesamiento de las muestras del tracto genital ni para la cuantificación de la carga viral vaginal (CVV) del VIH. Los procedimientos no invasivos para la toma de muestras, el lavado cervicovaginal, la escobilla impregnada con secreciones genitales y la absorción con tira de papel absorbente marcada tienen importantes limitaciones3–6. El objetivo de nuestro estudio fue desarrollar una metodología para la obtención de muestras vaginales y analizar su consistencia para la cuantificación de la CVV del VIH.
Material y métodosSujetos. Se estudió a 52 mujeres infectadas por el VIH con edad superior a 18 años previa firma de un consentimiento informado. Los criterios de exclusión fueron menstruación, histerectomía, relaciones sexuales sin preservativo, ducha vaginal con antisépticos locales, empleo de espermicidas o medicación por vía vaginal en las 72h previas.
Toma de muestras vaginales. Se realizaron el mismo día de la extracción de sangre para determinar la CVP del VIH, 48h después se repitió la toma de muestra vaginal. Tras introducir un espéculo se obtuvieron secreciones del fondo del saco vaginal por aspiración directa mediante pipeta con punta estéril, y se evitaron muestras del cérvix. En cada toma se adquirió el máximo volumen de muestra posible que se vertió en microtubos estériles que contenían 500μl de plasma humano negativo para VIH, virus de la hepatitis C y hemoglobina. El cálculo de la cantidad de secreciones vaginales se realizó pesando antes y después el microtubo con una balanza electrónica modelo E-42 B de Jpselecta. En menos de 2h, las muestras diluidas se agitaron, se homogeneizaron y se conservaron a −70°C. Excluimos las muestras con espermatozoides o sangre.
Determinación de la carga viral de VIH-1 en el tracto genital. La extracción y la cuantificación de ácidos nucleicos totales (ADN+ARN) y el ARN del VIH con el equipo Cobas Amplicor HIV-1 Monitor versión 1.5 resultaron fallidas por la presencia de inhibidores que impedían la amplificación de ácidos nucleicos. Por esto utilizamos un método alternativo de extracción: el equipo QIAamp Viral-RNA kit (Qiagen, Alemania), e introdujimos el control interno estándar del equipo Cobas Amplicor HIV-1 Monitor. El volumen del control interno estándar añadido a cada muestra se calculó para que el número de copias en cada reacción de reacción en cadena de la polinerasa (PCR) fuera el mismo que el recomendado por el fabricante de Cobas Amplicor. De cada muestra se obtuvo un eluido de ácidos nucleicos y se trató con DNAsa (desoxirribonucleasa) libre de ARN para eliminar el ADN viral. Para cuantificar los ácidos nucleicos totales del virus se utilizó el eluido sin tratar. El cálculo del número de copias por gramo se realizó modificando el factor de dilución para ajustarlo a la cantidad obtenida.
Estudio de consistencia. En primer lugar, analizamos la concordancia de los 2 métodos de extracción de ácidos nucleicos: el estándar —Cobas Amplicor— y el alternativo con el equipo QIAamp Viral-RNA kit con las modificaciones descritas en 25 muestras de plasma con CVP del VIH detectable. El estudio de consistencia en muestras vaginales se realizó entre las 2 muestras obtenidas en el plazo de 48h. La cuantificación de la concordancia se realizó con el coeficiente de correlación intraclase y el método gráfico Bland-Altman. Se utilizó el programa SPSS (versión 11.5, 2003).
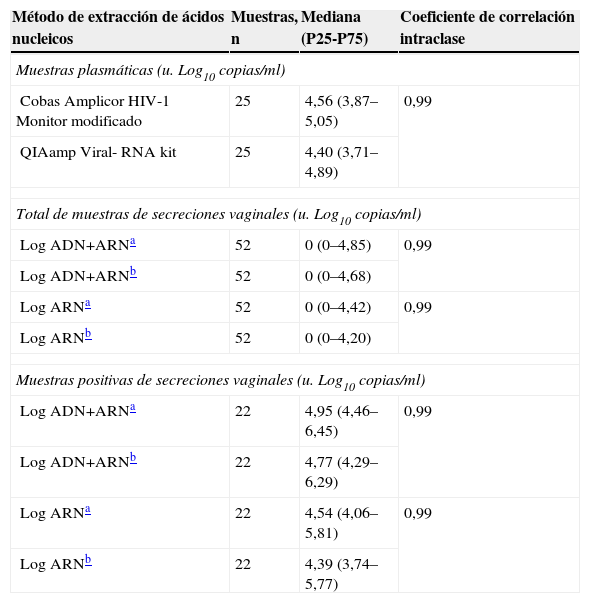
ResultadosLos coeficientes de correlación intraclase entre los 2 métodos para la cuantificación de la CVP del VIH y entre las 2 CVV (ARN+ADN y ARN de VIH) obtenidas secuencialmente en cada mujer se muestran en la tabla 1. El estudio de consistencia de las muestras vaginales señala que la metodología utilizada proporciona resultados reproducibles (tabla 1). Con el método de Bland-Altman obtuvimos diferencias inferiores a 0,40u. Log10 (el 95% de las muestras inferiores a 0,30u. Log10) entre las CVP obtenidas con los 2 métodos utilizados. La concordancia entre las 2 determinaciones de CVV en el total de muestras emparejadas se muestra en la figura 1. Para las muestras vaginales positivas (22 para ARN+ADN y 22 para ARN), las diferencias en el 100% de las muestras fueron inferiores a 0,43 y a 0,45u. Log10, respectivamente. El 95% de las muestras obtenidas pesaba más de 0,0073g. Al aplicar los factores de dilución empleados, el límite de detección en este ensayo fue de 9.818copias/ml.
Concordancia de los 2 métodos utilizados para la cuantificación de la carga viral plasmática del virus de la inmunodeficiencia humana y para la cuantificación de ácidos nucleicos en 2 muestras consecutivas de secreciones vaginales
| Método de extracción de ácidos nucleicos | Muestras, n | Mediana (P25-P75) | Coeficiente de correlación intraclase |
| Muestras plasmáticas (u. Log10 copias/ml) | |||
| Cobas Amplicor HIV-1 Monitor modificado | 25 | 4,56 (3,87–5,05) | 0,99 |
| QIAamp Viral- RNA kit | 25 | 4,40 (3,71–4,89) | |
| Total de muestras de secreciones vaginales (u. Log10 copias/ml) | |||
| Log ADN+ARNa | 52 | 0 (0–4,85) | 0,99 |
| Log ADN+ARNb | 52 | 0 (0–4,68) | |
| Log ARNa | 52 | 0 (0–4,42) | 0,99 |
| Log ARNb | 52 | 0 (0–4,20) | |
| Muestras positivas de secreciones vaginales (u. Log10 copias/ml) | |||
| Log ADN+ARNa | 22 | 4,95 (4,46–6,45) | 0,99 |
| Log ADN+ARNb | 22 | 4,77 (4,29–6,29) | |
| Log ARNa | 22 | 4,54 (4,06–5,81) | 0,99 |
| Log ARNb | 22 | 4,39 (3,74–5,77) | |
ADN: ácido desoxirribonucleico; ARN: ácido ribonucleico; Log: logaritmo; P: percentil.
Método de Bland-Altman para analizar la concordancia entre las 2 determinaciones de carga viral vaginal de virus de la inmunodeficiencia humana en las muestras emparejadas del tracto genital (n=52). A) Ácidos nucleicos totales ADN+ARN (figura de la izquierda). B) ARN viral (figura de la derecha). DE: desviación estándar.
El estudio de la consistencia demuestra que la metodología utilizada es un procedimiento estandarizado y reproducible aplicable al estudio de factores implicados en la concentración viral en el tracto genital femenino. La fiabilidad de los resultados obtenidos dependerá de la correcta obtención de muestras vaginales y de la extracción y posterior cuantificación de ácidos nucleicos del VIH.
La presencia de inhibidores de la PCR en secreciones vaginales no se ha referenciado en la literatura científica, probablemente porque la mayoría de los autores utilizan lavados cervicovaginales3,7,8 o escobillas3,9–11, que precisan diluirse con el consiguiente arrastre de inhibidores. El exceso de proteínas o sales minerales existentes en secreciones vaginales o la consistencia de estas podrían actuar como inhibidores de la RT-polimerasa (transcriptasa inversa). Por esto, elegimos el equipo QIAamp Viral-RNA que utiliza columnas de silica-gel que retienen contaminantes e inhibidores de la amplificación. Además, ofrecía los mejores resultados respecto a reproducibilidad, sensibilidad, precio razonable y tratamiento fácil y rápido12.
En el tracto genital femenino se ha demostrado que la forma de tomar las muestras contribuye significativamente a la variabilidad de los resultados obtenidos5. Dos estudios realizados sobre la misma cohorte de mujeres4,5 calculan la magnitud de esta variabilidad intrasujeto por la desviación estándar expresada en unidades logarítmicas, y es de 0,55 con tiras absorbentes, de 0,83 con lavado cervicovaginal y de 0,57 con cepillo citológico. La variabilidad observada en nuestro estudio fue inferior, y no superó el límite de las 0,50u. Log10 copias/ml. Sherlock et al6 observaron un coeficiente de correlación entre 2 determinaciones de carga viral para muestras cervicovaginales de 0,72, con un 12,5% de las muestras vaginales y un 10,9% de las muestras cervicales fuera de rango. En nuestro estudio, en el 95% de las muestras la diferencia entre 2 determinaciones de la CVV de ADN+ARV y ARN viral fue inferior a 0,43 y a 0,45u. Log10 copias/ml, respectivamente.
El método de obtención de muestras utilizado en nuestro estudio permite cuantificar la cantidad de muestra obtenida. Una de las limitaciones de nuestro estudio fue que no siempre obteníamos una cantidad suficiente de muestra y las cantidades no eran siempre uniformes, aunque conocíamos la cantidad de muestra obtenida. El porcentaje relativamente elevado de muestras negativas observadas probablemente se debió al poco volumen de muestra obtenido, lo que incrementó el límite inferior de detección de la prueba desde 200copias/ml del ensayo estándar hasta casi 10.000copias/ml, resultados similares a lo observado por otros autores que utilizaron otros métodos de medida6.
El método descrito de obtención de muestras vaginales y de cuantificación de la CVV del VIH precisa nuevos estudios que reproduzcan nuestros resultados. Una cuantificación estandarizada y validada del VIH en muestras cervicovaginales permitiría mediante un método sencillo estudiar la actividad de los fármacos antirretrovirales en el compartimento genital femenino, el riesgo de transmisión vertical y la necesidad de cesárea electiva.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.