Se describe la epidemiología molecular de las enterobacterias productoras de carbapenemasas en un hospital terciario.
Material y métodosSe incluyeron todos los aislamientos de enterobacterias productoras de carbapenemasas obtenidos entre febrero de 2015 y marzo de 2016 en el Hospital Universitario 12 de Octubre (Madrid). Se utilizaron métodos fenotípicos y moleculares.
ResultadosSe identificaron 7 especies bacterianas, predominando Klebsiella pneumoniae (K. pneumoniae) (78,9%) y Enterobacter cloacae (E. cloacae) (16,4%). La resistencia en K. pneumoniae y E. cloacae para carbapenemes fue del 88,7 y 88,6% para ertapenem, 21,4 y 54,3% para imipenem, y 20,8 y 34,3% para meropenem. El tipo de carbapenemasa más frecuente en K pneumoniae fue OXA-48 (91,1%) y en E. cloacae VIM (71,4%). Se identificaron 9 tipos clonales de K. pneumoniae, incluyendo uno mayoritario perteneciente al tipo de secuencia ST11, y 16 de E. cloacae.
ConclusionesEl incremento actual de enterobacterias productoras de carbapenemasas se debe en gran medida a la diseminación de K. pneumoniae productora de OXA-48.
A description is presented on the molecular epidemiology of carbapenemase-producing enterobacteriaceae infection in a tertiary hospital.
Material and methodsA study was made on all the carbapenemase-producing enterobacteriaceae isolations obtained between February 2015 and March 2016 in the Hospital Universitario 12 de Octubre (Madrid). Phenotypic and molecular methods were used.
ResultsA total of 7 bacterial species were identified, with the majority being Klebsiella pneumoniae (K. pneumoniae) (78.9%) and Enterobacter cloacae (E. cloacae) (16.4%). The resistance of K. pneumoniae and E. cloacae for carbapenems was 88.7 and 88.6% for ertapenem, 21.4 and 54.3% for imipenem, and 20.8 and 34.3% for meropenem, respectively. The most frequent carbapenemase type was OXA-48 (91.1%) and VIM (71.4%) in E. cloacae. A total of 9K. pneumoniae clonal types were identified, including a majority pertaining to the sequence type ST11. In E. cloacae, 16 clonal types were identified.
ConclusionsThe current increase in carbapenemase-producing enterobacteriaceae is mainly due to the spread of OXA-48-producing K. pneumoniae.
Actualmente, uno de los principales problemas de salud pública es el de las infecciones por bacterias multirresistentes, y en nuestro medio las más importantes son las causadas por enterobacterias productoras de carbapenemasas (EPC)1. En Europa, y en concreto en España, la carbapenemasa del tipo OXA-48 es la más frecuente, y es especialmente relevante en Klebsiella pneumoniae (K. pneumoniae)2,3. El incremento de infecciones/colonizaciones por EPC se ha producido, en gran medida, por la diseminación de clones epidémicos como es el caso en K. pneumoniae4. Un estudio previo realizado en nuestro hospital (2009-2014) demostraba la emergencia de K. pneumoniae productora de carbapenemasa, a expensas fundamentalmente de la diseminación de un clon perteneciente al secuenciotipo ST115. En base a estos antecedentes, se planteó conocer la epidemiología molecular de las colonizaciones/infecciones por EPC en nuestro hospital, y determinar la posible persistencia de algunos clones considerados de alto riesgo.
Material y métodosEl estudio incluyó todos los aislamientos de EPC desde febrero de 2015 hasta marzo de 2016 en el Hospital Universitario 12 de Octubre (Madrid). Se incluyó un aislamiento por paciente. La identificación se efectuó mediante el sistema MALDI-TOF MS (Microflex; Bruker Daltonics, Bremen, Alemania). El antibiograma se realizó por microdilución (Neg Combo Panel Type 53 y Neg Urine Combo Panel Type 59, Microscan Walkaway, Soria Melguizo, Madrid, España), y se utilizaron los criterios de interpretación del European Committee on Antimicrobial Susceptibility Testing (EUCAST version 5.0, 2015) para determinar la sensibilidad a los antibióticos. En aquellos aislamientos en los que se sospechó la presencia de una carbapenemasa, se llevó a cabo el test de Hodge modificado y se determinó la CMI exacta para los carbapenems (ertapenem, imipenem y meropenem) y para colistina mediante E-test (Biomérieux, Durham, NC). En los aislamientos con test de Hodge positivo, se realizó una PCR a tiempo real con primers específicos dirigidos frente a los genes blaOXA-48, blaVIM y blaKPC6–8 por ser los tipos de carbapenemasas más frecuentes en España. Se realizó secuenciación mediante el sistema BigDye 3.1 (3130 Genetic Analyzer; Applied Biosystems, Austin, TX) en muestras representativas de cada uno de los tipos de carbapenemasa para confirmar los resultados obtenidos mediante PCR.
La relación epidemiológica de los distintos aislamientos se estudió en todas las cepas de Enterobacter cloacae (E. cloacae) y en una selección representativa de cepas de K. pneumoniae distribuidas durante todo el periodo de estudio y por todos los servicios hospitalarios. Se realizó electroforesis en campo pulsado (PFGE) previa digestión con la enzima XbaI utilizando el sistema CHEF DRIII (Bio-Rad Laboratories, Hercules, CA). El análisis informático de los distintos patrones de bandas se efectuó con el programa Bionumerics software package v.3.0 (Applied Maths NV, Sint-Martens-Latem, Bélgica).
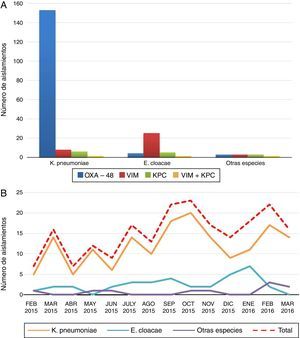
ResultadosDurante los 14 meses de estudio se identificaron un total de 213 aislamientos de EPC, 139 (65,3%) procedentes de muestras clínicas (orina [N=81], exudado/pus herida [N=24], sangre [N=13], respiratorio [N=11], líquido orgánico [N=6], catéter [N=3] y biopsia [N=1]), y 74 (34,7%) procedentes de muestras de vigilancia de portadores de microorganismos multirresistentes (exudados perianales). Los aislamientos pertenecían a 7 especies bacterianas: K. pneumoniae (78,9%), E. cloacae (16,4%), Citrobacter freundii –C. freundii– (1,9%), Klebsiella oxytoca –K. oxytoca– (0,9%), Escherichia coli –E. coli– (0,9%), Serratia marcescens –S. marcescens– (0,5%) y Proteus mirabilis –P. mirabilis– (0,5%) (fig. 1, panel A). El porcentaje de EPC con respecto al número total de aislamientos, por especie, fue: K. pneumoniae 4,9% (168/3404), E. cloacae 4,2% (35/841), C. freundii 3,1% (4/127), K. oxytoca 0,4% (2/480), S. marcescens 0,2% (1/472), P. mirabilis 0,1% (1/864), y E. coli 0,02% (2/11298). El 94,4% (201/213) de los pacientes infectados/colonizados por estas bacterias eran adultos, localizados en los siguientes servicios hospitalarios: UCI (29,9%), Urgencias (16,5%), Medicina Interna (12,4%), Cirugía (11,3%), Nefrología/Urología (9,8%), y otros servicios (11,3%). El 8,8% de los pacientes provenían de Atención Primaria. En el caso de los pacientes pediátricos (5,4%), la UCI pediátrica fue el servicio donde se identificaron el mayor número de EPC (9/12). Los casos se distribuyeron a lo largo de todo el periodo de estudio y se observó una tendencia creciente en su número (fig. 1, panel B).
En relación al tipo de carbapenemasa detectado, el 91,1% (153/168) de los aislamientos de K pneumoniae fueron productores de OXA-48, 4,8% de VIM (8/168), 3,6% de KPC (6/168), y un 0,6% (1/168) fueron coproductores de VIM y KPC. Respecto a E. cloacae, el 71,4% fueron productores de VIM (25/35), 14,3% de KPC (5/35), 11,4% de OXA-48 (4/35), y 2,9% (1/35) de VIM y KPC (fig. 1, panel A).
En cuanto a los resultados de sensibilidad a los antimicrobianos, meropenem fue el carbapenémico más activo, con un 23% de resistencia global entre las EPC (20,8 y 34,3% en K. pneumoniae y E. cloacae, respectivamente) (tabla 1). El análisis según el tipo de carbapenemasa mostró que las cepas productoras de KPC presentaron los porcentajes más elevados de resistencia a los carbapenémicos (ertapenem, imipenem y meropenem: 100%, 50%, 50% en K. pneumoniae, y 100%, 80%, 80% en E. cloacae, respectivamente). Los porcentajes de resistencia al resto de antibióticos se muestran en la tabla 1.
Patrón de resistencia a los distintos antibióticos en EPC
| Antibiótico (%) | Todos (N=213)* | K. pneumoniae (N=168) | E. cloacae (N=35) |
|---|---|---|---|
| Ertapenem | 86,8 | 88,7 | 88,6 |
| Imipenem | 28,1 | 21,4 | 54,3 |
| Meropenem | 23,0 | 20,8 | 34,3 |
| Gentamicina | 55,0 | 56,0 | 54,0 |
| Tobramicina | 81,0 | 82,0 | 80,0 |
| Amikacina | 15,2 | 15,9 | 9,1 |
| Fluoroquinolonas | 88,0 | 91,0 | 80,0 |
| Cotrimoxazol | 71,3 | 71,4 | 69,0 |
| Tigeciclina | 34,6 | 41,1 | 9,1 |
| Colistina | 25,0 | 27,4 | 20,0 |
Se seleccionaron 74 aislamientos para el estudio de tipificación molecular, 39K. pneumoniae (36 OXA-48, 2 VIM y 1 KPC) y 35 E. cloacae (25 VIM, 5 KPC, 4 OXA-48, y 1 VIM-KPC). En el caso de K. pneumoniae, el análisis reveló la presencia de 9 tipos clonales, 5 patrones agrupaban al 89,7% (35/39) de los aislamientos con un clon mayoritario (clon A), y 4 mostraron un patrón único. El clon A incluía 18 aislamientos productores de OXA-48 y 2 de VIM, y se observó en pacientes ingresados en cuatro servicios clínicos (UCI, Cirugía, Medicina Interna y Urgencias) y también en pacientes de atención primaria. La comparación de los patrones de PFGE con los incluidos en la base de datos de nuestro laboratorio permitió identificar al clon A como el mayoritario también en el periodo 2009-2014 en nuestro hospital, que había sido identificado previamente como ST11 (JNHB00000000). El estudio de PFGE en E. cloacae reveló la presencia de 16 tipos clonales; 24 aislamientos pertenecían a 5 tipos clonales y 11 mostraron un patrón único.
DiscusiónLa resistencia a antibióticos betalactámicos en Enterobacteriaceae ha aumentado dramáticamente en los últimos años, y esto es debido principalmente al incremento de cepas productoras de carbapenemasas9. Nuestros resultados muestran que hasta siete especies diferentes de enterobacterias son productoras de estas enzimas, destacando fundamentalmente K. peumoniae OXA-48. Un estudio multicéntrico realizado durante 2013 señalaba hasta 9 especies de EPC, siendo la más frecuente también K. pneumoniae productora de OXA-482.
El estudio de epidemiología molecular muestra diferentes patrones de diseminación de EPC en nuestro medio. Por una parte, la emergencia y diseminación de K. pneumoniae se produce a expensas de unos pocos clones, mayoritariamente portadores de OXA-48. La aparición de clones de alto riesgo epidémico, como es el caso de K. pneumoniae ST11 productora de carbapenemasa, agrava el problema, ya que se trata de un clon muy distribuido en España y en otros países de Europa que puede alojar distintos tipos de carbapenemasas además de múltiples resistencias a otros grupos de antimicrobianos4. En nuestro hospital, fue identificado por primera vez en 2011, en una cepa productora de VIM-1. A partir de ese momento, se expandió por todos los servicios clínicos pero a partir de 2012 la mayoría de los aislamientos fueron productores de OXA-485. Nuestros resultados confirman la persistencia de este clon y su amplia distribución por todo el hospital, encontrándonos en la actualidad en una situación de endemicidad a pesar del gran número de esfuerzos para controlar la diseminación de este tipo de infecciones. Por el contrario, E. cloacae mostró un patrón muy diferente, ya que fueron identificados 16 tipos clonales sin destacar ninguno en particular. Además, la mayoría de los aislamientos (71,4%) fueron productores de VIM, lo que sugiere la posible transmisión horizontal de los genes que codifican este tipo de carbapenemasa entre cepas de esta especie.
De cara al tratamiento empírico en pacientes con infecciones por EPC, es importante conocer el patrón de resistencia para poder optimizar el tratamiento antimicrobiano. Nuestro estudio muestra que meropenem es el carbapenémico más activo in vitro en todas las especies aisladas y para todos los tipos de carbapenemasas. También pone de manifiesto las elevadas tasas de resistencia a los aminoglucósidos, fluoroquinolonas, y cotrimoxazol, y especialmente también a colistina (25%) y tigeciclina (34,6%), dos antibióticos utilizados casi exclusivamente para el tratamiento de rescate por estos microorganismos. Un estudio realizado en 83 hospitales españoles durante 2013 detectaba 4,5% de resistencia a colistina y 29% a tigeciclina entre las cepas de EPC caracterizadas2. Destacar en el actual trabajo el incremento de resistencia a la colistina en K. pneumoniae observado en un nuestro hospital, del 2,1% en 2011-20145 al 27,4% en 2015-2016, alertando así del aumento en la resistencia a este antimicrobiano en esta especie.
Nuestros resultados también aportan información útil de cara a la posible utilidad de nuevos antibióticos como ceftazidima-avibactam en el tratamiento de las infecciones por EPC. Esta combinación puede tener un importante papel en el tratamiento de algunas de estas bacterias, ya que es potencialmente activo frente a cepas productoras de OXA-48 y también de KPC10, aunque habrá de confirmarse en cada caso la sensibilidad in vitro frente a este nuevo antimicrobiano.
Este estudio tiene algunas limitaciones. En primer lugar, los paneles de microdilución utilizados para realizar el antibiograma de las EPC contenían únicamente imipenem y ertapenem, y este último a concentraciones superiores a las recomendadas para sospechar la producción de algún tipo de carbapenemasa, por lo que es posible que alguna EPC no haya sido identificada. Además, solo se realizó PCR de OXA-48, VIM y KPC, por ser las carbapenemasas más frecuentes en España. Por último, el estudio por PFGE de K. pneumoniae no incluyó todos los aislamientos, sino una muestra representativa, por lo que probablemente no se detectaron todos los clones circulantes en nuestro hospital.
A pesar de ello, el estudio llama la atención sobre el grave problema de los microorganismos multirresistentes. Las infecciones por EPC traspasan los límites de los servicios clínicos y del propio hospital, diseminándose en diferentes tipos de pacientes y de ámbitos clínicos. Mientras estamos a la espera de nuevos antibióticos, es importante revisar e intensificar las medidas de control, y actualizar las políticas antibióticas a nivel hospitalario y extrahospitalario favoreciendo el uso prudente de los mismos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.