Las micosis invasoras siguen aumentando su incidencia en pacientes inmunodeprimidos u hospitalizados con graves enfermedades de base originando elevadas tasas de morbi-mortalidad. Candida, Cryptococcus, Pneumocystis y Aspergillus son los patógenos más frecuentemente implicados. La distribución de los agentes causales varía en función de la geografía, condiciones de los pacientes y unidades de hospitalización. En el último estudio multicéntrico español Candida albicans fue la especie más frecuentemente aislada, seguida de Candida parapsilosis, Candida glabrata, Candida tropicalis y Candida krusei, a diferencia de otros estudios europeos o americanos donde C. glabrata continúa siendo la segunda especie aislada. Aspergillus spp. es la principal causa de micosis invasora por mohos seguida de Fusarium spp., Scedosporium spp. y zigomicetos. Aspergillus fumigatus es la causa más frecuente de aspergilosis invasora (incluso con aislados resistentes a triazoles), pero Aspergillus flavus, Aspergillus nidulans y Aspergillus terreus se aíslan cada vez con más frecuencia, dependiendo de factores geográficos, tipo de huésped o terapia antifúngica previa.
Invasive mycoses associated with high morbidity and mortality rates are increasing among immunocompromised or severely ill patients. Candida, Cryptococcus, Pneumocystis and Aspergillus are most prevalent agents with varying distribution as regards geography, patient condition and hospital units. The latest multicentre candidaemia survey conducted in Spain, showed C. albicans as the most frequently isolated species followed by C. parapsilosis, C. glabrata, C. tropicalis and C. krusei in contrast with other European or American studies where C. glabrata was second in rank. Aspergillus spp. is the leading agent causing invasive mycoses among filamentous fungi followed by Fusarium spp., Scedosporium spp. and zygomycetes. Aspergillus fumigatus is the most common agent in invasive aspergillosis (and azole-resistant isolates have been reported) but in the last few years Aspergillus flavus, Aspergillus nidulans and Aspergillus terreus have been isolated with increasing frequency variable with geographical factors, patients’ underlying conditions or previous antifungal treatments.
A pesar de la mejora en los métodos diagnósticos y de la introducción y uso de nuevos antifúngicos en la última década, las micosis invasoras siguen aumentando su incidencia en pacientes inmunodeprimidos u hospitalizados con graves enfermedades de base, originando aún elevadas tasas tanto de morbilidad como de mortalidad y produciendo una importante carga de trabajo asistencial por su gravedad. Concretamente, en la mayoría de series y grupos de enfermos con enfermedades fúngicas invasoras (EFI), la tasa de mortalidad media relacionada con la candidemia es superior al 30% y la de la aspergilosis invasora (AI) es mayor del 50%, en parte debido a la dificultad para realizar un diagnóstico precoz y seguro de este tipo de infecciones1.
Entre los pacientes con mayor riesgo para desarrollar una EFI, tanto en población adulta como pediátrica, caben destacar los inmunodeprimidos por quimioterapia de sus enfermedades neoplásicas (con o sin neutropenia), los que reciben trasplante de progenitores hematopoyéticos (TPH) o de órganos sólidos (TOS), los que emplean dosis altas y prolongadas de corticoides u otros inmunosupresores, los pacientes infectados por el VIH en situación avanzada sin tratamiento antirretroviral, los intervenidos de cirugía mayor gastrointestinal, los pacientes con enfermedades inflamatorias crónicas autoinmunes que reciben nuevas terapias biológicas, los prematuros, los pacientes de edad más avanzada y los enfermos en situación crítica más graves que pueden beneficiarse de los avances en los cuidados médicos intensivos para mejorar su supervivencia (tabla 1)2–5.
Factores condicionantes y poblaciones de riesgo para desarrollar las principales EFI
| Candidiasis invasora/Candidemia | |
| Factores de riesgo generales: | - Gravedad de la enfermedad agudaa |
| - Edad:<1 año o>65años | |
| - Comorbilidades: diabetes mellitus, cirrosis, malnutrición, etc. | |
| - Cirugía (gastrointestinal) previa | |
| - Estancia prolongada en UCI | |
| - Dispositivos invasivos | |
| - Transfusiones múltiples | |
| - Nutrición parenteral | |
| - Catéter vesical | |
| - Ventilación mecánica | |
| Condicionantes interindividuales o población de mayor riesgo: | - Uso prolongado de catéter venoso centrala |
| - Antibióticos de amplio espectroa | |
| - Colonización previa por Candida spp.a | |
| - Insuficiencia renal y/o hemodiálisisa | |
| - Neutropeniaa | |
| - Quimioterapia, corticoides e inmunosupresores | |
| - Pancreatitis, perforación visceral, etc. | |
| - Politraumatismo | |
| - Gran quemado | |
| - Neonato con corta edad gestacional, - - Apgar bajo, uso de anti-H2, malformaciones congénitas, enfermedad gastrointestinal o shock | |
| Aspergilosis invasora | |
| Factores de riesgo: | - Neutropenia |
| - Déficits de función fagocitaria | |
| - Alteraciones de la inmunidad celular | |
| - Uso de corticoides y otros inmunosupresores | |
| - Rotura de barreras mucocutáneas | |
| - Exposición ambiental | |
| Población de riesgo: | - Neutropénico (<500eutrófilos/mm3 durante >10días): LMA/SMD o alo-TPH |
| - Pacientes con EICH en tratamiento inmunosupresor | |
| - Receptor de órgano sólido: pulmón>corazón>intestino>hígado>riñón | |
| - Infección por VIH-SIDA sin tratamiento antirretroviral con CD4<100células/μl | |
| - Enfermedad granulomatosa crónica | |
| - Uso de terapias biológicas, principalmente anti-CD52 (alemtuzumab), anti-TNFα (infliximab>adalimumab>etanercept) | |
| - Paciente crítico no hematológico | |
| - EPOC en tratamiento corticoideo crónico | |
| - Cirrosis hepática, enfermedad hepática avanzada | |
| - Post cirugía mayor y/o compleja | |
Alo-TPH: trasplante alogénico de progenitores hematopoyéticos; EICH: enfermedad del injerto contra el huésped; EPOC: enfermedad pulmonar obstructiva crónica; LMA: leucemia mieloide aguda; SMD: síndrome mielodisplásico.
Las EFI afectan habitualmente a tejidos (tanto superficiales como profundos), órganos (tanto vísceras huecas como parénquimas sólidos) y a líquidos orgánicos estériles (incluyendo la sangre). Pueden agruparse en dos categorías clínico-micológicas: las EFI oportunistas y las EFI endémicas. Aunque la lista de microorganismos patógenos causales de EFI oportunista aumenta día a día, Candida spp., Cryptococcus neoformans, Pneumocystis jiroveci y Aspergillus spp., son los patógenos más frecuentemente implicados6. Por su parte, la EFI endémica se asocia a determinadas áreas geográficas del continente americano, donde se encuentra el hábitat natural de sus agentes causales: Histoplasma capsulatum, Coccidioides immitis, Blastomyces dermatitidis o Paracoccidioides brasiliensis.
Además de las principales causas de EFI oportunista ya citadas, otros patógenos emergentes se aíslan cada vez con más frecuencia, bien sean hongos levaduriformes (Trichosporon spp., Sacharomyces spp., Rhodotorula spp. o Blastoschizomyces capitatus), hongos hialinos (Fusarium spp., Acremonium spp., Scedosporium spp., Scopulariopsis spp., Paecilomyces spp. o Trichoderma spp.), hongos dematiáceos (Alternaria spp., Bipolaris spp., Curvularia spp., Cladophialophora spp., Exophiala spp. o Exserohilum spp.) o zigomicetos (Rhizopus spp., Mucor spp., Rhizomucor spp., Absidia spp. o Cunninghamella spp.)7. Las infecciones causadas por estos nuevos hongos patógenos van desde infecciones localizadas en piel, tejidos blandos, huesos, articulaciones o senos paranasales, hasta infecciones generalizadas o muy graves como peritonitis, neumonías, lesiones cerebrales o incluso fungemia.
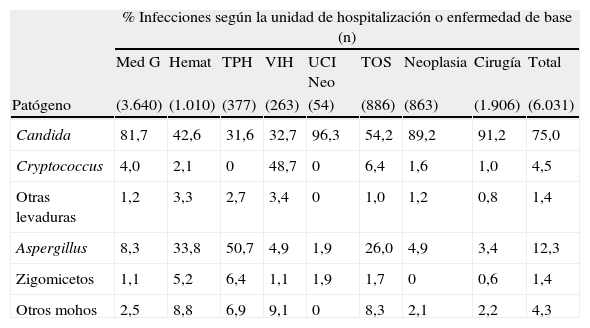
La distribución de los agentes patógenos causantes de EFI oportunista varía en función de las condiciones previas de los pacientes y de la unidad de hospitalización, tal y como se ha observado en un reciente estudio multicéntrico en el que han participado 23 hospitales americanos (tabla 2)5,8,9. En este estudio, las infecciones por Candida spp. fueron las más frecuentes en la mayoría de unidades de hospitalización y en los distintos tipos de pacientes; tan solo las EFI causadas por Aspergillus spp. (50,7%) fueron mayoritarias en receptores de TPH y las de Cryptococcus spp. (48,7%) en pacientes infectados por el VIH. Pero como refleja este estudio, y la mayoría de los publicados hasta la fecha, la infección sistémica por Candida spp., con o sin candidemia asociada, es la EFI más frecuente en todas las latitudes geográficas.
Distribución de los patógenos fúngicos según la unidad de hospitalización o condiciones previas del paciente (adaptado de Pfaller & Diekema5)
| % Infecciones según la unidad de hospitalización o enfermedad de base (n) | |||||||||
| Med G | Hemat | TPH | VIH | UCI Neo | TOS | Neoplasia | Cirugía | Total | |
| Patógeno | (3.640) | (1.010) | (377) | (263) | (54) | (886) | (863) | (1.906) | (6.031) |
| Candida | 81,7 | 42,6 | 31,6 | 32,7 | 96,3 | 54,2 | 89,2 | 91,2 | 75,0 |
| Cryptococcus | 4,0 | 2,1 | 0 | 48,7 | 0 | 6,4 | 1,6 | 1,0 | 4,5 |
| Otras levaduras | 1,2 | 3,3 | 2,7 | 3,4 | 0 | 1,0 | 1,2 | 0,8 | 1,4 |
| Aspergillus | 8,3 | 33,8 | 50,7 | 4,9 | 1,9 | 26,0 | 4,9 | 3,4 | 12,3 |
| Zigomicetos | 1,1 | 5,2 | 6,4 | 1,1 | 1,9 | 1,7 | 0 | 0,6 | 1,4 |
| Otros mohos | 2,5 | 8,8 | 6,9 | 9,1 | 0 | 8,3 | 2,1 | 2,2 | 4,3 |
Hemat: hematología; Med G: medicina general; TOS: receptor de trasplante de órgano sólido; TPH: receptores de trasplante de progenitores hematopoyéticos; UCI neo: unidad cuidados intensivos neonatales; VIH: virus de la inmunodeficiencia humana.
Los principales factores de riesgo de los pacientes con neoplasias hematológicas10, uno de los principales grupos diana de padecer una EFI, pueden agruparse en tres categorías: factores propios del huésped, factores ambientales y factores relacionados con la profilaxis antiinfecciosa utilizada (fig. 1 y tablas 3 y 4). Los factores del huésped comprenden varios tipos de situaciones de riesgo: el estado neto de la inmunosupresión, la disfunción de órganos vitales, la colonización microbiana y la reactivación de infecciones latentes (tabla 3). Los factores de riesgo relacionados con el entorno circundante del paciente y con los esquemas de profilaxis antimicrobiana seleccionados se describen en la tabla 4. Basándose en estos factores, los pacientes pueden estratificarse en dos grandes grupos, de alto y de bajo riesgo para padecer una EFI. En la tabla 5 se enumeran los factores que, de forma sumatoria, constituirían un grupo de alto riesgo para el desarrollo de EFI en pacientes oncohematológicos y justificarían, tal vez, la profilaxis antifúngica primaria.
Factores que incrementan el riesgo de EFI en el huésped hematológico
| Estado de inmunosupresión: |
| Neutropenia: intensidad, duración y dinámica de la misma |
| Linfopenia: profundidad y duración de la misma |
| Inmunodepresión celular y humoral |
| Malnutrición |
| Edad avanzada |
| Enfermedad inmunosupresora concomitante |
| Uso de altas dosis de arabinósido de citosina o de corticoides |
| Empleo de alemtuzumab, infliximab, globulina antitimocítica |
| Infecciones por virus inmunomoduladores: CMV, VEB, VHH-6, VHH-7, VHH-8 |
| Disfunción de órganos y sistemas: |
| Alteración de mucosas (mucositis) por la radioterapia/quimioterapia, EICH, virus herpes |
| Alteración de la piel y tegumentos con rotura de barreras por EICH, catéteres vasculares, radioterapia, quimioterapia |
| Insuficiencia renal |
| Insuficiencia hepática |
| Fenómenos obstructivos de tubo digestivo |
| Hipoesplenia/asplenia |
| Insuficiencia respiratoria secundaria a infección pulmonar por virus respiratorios |
| Colonización microbiana y reactivación de infecciones latentes: |
| Uso de antibióticos de amplio espectro |
| Empleo de antiácidos |
| Estancia hospitalaria prolongada |
| Cuerpos extraños |
| Daño en la función ciliar |
| Reactivación de infecciones latentes: micobacterias, toxoplasmosis, CMV, VEB, VHS, VVZ, VHB y VHC |
| EFI previa |
| Incremento de los depósitos de hierro en sistema monocito-macrófago, médula ósea, hígado, etc. |
CMV: citomegalovirus; EICH: enfermedad del injerto contra el huésped; VEB: virus Epstein-Barr; VHH-6: herpes virus humano 6; VHH-7: herpes virus humano 7; VHH-8: herpes virus humano 8; VHB: virus hepatitis B; VHC: virus hepatitis C; VHS: virus herpes simple; VVZ: virus varicela zóster.
Factores de riesgo de EFI relacionados con el ambiente y la profilaxis antiinfecciosa previa
| ENTORNO: |
| Patógenos adquiridos en la comunidad: |
| Aire: Aspergillus spp. |
| Alimentos y agua: Aspergillus spp., Penicillium spp., Paecilomyces spp. y otros hongos filamentosos |
| Tierra (jardines, obras, reparación viviendas): Aspergillus spp., Fusarium spp., Scedosporium spp., Acremonium spp., Alternaria spp., Curvularia spp., |
| Patógenos adquiridos en el hospital: |
| Aire: Aspergillus spp. |
| Alimentos y agua: Aspergillus spp., zigomicetos, Penicillium spp., Paecilomyces spp. y otros hongos filamentosos |
| Personal sanitario: Candida spp. |
| Fómites: Zigomicetos |
| PROFILAXIS ANTIMICROBIANA: |
| Profilaxis antibacteriana prolongada: Candida spp. (C. albicans, principalmente), Aspergillus spp. (A. fumigatus, principalmente) |
| Profilaxis antivírica (ganciclovir): Mohos, especialmente Aspergillus spp. |
| Empleo de fluconazol, itraconazol: C. albicans resistente y selección de C. krusei y C. glabrata, A. calidoustus |
| Empleo de candinas: Basidiomicetos (Cryptococcus spp., Trichosporon spp., Geotrichum spp., Blastoschizomyces spp., etc.), A. lentulus |
| Empleo de polienos: A. terreus, A. lentulus |
Factores que constituyen un grupo de alto riesgo para el desarrollo de EFI en pacientes oncohematológicos y justifican la profilaxis antifúngica primaria
| Edad>40 años |
| Mal estado general (ECOG/OMS) |
| Neutropenia profunda (RAN<500) y prolongada (>10días) |
| LMA con uso de dosis altas de ara-C |
| Linfocitopenia (CD4+<200) |
| Trasplante de progenitores hematopoyéticos alogénico (Alo-TPH) |
| Donante no emparentado en el alo-TPH |
| Mismatch HLA, no idéntico, parcialmente compatible |
| Depleción de linfocitos T (evitar la EICH) |
| EICH grados II-IV y tratamiento con inmunosupresores |
| Trasplante autólogo si CD34<2×106/kg |
| Tratamiento con análogos de las purinas |
| Tratamiento con alemtuzumab (anti-CD52) |
| Dosis altas de esteroides (>1mg/kg/día,>2 semanas) |
| Uso de terapias biológicas anti-TNFα (infliximab) |
| Fallo del injerto |
Ara-C: arabinósido de citosina; EICH: enfermedad del injerto frente al huésped; LMA: leucemia mieloide aguda; RAN: recuento absoluto de neutrófilos; TPH: trasplante de progenitores hematopoyéticos.
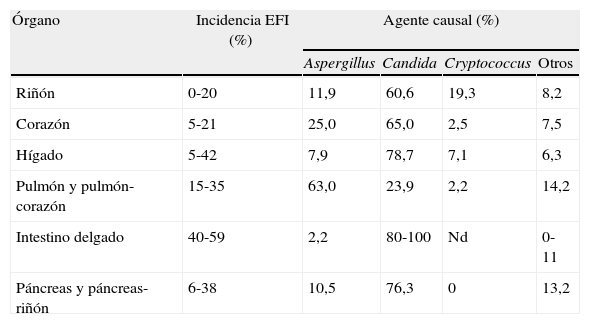
Los receptores de TOS también constituyen uno de los principales grupos de riesgo para desarrollar EFI; sin embargo, la incidencia de la misma y el agente causal varían sustancialmente dependiendo principalmente del órgano trasplantado (tabla 6). En esta población, los receptores de intestino delgado y los trasplantados de pulmón son los pacientes con mayor incidencia de EFI, siendo en estos últimos donde las infecciones por Aspergillus spp. son mayoritarias (63%). En el resto de los receptores de TOS, Candida spp. (60-100%) es la causa más habitual de EFI11.
Incidencia de EFI y sus agentes causales en receptores de TOS (adaptado de Pfaller & Diekema5)
| Órgano | Incidencia EFI (%) | Agente causal (%) | |||
| Aspergillus | Candida | Cryptococcus | Otros | ||
| Riñón | 0-20 | 11,9 | 60,6 | 19,3 | 8,2 |
| Corazón | 5-21 | 25,0 | 65,0 | 2,5 | 7,5 |
| Hígado | 5-42 | 7,9 | 78,7 | 7,1 | 6,3 |
| Pulmón y pulmón-corazón | 15-35 | 63,0 | 23,9 | 2,2 | 14,2 |
| Intestino delgado | 40-59 | 2,2 | 80-100 | Nd | 0-11 |
| Páncreas y páncreas-riñón | 6-38 | 10,5 | 76,3 | 0 | 13,2 |
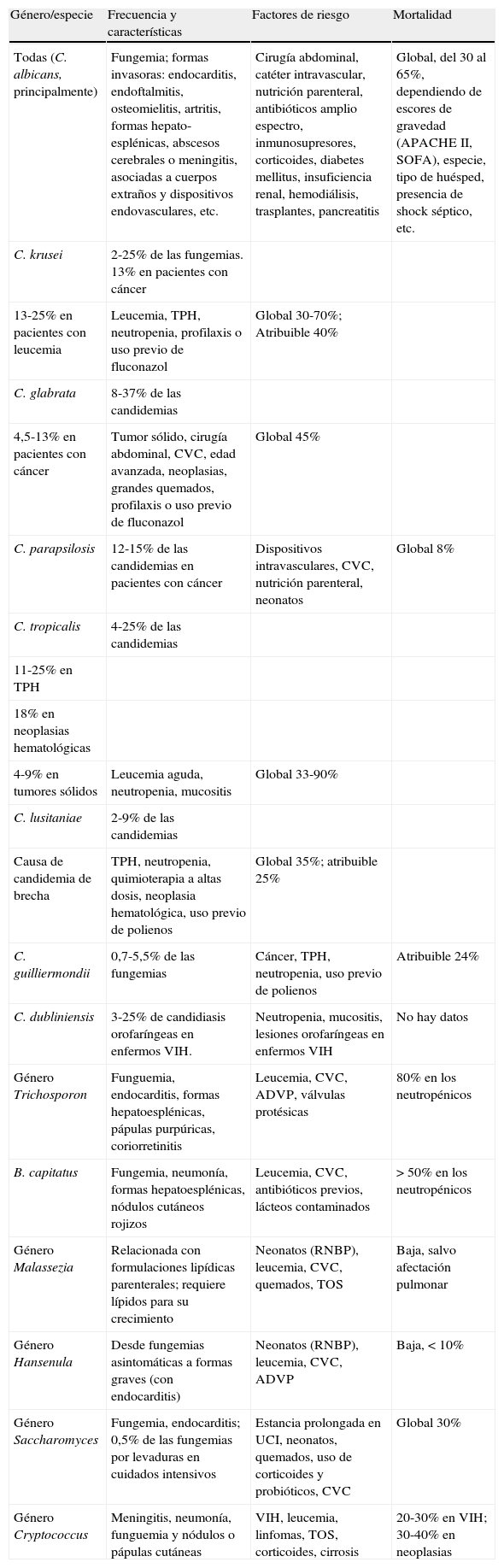
Sin lugar a dudas, la candidemia es la EFI más común en nuestro entorno y aunque hay descritas más de cien especies distintas de Candida, el 95-97% de todas las EFI producidas por levaduras de este género están causadas por solo cinco especies: Candida albicans, Candida glabrata, Candida parapsilosis, Candida tropicalis y Candida krusei. El 3-5% restante se encuentra representado por un grupo de 15-18 especies diferentes entre las que destacan Candida guilliermondii, Candida lusitaniae y Candida rugosa3.
La principal fuente de infección por Candida spp. es endógena (previa colonización de la piel o mucosas), aunque también puede trasmitirse a través de material infectado, personal sanitario o desde otros pacientes12,13. La supresión de la flora bacteriana habitual del tracto intestinal, por la acción de antibacterianos de amplio espectro, facilita la proliferación de levaduras en el tubo digestivo y, con ella, aumenta el riesgo del paso al torrente sanguíneo a través del epitelio intestinal por fenómenos de translocación, entre otros. La mayoría de los factores de riesgo descritos que favorecen una infección sistémica por levaduras (tabla 1) son muy habituales en los pacientes hospitalizados (diabetes mal controlada, corticoterapia prolongada, alteraciones inmunitarias de los mecanismos básicos de defensa) o alteran la integridad de la piel o de la mucosa digestiva (nutrición parenteral, catéteres intravasculares, fenómenos de isquemia y necrosis, perforación de víscera hueca o pancreatitis necrotizante)14–17. Aparte de los factores de riesgo comunes para todas las especies de Candida, también se han descrito otros factores específicamente relacionados con ciertas especies como son la neutropenia y/o el TPH con C. tropicalis y C. krusei, el uso previo de fluconazol como factor selector de C. glabrata y/o C. krusei, o bien la nutrición parenteral, el catéter intravascular y/o ser paciente neonato con C. parapsilosis, entre otros (tabla 7).
Características y factores de riesgo de las principales especies de Candida y de otras levaduras emergentes causantes de candidiasis invasiva, de fungemia o de EFI (adaptado de varias referencias1,14–16)
| Género/especie | Frecuencia y características | Factores de riesgo | Mortalidad |
| Todas (C. albicans, principalmente) | Fungemia; formas invasoras: endocarditis, endoftalmitis, osteomielitis, artritis, formas hepato-esplénicas, abscesos cerebrales o meningitis, asociadas a cuerpos extraños y dispositivos endovasculares, etc. | Cirugía abdominal, catéter intravascular, nutrición parenteral, antibióticos amplio espectro, inmunosupresores, corticoides, diabetes mellitus, insuficiencia renal, hemodiálisis, trasplantes, pancreatitis | Global, del 30 al 65%, dependiendo de escores de gravedad (APACHE II, SOFA), especie, tipo de huésped, presencia de shock séptico, etc. |
| C. krusei | 2-25% de las fungemias. 13% en pacientes con cáncer | ||
| 13-25% en pacientes con leucemia | Leucemia, TPH, neutropenia, profilaxis o uso previo de fluconazol | Global 30-70%; Atribuible 40% | |
| C. glabrata | 8-37% de las candidemias | ||
| 4,5-13% en pacientes con cáncer | Tumor sólido, cirugía abdominal, CVC, edad avanzada, neoplasias, grandes quemados, profilaxis o uso previo de fluconazol | Global 45% | |
| C. parapsilosis | 12-15% de las candidemias en pacientes con cáncer | Dispositivos intravasculares, CVC, nutrición parenteral, neonatos | Global 8% |
| C. tropicalis | 4-25% de las candidemias | ||
| 11-25% en TPH | |||
| 18% en neoplasias hematológicas | |||
| 4-9% en tumores sólidos | Leucemia aguda, neutropenia, mucositis | Global 33-90% | |
| C. lusitaniae | 2-9% de las candidemias | ||
| Causa de candidemia de brecha | TPH, neutropenia, quimioterapia a altas dosis, neoplasia hematológica, uso previo de polienos | Global 35%; atribuible 25% | |
| C. guilliermondii | 0,7-5,5% de las fungemias | Cáncer, TPH, neutropenia, uso previo de polienos | Atribuible 24% |
| C. dubliniensis | 3-25% de candidiasis orofaríngeas en enfermos VIH. | Neutropenia, mucositis, lesiones orofaríngeas en enfermos VIH | No hay datos |
| Género Trichosporon | Funguemia, endocarditis, formas hepatoesplénicas, pápulas purpúricas, coriorretinitis | Leucemia, CVC, ADVP, válvulas protésicas | 80% en los neutropénicos |
| B. capitatus | Fungemia, neumonía, formas hepatoesplénicas, nódulos cutáneos rojizos | Leucemia, CVC, antibióticos previos, lácteos contaminados | >50% en los neutropénicos |
| Género Malassezia | Relacionada con formulaciones lipídicas parenterales; requiere lípidos para su crecimiento | Neonatos (RNBP), leucemia, CVC, quemados, TOS | Baja, salvo afectación pulmonar |
| Género Hansenula | Desde fungemias asintomáticas a formas graves (con endocarditis) | Neonatos (RNBP), leucemia, CVC, ADVP | Baja, <10% |
| Género Saccharomyces | Fungemia, endocarditis; 0,5% de las fungemias por levaduras en cuidados intensivos | Estancia prolongada en UCI, neonatos, quemados, uso de corticoides y probióticos, CVC | Global 30% |
| Género Cryptococcus | Meningitis, neumonía, funguemia y nódulos o pápulas cutáneas | VIH, leucemia, linfomas, TOS, corticoides, cirrosis | 20-30% en VIH; 30-40% en neoplasias |
ADVP: adictos a drogas por vía parenteral; CVC: catéter vascular central; EFI: enfermedad fúngica invasora; RNBP: recién nacidos de bajo peso; TOS: trasplante de órgano sólido; TPH: trasplante de progenitores hematopoyéticos; UCI: unidades de cuidados intensivos; VIH: virus de la inmunodeficiencia humana.
La variabilidad geográfica en la distribución de las especies causantes de candidemia es un hecho ampliamente reconocido y, puesto que la sensibilidad de las mismas a los antifúngicos no es uniforme, antes de instaurar un tratamiento antifúngico empírico frente a estas graves infecciones es aconsejable conocer la realidad epidemiológica del entorno del paciente y del centro en que es asistido. De ahí, la importancia de la realización de estudios epidemiológicos periódicos que reflejen la realidad actual de las candidemias, tanto de la distribución de las especies causales como de su sensibilidad a los antifúngicos. En el último estudio epidemiológico multicéntrico de ámbito nacional realizado en España en 2009 (estudio FUNGEMYCA) participaron 43 centros hospitalarios y se incluyeron 1.377 aislamientos de hemocultivos pertenecientes a 1.357 episodios de fungemia18. En este estudio, C. albicans fue la especie más frecuentemente aislada (44,7%), seguida de C. parapsilosis (29,1%), C. glabrata (11,5%), C. tropicalis (8,2%) y C. krusei (2%). Estos resultados difieren sensiblemente de los de otros estudios multicéntricos europeos o americanos donde C. glabrata continúa siendo la segunda especie aislada, después de C. albicans y por delante de C. parapsilosis. Por lo tanto, es muy importante conocer la realidad epidemiológica de cada región o país (que tampoco suele ser globalmente uniforme) y las características propias de cada centro hospitalario con sus poblaciones especiales de pacientes y diferentes estrategias terapéuticas antifúngicas.
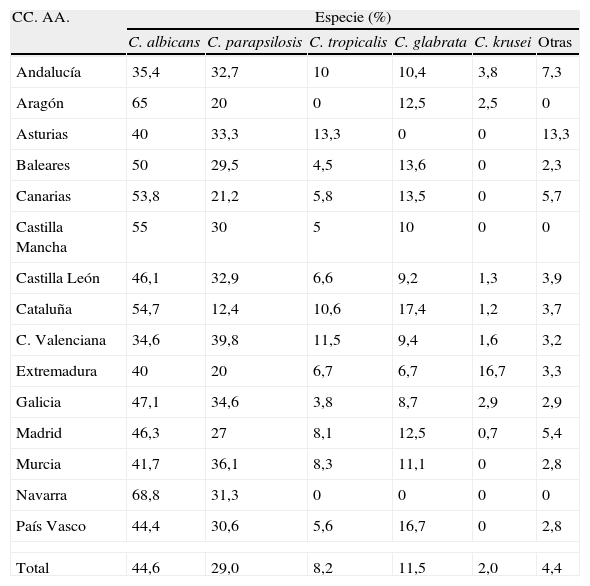
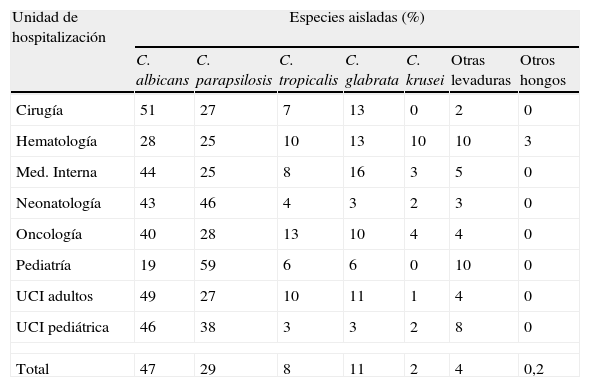
En el estudio FUNGEMYCA la distribución de las especies aisladas en España no fue completamente homogénea en todo el país (tabla 8), observándose notables diferencias según la comunidad autónoma y/o el hospital estudiado. Navarra (69%) y Aragón (65%) fueron las comunidades autónomas donde C. albicans se aisló con una frecuencia muy superior a la media nacional (44,7%) y la Comunidad Valenciana y Andalucía fueron las comunidades donde la tasa de aislamientos de esta especie fue la más baja (35%). Por su parte, C. parapsilosis se aisló de manera más notable en la Comunidad Valenciana (40%) y Murcia (36%) y de forma muy inferior a la media nacional (29%) en Cataluña (12%). Sin embargo, Cataluña y el País Vasco fueron las comunidades con mayor porcentaje de aislamientos de C. glabrata (17%), especie que no fue aislada en Asturias ni en Navarra. C. tropicalis se aisló con más frecuencia en Asturias (13%) y en la Comunidad Valenciana (12%) y no se registró ningún aislamiento en Aragón ni en Navarra. Extremadura fue la comunidad con más aislamientos de C. krusei (17%), tasa muy superior a la media nacional (2%). Por su parte, al analizar la distribución de las especies causales en función de la unidad de hospitalización donde se encontraba el paciente en el momento de la fungemia, se observó una distribución similar pero no homogénea de las principales especies (tabla 9). Aunque C. albicans, C. parapsilosis y C. glabrata fueron las tres especies mayoritarias en casi todas las unidades de hospitalización, y en este mismo orden, en los Servicios de Neonatología y de Pediatría General, C. parapsilosis fue la especie predominante y se aisló con mayor frecuencia que C. albicans (46 vs. 43% y 59 vs. 19%, respectivamente) y que otras especies habituales en esta población como C. tropicalis. Al comparar los resultados obtenidos en este estudio con los obtenidos en otro trabajo similar realizado por nuestro grupo hace una década se observa cómo el porcentaje global de incidencia de las principales especies causantes de fungemia en nuestro país apenas ha variado a pesar de la incorporación de los nuevos antifúngicos acaecida desde entonces19. C. albicans fue y sigue siendo la especie predominante (43 vs. 44,6%) seguida de C. parapsilosis (29,7 vs. 29%); sin embargo, el porcentaje de aislamientos de C. glabrata se ha incrementado ligeramente (8,9 vs. 11,5%) y los de C. tropicalis (10,2 vs. 8,2%) y C. krusei (3,4 vs. 2%) han descendido.
Estudio FUNGEMYCA; distribución por especies de Candida y según CC. AA. (Pemán et al.18)
| CC. AA. | Especie (%) | |||||
| C. albicans | C. parapsilosis | C. tropicalis | C. glabrata | C. krusei | Otras | |
| Andalucía | 35,4 | 32,7 | 10 | 10,4 | 3,8 | 7,3 |
| Aragón | 65 | 20 | 0 | 12,5 | 2,5 | 0 |
| Asturias | 40 | 33,3 | 13,3 | 0 | 0 | 13,3 |
| Baleares | 50 | 29,5 | 4,5 | 13,6 | 0 | 2,3 |
| Canarias | 53,8 | 21,2 | 5,8 | 13,5 | 0 | 5,7 |
| Castilla Mancha | 55 | 30 | 5 | 10 | 0 | 0 |
| Castilla León | 46,1 | 32,9 | 6,6 | 9,2 | 1,3 | 3,9 |
| Cataluña | 54,7 | 12,4 | 10,6 | 17,4 | 1,2 | 3,7 |
| C. Valenciana | 34,6 | 39,8 | 11,5 | 9,4 | 1,6 | 3,2 |
| Extremadura | 40 | 20 | 6,7 | 6,7 | 16,7 | 3,3 |
| Galicia | 47,1 | 34,6 | 3,8 | 8,7 | 2,9 | 2,9 |
| Madrid | 46,3 | 27 | 8,1 | 12,5 | 0,7 | 5,4 |
| Murcia | 41,7 | 36,1 | 8,3 | 11,1 | 0 | 2,8 |
| Navarra | 68,8 | 31,3 | 0 | 0 | 0 | 0 |
| País Vasco | 44,4 | 30,6 | 5,6 | 16,7 | 0 | 2,8 |
| Total | 44,6 | 29,0 | 8,2 | 11,5 | 2,0 | 4,4 |
Estudio FUNGEMYCA: Distribución de las especies aisladas por unidad de hospitalización (Pemán et al.18)
| Unidad de hospitalización | Especies aisladas (%) | ||||||
| C. albicans | C. parapsilosis | C. tropicalis | C. glabrata | C. krusei | Otras levaduras | Otros hongos | |
| Cirugía | 51 | 27 | 7 | 13 | 0 | 2 | 0 |
| Hematología | 28 | 25 | 10 | 13 | 10 | 10 | 3 |
| Med. Interna | 44 | 25 | 8 | 16 | 3 | 5 | 0 |
| Neonatología | 43 | 46 | 4 | 3 | 2 | 3 | 0 |
| Oncología | 40 | 28 | 13 | 10 | 4 | 4 | 0 |
| Pediatría | 19 | 59 | 6 | 6 | 0 | 10 | 0 |
| UCI adultos | 49 | 27 | 10 | 11 | 1 | 4 | 0 |
| UCI pediátrica | 46 | 38 | 3 | 3 | 2 | 8 | 0 |
| Total | 47 | 29 | 8 | 11 | 2 | 4 | 0,2 |
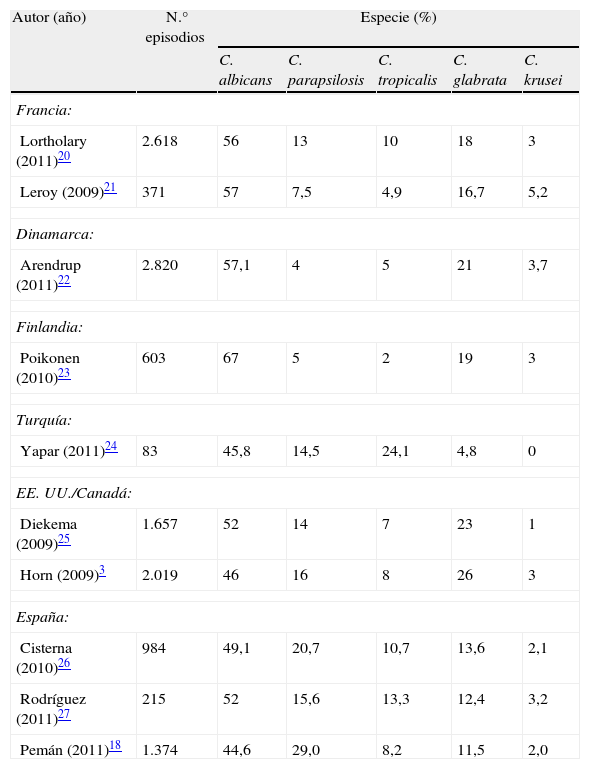
Como ya se ha comentado, la distribución de las especies causantes de candidemia y candidiasis invasora presenta una notable variabilidad geográfica. En la tabla 10 se ha resumido la distribución de las principales especies aisladas en los estudios multicéntricos publicados en los últimos 2años dentro y fuera de nuestro país. En todos ellos C. albicans permanece como la especie predominante pero, a diferencia de España, C. glabrata se aísla con mayor frecuencia que C. parapsilosis en Francia, Dinamarca, Finlandia, EE. UU. y Canadá3,18,20–27. Por consiguiente y debido a la diferente sensibilidad a los antifúngicos de cada una de estas especies principales, en el momento de instaurar un tratamiento antifúngico empírico debe tenerse en cuenta la epidemiología local real del entorno y las circunstancias propias del paciente, unidad de hospitalización, centro y país, dado que no basta con extrapolar los resultados obtenidos en otros países o épocas.
Distribución de las principales especies en los estudios multicéntricos de candidemia publicados en los últimos dos años
| Autor (año) | N.° episodios | Especie (%) | ||||
| C. albicans | C. parapsilosis | C. tropicalis | C. glabrata | C. krusei | ||
| Francia: | ||||||
| Lortholary (2011)20 | 2.618 | 56 | 13 | 10 | 18 | 3 |
| Leroy (2009)21 | 371 | 57 | 7,5 | 4,9 | 16,7 | 5,2 |
| Dinamarca: | ||||||
| Arendrup (2011)22 | 2.820 | 57,1 | 4 | 5 | 21 | 3,7 |
| Finlandia: | ||||||
| Poikonen (2010)23 | 603 | 67 | 5 | 2 | 19 | 3 |
| Turquía: | ||||||
| Yapar (2011)24 | 83 | 45,8 | 14,5 | 24,1 | 4,8 | 0 |
| EE. UU./Canadá: | ||||||
| Diekema (2009)25 | 1.657 | 52 | 14 | 7 | 23 | 1 |
| Horn (2009)3 | 2.019 | 46 | 16 | 8 | 26 | 3 |
| España: | ||||||
| Cisterna (2010)26 | 984 | 49,1 | 20,7 | 10,7 | 13,6 | 2,1 |
| Rodríguez (2011)27 | 215 | 52 | 15,6 | 13,3 | 12,4 | 3,2 |
| Pemán (2011)18 | 1.374 | 44,6 | 29,0 | 8,2 | 11,5 | 2,0 |
Aunque las especies de Candida y otras levaduras constituyen una importante causa de EFI, otros géneros, particularmente los hongos filamentosos o mohos, han ido incrementando su prevalencia en determinados huéspedes de los previamente mencionados28 (tablas 1 y 2). Concretamente, las especies del género Aspergillus son actualmente la principal causa de EFI por mohos en los enfermos más inmunodeprimidos (TPH y TOS), seguidas a mayor distancia por otros considerados emergentes y con mayor o menor protagonismo según áreas geográficas y tipos de pacientes, como Fusarium spp., Scedosporium spp. o los zigomicetos29. Todos ellos siguen ocasionando unas tasas elevadas de mortalidad (40-90%) entre los afectados. No obstante, las mejoras en los procedimientos diagnósticos microbiológicos, como la determinación del antígeno galactomanano de Aspergillus o del beta-D-glucano y las modernas técnicas moleculares basadas en la detección de ácidos nucleicos, junto con la puesta en marcha de nuevas técnicas de imagen como la tomografía computarizada de alta resolución (TC-AR) y la angio-TC, además de la disponibilidad de nuevos agentes antifúngicos más potentes, eficaces y mejor tolerados, han mejorado en conjunto el pronóstico y la supervivencia de los pacientes con EFI por hongos filamentosos30. Hoy en día, la evolución final de la AI y de las EFI por mohos depende de diferentes factores concurrentes como la enfermedad subyacente, los procedimientos a los que es sometido el paciente, el estado neto de inmunosupresión, la localización geográfica, virulencia y sensibilidad antifúngica del propio patógeno y, obviamente, de la estrategia terapéutica seleccionada y del agente antifúngico elegido en el marco de una terapia integral.
Las especies del género Aspergillus son mohos de carácter oportunista que pueden causar tanto síndromes alérgicos como invasores, ya sean éstos últimos localizados o diseminados, dependiendo este comportamiento clínico de factores derivados no solo del agente infeccioso sino también del hospedador31. En la actualidad se conocen más de 300 especies de Aspergillus, de las cuales solo un pequeño número son causantes de infecciones oportunistas. La especie que con mayor frecuencia causa aspergilosis es Aspergillus fumigatus, la cual comprende aproximadamente el 90% de las infecciones por este género32. Otras especies, como Aspergillus flavus, Aspergillus nidulans y Aspergillus terreus se aíslan cada vez con más frecuencia, dependiendo de factores geográficos, tipo de huésped o prescripción de antifúngicos, incrementando su papel como agentes etiológicos33–35. Paralelamente, existen diferencias, ocasionalmente bien documentadas, en las formas de presentación clínica causadas por estas especies de Aspergillus. Como ejemplos, A. flavus produce un importante número de infecciones otorrinolaringológicas, con claro tropismo por los senos paranasales, mientras que A. nidulans es un protagonista común en los pacientes diagnosticados de enfermedad granulomatosa crónica y, por tanto, más frecuente en población en edad pediátrica con este tipo de inmunodeficiencia. Aunque A. terreus aún sigue siendo una causa infrecuente de aspergilosis, la infección causada por esta especie se asocia con elevadas tasas de mortalidad, en parte debida a su falta de sensibilidad a la anfotericina B. En un reciente estudio epidemiológico ambiental de tres países europeos (Austria, Dinamarca y España) se observó que A. terreus era endémico en el Tirol, y fue casi exclusivamente aislado en hospitales de Austria; por su parte, Aspergillus niger fue la especie no-fumigatus más frecuentemente aislada en Madrid34.
Además, se ha observado un fenómeno importante relacionado con el incremento de la resistencia de Aspergillus a los azoles, sobre todo en zonas del Reino Unido (Manchester) y de Holanda (Nijmegen). El estudio holandés, que incluyó casi 2.000 cepas aisladas de A. fumigatus durante un periodo de 14 años, mostró que 30 de 32 aislamientos que exhibían un aumento de la resistencia a todos los azoles evaluados, poseían el mismo mecanismo de resistencia dominante36. Todos mostraban un cambio de aminoácido único en el gen cyp51A (el cual codifica la enzima diana del citocromo P450, la esterol-14-α-demetilasa) y una alteración en la región del promotor de este gen. Un reciente estudio de Pfaller et al. determinó la sensibilidad a itraconazol, voriconazol y posaconazol de 1.789 aislamientos de Aspergillus de centros de todo el mundo, recogidos en el periodo de 2001 a 2009, observando una disminución en su sensibilidad, dependiente de la especie aislada, en 49 aislados37. Algunas de las cepas que poseían una CMI mayor a 4μg/ml para itraconazol mostraban resistencia cruzada a posaconazol y voriconazol. Además, se han comunicado casos de EFI pulmonares, cerebrales y óseas causadas por aislados de Aspergillus spp. resistentes a azoles38,39, y casos de aspergiloma con fracaso terapéutico de itraconazol. En España, la tasa de resistencia a los azoles entre los aislados clínicos de A. fumigatus es del 2%, mientras que en Austria es del 0%40. Las razones para explicar este aumento en la resistencia no están todavía dilucidadas, si bien se dispone de algunas evidencias para pensar que podría deberse al uso excesivo de los azoles en medios agrícolas y/o ganaderos41,42.
La AI permanece en los últimos 15años como la principal causa de EFI causada por mohos43. Las razones de esta predominancia radican en el continuo incremento de las poblaciones con riesgo más alto de padecerla (tablas 1-6), entre las cuales se incluyen: pacientes con neoplasias hematológicas, enfermos con neumopatía crónica grave (como los pacientes con enfermedad pulmonar crónica obstructiva, fibrosis quística, o bronquiectasias), receptores de TOS, personas infectadas por el VIH (con bajos recuentos de linfocitos CD4) y pacientes con tumores sólidos (debido a los regímenes de quimioterapia o anticuerpos monoclonales)44,45. En los pacientes sometidos a TPH, especialmente en los alotrasplantados, se ha observado una presencia bimodal de la AI tras el alo-TPH, apreciando cada vez más la aparición de formas de inicio tardío de AI28,46. Los factores específicos promotores de un mayor riesgo en estas poblaciones más susceptibles son muy variados e incluyen (tablas 1, 3 y 5): neutropenia (recuento de polimorfonucleares<500/μl), antibioterapia prolongada de amplio espectro, tratamiento con corticoides, quimioterapia citotóxica, otros agentes inmunosupresores, la colonización por Aspergillus, la infección por citomegalovirus o por Pneumocystis jiroveci, la fuente de progenitores hematopoyéticos, la enfermedad del injerto frente al huésped (EICH), el grado de concordancia en el HLA del TPH, el uso de terapias biológicas y de análogos de nucleósidos47–49. La presentación clínica de la AI difiere entre los pacientes neutropénicos y los no-neutropénicos; en éstos últimos la AI se caracteriza por una mayor pobreza en la semiología (solo fiebre, tos, dolor torácico), más casos de neumonía y una tasa de mortalidad más alta que en los neutropénicos.
La AI se ha asociado durante décadas a una alta tasa de mortalidad; sin embargo, existen evidencias de que las tasas de supervivencia se han mejorado en los últimos años, al menos en la población de pacientes oncohematológicos y en los sometidos a TPH, tal vez influidas por los regímenes de acondicionamiento menos mieloablativos, el uso de fuentes de progenitores hematopoyéticos de sangre periférica, los medios de diagnóstico más precoces y el empleo de regímenes de profilaxis y de tratamiento antifúngico más eficaces y mejor tolerados50. Se ha constatado una mejora en el pronóstico de la AI en pacientes con leucemia aguda, como muestra un estudio del grupo italiano en el que se redujo de forma significativa la tasa de mortalidad atribuible, del 60% (en el periodo de 1987-1988) al 32% (entre 2002-2003)51. En otros estudios multicéntricos consecutivos, Pagano et al. demostraron un decremento en la tasa de mortalidad de la AI, del 48% (periodo 1987-1998) al 38,5% (periodo 1999-2003) y al 27% (periodo 2004-2007)52,53. Aun así, las tasas de mortalidad de la AI son altas, oscilando entre un 35% en enfermos con leucemia mieloide aguda hasta un 95% en determinados pacientes sin neutropenia54,55. La epidemiología de la AI en pacientes con EPOC era poco conocida hasta el momento, pero se han aportado datos muy interesantes en los últimos años y, entre ellos, se describen tasas de mortalidad cercanas al 100%56. Las formas de enfermedad diseminada, la coinfección con otros patógenos oportunistas (como P. jiroveci y/o citomegalovirus) o la presencia de neumonía bacteriana intercurrente se han identificado como factores de mal pronóstico en estos pacientes. La mortalidad de la AI varía en relación con la forma de presentación y localización anatómica, además de la extensión o progresión de la misma. En el trabajo de Lin et al.57 la tasa de mortalidad media global de los 1.941 casos incluidos fue del 57%, y la mayor mortalidad correspondió a las formas localizadas en sistema nervioso central (88%), seguidas de las formas diseminadas multifocales (67%) y de las aspergilosis pulmonares invasivas (60%). En este magno trabajo sobre mortalidad de la AI basado en la revisión sistemática de la literatura, si bien pertenece a una década anterior a la actual, se pudo establecer una fotografía comparativa respecto al pronóstico y supervivencia entre los distintos grupos de población de enfermos, siendo la mortalidad más alta en los pacientes con TPH (86,7%), seguida de los pacientes infectados por el VIH o con sida (85,7%), con trasplante hepático (67,6%), trasplante renal (62,5%), oncohematológicos con leucemias o linfomas (49%) y, por último, los trasplantados de corazón/pulmón (43%). Probablemente estas tasas de mortalidad han cambiado en la actualidad, dependiendo de cada centro y área geográfica, así como de la complejidad de los pacientes y de la introducción de nuevos antifúngicos58.
Otras levaduras y mohos emergentes de interésLas EFI causadas por nuevos mohos y levaduras emergentes distintos de Candida spp. y Aspergillus spp. se han incrementado en frecuencia y gravedad en las últimas dos décadas, asociadas a tasas muy elevadas de morbilidad y mortalidad (65-90%), especialmente en los grupos de pacientes más inmunodeprimidos. Específicamente, y casi en un cierto orden de frecuencia, que puede variar en los distintos huéspedes (según sean por neoplasias hematológicas, trasplantados, infectados por el VIH, sometidos a corticoterapia prolongada o a nuevas terapias biológicas) destacan las siguientes familias o géneros: zigomicetos (Mucor spp., Rhizopus spp., Absidia spp.), otros mohos (Fusarium spp., Scedosporium spp., Acremonium spp., Penicillium spp., Paecilomyces spp. y Trichoderma spp.), especies de Cryptococcus y otras levaduras (Trichosporon spp., Blastoschizomyces spp., Geotrichum spp., Malassezia spp., Saccharomyces spp., Hansenula spp. y Rhodotorula spp.). Aunque estas EFI por hongos emergentes son infrecuentes, gran parte de su importancia reside en la virulencia de su comportamiento, en el grado de inmunosupresión del huésped en el que asientan y en las opciones limitadas del tratamiento antifúngico debido a su amplio perfil de resistencia a la mayoría de los fármacos disponibles, en ocasiones hasta de pan-resistencia. Por ello, la combinación de varios antifúngicos, y ocasionalmente de otras medidas adyuvantes como la cirugía, es el tratamiento más apropiado de estas micosis emergentes con elevada letalidad intrínseca59.