En la fase de eliminación del sarampión, reviste especial importancia la investigación de cada caso sospechoso, especialmente en personas vacunadas, pues en ellas la clínica es más leve, y los resultados de laboratorio más difíciles de interpretar. Nuestro estudio se centró en la epidemiología del sarampión en personas vacunadas.
MétodosSe realizó un estudio longitudinal de los casos de sarampión en personas vacunadas notificados en España entre 2003 y 2014.
ResultadosSe observaron 138 casos confirmados de sarampión en personas vacunadas con 2 dosis, 90 de ellos confirmados por laboratorio. La mediana de tiempo entre la última dosis de vacuna recibida y la aparición del exantema mostró una tendencia lineal creciente (p<0,001) en función de las dosis de vacuna (0, 1, 2 dosis). El riesgo de hospitalización disminuyó de forma inversamente proporcional al número de dosis de vacuna recibidas (p<0,001). Solo en el 23,9% de los casos confirmados y en el 50% de los descartados, se cumplió el protocolo de recogida de muestras clínicas. En el 50% de los casos estudiados en vacunados con 2 dosis, las muestras se tomaron precozmente. El 16,7% de los descartados mediante IgM negativa podrían ser falsos negativos, pues procedían de muestras precoces.
ConclusiónNuestros resultados evidencian la importancia de cumplir el protocolo diagnóstico para confirmar o descartar casos de sarampión, especialmente en los vacunados con 2 dosis. Ante una IgM negativa en muestras precoces, sería necesario obtener una nueva muestra y realizar un nuevo test de IgM, así como la prueba de PCR.
During the final phase of measles elimination rigorous investigation of each individual case becomes fundamental to confirm or discard cases, particularly among vaccinated people, since they experience a milder disease, and laboratory diagnosis is more complex. Our study focused in the epidemiology of measles in vaccinated people.
MethodsLongitudinal study on measles cases in two dose vaccinated people in Spain from 2003 to 2014.
ResultsWe confirmed 138 measles cases (90 of them, laboratory confirmed) in people with two doses of vaccine. The median of time from last vaccination to rash onset showed a lineal trend (P<.001), in parallel with the number of doses of vaccine received (0, 1, 2 doses). Among confirmed cases, the hospitalization risk decreased inversely proportional to the number of administered vaccine doses (linear trend, P<.001). Only in 23.9% of confirmed cases and 50% of discarded cases the guidelines about sample taking were fulfilled. 50% of samples in two dose vaccinated people were taken without fulfilling time delay criteria. 16.7% (36/215) of discarded cases with a negative IgM result did correspond to samples taken early (first 72h after rash) and could represent false negatives.
ConclusionOur results highlight the importance of fulfilling properly the guidelines for laboratory diagnosis in order to confirm or discard every measles case, especially in two dose vaccinated people. When a negative IgM result is obtained in early samples a new IgM test should be practiced, as well as a PCR test, in order to avoid infra-detection of cases.
En las últimas décadas hemos asistido a una drástica disminución de la morbimortalidad asociada al sarampión gracias a la generalización del uso de la vacuna1. El sarampión es una enfermedad eliminable pues su reservorio es exclusivamente humano, el agente sobrevive difícilmente en el ambiente, y junto con buenas técnicas diagnósticas, se dispone de una vacuna efectiva y económica que origina inmunidad duradera2. La eliminación supone la interrupción de la transmisión endémica del virus del sarampión en un territorio durante al menos 12 meses, en presencia de un sistema de vigilancia de alta calidad3. La Región Europea de la Organización Mundial de la Salud (OMS) se marcó el objetivo de eliminar el sarampión en 20154,5. El presente estudio se enmarca en el Plan Nacional para la Eliminación del Sarampión y la Rubéola6, incluido en la Estrategia Europea para la eliminación del Sarampión y la Rubéola5,7. A pesar de los esfuerzos, en los últimos años, más entre 2010 y 2012, se han registrado diversos brotes de sarampión en España y en otros países de Europa8-10.
En zonas con altas coberturas vacunales, la introducción de un nuevo caso de sarampión genera pocos casos secundarios, pero una proporción importante de ellos serán en personas vacunadas11. En ellas la enfermedad puede deberse a fallo vacunal primario (no respuesta inicial) o a fallo vacunal secundario (por evanescencia de la inmunidad, o, menos frecuentemente, por ausencia de capacidad neutralizante de los anticuerpos). La evanescencia implica una respuesta inmune atenuada, insuficiente para evitar la enfermedad, pues los niveles de anticuerpos específicos frente al sarampión son menores en vacunados que en expuestos al virus salvaje12,13. En vacunados, el sarampión es menos contagioso y la clínica más leve14,15.
Las principales estrategias de la OMS para acelerar la eliminación del sarampión en la Región Europea se dirigen a: mantener la inmunidad de la población frente al sarampión, reforzar el protocolo de vigilancia (investigando oportuna y rigurosamente cada caso sospechoso en el laboratorio), establecer medidas de control de la transmisión, conocer la circulación del virus, y verificar su eliminación3,6.
En vacunados, la confirmación/descarte de casos sospechosos resulta más difícil, pues la carga viral es menor, y además la serología para IgM en los 3 primeros días tras el inicio del exantema puede ser negativa, incluso en verdaderos casos de sarampión. Algunos estudios recomiendan complementar los métodos diagnósticos habituales con técnicas como el test de IgG de alta avidez, o el test cuantitativo de IgG15,16. En la fase final de la eliminación, con muy bajas incidencias, es preciso estudiar rigurosamente las sospechas de sarampión en personas vacunadas, especialmente sin han recibido 2 dosis.
El objetivo principal del estudio fue analizar las características de las sospechas de sarampión en vacunados con 2 dosis, notificadas al Plan Nacional de Eliminación del Sarampión entre 2003 y 2014, y examinar la adecuación de los procedimientos de laboratorio (toma de muestras clínicas y pruebas realizadas) al protocolo de vigilancia vigente.
MetodologíaSiguiendo el protocolo de vigilancia del sarampión17 de la Red Nacional de Vigilancia Epidemiológica (RENAVE) utilizamos las siguientes definiciones de caso:
- •
Caso confirmado por laboratorio: reúne criterios clínicos y de laboratorio, no vacunado recientemente (21 días previos al exantema), o recientemente vacunado pero que presenta el genotipo salvaje del virus. La confirmación se establece mediante IgM positiva en suero (elección) y/o PCR positiva en orina/exudado faríngeo.
- •
Caso confirmado por vínculo epidemiológico: cumple los criterios clínicos y tiene vínculo epidemiológico con un caso confirmado por laboratorio.
- •
Caso clínicamente compatible: cumple los criterios clínicos pero no ha sido posible recoger muestras para su confirmación serológica, y no tiene vínculo epidemiológico con un caso confirmado por laboratorio. En grandes brotes (años 2010-2012), ante la dificultad de investigar todos los casos en laboratorio, gran parte se clasificó como «clínicamente compatible», representando con gran probabilidad verdaderos casos de sarampión. En el análisis estos casos se han considerado «confirmados».
- •
Caso descartado: cumple criterios clínicos de sarampión, con resultados de laboratorio negativos o con vínculo epidemiológico con un caso confirmado por laboratorio de otra enfermedad exantemática. Un resultado de IgM negativo descarta un caso. Un resultado de PCR negativo, por sí mismo, no descarta un caso.
- •
Toda sospecha de sarampión debe notificarse e investigarse, tomando oportunamente muestras de suero (a partir del cuarto día tras iniciarse el exantema, y nunca después del vigésimo octavo), y de orina y/o exudado faríngeo (en los 7 días tras iniciarse el exantema). Ante una IgM negativa en suero recogido en las primeras 72h debe tomarse una segunda muestra entre los días 4 y 28, en ausencia de otro resultado confirmatorio17.
Se diseñó un estudio de cohortes retrospectivo en el que se incluyeron todas las sospechas de sarampión notificadas al Plan Nacional de Eliminación del Sarampión entre 2003 y 2014. Se crearon estratos en función del estado de vacunación, grupo de edad y clasificación de caso (confirmado/descartado). Se calculó la incidencia de sarampión por grupos de edad, el riesgo relativo (RR) de confirmación de sarampión en casos sospechosos en función del grupo de edad y del número de dosis de vacuna recibidas, así como el RR de hospitalización en casos confirmados. El RR con su intervalo de confianza se calculó a partir de la odds ratio (OR), mediante el método de Kleinbaum para enfermedades poco prevalentes18. Las variables estudiadas fueron: año, clasificación de caso, edad, grupo de edad (<5 años, 5-19 años, 20 o más años), fecha de inicio del exantema, hospitalización, número de dosis de vacuna (se consideró dosis de vacuna válida la administrada al menos 21 días antes de iniciarse el exantema, tiempo requerido para el desarrollo de la respuesta inmune), fecha de última dosis de vacuna, diferencia en años entre la fecha del exantema y la fecha de la última vacunación, muestras recogidas (solo suero, solo orina y/o exudado, ambos), pruebas realizadas para confirmación/descarte (solo IgM, solo PCR, ambas), y días de diferencia entre la fecha de la primera muestra de suero y la fecha de inicio del exantema.
Las variables cuantitativas se describieron mediante su media y desviación estándar (o mediana y rango intercuartílico en variables no paramétricas). La normalidad se exploró mediante el test de Shapiro Wilk. Las variables cualitativas se describieron mediante su distribución de frecuencias. En la comparación de variables cuantitativas se utilizaron los test de U de Mann Whitney (2 variables, no paramétricas) o Kruskal Wallis (3 o más variables, no paramétricas), y en la de variables cualitativas, la chi cuadrado de Pearson (paramétricas) o el test exacto de Fisher (no paramétricas), además de la prueba de tendencia lineal para aquellas con más de 2 categorías y secuencia ordinal. En el análisis se utilizó regresión logística.
Se utilizaron los programas Excel 2010 y Stata© versión 13.1 para el procesamiento de los datos y el análisis estadístico.
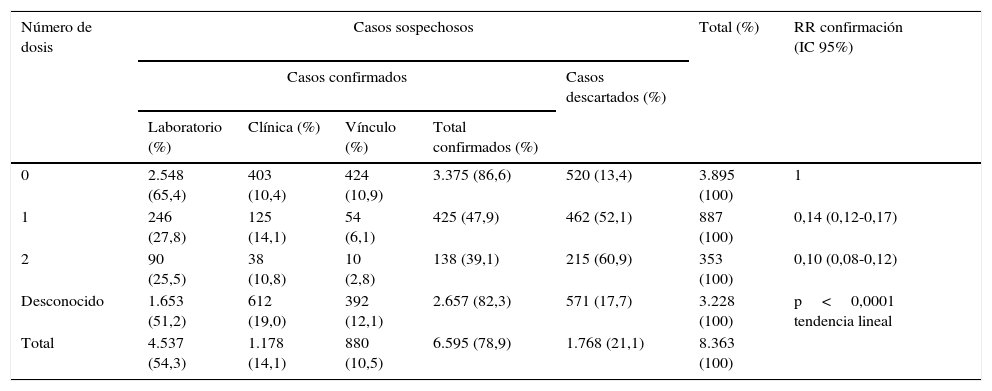
ResultadosEntre 2003 y 2014 se notificaron 8.363 sospechas de sarampión. El 78,9% de las sospechas se confirmaron y el 21,1% se descartaron. En 5.135 casos (61,40%) se conocía el antecedente de vacunación. De estos 5.135 casos, el 3,50% (138/3.938) de los confirmados y el 17,9% (215/1.197) de los descartados habían recibido 2 dosis de vacuna (tabla 1).
Clasificación de casos de sarampión en función de número de dosis de vacuna recibidas, España 2003-2014
| Número de dosis | Casos sospechosos | Total (%) | RR confirmación (IC 95%) | ||||
|---|---|---|---|---|---|---|---|
| Casos confirmados | Casos descartados (%) | ||||||
| Laboratorio (%) | Clínica (%) | Vínculo (%) | Total confirmados (%) | ||||
| 0 | 2.548 (65,4) | 403 (10,4) | 424 (10,9) | 3.375 (86,6) | 520 (13,4) | 3.895 (100) | 1 |
| 1 | 246 (27,8) | 125 (14,1) | 54 (6,1) | 425 (47,9) | 462 (52,1) | 887 (100) | 0,14 (0,12-0,17) |
| 2 | 90 (25,5) | 38 (10,8) | 10 (2,8) | 138 (39,1) | 215 (60,9) | 353 (100) | 0,10 (0,08-0,12) |
| Desconocido | 1.653 (51,2) | 612 (19,0) | 392 (12,1) | 2.657 (82,3) | 571 (17,7) | 3.228 (100) | p<0,0001 tendencia lineal |
| Total | 4.537 (54,3) | 1.178 (14,1) | 880 (10,5) | 6.595 (78,9) | 1.768 (21,1) | 8.363 (100) | |
La incidencia media de sarampión en España durante este período fue de 1,23 (IC 95%: 1,13-1,33) casos confirmados por 100.000 habitantes y año. Esta incidencia varió en los distintos grupos de edad, siendo de 7,91 (6,85-9,13) casos por 100.000 habitantes y año en menores de 5 años, 1,8 (1,51-2,15) casos por 100.000 habitantes y año entre los 5 y los 19 años, y 0,32 (0,26-0,38) casos por 100.000 habitantes y año en las personas con 20 o más años. La proporción de casos confirmados entre las sospechas de sarampión disminuyó al aumentar el número de dosis de vacuna recibidas. Tomando como referencia los no vacunados (RR 1), el RR de confirmación en vacunados con una dosis fue 0,14 (IC 95%: 0,12-0,17), y en vacunados con 2 dosis, 0,10 (IC 95%: 0,08-0,12) (prueba de tendencia lineal significativa, p<0,001) (tabla 1).
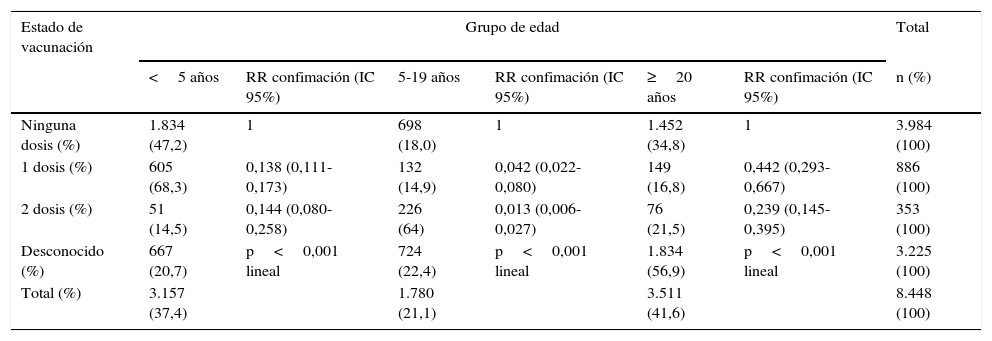
Las sospechas de sarampión en los no vacunados se concentraron en menores de 5 años (47,2%) y en adultos con 20 o más años (34,8%); en los vacunados con una dosis, estas fueron más frecuentes en menores de 5 años (68,3%), y en los vacunados con 2 dosis, entre los 5 y 19 años (64,0%). El RR de confirmación de los casos sospechosos mostró una tendencia lineal global significativa decreciente en función del número de dosis (p<0,001). Este RR de confirmación fue diferente, asimismo, en los distintos grupos etarios. El riesgo de confirmación ante una sospecha de sarampión, a igual estado de vacunación, fue mayor en el grupo de 20 o más años, seguido del grupo de 5 o menos años, y por último, del grupo de 5 a 19 años (tabla 2).
Casos sospechosos de sarampión con RR de confirmación por grupo de edad y estado de vacunación, España 2003-2014
| Estado de vacunación | Grupo de edad | Total | |||||
|---|---|---|---|---|---|---|---|
| <5 años | RR confimación (IC 95%) | 5-19 años | RR confimación (IC 95%) | ≥20 años | RR confimación (IC 95%) | n (%) | |
| Ninguna dosis (%) | 1.834 (47,2) | 1 | 698 (18,0) | 1 | 1.452 (34,8) | 1 | 3.984 (100) |
| 1 dosis (%) | 605 (68,3) | 0,138 (0,111-0,173) | 132 (14,9) | 0,042 (0,022-0,080) | 149 (16,8) | 0,442 (0,293-0,667) | 886 (100) |
| 2 dosis (%) | 51 (14,5) | 0,144 (0,080-0,258) | 226 (64) | 0,013 (0,006-0,027) | 76 (21,5) | 0,239 (0,145-0,395) | 353 (100) |
| Desconocido (%) | 667 (20,7) | p<0,001 lineal | 724 (22,4) | p<0,001 lineal | 1.834 (56,9) | p<0,001 lineal | 3.225 (100) |
| Total (%) | 3.157 (37,4) | 1.780 (21,1) | 3.511 (41,6) | 8.448 (100) | |||
En los casos confirmados en personas vacunadas, la mediana de tiempo entre la última dosis de vacuna y la aparición del exantema fue 4,0 años (rango intercuartílico [RI] 0 a 10,9 años) en los vacunados con 2 dosis, y de 1,0 años (RI 0,1 a 7,1 años) en los vacunados con una dosis (U de Mann Whitney p=0,075).
El 20,7% de los casos confirmados requirió hospitalización. La proporción de hospitalizados fue diferente en función del estado de vacunación: 23,4% en no vacunados, 14,7% en vacunados con una dosis, y 10,2% en vacunados con 2 dosis. Tomando como referencia los no vacunados (RR 1), los vacunados con una dosis presentaron un RR de hospitalización de 0,43 (IC 95%: 0,34-0,54), y los vacunados con 2 dosis, un RR de hospitalización de 0,31 (IC 95%: 0,20-0,45) (prueba de tendencia lineal significativa, p<0,001).
A 206 (95,8%) de los 215 casos descartados en vacunados con 2 dosis se les había recogido muestra. De ellos, solo en 103 (50,0%) casos se recogieron suero y exudado y/u orina, como recomienda el protocolo. Se descartaron 188 casos (87,4%) mediante IgM negativa (técnica de elección). En los 18 restantes (9 de ellos con PCR negativa, otros con vínculo epidemiológico con un caso confirmado de otra enfermedad exantemática) se valoró su situación epidemiológica. Aunque la PCR por sí sola no basta para descartar casos, esos 9 casos se valoraron individualmente y terminaron descartándose (tabla 3).
Muestras y pruebas de laboratorio en casos confirmados y descartados de sarampión en personas que han recibido 2 dosis de vacuna
| Casos confirmados (%) | Muestras | Casos descartados (%) |
|---|---|---|
| 37 (42,0) | Solo suero | 91 (44,2) |
| 30 (34,1) | Solo exudado/orina | 12 (5,8) |
| 21 (23,9) | Suero y exudado/orina | 103 (50,0) |
| Casos confirmados n (%) | Pruebas de laboratorio | Casos descartados n (%) | |
|---|---|---|---|
| 35 (42,2) | Solo IgM+ | Solo IgM– | 88 (44,6) |
| 36 (43,4) | Solo PCR+ | Solo PCR– | 9 (5,6) |
| 12 (14,4) | IgM+ y PCR+ | IgM– y PCR– | 100 (50,8) |
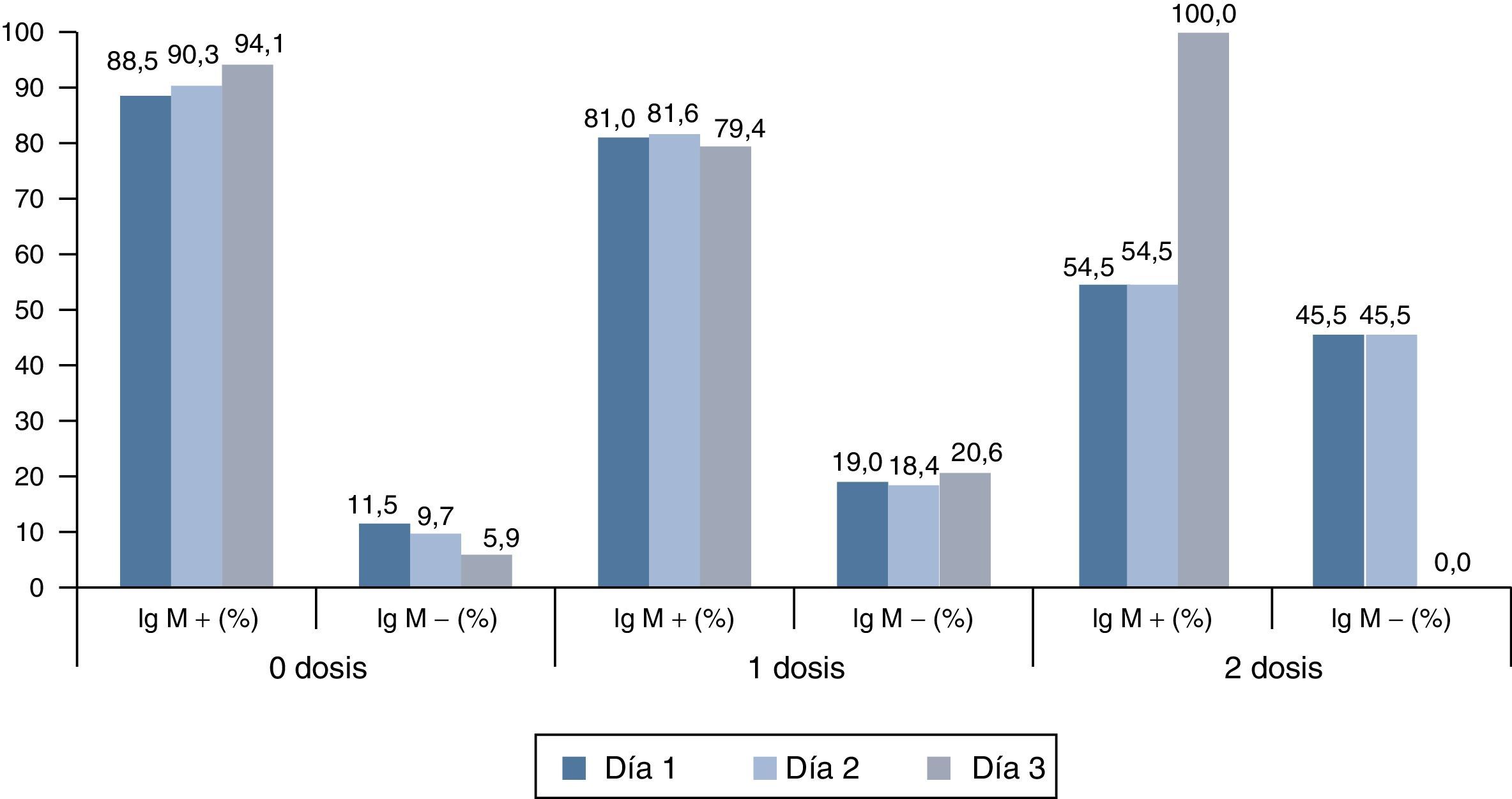
Para evaluar la oportunidad de la toma de muestra se exploró la variable «número de días entre inicio del exantema y toma de la primera muestra de suero». En vacunados con 2 dosis, la mediana de esta variable fue 3 días (RI 1-5 días). Es decir, un 50% de muestras se tomaron precozmente. De los 215 casos descartados en los vacunados con 2 dosis, en 92 casos (42,8%) la IgM negativa se obtuvo en muestras no oportunas. De esos 92 casos, en 36 (16,7% del total de descartados) no había otro resultado de laboratorio que apoyara el descarte (no se realizó PCR).
Examinamos por último la probabilidad de que una IgM negativa en una muestra de suero tomada precozmente representara un falso negativo. Para ello estudiamos los casos que, tras un primer resultado de IgM negativa en una muestra precoz, se confirmaron por laboratorio en una segunda muestra de suero (con IgM positiva y/o PCR positiva), estratificándolos según el número de dosis de vacuna recibidas (0, 1 o 2 dosis). Se observó en estos casos confirmados por laboratorio que a medida que aumentaba el número de dosis de vacuna recibidas, aumentaba la proporción de casos con IgM negativa en sueros precoces (fig. 1).
DiscusiónComo destacan otros estudios (Van der Hoek et al. y Kutty et al.), el diagnóstico del sarampión en personas vacunadas es más complejo, pues en ellas la clínica es más leve, la respuesta inmune de IgM puede estar ausente o acortada, y, debido a la escasa replicación del virus, la detección molecular mediante PCR está limitada13,19. Todo ello puede acarrear la infra-detección del sarampión en personas vacunadas, la clasificación incorrecta de casos (Hyde et al.)20, la consiguiente interrupción de la investigación de casos y brotes, y la no aplicación de las medidas de control pertinentes. Los casos de sarampión en personas vacunadas son menos contagiosos (Rota et al.)21 y raramente generan brotes, aunque pueden hacerlo (Rosen et al.)22.
El hecho de que, en nuestro estudio, la proporción de hospitalizados sea inversamente proporcional al número de dosis de vacuna, con tendencia lineal significativa, es coherente con lo apuntado previamente sobre la menor gravedad del sarampión al mejorar el estado de vacunación (MMWR 198011, Damien et al.12).
En relación con el fenómeno de la evanescencia, Mercader et al. señalaron un descenso progresivo en los niveles de anticuerpos frente al sarampión con el paso del tiempo desde la vacunación15. Congruentemente con esta evanescencia de la inmunidad que destaca también el grupo de LeBaron et al.23, en nuestro estudio observamos que el riesgo de confirmación de las sospechas de sarampión en individuos previamente vacunados (con 1 o 2 dosis) fue sensiblemente superior en adultos de 20 o más años que en niños y jóvenes entre 5 y 19 años. No obstante, es necesario tener en cuenta al interpretar este resultado que también los exantemas febriles por otros agentes infecciosos son más frecuentes en estas edades, con lo que parte de la menor proporción de casos sospechosos confirmados para sarampión en el grupo de 5 a 19 años podría explicarse por este motivo.
En poblaciones con alta cobertura vacunal como la nuestra (superior al 95% la primera dosis desde 1999, y superior al 90% la segunda dosis desde 2006), cada vez serán más frecuentes las sospechas de sarampión en personas vacunadas. El escenario más probable al final de la fase de eliminación será que la mayoría de las sospechas notificadas que se investiguen terminen descartándose. En nuestro estudio encontramos que el riesgo de que una sospecha de sarampión se descartara tras su investigación fue mayor en individuos vacunados que en no vacunados, y además mostró tendencia lineal significativa inversamente proporcional al número de dosis de vacuna recibidas (p<0,001).
La mayor dificultad para confirmar o descartar casos de sarampión en personas con 2 dosis de vacuna, especialmente en la fase de eliminación, motivó en nuestro estudio el análisis detallado de la adecuación al protocolo vigente de investigación en laboratorio (muestras clínicas y pruebas realizadas) de los casos sospechosos en este grupo, con especial atención a los descartados. Ante toda sospecha de sarampión es fundamental que se obtengan oportunamente las 3 muestras clínicas (suero/exudado/orina).
En nuestro estudio, en el 50% de los casos estudiados en vacunados con 2 dosis, la primera muestra de suero se había obtenido precozmente. En el 16,7% de los descartados se obtuvo una IgM negativa precoz, y no se realizó PCR, pudiendo tratarse de falsos negativos. Un resultado negativo de IgM en muestras precoces, como señalan Atkinson et al.24 o Hyde et al.20, no permite descartar un caso sospechoso. En virtud de ello, resulta especialmente importante cumplir el protocolo de toma de muestras y realización de pruebas de laboratorio en los vacunados con 2 dosis, repitiendo oportunamente la toma de suero para un segundo test de IgM, y realizando siempre además el test de PCR en exudado y orina. Asimismo se podría valorar la inclusión, en el protocolo de vigilancia del sarampión, de procedimientos diagnósticos adicionales como el test cuantitativo de IgG o el test de avidez de IgG, pues dichos test muestran características diferenciales en personas previamente inmunizadas, como mencionaron Mercader et al.15, o Hickman et al.16.
En conclusión, tras analizar los casos de sarampión notificados al Plan Nacional de Eliminación del Sarampión y Rubéola, en los últimos 12 años hemos encontrado que el estado previo de vacunación individual da lugar a diferencias tanto en el desarrollo de la respuesta inmune como en la presentación clínica de la enfermedad. Los casos de sarampión en personas vacunadas, particularmente en quienes han recibido 2 dosis de vacuna, se asocian a una menor hospitalización y cursan de forma más leve. Las sospechas de sarampión se confirman asimismo en menor grado en las personas vacunadas. Por último, el diagnóstico en personas vacunadas es más difícil, pues la IgM tarda más en positivizarse, siendo más frecuentes los falsos negativos cuando la toma de muestra ha sido precoz. Por todo ello estimamos especialmente conveniente cumplir en ellas correctamente el protocolo de vigilancia vigente, garantizando que la toma de muestra se realice oportunamente, y realizando siempre el test de PCR, especialmente en esta fase final del proceso de eliminación del sarampión.
FinanciaciónNo se recibió financiación para el trabajo.
Conflicto de interesesNingún autor presenta conflicto de intereses.
A los responsables de la vigilancia epidemiológica y de laboratorio para el sarampión en la Red Nacional de Vigilancia Epidemiológica.
Al doctor Andrés Aragón, jefe de Sección de Epidemiología de Área de la Comunidad de Madrid, por sus comentarios y sugerencias sobre el contenido y la redacción del artículo.