La infección por el virus de la inmunodeficiencia humana (VIH) se ha asociado a un mayor riesgo de aterosclerosis subclínica y de episodios cardiovasculares. La enfermedad arterial periférica (EAP) es un buen marcador de aterosclerosis sistémica y un importante predictor de morbilidad y mortalidad de origen cardiovascular. El objetivo de este estudio fue determinar la prevalencia de EAP asintomática y los factores de riesgo asociados en los pacientes infectados por el VIH.
MétodosEstudio transversal de los pacientes infectados por el VIH mayores de 20 años, sin síntomas de claudicación intermitente, atendidos de forma consecutiva en nuestra unidad entre noviembre de 2008 y diciembre de 2009. Se evaluó la presencia de EAP mediante la determinación del índice tobillo-brazo (ITB) en reposo. La EAP se definió como un ITB ≤0,90. Se registraron las características clínico-epidemiológicas de la infección por VIH y los factores de riesgo cardiovascular (FRCV).
ResultadosSe incluyeron 205 pacientes (66,8% varones), con una edad media de 41 años y una mediana de 2 FRCV (63,9% tabaquismo). La prevalencia de EAP detectada mediante ITB bajo (≤0,90) fue del 6,3% (n=13). Tan solo hubo un caso de ITB alto (>1,40). En el análisis multivariable, los factores que se asociaron significativamente con la EAP fueron el sobrepeso (odds ratio ajustada [ORaj] 4,21; intervalo de confianza [IC] del 95% 1,00-18,78), la obesidad (ORaj 5,76; IC 95% 1,17-28,37) y el estadio clínico C de la infección por VIH (ORaj 2,95; IC 95% 1,00-9,83).
ConclusionesLa prevalencia de EAP asintomática en una cohorte relativamente joven de pacientes infectados por el VIH es comparable a la observada en la población adulta de mediana edad no infectada. El sobrepeso, la obesidad y el estadio clínico avanzado de la infección por VIH (criterios definitorios de sida) son factores de riesgo independientes para su desarrollo.
Human immunodeficiency virus (HIV) infection has been associated with a higher risk of subclinical atherosclerosis and cardiovascular events. Peripheral arterial disease (PAD) is a good marker of systemic atherosclerosis and a powerful predictor of cardiovascular morbidity and mortality. The objective of this study was to determine the prevalence of asymptomatic PAD and associated risk factors in HIV-infected people.
MethodsCross-sectional study was conducted on all consecutive HIV-positive patients older than 20 years without symptoms of intermittent claudication who attended our clinic between November 2008 and December 2009. PAD was assessed by measuring the ankle-brachial index (ABI) at rest. To define PAD, an ABI ≤ 0.90 was used. Main epidemiological and clinical characteristics of the HIV infection and cardiovascular risk factors (CVRF) were recorded.
ResultsTwo hundred and five patients were evaluated (66.8% male), with a mean age of 41 years and there was a median of 2 CVRF (63.9% smokers). Prevalence of asymptomatic PAD (ABI ≤0.90) was 6.3% (n=13). There was only 1 patient with a high ABI (>1.40). In the multivariate analysis, factors significantly associated with PAD were overweight (adjusted odds ratio [ORadj] 4.21; 95% confidence interval [CI] 1.00-18.78), obesity (ORadj 5.76; 95% CI 1.17-28.37) and clinical stage C of HIV infection (ORadj 2.95; 95% CI 1.00-9.83).
ConclusionsPrevalence of asymptomatic PAD in a relatively young HIV-infected cohort is similar to that observed in the uninfected middle-aged adult population. Overweight, obesity and advanced clinical stage of HIV infection (AIDS-defining conditions) were identified as independent risk factors for PAD.
La enfermedad cardiovascular se ha convertido en una causa importante de morbilidad y mortalidad en los pacientes infectados por el virus de la inmunodeficiencia humana (VIH)1. La introducción del tratamiento antirretroviral de gran actividad (TARGA) ha conseguido disminuir drásticamente la mortalidad relacionada con la infección por VIH; sin embargo, el aumento de la supervivencia de los pacientes, la elevada prevalencia de los factores de riesgo cardiovascular (FRCV) tradicionales2 y las alteraciones metabólicas producidas por los fármacos antirretrovirales (dislipidemia, resistencia a la insulina, lipodistrofia) han contribuido a un incremento del riesgo cardiovascular (RCV) en esta población3,4. Además, tanto la propia infección por VIH (inflamación crónica, activación inmunitaria, disfunción endotelial)5–7 como el TARGA se han asociado al desarrollo de aterosclerosis subclínica prematura y a una mayor incidencia de episodios cardiovasculares que en la población general8,9. La aterosclerosis subclínica se ha investigado en estos pacientes mediante diversas técnicas, como la medida del grosor íntima-media carotídeo, la estimación de disfunción endotelial mediante dilatación mediada por el flujo o la detección de calcificaciones coronarias por tomografía computarizada7,10,11. La enfermedad arterial periférica (EAP) de los miembros inferiores, con frecuencia asintomática hasta estadios avanzados, es un indicador importante de aterosclerosis sistémica y un potente predictor de muerte por causas cardiovasculares en la población general12. El índice tobillo-brazo (ITB) es una técnica no invasiva, sencilla y barata para el diagnóstico de EAP de los miembros inferiores y una herramienta útil para la predicción de RCV. A diferencia de otros métodos diagnósticos de aterosclerosis subclínica, como el grosor íntima-media carotídeo, no precisa personal especialmente cualificado y permite la detección de EAP asintomática y la estratificación de su gravedad. Tradicionalmente, se acepta que un ITB ≤ 0,90, medido en reposo, es diagnóstico de EAP y un indicador fiable de aterosclerosis oclusiva en las arterias principales de las extremidades inferiores (sensibilidad del 79% y especificidad del 96% para la detección de estenosis ≥50%)13. Los valores de ITB > 1,30 también se consideran patológicos14, aunque se relacionan con arterias no compresibles (calcificación o rigidez de la pared vascular), y no parecen indicar una verdadera estenosis aterosclerótica. En la población general, se ha demostrado que tanto los valores bajos (≤ 0,90) como los valores altos (>1,40) de ITB se asocian a un aumento de la mortalidad global y de origen cardiovascular15–17.
La prevalencia de EAP en la población general oscila entre un 3 y un 20%18, dependiendo fundamentalmente de la edad, la definición de EAP y los FRCV asociados. En individuos de mediana edad (40-70 años), varios estudios epidemiológicos han descrito una prevalencia de EAP, definida como un ITB ≤ 0,90, de entre un 3 y un 10,5%19–22.
La EAP ha sido escasamente evaluada en pacientes con infección por VIH y su frecuencia real se desconoce. Hasta la fecha, tan solo unos pocos estudios han investigado la prevalencia de EAP en esta población mediante la medición del ITB y los resultados han sido dispares23–30.
La detección de EAP subclínica mediante el ITB puede ser una estrategia sencilla y útil para mejorar la estratificación del RCV en los pacientes infectados por el VIH, y permitiría la adopción temprana de medidas terapéuticas enérgicas para el control de los FRCV. El objetivo del presente estudio fue determinar la prevalencia de EAP subclínica, estimada mediante el cálculo del ITB, en una serie de pacientes consecutivos con infección por el VIH, y evaluar los factores de riesgo asociados al desarrollo de EAP en esta población.
Pacientes y métodosEstudio epidemiológico transversal de los pacientes con infección por VIH atendidos de forma consecutiva en la Unidad de Enfermedades Infecciosas del Hospital Universitario de Fuenlabrada (Madrid) en el periodo comprendido entre noviembre de 2008 y diciembre de 2009. Se incluyeron los pacientes de edad superior a 20 años que no presentaban síntomas de claudicación intermitente, según el cuestionario de Edimburgo31. Fueron criterios de exclusión el diagnóstico previo de EAP y el consumo activo de drogas por vía parenteral en los últimos 3 meses. A todos los participantes en el estudio se les realizó un examen físico que incluía peso, talla, índice de masa corporal (IMC) y medición de la presión arterial; una analítica sanguínea tras ayuno de 12 h; y la determinación del ITB en reposo. Se determinaron la glucosa, la creatinina, el colesterol total, el colesterol unido a las lipoproteínas de baja densidad (cLDL), el colesterol unido a las lipoproteínas de alta densidad (cHDL), los triglicéridos, el recuento de linfocitos CD4 y la carga viral del VIH.
Las concentraciones plasmáticas de glucosa, creatinina, lípidos y lipoproteínas se determinaron mediante métodos enzimáticos colorimétricos en un autoanalizador. El cLDL se calculó utilizando la fórmula de Friedewald, excepto cuando la cifra de triglicéridos era mayor de 400mg/dl, en cuyo caso se midió directamente (ultracentrifugación de lipoproteínas).
Se evaluaron los FRCV tradicionales según las recomendaciones del Panel III del National Cholesterol Education Program (NCEP)32, incluyendo edad (hombres ≥ 45 años; mujeres ≥ 55 años), historia familiar de enfermedad coronaria prematura (familiar de primer grado <55 años si es hombre y <65 años si es mujer), tabaquismo (fumador activo o ex fumador de menos de un año), diabetes, hipertensión arterial (HTA) y dislipidemia. El diagnóstico de diabetes mellitus se estableció cuando la glucemia en ayunas fue ≥ 126mg/dl, o bien, si el paciente había sido diagnosticado previamente o estaba recibiendo tratamiento hipoglucemiante. Se consideró hipertenso a todo paciente con una presión arterial ≥ 140/90mmHg, con diagnóstico previo o que recibía fármacos antihipertensivos. La dislipidemia se definió como una concentración de colesterol total ≥ 240mg/dl, cHDL < 40mg/dl, cLDL ≥ 160mg/dl, triglicéridos > 200mg/dl, o tratamiento activo con hipolipemiantes. La hipercolesterolemia (colesterol total ≥ 240mg/dl) y la hipertrigliceridemia (triglicéridos > 200mg/dl) se evaluaron también de forma independiente, incluyendo en la definición el diagnóstico establecido previamente y el uso de hipolipemiantes. El IMC se calculó dividiendo el peso en kilogramos por la talla en metros cuadrados (kg/m2) y se clasificó en 3 categorías: normal (<25,0), sobrepeso (25,0-29,9) y obesidad (≥30,0).
En relación con la infección por el VIH, se evaluaron el recuento de linfocitos CD4 y la carga viral en el momento del estudio, el grupo de riesgo de transmisión de la enfermedad, el estadio clínico e inmunológico (categorías de linfocitos CD4) en el momento del estudio según la clasificación de los Centers for Disease Control and Prevention (CDC) de 1993, el tiempo transcurrido desde el diagnóstico de la infección y el tiempo acumulado bajo tratamiento antirretroviral (TAR). Se consideraron también la historia de exposición a antirretrovirales y a inhibidores de proteasa (IP), y la presencia o no de coinfección por los virus de la hepatitis B (VHB) y C (VHC).
La medición del ITB se efectuó con ayuda de un eco-Doppler portátil bidireccional de 8MHz y de un esfigmomanómetro de mercurio calibrado. Tras un periodo de reposo de 5min, se midió la presión arterial sistólica (PAS) en la arteria braquial de ambos miembros superiores y en las arterias tibial posterior y pedia de ambos miembros inferiores. El valor del ITB para cada uno de los miembros inferiores se calculó dividiendo la PAS más alta de las 2 obtenidas en cada tobillo (tibial posterior o pedia) entre la PAS más alta de las obtenidas en ambos brazos. Se consideró patológico un ITB ≤ 0,90 (bajo) o un ITB > 1,40 (alto) en cualquiera de los miembros inferiores, y normal un ITB > 0,90 y ≤ 1,40 en ambos miembros inferiores. La EAP se definió como un ITB bajo (≤0,90).
En los pacientes con ITB bajo se investigó la presencia de lesiones ateroscleróticas mediante ecografía dúplex-Doppler color arterial de ambos miembros inferiores (ecógrafo LOGIC 7, GE Healthcare). Se evaluaron los sectores aortoilíaco, femoropoplíteo y tibioperoneo. Las placas se definieron como engrosamientos focales del espesor íntima-media > 1,2mm o superiores al 50% del espesor íntima-media adyacente. El porcentaje de estenosis se calculó mediante el cociente de velocidad pico sistólica estenosis/preestenosis. Todas las exploraciones fueron realizadas por un único especialista.
El estudio fue aprobado por el Comité de Ética e Investigación Clínica de nuestra área sanitaria y todos los pacientes firmaron un documento de consentimiento informado.
Análisis estadísticoSe ha realizado un análisis descriptivo de todos los parámetros recogidos, que incluye media y desviación estándar o, en caso de asimetría, mediana y rango intercuartílico (RIC), así como frecuencias absolutas y relativas para las variables cualitativas. Para la comparación de variables cuantitativas se utilizó el test de la t de Student o el test de la mediana. Para la comparación de variables cualitativas el test de la χ2 o el test exacto de Fisher. Los valores «perdidos» (datos ausentes en el cuaderno de recogida de datos) no se contabilizaron para el cálculo de porcentajes. La asociación entre FRCV y factores relacionados con la infección por VIH y la EAP se evaluó mediante análisis univariable y multivariable. El ITB bajo (≤0,90) se usó para definir la EAP, y fue la única variable dependiente utilizada en el análisis. Solo hubo un caso de ITB alto (>1,40), que no se incluyó en el análisis. Para el análisis multivariable se ajustó un modelo de regresión logística en el que se incluyeron como variables independientes aquellas que en el análisis univariable obtuvieron un valor de p < 0,10 (diabetes mellitus, HTA, hipertrigliceridemia, hipercolesterolemia, IMC, estadio clínico C de los CDC) y las que se consideraron clínicamente relevantes, evaluando la confusión que una variable produce en el modelo cuando está y cuando no está. Se calcularon las odds ratio (OR) univariables y ajustadas (ORaj) junto a sus intervalos de confianza (IC) del 95%. El análisis estadístico se realizó con el programa SPSS versión 15.0 para Windows (SPSS Inc., Chicago, IL, Estados Unidos) y el programa Stata versión 9.0.
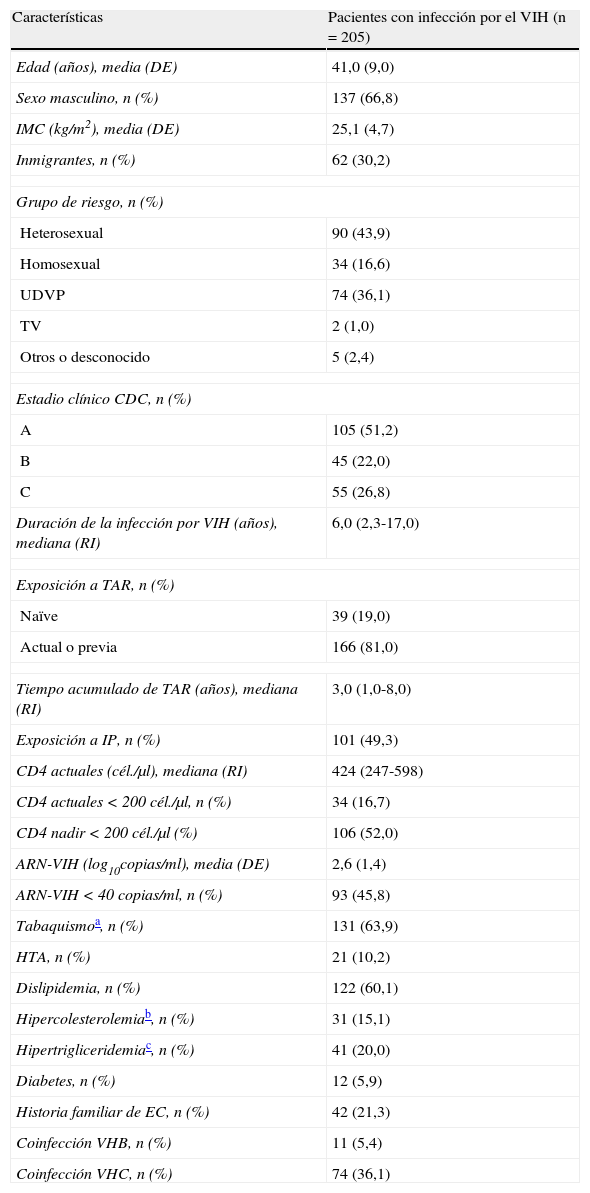
ResultadosEntre noviembre de 2008 y diciembre de 2009 un total de 205 pacientes fueron incluidos en el estudio, con una edad media de 41±9 años y predominio del sexo masculino (66,8%). Las características clínicas y demográficas de los pacientes se muestran en la tabla 1. La proporción de inmigrantes en la población de estudio era del 30,2%, la mayoría procedentes del África Subsahariana, con un 10,2% de hipertensos. El grupo de riesgo más numeroso fue el heterosexual (43,9%). La prevalencia de FRCV tradicionales entre los pacientes incluidos era elevada, con una mediana de 2 (RIC 1-3) por paciente. Un 27,8% tenían ≥ 3 FRCV, siendo el tabaquismo (63,9%) y la dislipidemia (60,1%) los más prevalentes. Con respecto a las características de la infección por VIH, 106 (52%) pacientes presentaban unos linfocitos CD4 nadir < 200 cél./μl y solo 34 (16,7%) tenían un recuento actual de CD4 < 200 cél./μl. La carga viral era indetectable en menos de la mitad de los casos (45,8%). En el momento del estudio 150 (73,2%) pacientes recibían TAR y 39 (19%) no habían recibido tratamiento previamente. La exposición a TAR se había producido en 166 (81%) pacientes durante una mediana de tiempo de 3,0 años (RIC 1,0-8,0) y 101 (49,3%) habían sido tratados con IP.
Características clínicas y demográficas de los 205 participantes en el estudio
| Características | Pacientes con infección por el VIH (n=205) |
| Edad (años), media (DE) | 41,0 (9,0) |
| Sexo masculino, n (%) | 137 (66,8) |
| IMC (kg/m2), media (DE) | 25,1 (4,7) |
| Inmigrantes, n (%) | 62 (30,2) |
| Grupo de riesgo, n (%) | |
| Heterosexual | 90 (43,9) |
| Homosexual | 34 (16,6) |
| UDVP | 74 (36,1) |
| TV | 2 (1,0) |
| Otros o desconocido | 5 (2,4) |
| Estadio clínico CDC, n (%) | |
| A | 105 (51,2) |
| B | 45 (22,0) |
| C | 55 (26,8) |
| Duración de la infección por VIH (años), mediana (RI) | 6,0 (2,3-17,0) |
| Exposición a TAR, n (%) | |
| Naïve | 39 (19,0) |
| Actual o previa | 166 (81,0) |
| Tiempo acumulado de TAR (años), mediana (RI) | 3,0 (1,0-8,0) |
| Exposición a IP, n (%) | 101 (49,3) |
| CD4 actuales (cél./μl), mediana (RI) | 424 (247-598) |
| CD4 actuales < 200 cél./μl, n (%) | 34 (16,7) |
| CD4 nadir < 200 cél./μl (%) | 106 (52,0) |
| ARN-VIH (log10copias/ml), media (DE) | 2,6 (1,4) |
| ARN-VIH < 40 copias/ml, n (%) | 93 (45,8) |
| Tabaquismoa, n (%) | 131 (63,9) |
| HTA, n (%) | 21 (10,2) |
| Dislipidemia, n (%) | 122 (60,1) |
| Hipercolesterolemiab, n (%) | 31 (15,1) |
| Hipertrigliceridemiac, n (%) | 41 (20,0) |
| Diabetes, n (%) | 12 (5,9) |
| Historia familiar de EC, n (%) | 42 (21,3) |
| Coinfección VHB, n (%) | 11 (5,4) |
| Coinfección VHC, n (%) | 74 (36,1) |
CDC: Centers for Disease Control and Prevention; DE: desviación estándar; EC: enfermedad coronaria; HTA: hipertensión arterial; IMC: índice de masa corporal; IP: inhibidores de proteasa; ITB: índice tobillo-brazo; RI: rango intercuartílico; TAR: tratamiento antirretroviral; TV: transmisión vertical; UDVP: usuario de drogas por vía parenteral; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana.
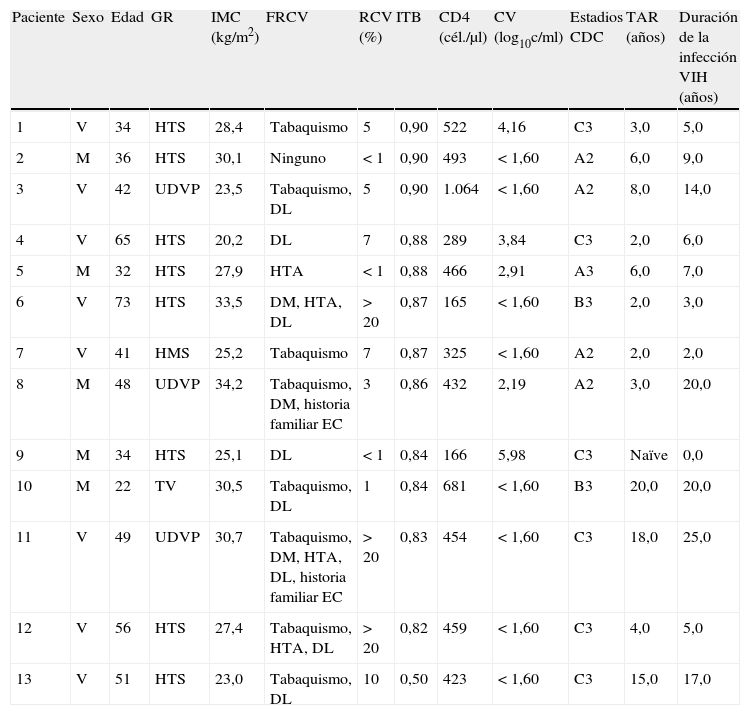
La prevalencia de EAP subclínica (ITB ≤ 0,90) en la población de estudio fue del 6,3% (IC 95% 2,8-9,9%; n=13). Tan solo hubo un caso de ITB alto (>1,40). Mediante ecografía dúplex se evaluaron las principales arterias de miembros inferiores en 10 de los 13 pacientes con ITB bajo, hallándose lesiones ateroscleróticas en todos ellos. En la tabla 2 se exponen las características de los 13 pacientes con un ITB bajo. Los pacientes con EAP tenían una edad media de 45±14 años, y todos, excepto uno, habían recibido TAR, 8 de ellos (61,5%) con IP. La mediana de tiempo de exposición a los antirretrovirales era de 4,0 años (RIC 2,0-8,0). La carga viral era indetectable en 8 (61,5%) y tan solo 2 tenían un recuento actual de linfocitos CD4 < 200 cél./μl, aunque 9 (69,2%) presentaban una cifra nadir de CD4 < 200 cél./μl. Cinco de los 13 pacientes (38,5%) tenían ≥ 3 FRCV y solo 3 (23,1%) presentaban un RCV a 10 años > 20% calculado mediante la ecuación de Framingham32.
Características de los 13 pacientes con enfermedad arterial periférica (ITB ≤ 0,90)
| Paciente | Sexo | Edad | GR | IMC (kg/m2) | FRCV | RCV (%) | ITB | CD4 (cél./μl) | CV (log10c/ml) | Estadios CDC | TAR (años) | Duración de la infección VIH (años) |
| 1 | V | 34 | HTS | 28,4 | Tabaquismo | 5 | 0,90 | 522 | 4,16 | C3 | 3,0 | 5,0 |
| 2 | M | 36 | HTS | 30,1 | Ninguno | < 1 | 0,90 | 493 | < 1,60 | A2 | 6,0 | 9,0 |
| 3 | V | 42 | UDVP | 23,5 | Tabaquismo, DL | 5 | 0,90 | 1.064 | < 1,60 | A2 | 8,0 | 14,0 |
| 4 | V | 65 | HTS | 20,2 | DL | 7 | 0,88 | 289 | 3,84 | C3 | 2,0 | 6,0 |
| 5 | M | 32 | HTS | 27,9 | HTA | < 1 | 0,88 | 466 | 2,91 | A3 | 6,0 | 7,0 |
| 6 | V | 73 | HTS | 33,5 | DM, HTA, DL | > 20 | 0,87 | 165 | < 1,60 | B3 | 2,0 | 3,0 |
| 7 | V | 41 | HMS | 25,2 | Tabaquismo | 7 | 0,87 | 325 | < 1,60 | A2 | 2,0 | 2,0 |
| 8 | M | 48 | UDVP | 34,2 | Tabaquismo, DM, historia familiar EC | 3 | 0,86 | 432 | 2,19 | A2 | 3,0 | 20,0 |
| 9 | M | 34 | HTS | 25,1 | DL | < 1 | 0,84 | 166 | 5,98 | C3 | Naïve | 0,0 |
| 10 | M | 22 | TV | 30,5 | Tabaquismo, DL | 1 | 0,84 | 681 | < 1,60 | B3 | 20,0 | 20,0 |
| 11 | V | 49 | UDVP | 30,7 | Tabaquismo, DM, HTA, DL, historia familiar EC | > 20 | 0,83 | 454 | < 1,60 | C3 | 18,0 | 25,0 |
| 12 | V | 56 | HTS | 27,4 | Tabaquismo, HTA, DL | > 20 | 0,82 | 459 | < 1,60 | C3 | 4,0 | 5,0 |
| 13 | V | 51 | HTS | 23,0 | Tabaquismo, DL | 10 | 0,50 | 423 | < 1,60 | C3 | 15,0 | 17,0 |
| Paciente | Ecografía dúplex |
| 1 | NR |
| 2 | NR |
| 3 | Estenosis del 20% bilateral en las arterias ilíacas comunes. Aterosclerosis difusa tibial |
| 4 | NR |
| 5 | Placas ateroscleróticas en las arterias tibiales posteriores |
| 6 | Aterosclerosis difusa aortoilíaca, femoropoplítea y tibial. Estenosis del 40% de la arteria femoral superficial derecha |
| 7 | Placas ateroscleróticas en las arterias femorales superficiales |
| 8 | Aterosclerosis difusa aortoilíaca. Placas ateroscleróticas en las arterias tibiales posteriores |
| 9 | Placas ateroscleróticas en las arterias femorales superficiales |
| 10 | Placas ateroscleróticas en las arterias tibiales posteriores |
| 11 | Aterosclerosis difusa femoropoplítea y tibial. Estenosis del 40% en la arteria tibial anterior izquierda |
| 12 | Aterosclerosis difusa femoropoplítea y tibial |
| 13 | Oclusión bilateral de las arterias ilíacas comunes |
CDC: Centers for Disease Control and Prevention; CV: carga viral; DL: dislipidemia; DM: diabetes mellitus; EAP: enfermedad arterial periférica; EC: enfermedad coronaria; FRCV: factores de riesgo cardiovascular; GR: grupo de riesgo; HMS: homosexual; HTA: hipertensión arterial; HTS: heterosexual; IMC: índice de masa corporal; ITB: índice tobillo-brazo; M: mujer; NR: no realizado; RCV: riesgo cardiovascular a 10 años (ecuación Framingham); TAR: tratamiento antirretroviral; TV: transmisión vertical; UDVP: usuario de drogas por vía parenteral; V: varón; VIH: virus de la inmunodeficiencia humana.
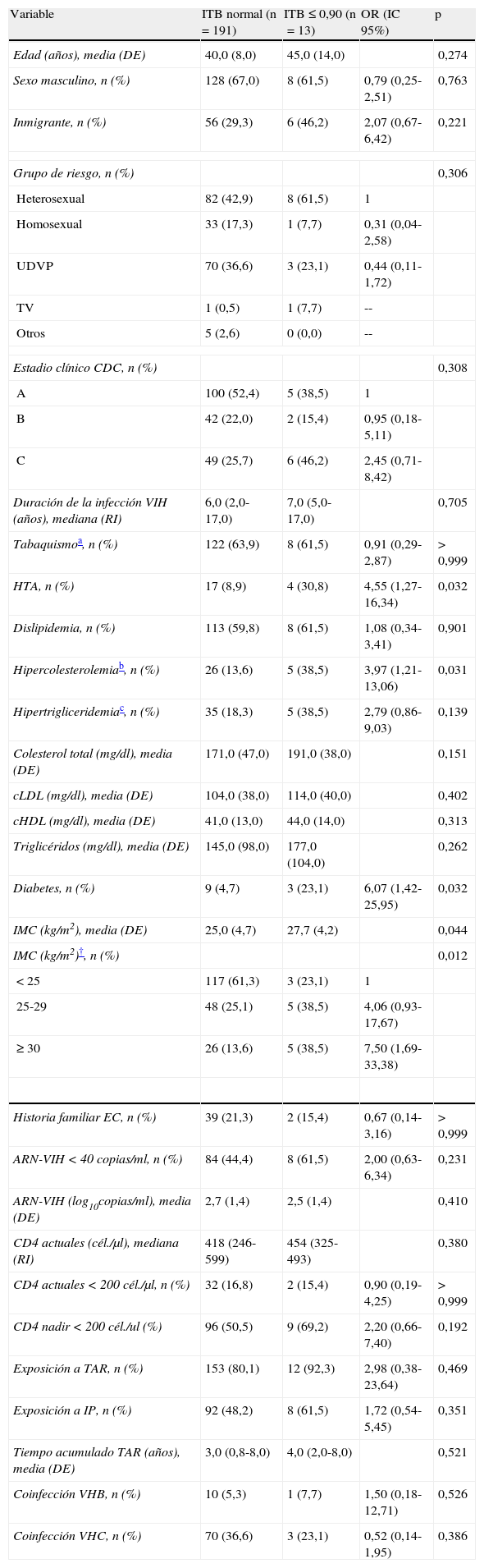
Al comparar los grupos de ITB bajo y normal mediante un análisis univariable (tabla 3), se encontró una proporción significativamente mayor de hipercolesterolemia (OR 3,97; IC 95% 1,21-13,06), HTA (OR 4,55; IC 95% 1,27-16,34) y diabetes mellitus (OR 6,07; IC 95% 1,42-25,95) en los pacientes con ITB bajo. También el IMC fue significativamente mayor en el grupo de ITB bajo (27,7 vs. 25,0; p=0,044), con una proporción más elevada de sobrepeso (OR 4,06; IC 95% 0,93-17,67) y obesidad (OR 7,50; IC 95% 1,69-33,38). De los factores relacionados con la infección por VIH, la exposición a TAR (OR 2,98; IC 95% 0,38-23,64; p=0,469), el estadio clínico C de los CDC (OR 2,45; IC 95% 0,71-8,42; p=0,100) y unos linfocitos CD4 nadir < 200 cél./μl (OR 2,20; IC 95% 0,66-7,40; p=0,192) se asociaron a ITB bajo, aunque estas asociaciones no fueron estadísticamente significativas. Otros factores como el recuento actual de linfocitos CD4, la carga viral, la exposición a IP, el tiempo acumulado de TAR o la antigüedad de la infección por VIH, no se correlacionaron con el ITB bajo.
Análisis de los factores asociados con la presencia de enfermedad arterial periférica (ITB ≤ 0,90) en pacientes infectados por el VIH
| Variable | ITB normal (n=191) | ITB ≤ 0,90 (n=13) | OR (IC 95%) | p |
| Edad (años), media (DE) | 40,0 (8,0) | 45,0 (14,0) | 0,274 | |
| Sexo masculino, n (%) | 128 (67,0) | 8 (61,5) | 0,79 (0,25-2,51) | 0,763 |
| Inmigrante, n (%) | 56 (29,3) | 6 (46,2) | 2,07 (0,67-6,42) | 0,221 |
| Grupo de riesgo, n (%) | 0,306 | |||
| Heterosexual | 82 (42,9) | 8 (61,5) | 1 | |
| Homosexual | 33 (17,3) | 1 (7,7) | 0,31 (0,04-2,58) | |
| UDVP | 70 (36,6) | 3 (23,1) | 0,44 (0,11-1,72) | |
| TV | 1 (0,5) | 1 (7,7) | -- | |
| Otros | 5 (2,6) | 0 (0,0) | -- | |
| Estadio clínico CDC, n (%) | 0,308 | |||
| A | 100 (52,4) | 5 (38,5) | 1 | |
| B | 42 (22,0) | 2 (15,4) | 0,95 (0,18-5,11) | |
| C | 49 (25,7) | 6 (46,2) | 2,45 (0,71-8,42) | |
| Duración de la infección VIH (años), mediana (RI) | 6,0 (2,0-17,0) | 7,0 (5,0-17,0) | 0,705 | |
| Tabaquismoa, n (%) | 122 (63,9) | 8 (61,5) | 0,91 (0,29-2,87) | > 0,999 |
| HTA, n (%) | 17 (8,9) | 4 (30,8) | 4,55 (1,27-16,34) | 0,032 |
| Dislipidemia, n (%) | 113 (59,8) | 8 (61,5) | 1,08 (0,34-3,41) | 0,901 |
| Hipercolesterolemiab, n (%) | 26 (13,6) | 5 (38,5) | 3,97 (1,21-13,06) | 0,031 |
| Hipertrigliceridemiac, n (%) | 35 (18,3) | 5 (38,5) | 2,79 (0,86-9,03) | 0,139 |
| Colesterol total (mg/dl), media (DE) | 171,0 (47,0) | 191,0 (38,0) | 0,151 | |
| cLDL (mg/dl), media (DE) | 104,0 (38,0) | 114,0 (40,0) | 0,402 | |
| cHDL (mg/dl), media (DE) | 41,0 (13,0) | 44,0 (14,0) | 0,313 | |
| Triglicéridos (mg/dl), media (DE) | 145,0 (98,0) | 177,0 (104,0) | 0,262 | |
| Diabetes, n (%) | 9 (4,7) | 3 (23,1) | 6,07 (1,42-25,95) | 0,032 |
| IMC (kg/m2), media (DE) | 25,0 (4,7) | 27,7 (4,2) | 0,044 | |
| IMC (kg/m2)†, n (%) | 0,012 | |||
| < 25 | 117 (61,3) | 3 (23,1) | 1 | |
| 25-29 | 48 (25,1) | 5 (38,5) | 4,06 (0,93-17,67) | |
| ≥ 30 | 26 (13,6) | 5 (38,5) | 7,50 (1,69-33,38) | |
| Historia familiar EC, n (%) | 39 (21,3) | 2 (15,4) | 0,67 (0,14-3,16) | > 0,999 |
| ARN-VIH < 40 copias/ml, n (%) | 84 (44,4) | 8 (61,5) | 2,00 (0,63-6,34) | 0,231 |
| ARN-VIH (log10copias/ml), media (DE) | 2,7 (1,4) | 2,5 (1,4) | 0,410 | |
| CD4 actuales (cél./μl), mediana (RI) | 418 (246-599) | 454 (325-493) | 0,380 | |
| CD4 actuales < 200 cél./μl, n (%) | 32 (16,8) | 2 (15,4) | 0,90 (0,19-4,25) | > 0,999 |
| CD4 nadir < 200 cél./ul (%) | 96 (50,5) | 9 (69,2) | 2,20 (0,66-7,40) | 0,192 |
| Exposición a TAR, n (%) | 153 (80,1) | 12 (92,3) | 2,98 (0,38-23,64) | 0,469 |
| Exposición a IP, n (%) | 92 (48,2) | 8 (61,5) | 1,72 (0,54-5,45) | 0,351 |
| Tiempo acumulado TAR (años), media (DE) | 3,0 (0,8-8,0) | 4,0 (2,0-8,0) | 0,521 | |
| Coinfección VHB, n (%) | 10 (5,3) | 1 (7,7) | 1,50 (0,18-12,71) | 0,526 |
| Coinfección VHC, n (%) | 70 (36,6) | 3 (23,1) | 0,52 (0,14-1,95) | 0,386 |
CDC: Centers for Disease Control and Prevention; DE: desviación estándar; EC: enfermedad coronaria; HTA: hipertensión arterial; IC: intervalo de confianza; IMC: índice de masa corporal; IP: inhibidores de proteasa; ITB: índice tobillo-brazo; OR: odds ratio; RI: rango intercuartílico; TAR: tratamiento antirretroviral; TV: transmisión vertical; UDVP: usuario de drogas por vía parenteral; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana.
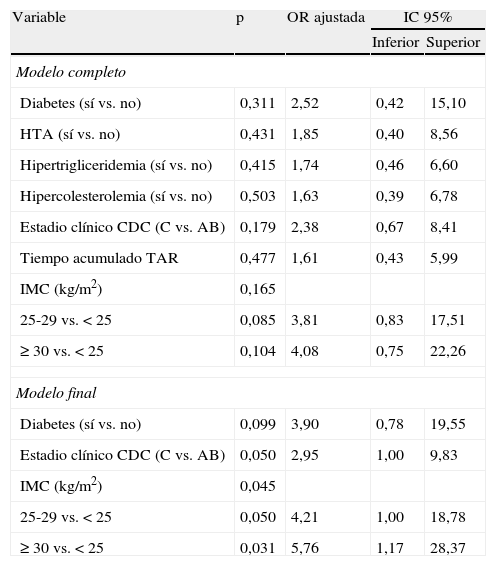
En el análisis multivariable (tabla 4), los únicos factores asociados de forma independiente con la presencia de EAP fueron el sobrepeso (ORaj 4,21; IC 95% 1,00-18,78), la obesidad (ORaj 5,76; IC 95% 1,17-28,37) y el estadio clínico C de la infección por VIH (ORaj 2,95; IC 95% 1,00-9,83). La diabetes mellitus también permaneció en el modelo, aunque la asociación con la EAP no llegó a alcanzar significación estadística (ORaj 3,90; IC 95% 0,78-19,55).
Análisis de regresión logística multivariable. Factores predictivos de enfermedad arterial periférica (ITB ≤ 0,90) en pacientes infectados por el VIH
| Variable | p | OR ajustada | IC 95% | |
| Inferior | Superior | |||
| Modelo completo | ||||
| Diabetes (sí vs. no) | 0,311 | 2,52 | 0,42 | 15,10 |
| HTA (sí vs. no) | 0,431 | 1,85 | 0,40 | 8,56 |
| Hipertrigliceridemia (sí vs. no) | 0,415 | 1,74 | 0,46 | 6,60 |
| Hipercolesterolemia (sí vs. no) | 0,503 | 1,63 | 0,39 | 6,78 |
| Estadio clínico CDC (C vs. AB) | 0,179 | 2,38 | 0,67 | 8,41 |
| Tiempo acumulado TAR | 0,477 | 1,61 | 0,43 | 5,99 |
| IMC (kg/m2) | 0,165 | |||
| 25-29 vs. < 25 | 0,085 | 3,81 | 0,83 | 17,51 |
| ≥ 30 vs. < 25 | 0,104 | 4,08 | 0,75 | 22,26 |
| Modelo final | ||||
| Diabetes (sí vs. no) | 0,099 | 3,90 | 0,78 | 19,55 |
| Estadio clínico CDC (C vs. AB) | 0,050 | 2,95 | 1,00 | 9,83 |
| IMC (kg/m2) | 0,045 | |||
| 25-29 vs. < 25 | 0,050 | 4,21 | 1,00 | 18,78 |
| ≥ 30 vs. < 25 | 0,031 | 5,76 | 1,17 | 28,37 |
CDC: Centers for Disease Control and Prevention; HTA: hipertensión arterial; IC: intervalo de confianza; IMC: índice de masa corporal; ITB: índice tobillo-brazo; OR: odds ratio; TAR: tratamiento antirretroviral; VIH: virus de la inmunodeficiencia humana.
El modelo incluye las siguientes variables: diabetes, HTA, hipertrigliceridemia, hipercolesterolemia, estadio clínico CDC, tiempo acumulado TAR e IMC.
Nuestro estudio muestra una prevalencia de EAP asintomática del 6,3% en una cohorte de pacientes infectados por el VIH mayores de 20 años, que es similar a la descrita en la población general para individuos de mediana edad (3-10,5%)19–22. Sin embargo, esta prevalencia es incluso superior a la encontrada en algunos estudios epidemiológicos poblacionales realizados con sujetos de mayor edad. Por ejemplo, en el estudio de Ramos et al.33 en España, que incluyó a pacientes ≥35 años, la prevalencia global fue del 4,5%; y en el estudio de Selvin et al.21 en Estados Unidos, con pacientes ≥40 años, la prevalencia fue del 4,3%. Es difícil comparar la prevalencia de EAP de nuestra población de estudio con la encontrada en otros trabajos realizados hasta la fecha en pacientes con infección por VIH, debido a la heterogeneidad de las poblaciones incluidas y a las diferencias en la definición de EAP. No obstante, si atendemos exclusivamente a la definición de EAP como un ITB bajo (≤0,90), la prevalencia encontrada en nuestros pacientes es inferior a la hallada por Periard et al.23, Palacios et al.24 y Jang et al.30, y superior a la descrita por el resto de los estudios publicados25–29. En todos estos trabajos la edad media de los pacientes fue superior a la de los incluidos en nuestro estudio, a excepción del trabajo de Sharma et al.26, donde solo se incluyeron mujeres. Jang et al.30 son los que encuentran una prevalencia más elevada de EAP en pacientes infectados por el VIH (11%), lo que quizá podría justificarse por la mayor edad de la población de estudio (edad media 48,4 años) y por la inclusión de pacientes con EAP sintomática. En los estudios de Periard et al.23 y Palacios et al.24 también se incluyeron pacientes de mayor edad (≥40 y >50 años, respectivamente) y sintomáticos, por lo que la prevalencia de EAP observada por ellos no es fácilmente comparable con la detectada en nuestra serie.
A diferencia de algunos trabajos que han mostrado una elevada prevalencia de ITB alto en pacientes infectados por el VIH26–30, nosotros hemos encontrado tan solo un caso de ITB > 1,40. Esta baja prevalencia de ITB alto es difícil de explicar, aunque podrían influir la menor edad de nuestra cohorte, la elección de un punto de corte de ITB más elevado que en otros estudios (1,40 vs. 1,30) y la exclusión de pacientes con síntomas de EAP. De todas formas, conviene recordar que, aunque un ITB > 1,40 se ha asociado a un aumento de la mortalidad en la población no infectada15–17, solo el ITB bajo es un indicador fiable de aterosclerosis sistémica y EAP.
El sobrepeso (IMC 25,0-29,9), la obesidad (IMC ≥ 30,0) y el estadio clínico C de la infección por VIH (criterios definitorios de sida) fueron los únicos factores que se asociaron de forma independiente a la EAP demostrada mediante un ITB bajo en nuestro estudio. Dentro de los FRCV tradicionales, la HTA, la hipercolesterolemia y la diabetes mellitus se relacionaron también con la EAP en esta población, pero tal asociación no llegó a ser significativa en el análisis multivariable, quizá debido al reducido tamaño muestral. Aunque el 63,9% de nuestros pacientes eran fumadores, el tabaquismo no se identificó como factor de riesgo de EAP en esta serie. Esto, sin embargo, coincide con lo observado en otros trabajos previos24,27,28,30 e indica que, independientemente de los FRCV tradicionales, la propia infección por VIH podría contribuir al desarrollo de EAP en esta población6.
La prevalencia de sobrepeso y obesidad en los pacientes con EAP fue muy elevada (77%), en comparación con aquellos que presentaron un ITB normal (38,7%), lo que constituye una diferencia importante con anteriores estudios realizados en pacientes infectados por el VIH. Tan solo Sharma et al.26 hallaron una asociación significativa entre sobrepeso e ITB alto, aunque tal asociación no pudo demostrarse en el grupo de ITB bajo, debido a su baja prevalencia (0,9%). Tanto la obesidad como el sobrepeso se han relacionado con la EAP en sujetos no infectados por el VIH34–36, aunque no son factores de riesgo establecidos de EAP, como edad, tabaquismo, HTA, diabetes o hipercolesterolemia14,19.
En series previas de pacientes infectados por el VIH, Periard et al.23 identificaron el recuento bajo de linfocitos CD4 (< 200 cél./μl) como factor de riesgo independiente de EAP, mientras que Olalla et al.27 y Salas et al.28 hallaron una asociación estadísticamente significativa entre el uso de IP y la presencia de un ITB alterado. En nuestro estudio, solo el estadio clínico C de la infección por VIH (criterios definitorios de sida) se ha mostrado como predictor independiente de EAP, y no hemos encontrado una asociación significativa entre la presencia de ITB bajo y el resto de los factores relacionados con la infección por VIH.
Las principales limitaciones del presente estudio son su reducido tamaño muestral y la falta de un grupo control de pacientes no infectados. La inclusión de un número relativamente elevado de pacientes no tratados previamente (naïve) (19%) y con interrupción del tratamiento (7,8%) en nuestra serie, podría haber influido en la prevalencia de EAP encontrada, limitando, incluso, la capacidad del estudio para detectar una posible asociación con el TAR. Se necesitarían estudios epidemiológicos más amplios, con grupos más homogéneos y con seguimiento a largo plazo para caracterizar mejor los factores de riesgo de EAP subclínica y determinar su pronóstico en pacientes infectados por el VIH.
En conclusión, los resultados de este estudio revelan que la prevalencia de EAP subclínica en pacientes infectados por el VIH es similar a la de la población general no infectada. Sin embargo, si tenemos en cuenta que la EAP es claramente dependiente de la edad21 y que la mayoría de los estudios epidemiológicos que han evaluado la prevalencia de EAP en la población general incluyeron individuos de mayor edad que la de los participantes en nuestro estudio, la prevalencia observada puede considerarse elevada. El sobrepeso, la obesidad y el estadio clínico avanzado de la infección por VIH (estadio C de los CDC) se asociaron significativamente con un ITB bajo y comportan un mayor riesgo de EAP en esta población. En los pacientes infectados por VIH, la detección de un ITB bajo identifica a sujetos con alto RCV y justifica la instauración de medidas enérgicas para el control óptimo de los FRCV, e incluso la utilización de antiagregantes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores quieren expresar su gratitud a la Dra. Cristina Fernández Pérez (Servicio de Medicina Preventiva, Hospital Clínico Universitario de San Carlos, Madrid), por su ayuda en el análisis estadístico de los datos; y a Paloma González y María Luz Cachinero, auxiliares de la consulta de Medicina Interna del Hospital Universitario de Fuenlabrada, por su colaboración en el estudio.