La supervivencia y calidad de vida de los pacientes infectados por el virus de la inmunodeficiencia humana (VIH-1) ha mejorado espectacularmente en los países desarrollados tras la introducción del tratamiento antirretroviral de gran actividad (TARGA). Sin embargo, al transformarse esta infección en una enfermedad crónica, han comenzado a observarse una serie de consecuencias a largo plazo entre las que se encuentra la osteoporosis. La prevalencia de esta enfermedad está aumentada en los pacientes con infección por el VIH-1 y, a pesar de que hasta el momento no parece que las fracturas osteoporóticas representen un problema relevante en ellos, cabe la posibilidad de que en un próximo futuro, al aumentar su edad, lo haga también la incidencia de éstas, lo que sin duda repercutiría en la calidad de vida de estas personas. Las causas que favorecen la aparición de este trastorno son numerosas y guardan relación con la propia infección y con el tratamiento que reciben estos pacientes.
Life expectancy and quality of life among patients infected with human immunodeficiency virus (HIV) has dramatically improved with the advent of highly active antiretroviral therapy. Nonetheless, with the transformation of HIV infection into a chronic disease, a series of long-term consequences have been observed, among them osteoporosis. The prevalence of this condition is increasing among individuals with HIV infection. Although an epidemic of fragility fractures has not been described in these patients, an increase in the incidence of such fractures is anticipated as the HIV population ages, and this will undoubtedly have an impact on their quality of life. The numerous factors that favor thedevelopment of osteoporosis in these patients are related to the infection, itself, and the treatment received.
La osteoporosis es una enfermedad generalizada del esqueleto que se caracteriza por una pérdida de la masa ósea y una alteración de la microarquitectura del hueso, lo que conlleva una menor resistencia ósea y el consiguiente aumento de la susceptibilidad para el desarrollo de las fracturas1. Hasta hace unos años se tendía a reservar el diagnóstico de osteoporosis para aquellas situaciones en las que ya estaban presentes las fracturas. Sin embargo, un grupo de expertos de la Organización Mundial de la Salud (OMS) propuso hace algunos años unos criterios diagnósticos basados en la determinación de la densidad mineral ósea (DMO). Las mujeres de raza blanca posmenopáusicas con valores de densidad ósea inferiores a la media juvenil en más de 2,5 desviaciones estándar (DE) (T < −2,5 DE) deben diagnosticarse de osteoporosis aunque no tengan fracturas. Cuando la densidad ósea se encuentra entre −1 y −2,5 DE, se habla de osteopenia2. En los varones, en las mujeres blancas premenopáusicas y en las mujeres de otras razas no existen aún criterios definidos, pero para los primeros se aceptan de momento criterios equivalentes a los de las mujeres.
La osteoporosis es una enfermedad multifactorial, a cuyo desarrollo contribuyen numerosos factores genéticos (herencia poligénica) y ambientales. Como suele ocurrir en este tipo de enfermedades, cada uno de los factores tiene un peso relativamente pequeño en el desarrollo de la enfermedad. Son excepción a esta regla el envejecimiento y la menopausia, que tienen un gran peso, y lo pueden ser ocasionalmente otros factores, como la ingesta de esteroides (tabla 1)3.
Factores de riesgo de osteoporosis
|
A partir de la introducción del tratamiento antirretroviral de gran actividad (TARGA), la infección por el virus de la inmunodeficiencia humana (VIH-1) se ha transformado en una enfermedad crónica con una aceptable calidad de vida4. Sin embargo, al aumentar la edad y el número de pacientes que sobreviven, han comenzado a observarse una serie de complicaciones, entre las que se encuentra la osteoporosis. Las causas que determinan la aparición de este trastorno son múltiples. Algunas guardan relación con la propia infección por el VIH-1: activación linfocitaria, liberación de citoquinas que actúan estimulando la resorción ósea, incluido el ligando del receptor activador del factor nuclear κ-B (RANKL), hipogonadismo, déficit de vitamina D, malnutrición, menor actividad física, etc. Otras guardan relación con el tratamiento que reciben estos pacientes: corticosteroides, antirretrovirales, etc.5-10. En los apartados siguientes se revisa la información de la que se dispone actualmente sobre la osteoporosis en los pacientes con infección por el VIH-1 y sus implicaciones en la práctica clínica.
Prevalencia de osteopenia y osteoporosisEn los estudios iniciales, realizados antes de la introducción del TARGA, no se observaron alteraciones significativas del metabolismo mineral en los pacientes con infección por el VIH-111-13. Hernández Quero et al11 comprobaron que la masa ósea era normal en 16 pacientes seropositivos. Tampoco se apreciaron cambios significativos de la masa ósea en los 22 pacientes evaluados por Serrano et al12. Finalmente, Paton et al13 describieron la existencia de una ligera disminución (en torno al 3%) en la DMO de la columna lumbar en 45 pacientes VIH-1 positivos, aunque no se observaron cambios en la DMO de la cadera y de la DMO corporal total. Además, estos autores13 pudieron estudiar la evolución de la masa ósea durante algo más de un año en casi la mitad de estos pacientes, observando un discreto descenso del 1,6% en la DMO del cuerpo total.
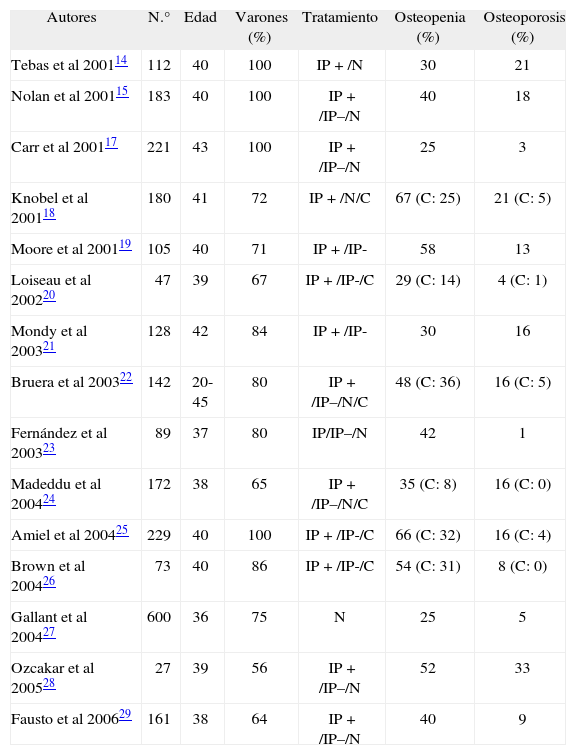
Sin embargo, con posterioridad se han llevado a cabo numerosos estudios que demuestran que los pacientes con infección por el VIH-1 presentan una menor masa ósea que las personas no infectadas, tanto en la columna lumbar como en la cadera, y la prevalencia de osteopenia y osteoporosis es también mayor14-40. En general, se trata de estudios muy heterogéneos, realizados con distinto número de pacientes, en su mayoría varones y con una media de edad cercana a los 40 años. Además, los pacientes analizados presentaban distinta gravedad y la mayoría de ellos estaban recibiendo tratamiento antirretroviral que incluía fármacos inhibidores de la proteasa (tabla 2)14-29. Podríamos, no obstante, señalar que la prevalencia de osteopenia en estos pacientes se encontraría entre el 25 y el 70%, mientras que la de osteoporosis estaría entre el 5 y el 20%. En las personas sanas de la misma edad, la prevalencia de osteopenia y osteoporosis se sitúa en torno al 25 y el 5%, respectivamente40.
Prevalencia de osteopenia y osteoporosis en pacientes con infección por el VIH
| Autores | N.° | Edad | Varones (%) | Tratamiento | Osteopenia (%) | Osteoporosis (%) |
| Tebas et al 200114 | 112 | 40 | 100 | IP + /N | 30 | 21 |
| Nolan et al 200115 | 183 | 40 | 100 | IP + /IP–/N | 40 | 18 |
| Carr et al 200117 | 221 | 43 | 100 | IP + /IP–/N | 25 | 3 |
| Knobel et al 200118 | 180 | 41 | 72 | IP + /N/C | 67 (C: 25) | 21 (C: 5) |
| Moore et al 200119 | 105 | 40 | 71 | IP + /IP- | 58 | 13 |
| Loiseau et al 200220 | 47 | 39 | 67 | IP + /IP-/C | 29 (C: 14) | 4 (C: 1) |
| Mondy et al 200321 | 128 | 42 | 84 | IP + /IP- | 30 | 16 |
| Bruera et al 200322 | 142 | 20-45 | 80 | IP + /IP–/N/C | 48 (C: 36) | 16 (C: 5) |
| Fernández et al 200323 | 89 | 37 | 80 | IP/IP–/N | 42 | 1 |
| Madeddu et al 200424 | 172 | 38 | 65 | IP + /IP–/N/C | 35 (C: 8) | 16 (C: 0) |
| Amiel et al 200425 | 229 | 40 | 100 | IP + /IP-/C | 66 (C: 32) | 16 (C: 4) |
| Brown et al 200426 | 73 | 40 | 86 | IP + /IP-/C | 54 (C: 31) | 8 (C: 0) |
| Gallant et al 200427 | 600 | 36 | 75 | N | 25 | 5 |
| Ozcakar et al 200528 | 27 | 39 | 56 | IP + /IP–/N | 52 | 33 |
| Fausto et al 200629 | 161 | 38 | 64 | IP + /IP–/N | 40 | 9 |
C: controles; IP+: tratamiento con inhibidores de la proteasa; IP–: tratamiento con otros antirretrovirales; N: sin tratamiento antirretroviral.
La osteoporosis es una enfermedad propia de las personas de edad avanzada que afecta especialmente a las mujeres. Sin embargo, no hemos dispuesto de estudios realizados entre la población femenina con infección por VIH-1 hasta hace pocos años30-35. En ellos se ha comprobado que, al igual que sucedía con los varones, las mujeres con infección por el VIH-1 presentan menor masa ósea que las sanas. Estos resultados se han observado tanto en las mujeres premenopáusicas30-33, como en las perimenopáusicas34 o en las posmenopáusicas35.
Otro grupo de pacientes con infección por el VIH-1 que potencialmente tiene un alto riesgo de desarrollar baja masa ósea es el de los niños. La masa ósea que posee una persona en un momento concreto de su vida depende de la que llegó a tener al completar su desarrollo y de las pérdidas sufridas posteriormente. Durante la infancia y adolescencia es cuando se desarrolla la masa ósea, por lo que la posible repercusión de la infección por el VIH-1 en el esqueleto podría ser aún mayor que en los adultos36. O'Brien et al37 comprobaron que la DMO estaba claramente reducida en niñas con infección por el VIH-1 y edades comprendidas entre los 6 y los 15 años. De hecho, los valores medios de la Z (número de DE en relación con las personas de la misma edad) estaba por debajo de −2,737. Mora et al38, estudiaron la DMO de la CL en 32 niños y niñas de unos 12 años de edad con infección por el VIH-1, observando una disminución del 8% en relación con el grupo control. Por último, Rojo et al39 han publicado recientemente un trabajo realizado con 50 niños y niñas españoles seropositivos, de alrededor de 10 años, en el que señalan que hasta el 40% de los mismos presentaban una disminución de la masa ósea (Z < −1).
Consecuencias clínicas de la osteoporosis en los pacientes con infección por el VIH-1El aspecto clínico fundamental de la osteoporosis consiste en la predisposición al desarrollo de fracturas. Las fracturas osteoporóticas son, por definición, patológicas, es decir, inapropiadas para el traumatismo que las causa. En su desarrollo intervienen fundamentalmente dos factores: la fragilidad ósea y el traumatismo. La fragilidad, a su vez, guarda relación con la cantidad y la calidad del hueso. Cuanto menor sea la masa ósea, más frágil será el hueso (en líneas generales se acepta que por cada DE que descienda la masa ósea se multiplica por 2 el riesgo de sufrir una fractura osteoporótica). Sin embargo, a pesar de que se han comunicado algunos casos de fracturas osteoporóticas en enfermos seropositivos41-43, no parece que la prevalencia e incidencia de fracturas esté aumentada en esta población6,9,10. No obstante, hay que tener presente que todavía no disponemos de estudios suficientemente amplios y con un adecuado seguimiento que nos permitan afirmarlo de forma definitiva. El más extenso es un estudio retrospectivo realizado en 55 clínicas de EE.UU.44 que englobó a más de 8.000 pacientes, en su mayoría varones, entre los que se identificaron 55 pacientes con fracturas atraumáticas (fundamentalmente vertebrales). Los datos de las fracturas se recogieron a través de la codificación de las historias clínicas y preguntando a los médicos encargados de la atención de los pacientes, por lo que la prevalencia real podría ser bastante mayor44. En cualquier caso, conviene recordar que los pacientes con infección por el VIH-1 son todavía relativamente jóvenes, por lo que cabe la posibilidad de que en un futuro, al aumentar la edad de estas personas y, en el caso de las mujeres, alcanzar la menopausia, aumente también la incidencia de fracturas osteoporóticas, lo que sin duda repercutiría en su calidad de vida6-10.
Mecanismos patogénicosEl esqueleto está sometido a un proceso continuo de renovación que se conoce con el nombre de remodelación ósea y se lleva a cabo mediante la destrucción por los osteoclastos de pequeñas unidades microscópicas de tejido, dispersas por el esqueleto, que son posteriormente sustituidas por tejido nuevo formado por los osteoblastos. Las referidas unidades se conocen con el nombre de unidades de remodelación ósea (BRU, bone remodeling units), y están integradas por osteoclastos, osteoblastos, junto con las células derivadas de éstos (osteocitos) y otras células accesorias de significado incierto45. A este respecto, debe recordarse que son los trastornos del fenómeno de la remodelación los que están en la base de las distintas osteopatías metabólicas, incluida la osteoporosis46. A partir de los 30-40 años se aprecia un ligero balance negativo en cada unidad (la destrucción supera a la formación), que explica la pérdida fisiológica de masa ósea que acontece con la edad (0,5-1% anual). Esta pérdida se ve intensificada en dos situaciones: la primera, cuando se acentúa el balance negativo (como ocurre, por ejemplo, cuando se administran corticoides); la segunda, cuando aumenta el número de BRU (puesto que la puesta en marcha de cada una de ellas supone la pérdida de hueso que determina el balance negativo), lo que se suele describir como aumento del recambio o turnover óseo. Ambas circunstancias (acentuación del balance negativo y aumento del número de BRU) parecen darse en los pacientes con infección por el VIH-1, lo que favorecería la pérdida de hueso en estos pacientes.
El recambio óseo puede medirse de forma directa mediante histomorfometría a partir de la biopsia ósea47. Se trata de un proceso cruento y tedioso, por lo que se ha utilizado en muy pocas ocasiones en los pacientes con infección por el VIH-1. De hecho, el único trabajo consistente publicado hasta la fecha es el realizado en Barcelona por Serrano et al12 en 22 pacientes VIH no tratados que presentaban una DMO normal. No se observaron trastornos en la mineralización en estos enfermos y, curiosamente, tanto los parámetros de formación como de resorción estaban disminuidos y guardaban relación con el número de linfocitos CD4. En un segundo estudio21* llevado a cabo tan sólo con 7 pacientes que tenían una baja densidad ósea y seguían tratamiento antirretroviral, los resultados fueron más heterogéneos.
También se puede valorar el recambio óseo de forma indirecta, mediante la determinación de una serie de sustancias en la sangre o en la orina cuya concentración o actividad reflejan la formación o resorción óseas. Se conocen como “marcadores del recambio o de la remodelación óseas” y, o bien son sintetizadas por los osteoblastos (isoenzima de la fosfatasa alcalina [FAO], osteocalcina [BGP], péptidos carboxi y aminoterminales del procolágeno tipo 1 [PICP y PINP]) y por los osteoclastos (fosfatasa ácida resistente el tartrato, FART]), o bien son liberadas desde la matriz ósea durante el proceso de resorción (hidroxiprolina, telopéptido carboxiterminal del colágeno tipo 1 con puentes de piridinolina [ICTP], piridinolina [Pyr] y deoxipiridinolina [Dpyr], telopéptido aminoterminal de colágeno tipo 1 con puentes de piridinolina [NTX], telopéptido carboxiterminal del colágeno tipo 1 [β-CrossLaps; CTX]). Los primeros (FAO, BGP, PICP y PINP) constituyen los marcadores de formación y los demás, los marcadores de resorción ósea48.
Existen numerosos trabajos que han valorado el comportamiento de los marcadores de la remodelación en los pacientes con infección por el VIH-1. En ellos se observa que, en general, los marcadores de formación (FAO, BGP y PICP) se encuentran disminuidos, mientras que los de resorción están aumentados (ICTP, Dpyr, NTX y CTX)11,12,21-29,31,34,36,37,49,50. Además, en la mayoría de los estudios se observa que estos trastornos se hacen más evidentes conforme avanza la gravedad de la infección12,24,25,29,36,38,50
El aumento de los marcadores de resorción suele suponer un aumento del número de BRU, y la disminución de los marcadores de formación con relación al aumento de los de resorción, una acentuación del balance negativo. Ambos hechos podrían desempeñar un importante papel en la patogenia de la pérdida de masa ósea que presentan estos enfermos. Las causas que determinan la aparición de estos defectos pueden ser numerosas y guardan relación con la propia enfermedad o con el tratamiento que reciben estos pacientes.
Influencia de la infección por el VIH-1No parece que el VIH-1 sea capaz de actuar directamente sobre las células óseas. Hace ya algunos años, Mellert et al51 señalaron que el VIH-1 podría infectar algunas líneas celulares de estirpe osteoblástica, como las TE-85 y las SaOS, aunque en posteriores estudios no se confirmaron estos hallazgos52. En definitiva, no se ha demostrado fehacientemente que el VIH-1 sea capaz de infectar a los osteoblastos y osteoclastos maduros, y tampoco se ha podido demostrar que el VIH-1 ejerza un efecto directo sobre la diferenciación o actividad de las células óseas5,53.
Sin embargo, el VIH-1 puede influir indirectamente sobre el proceso de la remodelación a través de diversos mecanismos. El aumento en la resorción ósea que presentan los pacientes con infección por el VIH-1 podría guardar relación con el aumento en la liberación de citoquinas proinflamatorias. La activación linfocitaria causada por la infección del VIH-1 determina la liberación de algunas citoquinas, como la IL-1, IL-6 o factor de la necrosis tumoral alfa (TNF-α) que aumentan la actividad osteoclástica54. Los pacientes con enfermedad avanzada presentan mayores concentraciones de TNF-α55-57, y en algunos estudios se ha comprobado que los marcadores de resorción se correlacionan con los niveles del mismo25,49.
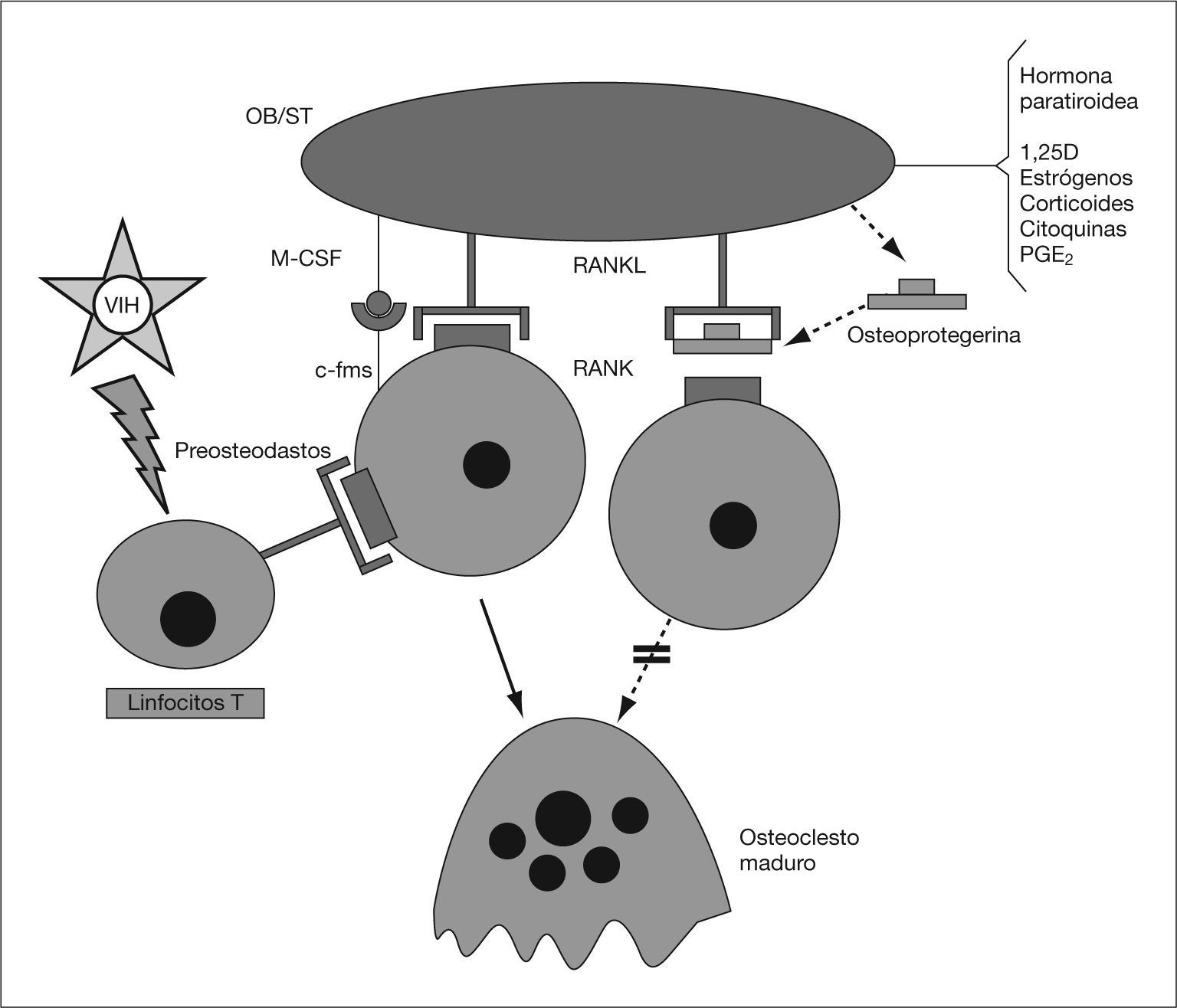
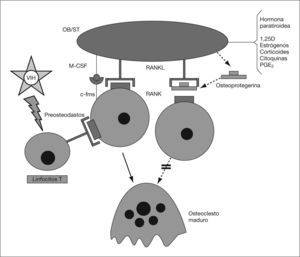
Además del efecto sobre la secreción de citoquinas, el VIH-1 estimula la liberación de RANKL. Desde hace unos años se sabe que en la formación de los osteoclastos intervienen células inmaduras de estirpe osteoblástica, las cuales poseen en su membrana una proteína (RANKL, o ligando del RANK) capaz de unirse a un receptor presente en los preosteoclastos y osteoclastos (RANK, receptor activador del factor nuclear κ-B)58,59. Dicha unión determina la puesta en marcha en estas células de fenómenos de diferenciación y activación, así como de inhibición de la apoptosis. Por otra parte, las mismas células inmaduras de estirpe osteoblástica que expresan en su superficie el RANKL, producen y segregan una proteína soluble denominada “osteoprotegerina” (OPG), con afinidad por el propio RANKL. La unión de la OPG al RANKL impide el acceso del mismo al RANK y, por tanto, la diferenciación y la activación osteoclástica. Este sistema desempeña un papel fundamental en la regulación del proceso de la remodelación ósea (fig. 1)58,59. Pero, además, los linfocitos T activados también expresan el RANKL, por lo que cabe la posibilidad de que este mecanismo desempeñe un importante papel en la pérdida de masa ósea que padecen los pacientes con infección por el VIH-1. En algunos estudios se ha comprobado que los pacientes seropositivos presentan un incremento en la concentración sérica de RANKL y OPG9,32,60 y Fakruddin et al61 demostraron que al incubar las células T de personas sanas con la proteína gp120 del VIH-1 aumentaba la secreción in vitro de RANKL. En este mismo trabajo se observó que tanto el RANKL como la proteína gp120 favorecían la diferenciación osteoclástica de las células mononucleares de sangre periférica procedentes de donantes sanos y de algunas líneas celulares monocitarias murinas61.
El sistema RANK/RANKL/ OPG. 1,25D: calcitriol; c-fms: receptor del CSF-M; M-CSF: factor estimulador de las colonias de nacrófagos; OB/ST: preosteoblastos y células del estroma medular; PGE2: prostaglandina E2; RANK: Receptor activador del receptor del factor nuclear κ-B; RANKL: ligando del RANK.
Además de los efectos sobre las células óseas y accesorias que hemos comentado, la infección por el VIH-1 también puede ejercer un efecto indirecto sobre algunos de los factores que regulan el proceso de la remodelación ósea45,46,54. Al margen de la inactividad física que con relativa frecuencia presentan estos enfermos, y que lógicamente puede colaborar en el desarrollo de osteoporosis62, la infección por el VIH-1 se acompaña de una serie de trastornos en algunas de las hormonas que regulan este proceso, como ocurre por ejemplo con las hormonas sexuales63. Hasta el 20-30% de estos pacientes presentan hipogonadismo63,64. Se ha señalado que el 70% de los varones infectados por el VIH-1 refieren disminución de la libido y el 30% impotencia65, mientras que en las mujeres, la edad de la menopausia se acorta en unos 5 años66. Además, en las mujeres seropositivas, la DMO guarda una relación directa con las concentraciones de estrógenos e inversa con el tiempo trascurrido desde la menopausia31,35,64.
También se han descrito trastornos en la secreción de la hormona de crecimiento (GH) y de las hormonas suprarrenales65,67-69. La secreción de GH está disminuida en los pacientes con lipodistrofia70, mientras que en los pacientes con síndrome de emaciación se ha señalado la existencia de una resistencia a la acción de la GH31.
Por otra parte, con frecuencia se observan alteraciones en el metabolismo de las denominadas hormonas calciotropas, fundamentalmente de la vitamina D5,8,9,71-73. Los pacientes con infección por el VIH presentan concentraciones reducidas del metabolito activo de esta hormona, el 1,25(OH)2D3 o calcitriol5,24,74. Sin embargo, las concentraciones de 25OHD y de la proteína transportadora (DBP) suelen ser normales, lo que hablaría a favor de la existencia de una inhibición de la a1-hidroxilación, que se ha puesto en relación con un aumento de las concentraciones de fosfato, de TNF-α o a la existencia de una resistencia parcial a la acción de la PTH24,55,75,76. Además, el TNF-α disminuye el número de receptores del calcitriol en las células osteoblásticas, lo que podría contribuir a reducir el efecto biológico de la vitamina D en estos pacientes77.
Influencia de otros factores relacionados con la infección por el VIH-1La malnutrición, frecuente en estos pacientes, es un conocido factor de riesgo de osteoporosis3. Se ha comprobado que la DMO está especialmente reducida en los pacientes con síndrome de emaciación31,50. Además, en diversos trabajos se ha observado que la DMO guarda relación con la masa magra y con el peso de los pacientes, tanto el que tenían en el momento de realizarse la densitometría como con el más bajo que tuvieron a lo largo de su evolución16,25,29,34,35,49,70. También conviene recordar que otros de los factores clásicos de riesgo de osteoporosis, como el consumo de tabaco y alcohol o algunas enfermedades, como las hepatopatías crónicas, son más frecuentes en los pacientes infectados por el VIH-1 que en la población general10.
Finalmente, como es bien conocido, en nuestro país la mayoría de los pacientes seropositivos son o han sido usuarios de drogas por vía parenteral. Hace más de 10 años que se describió la existencia de una disminución en la masa ósea en los heroinómanos VIH-1 negativos78. El trastorno era especialmente intenso en la columna lumbar, donde la reducción de la masa ósea alcanzó el 11%. Por otra parte, Ensrud et al44 han descrito la existencia de un aumento del 40% en la incidencia de fracturas entre las más de 8.000 ancianas que recibieron tratamiento analgésico con opiáceos durante 5 años. Finalmente, en el estudio de Arnsten et al34, realizado en 495 mujeres, que en su inmensa mayoría consumían o habían consumido drogas (cocaína, crack y heroína) y la mitad de las cuales eran VIH-1 positivas, se observó que el consumo de opiáceos se asociaba a una menor masa ósea tanto en columna como en cadera.
Las causas que pueden contribuir a deteriorar la masa ósea en los heroinómanos son varias79. El uso de heroína se ha asociado a una mayor frecuencia de hipogonadismo e insuficiencia suprarrenal de origen central, así como una menor respuesta en la secreción de GH80,81. Pero, además, la heroína podría actuar directamente sobre los osteoblastos. Rico et al82 describieron en 1990 la existencia de una disminución en las concentraciones de osteocalcina en heroinómanas embarazadas y otros autores83 observaron que la adición de opioides frenaba in vitro la proliferación osteoblástica. Por otra parte, nuestro grupo describió la presencia de los tres tipos de receptores opiáceos (mu, delta y kappa) en células osteoblásticas humanas, comprobando que, al añadir concentraciones elevadas de morfina o de un agonista delta (DAMGO), se producía una inhibición en la síntesis de osteocalcina que revertía al incubar las células con naloxona84.
Influencia del tratamientoEl tratamiento que reciben estos pacientes también puede contribuir a la pérdida de hueso5,8-10. Ya hemos comentado que, en los primeros estudios, antes de la introducción del TARGA, no se observaron grandes alteraciones en la DMO en los pacientes con infección por el VIH-111-13. Ello planteó la posibilidad de que los nuevos esquemas terapéuticos fueran perjudiciales para el esqueleto. Carr et al17 observaron la existencia de una relación entre la presencia de osteopenia y lactacidemia que, para estos autores, podría ser secundaria a la toxicidad mitocondrial producida por los análogos de los nucleósidos. Tebas et al14 señalaron que los pacientes que recibían tratamiento con inhibidores de la proteasa (IP) tenían menor masa ósea que los que no recibían estos fármacos. Otros autores describieron resultados similares, así como una mayor alteración en los marcadores de la remodelación ósea en los pacientes tratados con inhibidores de proteasas16,23,24. También se ha señalado que los pacientes que desarrollan lipodistrofia presentan una pérdida de hueso mayor que los que no desarrollan esta complicación, probablemente debido a la mayor infiltración grasa de la médula ósea38,70. Sin embargo, estos hallazgos no se pudieron confirmar en posteriores estudios. Así, Bruera et al22, comprobaron que la prevalencia de osteoporosis y osteopenia era similar en los pacientes seropositivos con independencia de que estuvieran o no en tratamiento con análogos de los nuclesósidos o inhibidores de la proteasa. A conclusiones parecidas llegaron otros autores15,18,20,25,26,29,32,34,35,39, quienes señalaron además, que la disminución de la masa ósea observada en los pacientes seropositivos guardaba fundamentalmente relación con los clásicos factores de riesgo de osteoporosis, como el peso, el índice de masa corporal, los antecedentes de tratamiento esteroideo y la presencia de hipogonadismo. Finalmente, también se han llevado a cabo algunos estudios dirigidos a valorar la evolución de la masa ósea en pacientes que iniciaban tratamiento con antirretrovirales. En el realizado por Mondy et al21 en 128 pacientes seropositivos, la DMO en columna lumbar aumentó discretamente a las 48 y 72 semanas de iniciarse el tratamiento, tanto en los que recibían inhibidores de la transcriptasa inversa como en los que siguieron tratamiento con inhibidores de proteasas. En España, Fernández-Rivera et al23 no observaron cambios en la masa ósea en 72 pacientes tratados durante un año. Por último, en el estudio Gilead 903 ya comentado27, la DMO experimentó tan sólo un discreto descenso a lo largo de los 3 años de seguimiento, aunque fue algo mayor en los pacientes tratados con tenofovir (2%) que en los que recibieron estavudina (1%).
Por otra parte, los estudios diseñados para valorar la respuesta in vitro frente a los distintos antirretrovirales han aportado resultados poco homogéneos e incluso contradictorios61,85,86. Así, Jain et al85 observaron que algunos inhibidores de la proteasa como el nelfinavir, indinavir, saquinavir y ritonavir, estimulaban la actividad osteoclástica, mientras que no lo hacían otros compuestos, como el lopinavir y el amprenavir. Por otro lado, entre todos estos fármacos, tan sólo el nelfinavir y el lopinavir fueron capaces de inhibir la actividad osteoblástica85. En otro estudio61 se señaló que el ritonavir y el saquinavir, a diferencia del indinavir y el nelfinavir, favorecían la resorción ósea al bloquear la degradación proteasómica del TRAF6, factor de transcripción que interviene en la activación osteoclástica mediada por el RANK. Por el contrario, Wang et al86 observaron que el ritonavir, pero no el indinavir, podría actuar bloqueando la osteoclastogénesis al inhibir el reclutamiento del TRAF6 y de otra proteína involucrada en la activación osteoclástica: el cSrc. Por lo tanto, no está suficientemente aclarado el posible mecanismo de acción ni los efectos de los distintos antirretrovirales sobre el metabolismo óseo. Cabe incluso la posibilidad de que los posibles efectos adversos de estos fármacos se vean compensados por los efectos beneficiosos relacionados con la mejoría inmunológica que causan en los pacientes con infección por el VIH-121,87. De hecho, en algunos estudios se ha señalado la existencia de una relación entre la pérdida de hueso y la gravedad de la infección, valorada a través de la clasificación de los CDC, del número de linfocitos CD4 o de la carga viral12,29,34. Por tanto, a pesar de que en algún estudio se planteó la posibilidad de que el TARGA y más concretamente los fármacos del grupo de los inhibidores de la proteasa pudieran potenciar la pérdida de masa ósea, en el momento actual parece aceptarse que la terapia antirretroviral no resulta especialmente perjudicial para el esqueleto9.
Por último, además de los antirretrovirales, los pacientes con infección por el VIH-1 pueden recibir otros fármacos para el tratamiento de procesos asociados que pueden ser perjudiciales para el hueso7,8,10. Es bien sabido que el tratamiento prolongado con corticoides es una de las causas más frecuente de osteoporosis secundaria en nuestro país3,46,88. Pero, además, estos pacientes reciben en ocasiones otros compuestos, como los fármacos anticonvulsionantes, los antineoplásicos y la pentamidina, que pueden favorecer también la pérdida de masa ósea3,10,46,89.
Actitud ante la sospecha de osteoporosisEl reconocimiento de la osteoporosis como una de las consecuencias tardías de la infección por el VIH-1 obliga a plantearse el diagnóstico precoz de dicha enfermedad en estas personas, con objeto de adoptar las oportunas medidas preventivas y terapéuticas. Por ello, parece razonable realizar una detallada historia clínica a los enfermos con infección por el VIH-1 que incluya los clásicos factores de riesgo de osteoporosis, prestando una especial atención al tratamiento recibido (corticoides, TARGA, etc.) y a la evolución de la enfermedad. Además de las pruebas analíticas rutinarias debe realizarse una densitometría ósea siempre que existan datos de hipogonadismo, tratamiento esteroideo crónico o antecedentes de fracturas osteoporóticas8,9. Se debe insistir en las medidas generales recomendadas al conjunto de la población: ejercicio físico, ingesta adecuada de calcio y vitamina D y corregir los factores de riesgo (alcohol, tabaco, deficiencias nutricionales)3. En los pacientes diagnosticados de osteoporosis que presenten hipogonadismo podría estar indicada la terapia hormonal sustitutiva. En el resto de los casos pueden utilizarse los bisfosfonatos1,6,8-10. Estos fármacos son bien tolerados, pueden administrarse de forma intermitente (semanal, mensual), no parecen interaccionar con los antirretrovirales y han demostrado su utilidad en la prevención y tratamiento de la osteoporosis90. No obstante, conviene señalar que no existe todavía experiencia suficiente sobre el tratamiento farmacológico de la osteoporosis en los pacientes con infección por el VIH-1. Así, algunos autores han señalado un descenso en los marcadores de resorción tras la administración de la hormona liberadora de somatotrofina (GHRH) en pacientes con infección por el VIH-191. Otros han comprobado que el tratamiento con testosterona es capaz de mejorar la densidad mineral ósea en varones eugonadales con síndrome de emaciación50. También existen algunos trabajos, en general con un escaso número de pacientes, en los que se ha observado que el tratamiento con alendronato semanal junto con calcio y vitamina D consigue mejorar la masa ósea en la columna lumbar y la cadera92-94. Además, se está a la espera de conocer los resultados de un ensayo clínico llevado a cabo con un amplio número de pacientes seropositivos tratados con alendronato (Adult AIDS Clinical Trials Group 5163)9, lo que, sin duda, aportará nuevas evidencias acerca de la posible eficacia del tratamiento antiosteoporótico en estos pacientes.