Las técnicas de diagnóstico rápido son herramientas de gran valor en el diagnóstico de las infecciones gastrointestinales, especialmente para la detección de algunos microorganismos y en determinados grupos de pacientes. Mientras que las técnicas de detección de antígeno son práctica habitual en los laboratorios de microbiología clínica para el diagnóstico de virus, algunos parásitos y algunas bacterias, las técnicas moleculares se utilizan de manera rutinaria solo para determinados patógenos (como Clostridium difficile). Sin embargo, son técnicas en constante evolución que permiten el diagnóstico rápido de un número cada vez mayor de patógenos con una elevada sensibilidad y especificidad y también permiten la detección de factores de virulencia o mecanismos de resistencia. Los sistemas de diagnóstico sindrómico, que detectan diferentes patógenos de forma simultánea, son muy prometedores porque permiten diagnosticar en pocas horas los patógenos más frecuentes y pueden ser de gran utilidad en determinados pacientes.
Para el diagnóstico de la infección por Helicobacter pylori las técnicas moleculares, que pueden detectar tanto la bacteria como su resistencia a claritromicina y levofloxacino, permiten seleccionar el tratamiento más adecuado para cada paciente cuando el cultivo de la bacteria no es posible.
Rapid diagnostic techniques are valuable tools in the diagnosis of gastrointestinal infections, especially for the detection of some microorganisms and in certain groups of patients. While antigen detection techniques are widely used in Clinical Microbiology laboratories, for the diagnosis of viruses, some parasites and some bacteria, molecular techniques are routinely used only for some pathogens (such as Clostridium difficile). However, molecular techniques are constantly evolving, and they allow a rapid diagnosis for an increasing number of pathogens, with high sensitivity and specificity. In addition, they are also able to detect virulence factors or resistance mechanisms. Syndromic surveillance systems, which detect different pathogens simultaneously, are very promising because they enable the most frequent pathogens to be diagnosed in a few hours and they can be very useful in certain patients.
For the diagnosis of Helicobacter pylori infection, molecular techniques are able to detect bacteria and its resistance to clarithromycin and levofloxacin, allowing the most appropriate treatment to be selected for each patient when bacterial culture is not possible.
Las infecciones del tracto gastrointestinal incluyen 2 entidades clínicas bien diferenciadas: infecciones gástricas producidas por Helicobacter pylori, y gastroenteritis, inflamación de la mucosa gástrica e intestinal, que puede estar producida por diferentes patógenos (bacterias, virus, o parásitos) o sus toxinas, y que cursa con diarrea, vómitos, dolor abdominal y/o fiebre. Diferentes patógenos pueden dar lugar a síntomas similares, por lo que es importante el diagnóstico etiológico. Con frecuencia son procesos autolimitados, pero pueden presentar alta morbimortalidad, especialmente en niños pequeños o en pacientes inmunodeprimidos1. En países en desarrollo se asocian con malas condiciones sanitarias, falta de instalaciones de agua corriente y con deficiencias nutricionales de la población, y presentan mayor morbimortalidad que en países desarrollados, donde, con frecuencia, se asocian a infecciones transmitidas con la comida2,3.
El diagnóstico rápido y acertado del patógeno implicado en el cuadro clínico es importante ya que algunos patógenos requieren un tratamiento específico; con algunos es necesario utilizar medidas de control para evitar la diseminación, y en algunos casos conocer el patógeno permitirá tomar la decisión de hospitalizar al paciente o tratarlo de forma ambulatoria1,4.
Tipos de técnicas rápidasLos métodos de diagnóstico convencionales utilizados en el diagnóstico de gastroenteritis incluyen técnicas de cultivo bacteriano, que requieren varios días para obtener resultados, pruebas microscópicas para detección de huevos y parásitos, que requieren alta especialización del personal, y técnicas de detección de antígeno1. Con frecuencia, cuando se consigue cultivar el agente etiológico productor del cuadro clínico, los síntomas ya se han resuelto y no es útil para el manejo del paciente.
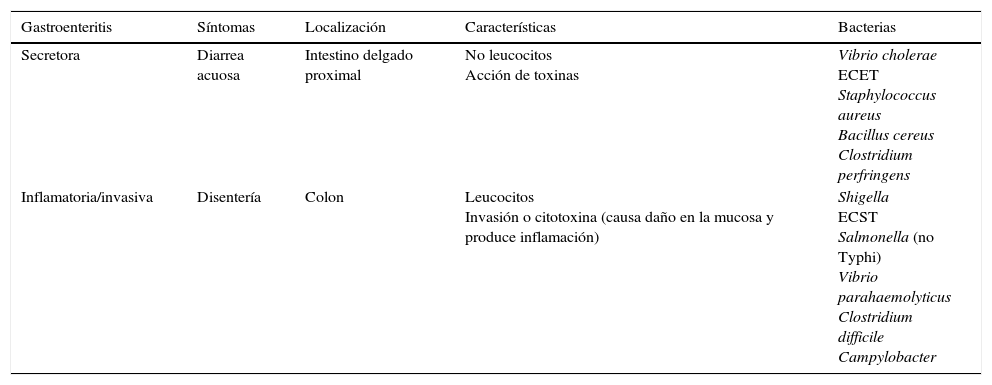
Técnicas rápidas basadas en observación microscópicaLa tinción de Gram, técnica utilizada en la mayoría de muestras clínicas, no es útil en muestras de heces, pues se teñirán las bacterias de la microbiota habitual. Sí que permite observar las estructuras curvadas características de Campylobacter, que puede tener valor en determinadas circunstancias, aunque no se realiza de rutina2. El examen microscópico para detectar leucocitos es poco específico, pero puede ser de utilidad si se sospecha enteritis invasiva (tabla 1).
Tipos de diarrea en cuanto al mecanismo de acción
| Gastroenteritis | Síntomas | Localización | Características | Bacterias |
|---|---|---|---|---|
| Secretora | Diarrea acuosa | Intestino delgado proximal | No leucocitos Acción de toxinas | Vibrio cholerae ECET Staphylococcus aureus Bacillus cereus Clostridium perfringens |
| Inflamatoria/invasiva | Disentería | Colon | Leucocitos Invasión o citotoxina (causa daño en la mucosa y produce inflamación) | Shigella ECST Salmonella (no Typhi) Vibrio parahaemolyticus Clostridium difficile Campylobacter |
Los antígenos microbianos presentes en las muestras biológicas se pueden detectar y cuantificar mediante técnicas inmunológicas basadas en la especificidad de las reacciones antígeno-anticuerpo. Existe una gran variedad de inmunoanálisis disponibles para el diagnóstico de las infecciones del tracto gastrointestinal. Algunos, como la inmunofluorescencia o los enzimoinmunoanálisis (EIA) tipo ELISA (enzyme-linked immunosorbent assay), resultan laboriosos y requieren personal entrenado, mientras que otros, como los EIA de membrana, los inmunoanálisis de flujo lateral o inmunocromatográficos (ICT), y las técnicas de aglutinación, son extremadamente sencillos y rápidos.
Enzimoinmunoanálisis tipo ELISAUtilizan anticuerpos específicos del antígeno problema, unidos generalmente a los pocillos de una microplaca. El antígeno presente en la muestra clínica se combina con el anticuerpo fijado a la fase sólida y su presencia se detecta mediante la adición de un segundo anticuerpo conjugado a una enzima. Las enzimas empleadas con mayor frecuencia son la peroxidasa y la fosfatasa alcalina. Al actuar la enzima sobre el sustrato, se producirá una señal colorimétrica observable a simple vista o cuantificable mediante el uso de un espectrofotómetro. En general, los valores de sensibilidad y especificidad de estas técnicas son excelentes. Permiten procesar simultáneamente lotes de muestras y, en algunos casos, realizar una cuantificación del antígeno detectado. Son técnicas laboriosas ya que requieren la adición de múltiples reactivos, pasos de lavados y tiempos de incubación. Sin embargo, son fácilmente automatizables.
Enzimoinmunoanálisis de membranaEl anticuerpo de captura se inmoviliza en una membrana a través de la cual fluye la muestra. Si el antígeno está presente, será retenido por dicho anticuerpo, y la unión antígeno-anticuerpo se pondrá de manifiesto, como en un ELISA convencional, mediante un segundo anticuerpo conjugado a una enzima. La interacción de la enzima y su sustrato provoca un cambio de color. Una determinación se considera positiva cuando se obtienen bandas coloreadas tanto en la línea control (donde se fija el conjugado) como en la línea de reacción (donde se fija el antígeno). Mediante este tipo de ensayos las muestras se procesan individualmente, no se requieren equipos ni personal especializado, los resultados se obtienen aproximadamente en 15-20min, y son fácilmente interpretables.
Pruebas inmunocromatográficas o inmunoanálisis de flujo lateral (lateral flow)Consisten en membranas de nitrocelulosa o nylon, a modo de tira o de cassette, por las que fluye la muestra por capilaridad. En los ensayos tipo sándwich, los más habituales, se distinguen 2 zonas en la tira: la zona de reacción, donde se inmovilizan anticuerpos contra el antígeno problema y la zona de control, donde se inmovilizan anticuerpos anticonjugado. El conjugado es un anticuerpo, específico del antígeno problema, marcado con una molécula de oro coloidal o bien con unas microesferas de poliestireno coloreadas. Si el antígeno está presente en la muestra, se unirá, tanto al anticuerpo conjugado como al anticuerpo de captura inmovilizado en la zona de reacción. El exceso de anticuerpo conjugado seguirá migrando a través de la membrana hasta quedar retenido en la zona de control. En el caso de muestras negativas solo aparecerá coloreada la zona control, mientras que si la muestra es positiva aparecerán coloreadas tanto la zona de control como la de reacción5. Se trata de técnicas cualitativas, muy rápidas y sencillas de realizar, que no necesitan equipos de laboratorio especiales y las muestras se procesan de forma individual. La mayoría presentan valores elevados de sensibilidad y especificidad, aunque en general inferiores a los que presentan las técnicas de ELISA convencionales.
Técnicas de aglutinación en látexSe basan en el empleo de partículas de látex unidas al fragmento cristalizable (Fc) de las inmunoglobulinas. Los fragmentos de unión del anticuerpo (Fab) quedan expuestos y son capaces de unirse al antígeno que se encuentra en la muestra. Cuando los anticuerpos se unen al antígeno se produce un entramado de las partículas de látex que da como resultado una aglutinación visible. Este tipo de técnicas requieren procesar las muestras individualmente, son fáciles de realizar, rápidas y no necesitan equipos especiales. Sin embargo, pueden producirse reacciones cruzadas con otros antígenos de la muestra o fenómenos de prozona, en los cuales un exceso de anticuerpos impide la formación del entramado.
Inmunofluorescencia directaSe basa en la detección de antígenos mediante la utilización de anticuerpos marcados con un fluorocromo sobre extensiones de muestras clínicas realizadas sobre un portaobjetos. La extensión se fija, se incuba con el anticuerpo específico para el antígeno problema conjugado con el fluorocromo y, tras un lavado, se realiza la lectura de los resultados por observación al microscopio de fluorescencia. Sus principales desventajas son el coste de los reactivos y la laboriosidad de la técnica.
Técnicas rápidas molecularesLas técnicas moleculares han revolucionado el diagnóstico microbiológico y, a pesar de su elevado coste, representan una interesante alternativa a los métodos convencionales debido a su rapidez y a su elevada sensibilidad y especificidad. La reacción en cadena de la polimerasa (PCR) reproduce in vitro el proceso fisiológico de la duplicación del ADN en las células, amplificando exponencialmente una secuencia específica de ADN bicatenario.
Desde su invención, se han diseñado diferentes variantes de la PCR que han permitido mejorar su rendimiento diagnóstico.
La PCR tras transcripción inversa o RT-PCR se utiliza para la detección y amplificación del ARN. El ARN presente en la muestra se utiliza como molde para sintetizar el ADN complementario (ADNc) mediante una transcriptasa inversa o transcriptasa reversa, y el ADN resultante se amplifica mediante una PCR convencional.
La PCR cuantitativa (qPCR) o PCR en tiempo real es mucho más rápida que la convencional, y proporciona una cuantificación continua y precisa del ADN que se va formando6. Para cuantificar el ADN o ARN presente en la muestra es necesario realizar en paralelo una curva patrón.
Las PCR multiplex permiten, mediante el uso de múltiples sondas o parejas de cebadores, la detección simultánea de diferentes patógenos. Estos sistemas permiten realizar un diagnóstico sindrómico de la enfermedad gastrointestinal detectando, de forma simultánea, los enteropatógenos más frecuentemente implicados, incluyendo bacterias, virus y parásitos.
Existen otras técnicas de amplificación disponibles, como las de amplificación isotérmica, en las cuales la amplificación del ácido nucleico tiene lugar a temperatura constante con la participación de diferentes enzimas como transcriptasa inversa, RNAsa H, helicasa o ARN polimerasa.
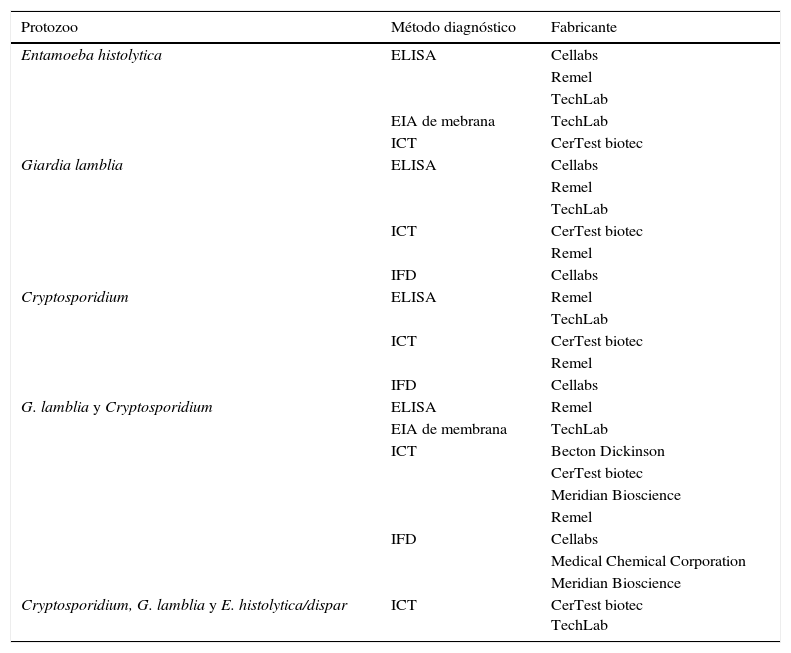
Técnicas rápidas para la detección de patógenos individualesDiagnóstico de parásitosTradicionalmente el diagnóstico microbiológico, tanto de los protozoos (amebas, flagelados, ciliados, coccidios y microsporidios) como de los helmintos (nematodos, cestodos y trematodos), se ha realizado por identificación microscópica de las formas parasitarias que se eliminan en las heces del paciente. Para incrementar el rendimiento diagnóstico es necesario utilizar técnicas de concentración y, en algunos casos, tinciones específicas. Estas determinaciones solo permiten el diagnóstico de la infección aguda y patente, exigen la toma de muestras seriadas, son muy laboriosas, requieren de personal especializado y presentan limitaciones de sensibilidad y especificidad. Las pruebas de detección de antígenos parasitarios eliminados en heces utilizan anticuerpos específicos que reconocen moléculas de secreción, superficie, o pared de los parásitos7. Existen sistemas comercializados que permiten la detección simultánea de 2 o 3 especies diferentes (tabla 2). Las pruebas de amplificación de secuencias genómicas son las de mayor sensibilidad y especificidad, y gracias a la constante caracterización de genomas de diversos organismos, es posible diseñar protocolos de PCR para cada uno de los parásitos de interés. Sin embargo, mediante estas técnicas solo pueden detectarse uno o pocos parásitos a la vez y hay muy pocas comercializadas8.
Ensayos comercializados, basados en la detección de coproantígenos, para el diagnóstico de infecciones del tracto gastrointestinal causadas por protozoos
| Protozoo | Método diagnóstico | Fabricante |
|---|---|---|
| Entamoeba histolytica | ELISA | Cellabs |
| Remel | ||
| TechLab | ||
| EIA de mebrana | TechLab | |
| ICT | CerTest biotec | |
| Giardia lamblia | ELISA | Cellabs |
| Remel | ||
| TechLab | ||
| ICT | CerTest biotec | |
| Remel | ||
| IFD | Cellabs | |
| Cryptosporidium | ELISA | Remel |
| TechLab | ||
| ICT | CerTest biotec | |
| Remel | ||
| IFD | Cellabs | |
| G. lamblia y Cryptosporidium | ELISA | Remel |
| EIA de membrana | TechLab | |
| ICT | Becton Dickinson | |
| CerTest biotec | ||
| Meridian Bioscience | ||
| Remel | ||
| IFD | Cellabs | |
| Medical Chemical Corporation | ||
| Meridian Bioscience | ||
| Cryptosporidium, G. lamblia y E. histolytica/dispar | ICT | CerTest biotec TechLab |
Entamoeba histolytica provoca disentería amebiana y es una de las posibles causas de la diarrea del viajero. El diagnóstico tradicional de la amebiasis se ha basado durante muchos años en la microscopia. Sin embargo, las técnicas microscópicas no permiten diferenciar E. histolytica de las amebas comensales Entamoeba dispar y Entamoeba moshkovskii. Las técnicas de PCR, basadas en su mayoría en la amplificación de regiones codificantes de la subunidad pequeña ribosomal 18S (18S ARNr), permiten diferenciar las 3 especies de Entamoeba morfológicamente indistinguibles y presentan una excelente sensibilidad y especificidad9. Por otra parte, la detección de antígenos de E. histolytica por ELISA es una buena opción si no se dispone de métodos moleculares. En la actualidad se dispone de distintos EIA de membrana y ensayos ICT comercializados que detectan antígenos específicos de E. histolytica en heces y en el contenido de abscesos10,11. Dichos ensayos están basados en la detección de epítopos específicos de la lectina amebiana y presentan una sensibilidad superior a la del examen microscópico10,12. Algunos de los ensayos comercializados solo permiten emplear heces recientes o congeladas.
Giardia lambliaLa giardiasis, causada por Giardia lamblia, constituye una parasitosis de gran importancia epidemiológica y clínica por su alta prevalencia y patogenicidad, fundamentalmente entre la población infantil. Para su diagnóstico se han comercializado diversos métodos de detección de antígeno con sensibilidad y especificidad superiores a las del examen microscópico. Estas pruebas resultan útiles también en el cribado de la población infantil y como control de tratamiento para confirmar la curación. Los diversos EIA comercializados utilizan anticuerpos, monoclonales o policlonales, para detectar antígenos de la membrana de G. lamblia como el GSA 65 o CWP111. Son técnicas rápidas, con una buena relación coste-efectividad y permiten procesar heces recientes o conservadas en formalina. Para G. lamblia también se dispone de ensayos ICT comercializados. Sin embargo, la mayoría requieren utilizar heces recientes o congeladas, sin conservantes, y presentan una menor sensibilidad que los ensayos de ELISA. También hay disponibles tinciones de inmunofluorescencia directa (IFD) para G. lamblia que utilizan un anticuerpo monoclonal específico del antígeno GSA 65.
CoccidiosCryptosporidium hominis y Cryptosporidium parvum son las 2 principales especies patógenas que parasitan al hombre. Fundamentalmente afectan a pacientes inmunodeprimidos y producen un grave cuadro de diarrea crónica. La detección de los coccidios se realiza tradicionalmente mediante la demostración microscópica de los ooquistes tras tinciones especiales, como la de Kinyoun o de auramina-rodamina. Como alternativas válidas existen en el mercado diversas técnicas de detección de antígenos, como la IFD, el ELISA o las técnicas ICT, que han mostrado valores de especificidad y de sensibilidad superiores a los de la observación microscópica7,11,13. Sin embargo, ninguno de los métodos mencionados permite la identificación de especies, para lo cual es necesario recurrir a técnicas de PCR.
HelmintosHay 3 grupos de helmintos de importancia médica: nematodos (gusanos redondos), cestodos (gusanos en cinta) y trematodos (o duelas). El diagnóstico de algunos cestodos se basa en la observación de las proglótides o de los segmentos. No obstante, en la mayoría de las infecciones por helmintos, el diagnóstico se realiza por identificación microscópica de sus huevos o larvas en las heces del paciente. Aunque también existen técnicas especiales, válidas únicamente para determinados helmintos, como la cinta de Graham en el diagnóstico de Enterobius vermicularis o el cultivo de Strongyloides stercoralis, los avances en el diagnóstico rápido de los helmintos intestinales no son tan significativos como en el de los protozoos. Las pruebas de detección de antígenos no han tenido un gran desarrollo y, aunque se han publicado diversos trabajos14, aún no han sido comercializadas. Más frecuentes son las pruebas serológicas de detección de anticuerpos específicos, disponibles para el diagnóstico de hidatidosis, cisticercosis, fasciolosis, esquistosomiasis, toxocariasis, anisakiasis, filariosis y estrongiloidiasis. Algunos de estos ensayos han sido comercializados, mientras que otros solo se realizan en centros de referencia. Todos ellos tienen el inconveniente de no distinguir entre infección actual y pasada, por lo que son más útiles en zonas no endémicas, y con frecuencia tienen problemas de reacciones cruzadas15,16. En cuanto al diagnóstico molecular, se han diseñado multitud de protocolos de PCR, tanto convencional como a tiempo real, para el diagnóstico de las helmintiasis8. Sin embargo, hasta el momento ninguna ha sido comercializada.
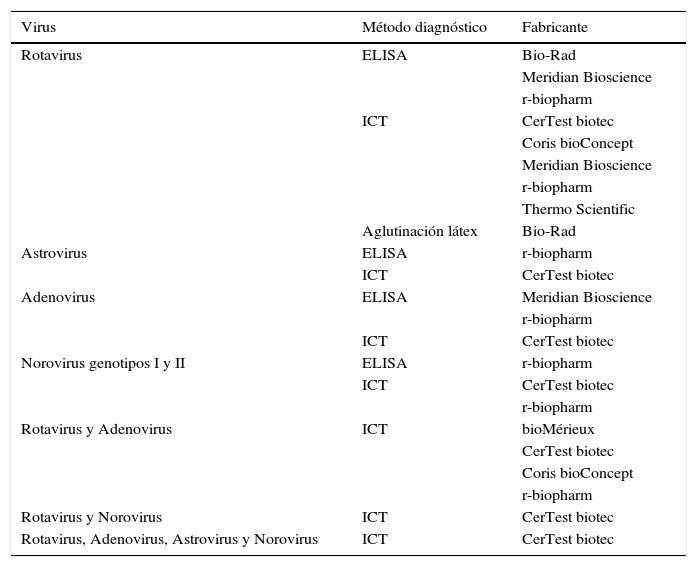
Diagnóstico de virusLos principales virus productores de gastroenteritis en el ser humano son los rotavirus, astrovirus, adenovirus y norovirus. Otros como los coronavirus, torovirus, picobirnavirus y picornavirus (virus Aichi) también pueden causar infección del tracto gastrointestinal, pero con una frecuencia mucho menor16. El diagnóstico rápido de las gastroenteritis víricas se realiza mediante la detección de antígenos virales (tabla 3) o por métodos moleculares basados en la detección de genes específicos.
Ensayos comercializados, basados en la detección de coproantígenos, para el diagnóstico de infecciones del tracto gastrointestinal causadas por virus
| Virus | Método diagnóstico | Fabricante |
|---|---|---|
| Rotavirus | ELISA | Bio-Rad |
| Meridian Bioscience | ||
| r-biopharm | ||
| ICT | CerTest biotec | |
| Coris bioConcept | ||
| Meridian Bioscience | ||
| r-biopharm | ||
| Thermo Scientific | ||
| Aglutinación látex | Bio-Rad | |
| Astrovirus | ELISA | r-biopharm |
| ICT | CerTest biotec | |
| Adenovirus | ELISA | Meridian Bioscience |
| r-biopharm | ||
| ICT | CerTest biotec | |
| Norovirus genotipos I y II | ELISA | r-biopharm |
| ICT | CerTest biotec | |
| r-biopharm | ||
| Rotavirus y Adenovirus | ICT | bioMérieux |
| CerTest biotec | ||
| Coris bioConcept | ||
| r-biopharm | ||
| Rotavirus y Norovirus | ICT | CerTest biotec |
| Rotavirus, Adenovirus, Astrovirus y Norovirus | ICT | CerTest biotec |
Los rotavirus son virus ARN muy contagiosos que se transmiten por vía fecal-oral, por fómites o por vía respiratoria. En función de las características antigénicas de la glicoproteína VP6, constituyente de la cápside interna del virión, se distinguen 8 serogrupos (A-H). Las infecciones humanas son producidas principalmente por rotavirus del serogrupo A y, en menor medida, por los serogrupos B y C. La proteína VP4, que constituye las espículas del virión, y la glucoproteína VP7, constituyente de la cápside externa, determinan la existencia de los serotipos P y G, respectivamente17. El diagnóstico de las infecciones por rotavirus del serogrupo A se basa en la detección de antígenos víricos en muestras de heces, concretamente de la glicoproteína VP6. Por el momento no existen métodos comercializados que permitan detectar rotavirus de otros serogrupos. Los formatos disponibles son muy variados: ELISA, EIA de membrana, ICT y aglutinación con látex18-20. El EIA de membrana, las técnicas ICT y la aglutinación con látex son métodos adecuados para hospitales con un número escaso o esporádico de muestras. Sin embargo, son menos sensibles que los ELISA convencionales. Los métodos moleculares, los de mayor sensibilidad y especificidad, se basan en una RT-PCR. Para el diagnóstico de rotavirus del grupo A mediante RT-PCR en tiempo real, los sistemas comercializados utilizan cebadores específicos del gen que codifica la proteína no estructural NSP3. Esta metodología también permite detectar rotavirus de serogrupos diferentes21.
AstrovirusLos astrovirus son virus sin envoltura con un genoma de ARN monocatenario de polaridad positiva, pequeños (28-41nm de diámetro) y con apariencia de estrella al microscopio electrónico. Existen 8 serotipos diferentes (1-8) pero, debido a la existencia de reacciones cruzadas antigénicas, es posible la detección de todos ellos mediante el empleo de un anticuerpo específico de grupo denominado MAb8E7, capaz de reconocer un epítopo común a todos los serotipos humanos. Actualmente se dispone de diversos kits comerciales de ELISA que permiten la detección de astrovirus humanos en heces. El diagnóstico también puede establecerse por RT-PCR22.
AdenovirusLos adenovirus entéricos de los serotipos 40 y 41 son los más frecuentemente asociados con gastroenteritis infantil. Existen métodos tipo específicos que detectan solo los serotipos 40 y 41 y otros métodos grupo específicos que detectan todos los adenovirus. El diagnóstico de las infecciones por adenovirus entéricos se establece habitualmente por métodos de ELISA, aglutinación con látex o ICT. Algunas de estas técnicas permiten detectar simultáneamente adenovirus y rotavirus. También existen comercializados métodos de PCR, muy sensibles y específicos, que permiten la detección y caracterización de los adenovirus entéricos16.
NorovirusLos norovirus son la principal causa de gastroenteritis no bacteriana en individuos de todas las edades y constituyen la causa más frecuente de brotes de gastroenteritis aguda. Son virus no envueltos, de un diámetro aproximado de 38nm, cuyo genoma está constituido por ARN monocatenario de polaridad positiva. De los 5 genogrupos descritos, solo los genogrupos I, II y IV presentan cepas que infectan a los seres humanos. La RT-PCR se ha convertido en la técnica de referencia para su diagnóstico. Los cebadores empleados permiten amplificar el gen de la ARN-polimerasa viral o el gen que codifica las proteínas de la cápside. La RT-PCR en tiempo real es más sensible y permite detectar y diferenciar entre los genogrupos I y II más rápidamente. Asimismo, existen comercializadas diversas pruebas diagnósticas basadas en la detección de antígenos23. Algunos ELISA presentan una especificidad elevada pero una moderada sensibilidad, por lo que son muy útiles en el estudio de brotes epidémicos, pero no tanto en el diagnóstico de casos esporádicos. Sin embargo, las pruebas ICT y los EIA de membrana disponibles presentan valores elevados de sensibilidad y de especificidad.
Diagnóstico de bacteriasClostridium difficile toxigénicoClostridium difficile es un bacilo grampositivo anaerobio, productor de esporas, que se encuentra en el suelo y en el tracto intestinal de animales y humanos y puede colonizar hasta el 50% de niños menores de un año, del 3 al 5% de los adultos sanos y a un mayor porcentaje de pacientes adultos hospitalizados o de residencias de ancianos. C. difficile produce diarrea asociada a antibióticos, pero los síntomas pueden variar desde portadores asintomáticos, diarrea moderada o leve y colitis seudomembranosa2,24,25. Las cepas patógenas tienen un locus de patogenicidad que codifica para la toxina A, una enterotoxina codificada por el gen tcdA, y la toxina B, una potente citotoxina codificada por el gen tcdB2,25, aunque pueden no presentar la toxina A y solo la toxina B. La cepa hipervirulenta NAP1/027/B1 se ha asociado con mayor morbimortalidad y produce mayor expresión de toxina, una esporulación más eficiente y la expresión de una toxina binaria, aunque no todas las cepas que se detectan actualmente presentan estas características de virulencia2,26.
Ante pacientes con factores de riesgo para diarrea por C. difficile, tanto hospitalizados como no hospitalizados, se deben realizar pruebas de detección de toxinas A y B, de forma rápida, para iniciar el tratamiento antibiótico y aplicar medidas de control para evitar la diseminación a otros pacientes.
Los métodos más utilizados son:
Detección de antígeno. Detección de glutamato deshidrogenasa (GDH) mediante EIA o partículas de látex. La GDH es un antígeno muy abundante de la pared celular de C. difficile y su detección es muy sensible pero poco específica, ya que está presente tanto en cepas toxigénicas como no toxigénicas2,24,27.
Detección de toxinas A y/o B. Se puede realizar mediante pruebas de citotoxicidad o mediante técnicas de ICT o de EIA4,28. La prueba de citotoxicidad se considera el método de referencia para detección de toxina B en las heces, con una alta sensibilidad y especificidad, pero es muy laboriosa, además de no ser una prueba rápida. Existen numerosas pruebas de EIA comerciales para la detección de toxinas A, B o las dos. Se recomienda utilizar técnicas de EIA que detecten toxina B o las 2, por las cepas productoras solo de toxina B. Sin embargo, estas técnicas comerciales tienen baja sensibilidad comparadas con cultivos celulares, por lo que es necesario utilizar técnicas de detección de ácidos nucleicos2,28. La detección de toxina a partir del aislamiento obtenido por cultivo no se debe utilizar como método único, pues requiere varios días para su crecimiento, pero su utilización, además de la detección directa de toxina, puede aumentar en un 10% la positividad29.
Detección de genes de las toxinas A/B mediante amplificación de ácidos nucleicos. Es la técnica que ofrece mayor sensibilidad y especificidad, aunque es más cara. Existen diferentes PCR en tiempo real, que permiten detectar C. difficile, la toxina B, y la toxina binaria en 90min. GeneXpert presenta un 98% de acuerdo con la prueba de referencia y mayor sensibilidad que la ICT4,30. Sin embargo, una muestra puede ser positiva mediante método molecular y negativa mediante EIA y cultivo celular, por lo que pueden surgir dudas del significado clínico2,27.
Para llegar a un diagnóstico correcto y que sea coste-efectivo, se deben usar alguno de los siguientes algoritmos2,24,25: 1) hacer GDH EIA y estudiar la presencia de toxina con método molecular cuando sea positivo, 2) hacer la combinación de GDH y toxina A/B EIA de forma simultánea y confirmar las muestras con resultados discrepantes entre ellas con método molecular o 3) hacer solo el método molecular a todas las muestras.
Escherichia coliEscherichia coli puede formar parte de la microbiota intestinal normal, pero algunas variantes (consideradas patovariedades o patotipos) tienen capacidad de producir diarrea y son causa de morbimortalidad en todo el mundo31. Se definen por la expresión de uno o más factores de virulencia: enteropatógeno (ECEP), productor de toxina Shiga (ECTS), también llamado enterohemorrágico o productor de verocitotoxina, que incluye al serotipo O157, enteroinvasivo (ECEI), enterotoxigénico (ECET), enteroagregativo (ECEA) e invasivo adherente2,31.
En la mayoría de los laboratorios clínicos y de salud pública solo se estudia ECTS y se define por la presencia de los genes de las toxinas Shiga 1 (stx1) y/o Shiga 2 (stx2). El cultivo permite detectar solo E. coli O157, pero los métodos independientes del cultivo detectan tanto los O157 como el resto2. El CDC recomienda realizar simultáneamente el cultivo diferencial para detectar E. coli O157 y el estudio molecular para la detección de stx1 y stx2, en heces de pacientes con diarrea aguda adquirida en la comunidad y con posible síndrome urémico hemolítico32. Si no se dispone de un método molecular se debería enviar a un centro de referencia.
Se pueden utilizar: 1) EIA Stx, que permiten detectar, y en algunos casos diferenciar, stx1 y stx2, a partir de un caldo enriquecido incubado una noche a 37°C, tanto de ECTS O157 como no-O157, y 2) técnicas moleculares, que detectan los genes stx1 y stx2 directamente de las heces, y que es el método más sensible2. Recientemente se ha publicado la utilización de una nueva ICT realizada directamente en muestras de heces con excelentes resultados30.
CampylobacterSe han desarrollado pruebas de detección de antígeno de Campylobacter a partir de muestras de heces, en formato de ELISA, en placa de micropocillos o en formato de ICT de flujo lateral. Aunque son métodos más rápidos que el cultivo, presentan menor sensibilidad y no diferencian entre Campylobacter jejuni y Campylobacter coli. Existen métodos moleculares para realizar directamente de las heces, que son los más sensibles, pero no están suficientemente validados2.
Técnicas rápidas para detección de otras bacterias productoras de diarreaUn test rápido (ICT, dipstick) permite detectar Shigella a partir de colonias, y directamente de las heces o de los exudados rectales, gracias a anticuerpos monoclonales frente al lipopolisacárido4. Las enterotoxinas de Staphylococcus aureus, Bacillus cereus y Clostridium perfringens se pueden detectar en alimentos, heces o en cepas cultivadas mediante métodos comerciales, mediante técnica de aglutinación pasiva reversa por látex o técnica de EIA33.
Helicobacter pyloriPara el diagnóstico rápido de la infección por H. pylori se han utilizado diferentes técnicas, ya que el cultivo de la biopsia es lento y exigente34.
Basadas en la ureasa de H. pylori. H. pylori tiene una potente ureasa y esta característica se utiliza, desde el inicio del descubrimiento de H. pylori, para su diagnóstico, en 2 tipos de pruebas: ureasa rápida a partir de la biopsia y test del aliento.
Si se incorpora un trozo de biopsia en un caldo o gel de urea, se producirá el cambio de color a rosa en pocos minutos. La prueba de la ureasa se puede utilizar para identificar la bacteria obtenida por cultivo, pero se utiliza principalmente como práctica habitual en las unidades de endoscopias. La primera que se comercializó con este fin fue el CLO-test, con la que se obtenían resultados positivos entre 30min y 3h, aunque podía dejarse hasta 24h, lo que suponía pérdida de especificidad por otras bacterias ureasa positivas. Actualmente existen diferentes marcas comerciales, que buscan acortar el tiempo para obtener el resultado35.
Para realizar la prueba del aliento con urea (urea breath test [UBT]), el paciente ingiere urea marcada y se recogen muestras del aliento antes y 30min después de la ingestión. Si H. pylori se encuentra en el estómago, hidrolizará la urea y se liberará CO2 marcado. Se puede utilizar un isotopo radioactivo, 14C, o un isotopo no radiactivo, 13C, que es el más utilizado y se puede medir con un espectrómetro de masas o de infrarrojos35. Es la prueba no invasiva de elección para el diagnóstico y seguimiento del paciente con H. pylori por su alta sensibilidad y especificidad (del 95 al 100%) para detectar infección activa35,36.
Basadas en la detección de anticuerpos. Existen numerosas pruebas serológicas para detectar anticuerpos anti-H. pylori IgG en el suero del paciente. La principal limitación es que no diferencian la infección activa de la pasada y es necesario que el kit que se utilice esté validado a nivel local35. Es útil para estudios epidemiológicos y cuando existe sangrado gastrointestinal, gastritis atrófica, cáncer gástrico o linfoma MALT (mucosa associated lymphoid tissue), ya que puede producir una baja carga bacteriana en el estómago y disminuirá la sensibilidad de otras pruebas diagnósticas36,37. También existen pruebas para detectar anticuerpos de H. pylori en orina o saliva, con resultados variables, por lo que actualmente no se recomienda su uso en el manejo del paciente35,38,39.
Basadas en la detección de antígeno en heces. La prueba de antígeno en heces es una prueba no invasiva y cualitativa, que detecta el antígeno de H. pylori que se ha eliminado en las heces. Se pueden usar: 1) como prueba para el diagnóstico inicial de la infección; 2) para el control del tratamiento (al menos 4 semanas después de terminarlo), y 3) para estudios epidemiológicos.
El primer kit que se desarrolló fue un EIA con anticuerpos policlonales39, aunque actualmente no se recomienda por tener menor sensibilidad y especificidad que los que utilizan anticuerpos monoclonales35,39. De los numerosos métodos comercializados que utilizan anticuerpos monoclonales, EIA o ICT presentan diferente precisión diagnóstica. Se obtienen mejores resultados con los kits basados en EIA en formato de micropocillos39 y se consideran equivalentes al UBT en el consenso de Maastricht34,35. Existe también un inmunoanálisis quimioluminiscente automatizado con resultados comparables al EIA34.
En 2 estudios que evaluaban ICT se observó sensibilidad del 93 y del 95% y especificidad del 89 y del 87% para el diagnóstico pretratamiento, y sensibilidad del 94 y del 100% y especificidad del 97 y del 91% para el seguimiento postratamiento35. En un estudio reciente se compararon 3 ICT comerciales y se observó que RAPID Hp StAR (Oxoid) era el más sensible (91-92%) pero el menos especifico (77-85%), mientras que para Uni-Gold™ H.pylori Antigen (Trinity Biotech) y para ImmunoCard STAT! HpSA (Meridian), se observó una sensibilidad del 83% y una especificidad del 90% (87-89%)40. En otros estudios también se han observado valores más bajos de sensibilidad y/o especificidad, por lo que se considera que las ICT necesitan mejorar para que sean fiables40.
Basadas en métodos moleculares (PCR). Desde hace muchos años se han utilizado métodos moleculares caseros para el diagnóstico de la infección por H. pylori a partir de diferentes muestras como biopsia gástrica, heces, saliva, jugo gástrico, etc. Además, permiten el estudio de mutaciones de resistencia a macrólidos como claritromicina (gen 23S ARNr), fluoroquinolonas (gen gyrA), tetraciclinas (gen 16S ARNr), rifabutina (gen rpoB) y amoxicilina (gen pbp-1a)41,42, y tienen las ventajas de la rapidez, de la mayor sensibilidad que el cultivo con métodos fenotípicos de sensibilidad a antibióticos, y detectan resistencia heterogénea, que puede ser difícil de obtener por cultivo39,43.
En el último consenso de Maastricht, se considera realizar estudios de sensibilidad a claritromicina, si se va a utilizar este antibiótico como primera línea de tratamiento, en regiones con tasa de resistencia mayor del 15%, tanto por cultivo y antibiograma como por un método molecular directamente de la biopsia36.
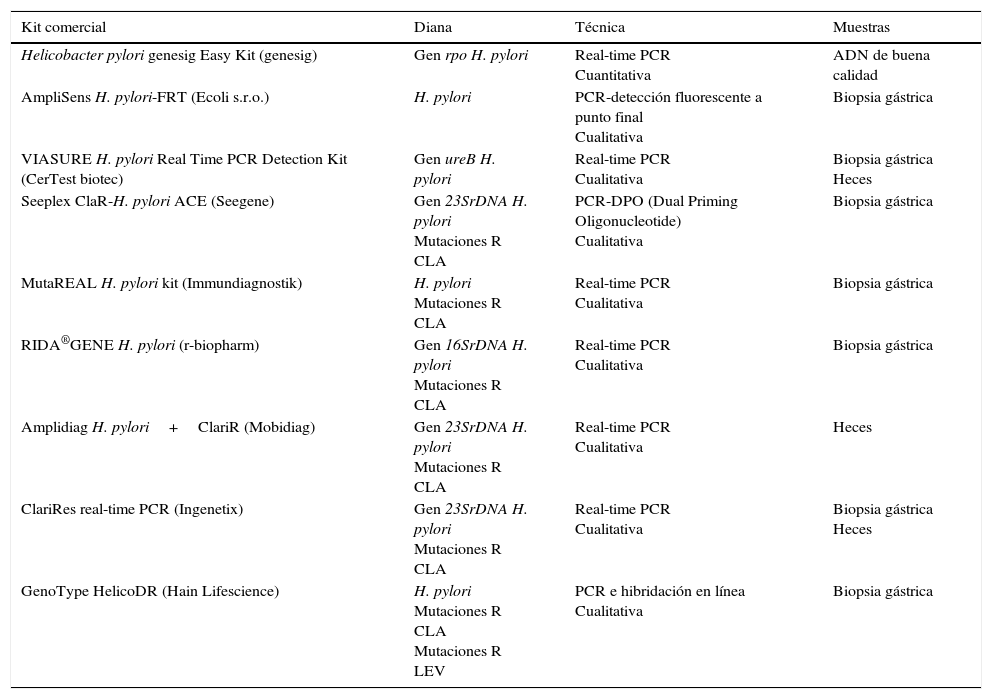
Existen varios kits comerciales basados en PCR en tiempo real que detectan H. pylori directamente en la biopsia; otros métodos, además de H. pylori, detectan las principales mutaciones que confieren resistencia a claritromicina44-47 (tabla 4). También existe un kit comercial basado en PCR y posterior hibridación en línea (GenoType HelicoDR) que permite detectar resistencia a claritromicina y a fluoroquinolonas. Se ha descrito sensibilidad del 94 al 100% y especificidad del 86 al 99% para la detección de resistencia a claritromicina y sensibilidad del 83 al 87% y especificidad del 95 al 98,5% para resistencia a fluoroquinolonas39,48, aunque en otros estudios se han observado datos más bajos tanto para claritromicina como para fluoroquinolonas39,49. Algunos de los kits comercializados pueden detectar H. pylori y su resistencia a claritromicina a partir de muestras de heces (Amplidiag H. pylori+ClariR, Mobidiag o ClariRes real-time PCR, Ingenetix), aunque no hay todavía artículos publicados.
Sistemas comerciales que utilizan métodos moleculares para el diagnóstico de Helicobacter pylori y resistencia a claritromicina o levofloxacino
| Kit comercial | Diana | Técnica | Muestras |
|---|---|---|---|
| Helicobacter pylori genesig Easy Kit (genesig) | Gen rpo H. pylori | Real-time PCR Cuantitativa | ADN de buena calidad |
| AmpliSens H. pylori-FRT (Ecoli s.r.o.) | H. pylori | PCR-detección fluorescente a punto final Cualitativa | Biopsia gástrica |
| VIASURE H. pylori Real Time PCR Detection Kit (CerTest biotec) | Gen ureB H. pylori | Real-time PCR Cualitativa | Biopsia gástrica Heces |
| Seeplex ClaR-H. pylori ACE (Seegene) | Gen 23SrDNA H. pylori Mutaciones R CLA | PCR-DPO (Dual Priming Oligonucleotide) Cualitativa | Biopsia gástrica |
| MutaREAL H. pylori kit (Immundiagnostik) | H. pylori Mutaciones R CLA | Real-time PCR Cualitativa | Biopsia gástrica |
| RIDA®GENE H. pylori (r-biopharm) | Gen 16SrDNA H. pylori Mutaciones R CLA | Real-time PCR Cualitativa | Biopsia gástrica |
| Amplidiag H. pylori+ClariR (Mobidiag) | Gen 23SrDNA H. pylori Mutaciones R CLA | Real-time PCR Cualitativa | Heces |
| ClariRes real-time PCR (Ingenetix) | Gen 23SrDNA H. pylori Mutaciones R CLA | Real-time PCR Cualitativa | Biopsia gástrica Heces |
| GenoType HelicoDR (Hain Lifescience) | H. pylori Mutaciones R CLA Mutaciones R LEV | PCR e hibridación en línea Cualitativa | Biopsia gástrica |
R CLA: resistencia a claritromicina; R LEV: resistencia a levofloxacino.
En los últimos años han surgido numerosos paneles sindrómicos para el diagnóstico microbiológico de diferentes enfermedades infecciosas, incluyendo patógenos productores de diarrea. Permiten disponer de resultados en poco tiempo de todos los patógenos incluidos en el kit y pueden ser una herramienta muy importante en algunas situaciones, como en pacientes inmunodeprimidos o pacientes graves1. La detección de la mayoría de los patógenos tiene una buena sensibilidad y tiene gran valor en la detección de coinfecciones4.
Existen diferentes técnicas comerciales que permiten detectar patógenos productores de gastroenteritis (tabla 5), y son muy variadas tanto en el número y tipo de patógenos que detectan como en la tecnología que utilizan1,2,50.
Patógenos detectados en paneles comerciales para el diagnóstico de gastroenteritis
| Virus | Bacterias | Parásitos | |
|---|---|---|---|
| FilmArray (bioMérieux) | Rotavirus A Norovirus GI/GII Adenovirus 40/41 Sapovirus Astrovirus | Aeromonas Campylobacter Clostridium difficile (toxinas A/B) Plesiomonas shigelloides Salmonella Yersinia enterocolitica Vibrio spp. Escherichia coli: ECEA, ECEP, ECET, ECTS (stx1 y stx2), E. coli 0157, ECEI/Shigella | Cryptosporidium Entamoeba histolytica Giardia lamblia Cyclospora cayetanensis |
| xTAG GPP (Luminex) | Rotavirus A Norovirus GI/GII Adenovirus 40/41 | Campylobacter C. difficile (toxinas A/B) Salmonella Y. enterocolitica Vibrio spp. E. coli: ETEC, ECTS (stx1 y stx2), E. coli 0157, ECEI/Shigella | Cryptosporidium E. histolytica G. lamblia |
| Verigene (Luminex) | Rotavirus A Norovirus GI/GII | Campylobacter Salmonella Y. enterocolitica Vibrio spp. E. coli: ECTS (stx1 y stx2), ECEI/Shigella | |
| Seeplex (Seegene) | Panel 1 Norovirus GI Norovirus GII Rotavirus Adenovirus Astrovirus Sapovirus | Panel 2 Salmonella spp. ECEI/Shigella spp. Vibrio spp. Campylobacter spp. C. difficile Toxina B Y. enterocolitica Aeromonas spp. Panel 3 C. difficile hypervirulent E. coli: E. coli O157:H7, ECEH (stx1/2), ECEP (eaeA), ECET (It/st), ECEA (aggR) | Panel 4 G. lamblia E. histolytica Cryptosporidium spp. Blastocystis hominis Dientamoeba fragilis C. cayetanensis |
| RIDA®GENE (R-Biopharm) | Norovirus GI/GII Rotavirus | Campylobacter spp. Salmonella spp. Y. enterocolitica C. difficile (tcdA, tcdB) E. coli: ECEH, ECEP, ECET, ECEI/Shigella spp. | G. lamblia Cryptosporidium parvum, E. histolytica D. fragilis |
| Faecal pathogens A (AusDiagnostics) | Rotavirus A Norovirus G1/G2, Adenovirus F/G | Salmonella spp. Shigella spp. Campylobacter spp. C. difficile (toxina B) Y. enterocolitica Aeromonas hydrophila | G. lamblia Cryptosporidium D. fragilis, E. histolytica B. hominis |
| Enteric Pathogens [EP] Test (Nanosphere) | Norovirus, Rotavirus | Campylobacter spp. Salmonella spp. Shigella spp. ECTS (stx1/stx2) Vibrio spp. Y. enterocolitica |
Luminex xTAG GPP. Permite detectar bacterias, virus y parásitos. Aprobado por la FDA y con marcado CE, se pueden hacer 24 muestras en unas 5h en un proceso que incluye: pretratamiento, extracción de ácidos nucleicos, una PCR multiplex, hibridación en bolitas, y análisis de los datos. Esta técnica aumenta la tasa de positividad con respecto a los métodos convencionales, y permite detectar infecciones mixtas1,51,52.
FilmArray GI panel (bioMérieux). Permite detectar bacterias, parásitos y virus. Aprobado por la FDA y con marcado CE, consiste en un dispositivo cerrado que requiere mínima manipulación. El sistema realiza la extracción de los ácidos nucleicos, PCR multiplex nested, y análisis de temperaturas de fusión. La realización de la prueba junto con el análisis tarda unos 60min. Se detectan mayores tasas de positividad y un porcentaje importante de infecciones mixtas, más frecuentes en niños menores de 5 años o en pacientes no hospitalizados. Los patógenos más frecuentes en coinfección fueron Campylobacter y ECEP1,53.
Allplex™ Gastrointestinal Full Panel Assay (Seegene) es un sistema con 4 paneles que permite la detección de virus, bacterias y parásitos y está aprobado para su uso en Europa (marcado CE).
Existen más sistemas comerciales como Nanosphere Verigene (Luminex), Prodesse ProGastro SSCS (Hologic Gen-Probe), BD MAX enteric bacterial panel (BD), EntericBio real-time Gastro (Serosep), CLART EnteroBac y Enteric Pathogens [EP] Test (Nanosphere)1,2,50.
Análisis de ácidos orgánicos volátilesLos ácidos orgánicos volátiles son un amplio rango de compuestos químicos, estables, volátiles a temperatura ambiente y que se pueden detectar en el aliento, la orina, las heces y el sudor de pacientes54. Se ha demostrado su utilidad en el diagnóstico de diferentes enfermedades como diabetes, enfermedades gastrointestinales y hepáticas, enfermedades pulmonares, diferentes tipos de cáncer y en diferentes infecciones, como en infecciones gastrointestinales y en la infección por H. pylori55-57.
Se pueden detectar al menos 40 ácidos volátiles en muestras de heces en pacientes con gastroenteritis, independientemente de la enfermedad clínica, y se observan distintos marcadores según el tipo específico de patógeno54. En pacientes de Bangladesh con infección por Vibrio cholerae se observa menor cantidad de determinados compuestos volátiles que en las muestras de donantes sanos58. En un estudio realizado en 35 pacientes con diarrea infecciosa, comparado con 6 controles, se observa ausencia de hidrocarbonos y terpenos en los pacientes con infección con Campylobacter, y la ausencia de especies de furano sin índoles era indicativo de infecciones con C. difficile54.
En el análisis del aliento exhalado de pacientes infectados con H. pylori se observan 3 compuestos volátiles (isobutano, 2-butanona, y etil acetato) que no se detectaron en los controles54,59. Estos compuestos pueden ser producidos por H. pylori in vivo o ser metabolitos que el huésped produce como resultado de la infección. También se han descrito niveles elevados de cianuro de hidrógeno (HCN) y de nitrato de hidrógeno en el aliento exhalado de pacientes con gastritis por H. pylori comparado con controles sanos, pero el HCN no es especifico de H. pylori, ya que se puede detectar en muestras del aliento exhalado de pacientes infectados con Pseudomonas aeruginosa54.
ConclusionesLas técnicas rápidas son herramientas de gran valor en el diagnóstico de las infecciones gastrointestinales. Las que se basan en la detección de antígenos son ya práctica habitual en los laboratorios de microbiología clínica, y las que se basan en técnicas moleculares lo son también, aunque solo para algunos patógenos como C. difficile y E. coli productor de toxina Shiga. A la hora de elegir la técnica y la marca comercial a utilizar, deberemos considerar diferentes criterios, que incluirán: el patógeno o patógenos que queremos detectar, a qué tipo de pacientes está dirigido, el número de solicitudes que estimamos realizar, la disponibilidad de equipos en el departamento, además del coste de la técnica. Si vamos a realizar pocas pruebas lo más conveniente será utilizar técnicas individuales tipo EIA o ICT, mientras que si el número de pruebas es elevado será más conveniente la realización de pruebas tipo ELISA. Las técnicas moleculares que detectan diferentes patógenos de forma simultánea pueden ser de gran utilidad en determinados grupos de pacientes e irán adquiriendo cada vez más protagonismo por su alta sensibilidad y especificidad, y por su rapidez, aunque a mayor coste.
Conflicto de interesesT. A. C. ha recibido ayudas esporádicas para asistencia a congresos de Hain Lifesciencie, bioMerieux, Meridian.