La sífilis es una infección de transmisión sexual causada por Treponema pallidum subsp. pallidum, cuya incidencia está aumentando en España y en el resto del mundo. El diagnóstico se basa fundamentalmente en la serología, puesto que el diagnóstico directo mediante microscopía de campo oscuro presenta dificultades que limitan su generalización. Las técnicas de biología molecular pueden ser una herramienta útil para el diagnóstico en sífilis primaria y secundaria, si bien no todos los tipos de muestra se comportan igual. También son útiles para el diagnóstico de la sífilis congénita, mientras que para la neurosífilis, y debido a la baja sensibilidad de la reacción en cadena de la polimerasa en el líquido cefalorraquídeo, no se recomiendan. Estás técnicas se han empleado para estudiar el controvertido origen de la sífilis, y mediante el sistema mejorado de los Centers for Disease Control and Prevention para realizar la tipificación que ayude a comprender mejor la epidemiología. Por último, las técnicas moleculares permiten determinar la presencia de mutaciones relacionadas con resistencia a los macrólidos, presentes en un porcentaje muy elevado de las infecciones.
Syphilis is a sexually transmitted infection caused by Treponema pallidum subsp. pallidum with an increasing incidence in Spain and in the rest of the world. Diagnosis is based mainly on serology, since direct diagnosis by dark field microscopy presents difficulties that limit its widespread use. Molecular biology techniques can be a useful tool for diagnosis in primary and secondary syphilis, although not all types of samples show the same behaviour. These techniques are also useful for the diagnosis of congenital syphilis. They are not recommended, however, for neurosyphilis, due to the low sensitivity of polymerase chain reaction in cerebrospinal fluid. These techniques have been used to study the controversial origin of syphilis, and, through the enhanced Centers for Disease Control method, to perform typing, which helps to elucidate the epidemiology of this infection. Finally, molecular techniques can detect mutations related to macrolide resistance, which are present in a very high percentage of infections.
La sífilis es una infección sistémica producida por Treponema pallidum subsp. pallidum (TP) perteneciente a la familia Spirochaetaceae. Se denominan trepanomatosis no venéreas a las producidas por T. pallidum subsp. pertenue,Treponema carateum y T. pallidum subsp. endemicum, que causan el pián, pinta y el bejel o sífilis endémica, respectivamente. Todas ellas son morfológica y serológicamente indistinguibles entre sí, diferenciándose por la epidemiología, la clínica y mediante el empleo de técnicas de biología molecular.
TP se transmite por vía sexual (tanto vaginal como oral y anal) y por vía vertical. Las treponematosis no venéreas se transmiten generalmente durante la infancia en ambientes de pobreza mediante contacto cutáneo1, si bien se han descrito en Japón casos de bejel con transmisión entre hombres que tienen relaciones con hombres (HSH)2.
La sífilis es una infección que evoluciona en fases con diferentes manifestaciones clínicas, aunque la mitad de los pacientes afectados nunca desarrollarán signos ni síntomas, y en los que aparecen, pueden ser muy variados, especialmente en la sífilis secundaria, lo que le ha valido a esta enfermedad el apelativo de “la gran imitadora”. Sin tratamiento, la evolución es lenta, pero el desarrollo de lesiones inflamatorias crónicas granulomatosas (gomas), la afectación cardiovascular y la afectación del sistema nervioso central pueden condicionar graves manifestaciones clínicas muchos años después de la infección.
El diagnóstico también presenta dificultades, especialmente en pacientes asintomáticos, gestantes, recién nacidos y en las fases iniciales de la infección.
El principal método diagnóstico es la serología, debido a la facilidad para la obtención de la muestra y a la automatización actual, que permite realizar el cribado y que proporciona el diagnóstico en pacientes asintomáticos. Es una técnica que no proporciona un diagnóstico definitivo, solo presuntivo3, precisando el empleo combinado de tests treponémicos y no treponémicos para poder informar un resultado positivo. Como desventajas tiene un período ventana desde la aparición de los primeros signos (chancro), lo que condiciona su sensibilidad, presenta reacciones falsas positivas y, en ocasiones, es difícil establecer la fase y evolución de la enfermedad.
Las técnicas directas, que determinan la presencia de TP en las lesiones, proporcionan el diagnóstico definitivo; entre ellas están: a) la infectividad en conejo, que solo está al alcance de centros muy especializados, y aunque recientemente se ha conseguido el cultivo de TP in vitro durante más de 6 meses4, no son métodos aplicables a la rutina diaria; b) el examen microscópico, que precisa de equipamiento no disponible en todos los laboratorios (microscopio de campo oscuro), microscopista experto y con disponibilidad inmediata para la observación de las preparaciones, que no se puede demorar más allá de 30min desde la recogida de la muestra de las lesiones exudativas. La microscopía no es válida en muestras en las que puede haber treponemas saprófitos, como en la boca.
Las técnicas de biología molecular también proporcionan diagnóstico directo y solventan la mayoría de las limitaciones de la microscopía de campo oscuro, lo que unido a la comercialización de equipos para estas técnicas, suponen una alternativa diagnóstica aún poco explorada en muchos centros. Recientemente se ha publicado en esta revista una revisión de los aspectos generales referidos a la clínica, diagnóstico y tratamiento de la sífilis5, por lo que el objetivo de este artículo será profundizar en el papel de las técnicas de biología molecular en el estudio de TP, que ha permitido el progreso en el conocimiento de varios aspectos de la infección, como los relativos a su origen y diseminación de la enfermedad, la tipificación epidemiológica, el diagnóstico en la sífilis primaria y las implicaciones de la detección de la bacteriemia y la detección de resistencias a macrólidos.
2Orígenes de la sífilisUsando técnicas de captura de ADN y secuenciación masiva6, en 70 muestras de 12 países de los años 2012 y 2013 y de 1912 en adelante, encontraron un ancestro común en la era moderna. Aunque no resuelven la pregunta acerca de si el origen fue americano o europeo en el siglo xvi, este análisis indica que el contexto de diseminación de un linaje de proporciones pandémicas fue posterior a la colonización americana. Además, la aparición de resistencia a macrólidos también es moderna.
En realidad, la relación filogenética entre treponemas y su evolución histórica es controvertida. Se propuso que la pinta era la forma original que dio lugar al bejel y después a la sífilis endémica y finalmente a la sífilis7. Otro autor planteó que todas ellas eran la misma enfermedad con distintas manifestaciones clínicas8; en este sentido, se vio que había una falta de distinción molecular de estas subespecies9 y que las no sifilíticas (pián y endémica) eran de origen más temprano. El principal problema de estos estudios es que no se han realizado con métodos de secuenciación masiva10. Durante la primera fase evolutiva, las 3 subespecies se separaron y formaron ancestros tempranos, se calcula que hace 879 (sífilis) y 799 años (endémicas), respectivamente. En este estudio10, todas las subespecies muestran un ancestro común y tuvieron el mismo origen y la cepa de TP se originó en Norteamérica. La epidemia global de TP reciente se originó más temprano que las endémicas (hace 510 frente a 421 años), lo que apunta a una variación genética de conversión en los genes tprG y tprJ, sugiriendo que las cepas más tempranas de TP fueron de Norteamérica a Europa, y aquí dieron lugar a 2 linajes distintos10.
Otra aplicación de los métodos moleculares ha sido en la reconstrucción del origen y evolución de la enfermedad en los estudios arqueológicos11.
3EpidemiologíaLa sífilis es una infección cada vez más frecuente. Según estimaciones de la OMS, en el año 2016 hubo 6 millones de nuevos casos, con una tasa de 170 casos por 100.000 mujeres y 160 casos por 100.000 varones (entre 15 y 49 años)12.
En Europa, el European Centre for Disease Prevention and Control (ECDC), constata un incremento de la incidencia desde el año 2011. Así, en 2017 se declararon 33.189 casos confirmados, lo que representa una tasa de 7,1 casos por 100.000 habitantes (6,1 en 2016). Es 9 veces más frecuente en varones que en mujeres, con un pico en los varones de entre 25 y 34 años (tasa de 28 casos por 100.000). Esta tendencia ascendente en la incidencia se debe fundamentalmente al aumento de infecciones entre los varones, especialmente los HSH, que suponen el 67% de todos los casos declarados13.
En España, las tasas se fueron incrementando de forma paulatina desde el mínimo observado en el año 2001 (1,77 casos por 100.000 habitantes), hasta alcanzar una estabilización entre los años 2010 y 2016 (tasas de 7-8 casos por 100.000 habitantes), pero los últimos datos de 2017 con 4.941 casos notificados (tasa de 10,61 por 100.000 habitantes) suponen un importante retroceso en el control de esta enfermedad14.
Ya se ha señalado que la mayor parte de los casos de sífilis se encuentran en HSH, probablemente relacionado con factores de riesgo que se dan en parte de esta población, como un elevado número de contactos sexuales, que pueden ser anónimos mediante contacto en redes sociales o en clubes y saunas, y especialmente debido a relaciones sexuales desprotegidas15–17. El fenómeno del chemsex, en el que se consumen drogas para estimular y alargar los contactos sexuales, habitualmente en grupo, es otro factor de riesgo importante18, así como ser VIH positivo, y se encuentra un incremento del riesgo con el tratamiento antirretroviral, probablemente derivado de la disminución de percepción de riesgo y el menor uso de preservativos19. Para abordar el incremento en la incidencia de la sífilis con medidas basadas en la prevención, debemos ser capaces de identificar grupos nucleares, las dinámicas de transmisión, la relación con factores conductuales y otros factores epidemiológicos, y todo ello no se consigue sin un adecuado sistema de tipificación de TP.
4TipificaciónPuesto que a efectos prácticos TP no se puede cultivar, se debe recurrir a métodos moleculares para la identificación de cepas.
El genoma de TP contiene regiones polimórficas apropiadas para técnicas de tipificación. La más usada hasta ahora fue desarrollada en 1998 y mejorada en 2010 y se suele denominar como “método mejorado de los CDC (E-CDC)”20,21. Se basa en el análisis de 3 regiones diferentes: el número de repeticiones del gen arp(“acidic repeat protein gene”), el patrón obtenido mediante enzimas de restricción (Mse1) de los genes tpr(“Treponema pallidum repeat gene”; tprE, tprG y tprJ) y la secuenciación de parte del gen tp0548. Otras modificaciones propuestas incluyen los genes tp0279 y tp0136, pero el método E-CDC es el más empleado, ya que ha demostrado estabilidad en las cepas después de pases sucesivos en conejo.
Mediante estas técnicas se han sugerido que las cepas 14a/a y 14d/f tienen el mayor grado de neuroinvasividad22, y que las cepas 14d/g y 8d/g podrían causar sífilis ocular23. Sin embargo, recientemente otros autores en Ámsterdam no hallaron relaciones entre los diferentes tipos encontrados y características demográficas o clínicas, siendo el tipo 14d/g el más frecuente (23%) en la población estudiada24.
También recientemente en Barcelona, Fernández-Naval et al25, mediante el sistema E-CDC consiguieron estudiar 62 cepas de origen genital, y obtuvieron 21 patrones diferentes, de los que el más frecuente fue el 14d/g (27,4%).
5Diagnóstico de laboratorioEl diagnóstico de la sífilis se ha realizado clásicamente mediante la detección directa por microscopía de campo oscuro y fundamentalmente por serología26.
Las técnicas de reacción en cadena de la polimerasa (PCR) se describieron por primera vez en 1990, y desde entonces han ido evolucionando en su formato y dianas27. A la PCR cualitativa inicial, le siguieron nested PCR, PCR a tiempo real (PCR TR) y, más recientemente, formatos multiplex. Las principales dianas descritas son los genes bmp, tpp47 y polA, la última de ellas es la más usada. El ADN de TP se ha encontrado en muestras de exudados de úlceras, líquido cefalorraquídeo (LCR), sangre, orina y diferentes tejidos, pero su principal utilidad es en úlceras y lesiones exudativas en pacientes con sífilis primaria y secundaria.
En un metaanálisis se vio que la sensibilidad de la PCR es del 78,4% en úlceras y chancros anales, mientras que la muestra de sangre presenta su mayor sensibilidad en casos de sífilis congénita, con un 83%, y de sífilis secundaria, con el 52,2%, por lo que según estos autores, la PCR sería útil para el diagnóstico en úlceras, especialmente cuando la serología es negativa y en situaciones de elevada prevalencia epidemiológica, aunque también afirman que serviría más para confirmar el diagnóstico que para excluirlo28.
Por el contrario, otros autores encuentran que en su experiencia, la PCR obtenida de chancros sugestivos de lesión sifilítica solo aporta un 3% de diagnósticos a los proporcionados por la serología, concluyendo que tiene un valor muy limitado, ya que la serología tiene un valor predictivo negativo del 99% en su estudio29.
La PCR TR determina la carga bacteriana, y esta varía en función del estadio y por la actividad de la infección, lo que puede tener importancia en predecir la actividad de la enfermedad, la respuesta al tratamiento e identificar a los pacientes con cura serológica30. Aunque en el caso de otras muestras como sangre total, en la sífilis secundaria puede ser positiva en algunos pacientes, no se aconseja para estos estadios fuera de la lesión de úlcera. En el caso de biopsias cutáneas, la sensibilidad varía entre el 39 y el 75%31,32. En un estudio que determinó la carga bacteriana de TP se vio que esta es heterogénea y alta en sífilis primaria, independientemente del sitio anatómico, reflejando la diferencia de duración de los chancros y su resolución; en el caso de la sífilis secundaria en sangre, se vio la alta dispersión de las concentraciones de bacterias y la baja o nula detección cuando permanece oculta en los nichos propios de la sífilis33.
Para muestras de tejidos en parafina y usando como diana el gen polA se ha visto buena sensibilidad de estas técnicas34. En otro estudio se usó con éxito también la técnica de FISH (hibridación fluorescente in situ)35. Puede ser útil para casos inciertos de tejidos como aspiración con aguja fina de nódulos linfáticos de pacientes con sífilis secundaria o latente36. Otra posibilidad es el diagnóstico de sífilis congénita mediante tejido de placenta37. En el caso de la neurolúes, los datos de una revisión de artículos encuentran una baja sensibilidad frente a la serología38.
En el momento actual, las principales guías de diagnóstico3,39,40 establecen que el papel de las PCR se limita a la detección de TP en las lesiones en las que se pueda sospechar de su existencia, especialmente si pudiesen existir treponemas saprófitos, como en la boca. Es válida para tejidos y humor acuoso, pero poco recomendable por su baja sensibilidad en sangre y en LCR. En pacientes VIH positivos con serologías de sífilis repetidamente negativas y sospecha clínica, la PCR de las lesiones también es de utilidad. En sífilis congénita, la positividad de PCR de TP en muestras de placenta, tejidos y exudativas del niño, típicamente de fosas nasales, proporcionan un diagnóstico definitivo.
El papel de las técnicas moleculares irá aumentando a medida que haya plataformas comerciales y automatizadas que complementen a la serología en el caso de la sífilis primaria y la detección de resistencias. La comercialización de técnicas en formato multiplex que proporciona el diagnóstico etiológico de los principales agentes responsables de las úlceras genitales (TP, virus herpes simplex, Chlamydia trachomatis productora de linfogranuloma venéreo, Haemophilus ducreyi) está permitiendo a los clínicos y al laboratorio disponer de técnicas moleculares para patógenos que hasta ahora eran de difícil diagnóstico, y probablemente permitirá la generalización del diagnóstico directo de la sífilis prescindiendo de la microscopía de campo oscuro, si bien la serología seguirá siendo una herramienta diagnóstica a la que seguiremos recurriendo.
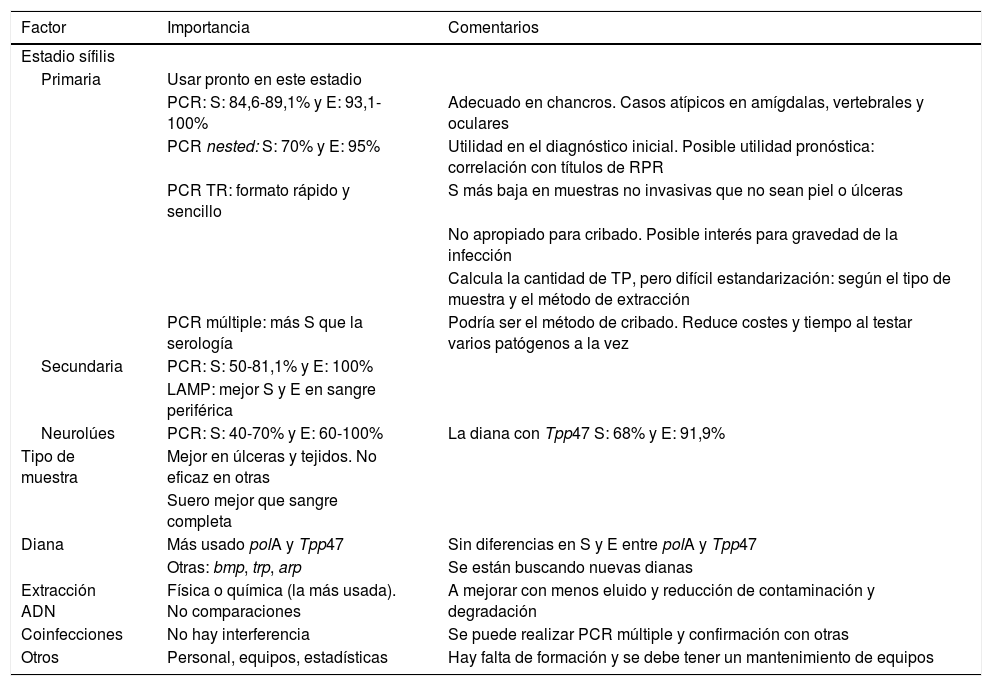
En la tabla 1 se expone de forma resumida las principales características de las diferentes PCR para TP.
Características de las diferentes PCR para el diagnóstico de Treponema pallidum
| Factor | Importancia | Comentarios |
|---|---|---|
| Estadio sífilis | ||
| Primaria | Usar pronto en este estadio | |
| PCR: S: 84,6-89,1% y E: 93,1-100% | Adecuado en chancros. Casos atípicos en amígdalas, vertebrales y oculares | |
| PCR nested: S: 70% y E: 95% | Utilidad en el diagnóstico inicial. Posible utilidad pronóstica: correlación con títulos de RPR | |
| PCR TR: formato rápido y sencillo | S más baja en muestras no invasivas que no sean piel o úlceras | |
| No apropiado para cribado. Posible interés para gravedad de la infección | ||
| Calcula la cantidad de TP, pero difícil estandarización: según el tipo de muestra y el método de extracción | ||
| PCR múltiple: más S que la serología | Podría ser el método de cribado. Reduce costes y tiempo al testar varios patógenos a la vez | |
| Secundaria | PCR: S: 50-81,1% y E: 100% | |
| LAMP: mejor S y E en sangre periférica | ||
| Neurolúes | PCR: S: 40-70% y E: 60-100% | La diana con Tpp47 S: 68% y E: 91,9% |
| Tipo de muestra | Mejor en úlceras y tejidos. No eficaz en otras | |
| Suero mejor que sangre completa | ||
| Diana | Más usado polA y Tpp47 | Sin diferencias en S y E entre polA y Tpp47 |
| Otras: bmp, trp, arp | Se están buscando nuevas dianas | |
| Extracción ADN | Física o química (la más usada). No comparaciones | A mejorar con menos eluido y reducción de contaminación y degradación |
| Coinfecciones | No hay interferencia | Se puede realizar PCR múltiple y confirmación con otras |
| Otros | Personal, equipos, estadísticas | Hay falta de formación y se debe tener un mantenimiento de equipos |
E: especificidad; LAMP: PCR isotérmica; PCR: reacción en cadena de la polimerasa; S: sensibilidad; TR: tiempo real.
Después del uso durante más de 70 años de penicilina, no se han encontrado resistencias, que hipotéticamente no se produciría por mutaciones simples, sino mediante la adquisición de información genética nueva mediante transferencia horizontal de genes o mediante un proceso de mutaciones múltiples. Se postula la lipoproteína Tp47 como eventual candidata a desarrollar una variante que confiera resistencia a la penicilina mediante su unión a la penicilina y su actividad betalactamasa41.
Los macrólidos no son una de las primeras opciones de tratamiento de la sífilis, pero ya han aparecido resistencias a eritromicina, azitromicina y espiramicina42. En 1977 se describieron resistencias a eritromicina con la cepa 14 Street; el mecanismo de estas resistencias es cromosómico con mutaciones A2058G y A2059G en el gen 23S ARNr. La primera de las mutaciones se describió en Estados Unidos, Canadá y China, mientras que la segunda lo fue en la República Checa, Colombia y Reino Unido43. Esta resistencia a macrólidos parece ir en aumento, aunque la frecuencia descrita puede ser muy variable entre series (el 0,7% en Taiwán y el 80% en Sidney), por lo que el tratamiento con macrólidos no se debería utilizar sin seguimiento, tal como recomiendan todas las guías30.
Las mutaciones pueden detectarse mediante amplificación de una secuencia específica del gen 23S rRNA y su posterior secuenciación, si bien se ha descrito una PCR TR que detecta las 2 mutaciones, permite la identificación rápida de estas resistencias y, por tanto, tendría interés en los casos en los que se tenga que recurrir a tratamientos con macrólidos44.
Las resistencias a tetraciclinas se buscan en las posiciones 965 y 1058 del gen 16S rRNA, y son muy poco frecuentes.
En Ámsterdam24 encontraron que un 88% de las cepas estudiadas presentaban mutaciones A2058G que confieren resistencia a macrólidos, si bien no encontraron ninguna mutación en la posición 2059.
En Barcelona25 se han encontrado mutaciones que confieren resistencia a macrólidos en el 95% de las cepas estudiadas, mientras que para tetraciclinas estaban ausentes.
Como conclusión final podemos señalar que las técnicas de diagnóstico molecular de la sífilis están experimentando importantes avances que nos van a permitir, no solo hacer diagnósticos directos de las lesiones que produce esta infección, sino también conocer con más detalle su epidemiología y poder hacer vigilancia de la aparición de resistencias antimicrobianas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.