Introducción
Las helmintiasis son las enfermedades producidas por vermes o gusanos. Aproximadamente, la cuarta parte de la población mundial, principalmente localizada en países tropicales y subtropicales, está infectada por uno o varios tipos de helmintos1. Aunque la mortalidad global por esta causa es baja, algunas como las filariasis linfáticas, la esquistosomiasis o la oncocercosis han sido señaladas por la Organización Mundial de la Salud (OMS) como importantes causas de morbilidad en países tropicales2.
Hasta hace unos años, en España, las helmintiasis no constituían un importante problema sanitario. Sólo algunas parasitosis como la toxocariasis, la estrongiloidosis o la hidatidosis presentaban por su prevalencia en algunas regiones españolas cierto interés médico3-5. Sin embargo, en los últimos años hemos asistido al incremento de las helmintiasis importadas por dos razones complementarias: la inmigración y el aumento de los viajes internacionales. Así, se ha constatado un aumento exponencial de la inmigración, pasando del 2,7% de la población española en el año 2000 al 7% en el año 2005 (Instituto Nacional de Estadística, padrón municipal)6. Un porcentaje importante de pacientes proceden del África Subsahariana y América Latina, donde las helmintiasis constituyen un verdadero problema sanitario. Diferentes estudios de grupos españoles observan en la población inmigrante subsahariana una prevalencia de geohelmintiasis del 23%, filariasis del 30% y esquistosomiasis del 15%7-9. La prevalencia de infección helmíntica en la población inmigrante latinoamericana es algo menor: helmintiasis intestinal 14% y filariasis 1%8. Además del fenómeno de la inmigración se ha incrementado el número de españoles (actualmente entre 700.000 y 1.000.000) que viajan cada año a países en vías de desarrollo, por motivos laborales, turísticos y de cooperación internacional10-11. Los datos de infección helmíntica en viajeros españoles no son tan bien conocidos. Un 2,5% de los viajeros que retornan de zonas endémicas pueden regresar con una infección por Schistosoma sp.9. Otras causas de helmintiasis ocasional en viajeros españoles son la larva cutánea migrans y la gnathostomosis12,13.
Aunque estas cifras demuestran una alta prevalencia de infección helmíntica, hay que tener en cuenta que dadas las características higiénico-sanitarias actuales en España (en el caso de las geohelmintiasis), la inexistencia de los vectores o reservorios (para las filariasis) y la ausencia de hospedadores intermediarios adecuados (en las esquistosomiasis) hacen muy difícil o imposible la transmisión a la población autóctona14. Por ello, el interés del diagnóstico, radica exclusivamente en la preservación de la salud de la población afectada.
El diagnóstico de estas enfermedades es complejo: el desconocimiento frecuente del modo de transmisión y ciclo biológico por los profesionales médicos que atienden a esta población, la falta de sensibilidad de los métodos parasitológicos clásicos, la ausencia de comercialización de tests eficaces de inmunodiagnóstico en muchos casos y el escaso desarrollo por ahora de métodos moleculares hacen que el diagnóstico sea dificultoso. En esta revisión se propone un esquema diagnóstico de helmintiasis importada contestando a 5 preguntas básicas, ¿cuándo sospechar una helmintiasis importada?, ¿qué utilidades y limitaciones presentan las técnicas de diagnóstico parasitológico clásico?, ¿son las técnicas serológicas útiles en el diagnóstico?, ¿pueden las técnicas de diagnóstico molecular en el futuro mejorar el rendimiento de las técnicas serológicas? y, finalmente, ¿cuáles son las estrategias más rentables en el cribado de una helmintiasis importada?
¿Cuándo sospechar una helmintiasis importada?
El diagnóstico de las enfermedades por helmintos es en ocasiones obvio tras la visualización directa del verme. Este es el caso de la loaiasis (causada por la filaria Loa-loa) que se diagnostica ocasionalmente al observar en un paciente procedente del África Occidental una filaria móvil en la conjuntiva ocular, o de la larva cutánea migrans (causada por Ancylostoma caninun o A. braziliensis) que se diagnostica al detectar una lesión cutánea serpinginosa de lenta progresión.
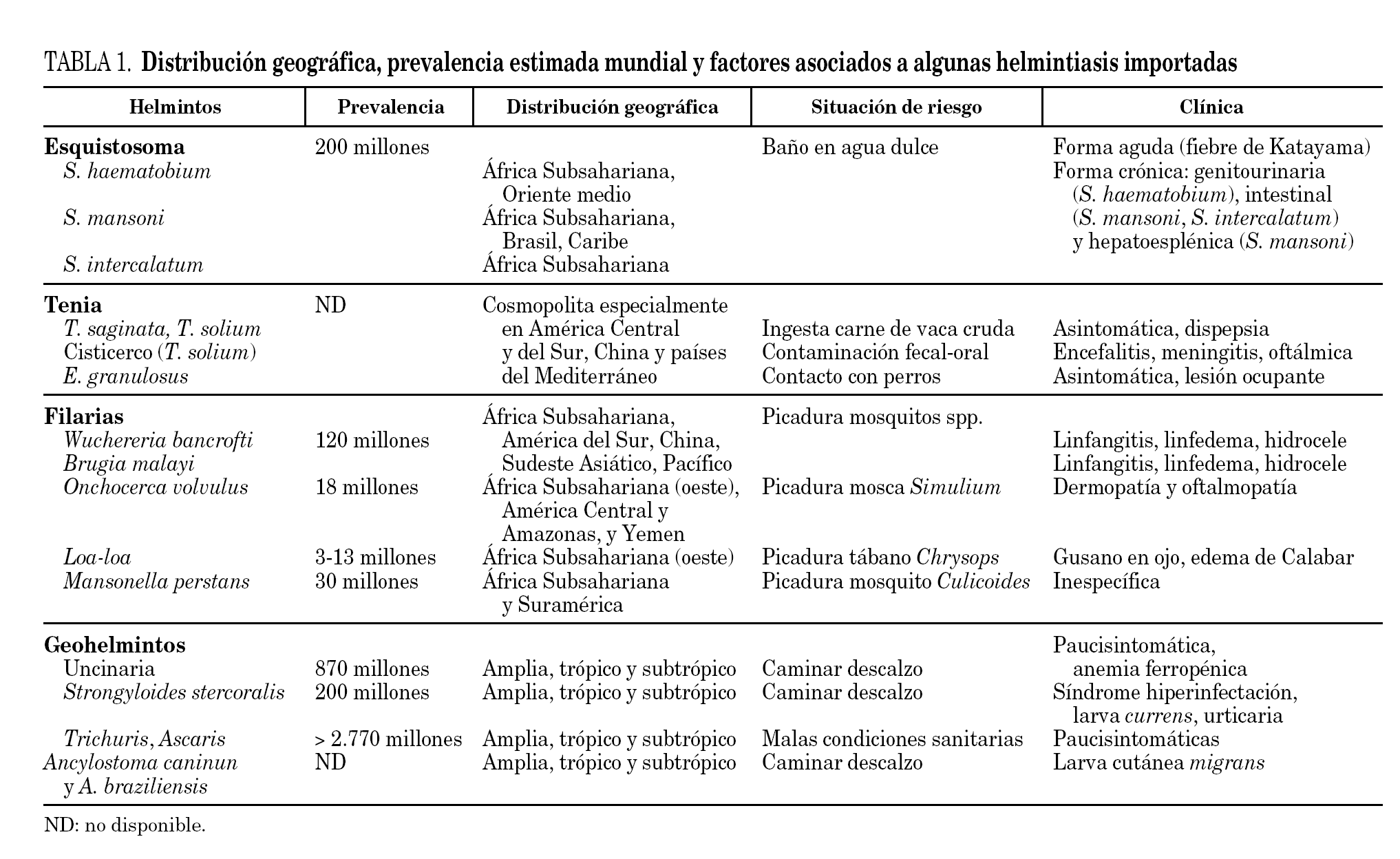
Sin embargo, en la mayoría de las ocasiones el diagnóstico no será tan evidente y se deberá establecer un diagnóstico de sospecha en función de la procedencia geográfica, las características epidemiológicas establecidas en la anamnesis (tipo de paciente y actividades de riesgo), las manifestaciones clínicas y las alteraciones en las pruebas complementarias (tabla 1).
Algunas helmintiasis tienen una amplia distribución geográfica (p. ej., las geohelmintiasis, las uncinariasis o la estrongiloidosis), mientras otras tienen una distribución geográfica más limitada (p. ej., la loaiasis que se distribuye exclusivamente en África Subsahariana Occidental o la infección por Opistorchis o Clonorchis de distribución exclusiva en el continente asiático). Otro aspecto que hay que tener en cuenta es que no todas las helmintiasis son igualmente frecuentes en una determinada zona de procedencia. Así, la infección por geohelmintos puede estar presente en el 15% de los inmigrantes procedentes de América Latina, mientras que sólo aparece en 1% o menos, de estos mismos inmigrantes8.
La frecuencia de helmintiasis importada también depende del tipo de paciente (viajero-inmigrante) y de las actividades de riesgo. Así, en viajeros, la larva cutánea migrans es una helmintiasis muy común mientras que los inmigrantes no suelen presentar esta manifestación clínica. En viajeros, es especialmente necesario conocer las actividades de riesgo, ya que algunas se asocian a helmintiasis concretas. Así, por ejemplo, el baño en agua dulce de zona endémica es una actividad reconocida para la infección por Schistosoma sp. o el caminar descalzo puede asociarse a infección por uncinarias o estrongiloidosis.
Una vez considerados los aspectos epidemiológicos es muy importante considerar aspectos clínicos asociados con la helmintiasis. La presencia de algunos datos clínicos es altamente sugerente de determinadas helmintiasis (tabla 1). La realización de una exploración física detallada es obligada en la valoración clínica inicial de cualquier paciente y permite excluir multiples patologías, aunque rara vez orienta el diagnóstico final de una helmintiasis15. Ocasionalmente podemos detectar alteraciones analíticas sugerentes de infección helmíntica importada. Así la aparición de microhematuria (en inmigrantes y viajeros procedentes del África Subsahariana, Egipto y Oriente Medio) se asocia frecuentemente al diagnóstico final de esquistosomiasis urinaria16. La elevación de la creatinfosfocinasa (CPK) se puede asociar a un diagnóstico final de triquinosis, si bien hay que tener en cuenta que los individuos de raza negra tienen valores superiores que los caucasianos17. Sin embargo, la eosinofilia es el dato analítico más frecuentemente asociado a helmintiasis importada. Al final de este texto nos referiremos más exhaustivamente al valor de la eosinofilia como marcador de infección helmíntica.
¿Cuáles son las ventajas y limitaciones que presentan las técnicas parasitológicas clásicas en el diagnóstico de las helmintiasis importadas?
En principio, las técnicas parasitológicas clásicas están al alcance de cualquier laboratorio, son fáciles y baratas. Permiten un diagnóstico específico de género y frecuentemente de especie, y una cuantificación de la intensidad de la infección que, en algunos casos, se ha correlacionado con la gravedad de las lesiones. Por el contrario son técnicas que consumen excesivo tiempo y que precisan experiencia por parte del observador. Además presentan una baja sensibilidad para el diagnóstico y en las fases agudas de la enfermedad no es posible el mismo. El tipo de muestra que hay que recoger depende de la helmintiasis y de la fase del ciclo parasitario.
La coprología se basa en la detección de huevos, larvas (sólo Strongyloides stercoralis y uncinarias) o adultos en las heces. Es una prueba útil en el diagnóstico de helmintos intestinales (Ascaris sp., Trichuris sp., uncinarias, Strongyloides sp., Schistosoma mansoni, tenias y otros) y biliares (Fasciola sp., Opistorchis sp., Clonorchis sp.) en fase patente de la enfermedad. Dado que la eliminación de huevos y larvas es intermitente y a menudo escasa es necesario la recogida de una muestra en 3 días diferentes antes de considerar un diagnóstico como negativo. Los métodos de concentración mejoran la sensibilidad de la inspección directa. El método más utilizado es la técnica de concentración con formol-éter o test de Ritchie. Aún en las mejores condiciones la sensibilidad de la técnica para la detección de algunos helmintos es baja. La recogida de jugo duodenal mediante aspirado o cápsula entérica (Enterotestì) puede aumentar la sensibilidad en el diagnóstico de S. stercoralis18 aunque son técnicas caras y molestas para el paciente. Los test de concentración basados en la capacidad de migración de las larvas rabditiformes de Strongyloides sp. en medio líquido (Baerman o Harada) o sólido (placa de agar) aumentan la sensibilidad diagnóstica hasta el 95%19.
El tamaño y fragilidad de los huevos de Schistosoma sp. y Fasciola sp. obliga a realizar técnicas de sedimentación como el Kato Katz para el diagnóstico de ambas trematodosis20,21. Sin embargo, la sensibilidad de esta técnica es baja. En pacientes con alta sospecha de esquistosomiasis intestinal la realización de biopsia rectal aumenta la rentabilidad diagnóstica del 57 al 100%22.
El estudio parasitario de orina permite la detección de huevos de Schistosoma haematobium en fase crónica de la enfermedad. Ocasionalmente puede detectarse microfilarias linfáticas. Las técnicas de concentración utilizadas son las de centrifugación y las de filtración con nailon de 3-20 µm23,24. La realización de biopsia vesical en pacientes con alto grado de sospecha de esquistosomiasis urinaria aumenta la sensibilidad diagnóstica de un 4 al 100%25.
El examen de sangre es la técnica de elección para la detección de la mayoría de las filariasis importadas. Aunque se pueden detectar en un test de gota gruesa en situaciones de alta parasitemia, es preciso en general utilizar métodos de concentración o de filtración. El método de concentración más empleado es el test de Knott. Además de éste, se han empleado los de filtración con membrana de nucleopore de 5 µm. Sin embargo, con esta técnica no es posible detectar microfilarias de Mansonella perstans ni M. ozzardi por su pequeño diámetro, debiendo utilizar filtros de 3 µm26. Hay que reseñar que teniendo en cuenta la periodicidad de liberación de microfilarias a la circulación sistémica, en la infección por Wuchereria bancrofti o Brugia malayi la muestra debe tomarse en período nocturno, mientras que para el diagnóstico de Loa-loa debe realizarse en período diurno. Este hecho asociado a la existencia de un porcentaje importante de pacientes infectados amicrofilarémicos hace que las técnicas de detección de microfilarias sean poco sensibles especialmente en pacientes con baja parasitemia.
Para el diagnóstico de filariasis cutánea (Onchocerca volvulus y Mansonella streptocerca) la técnica que hay que emplear es el pellizco cutáneo. Las regiones de mayor sensibilidad para la realización de esta técnica son las crestas ilíacas para pacientes procedentes de África y en región subescapular en los procedentes de América del Sur27,28. En ocasiones, en pacientes con nódulos cutáneos fijos o móviles se puede realizar una biopsia más profunda para detectar fases adultas de Onchocerca.
¿Qué utilidades y limitaciones presentan las técnicas serológicas en el diagnóstico de estas infecciones?
Los parásitos vivos producen y excretan múltiples compuestos proteicos en las diferentes fases del ciclo parasitario. Las técnicas de inmunodiagnóstico se basan en la detección de estas proteínas parasitarias o de anticuerpos formados frente a ellas. En general son técnicas más sensibles que las parasitológicas clásicas y son de especial utilidad para el diagnóstico de helmintiasis tisulares.
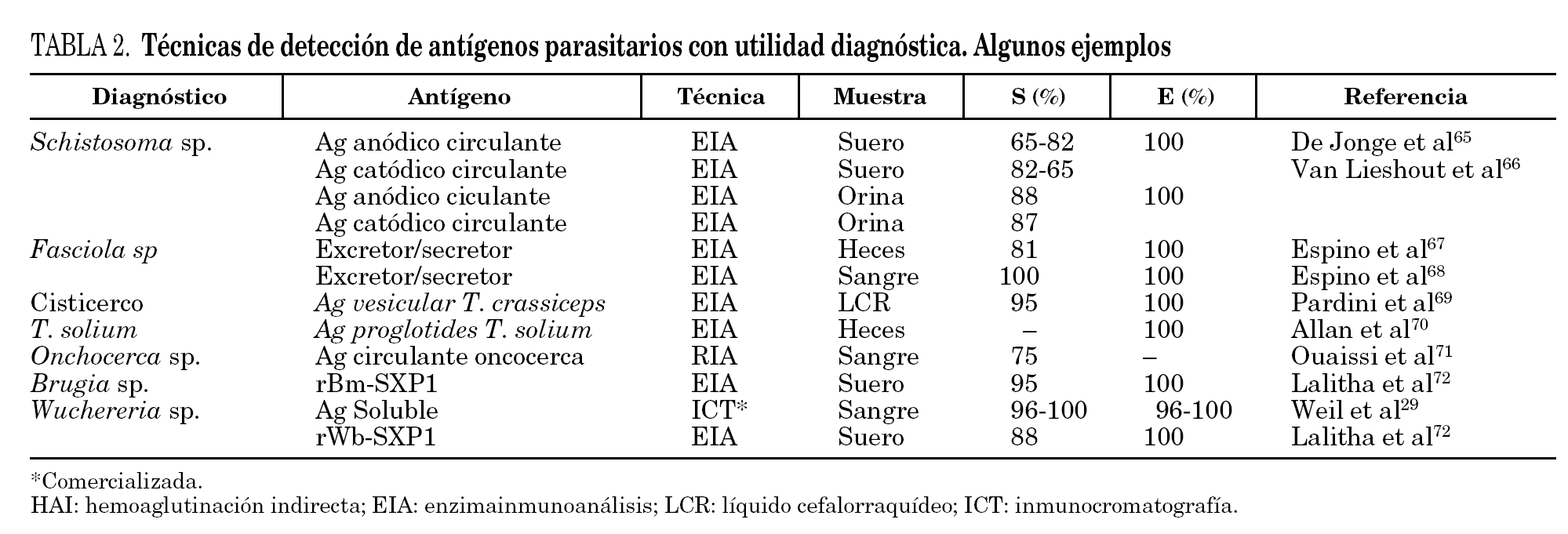
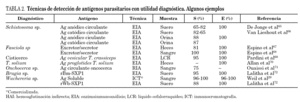
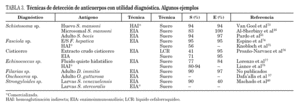
Para la detección de antígenos parasitarios se pueden utilizar diferentes tests inmunes aunque el sándwich-enzimoinmunoensayo (EIA) y la inmunocromatografía (ICT) han sido las más utilizadas. La ICT tiene la ventaja inicial de no necesitar un laboratorio para su realización, permitiendo una fácil lectura en pocos minutos, estando especialmente indicada para el diagnóstico de campo29. Las técnicas de inmunodiagnóstico de detección de antígenos circulantes permiten diferenciar infección activa de infección pasada, y son útiles en el control postratamiento30-33. Se ha correlacionado con la intensidad de la infección, morbilidad y gravedad34,35. Su principal inconveniente es que, con algunas excepciones como el ICT® filariasis test, comercializada para el diagnóstico de W. bancrofti, sólo están disponibles en laboratorios especializados y precisan en general del desarrollo y producción de metodología de anticuerpos monoclonales. Algunas de las técnicas más desarrolladas en el diagnóstico de helmintiasis importadas se muestran en la tabla 2.
Las pruebas de detección de anticuerpos permiten realizar un diagnóstico precoz de la enfermedad (en la fase prepatente), tienen una sensibilidad alta, permitiendo el diagnóstico de casos no detectados por técnicas parasitológicas convencionales, demostrándose especialmente útiles en las helmintiasis tisulares. Una excepción a esto lo constituye el diagnóstico de las metacestodosis en las que dada la baja sensibilidad de los métodos de serológicos, los métodos de diagnóstico radiológico siguen siendo los más rentables.
La limitación fundamental supone el no poder diferenciar infección actual de pasada, dado que los anticuerpos se pueden mantener a títulos altos durante meses e incluso años. Además presentan como problema importante una limitada especificidad, por la reactividad cruzada entre las diferentes helmintiasis.
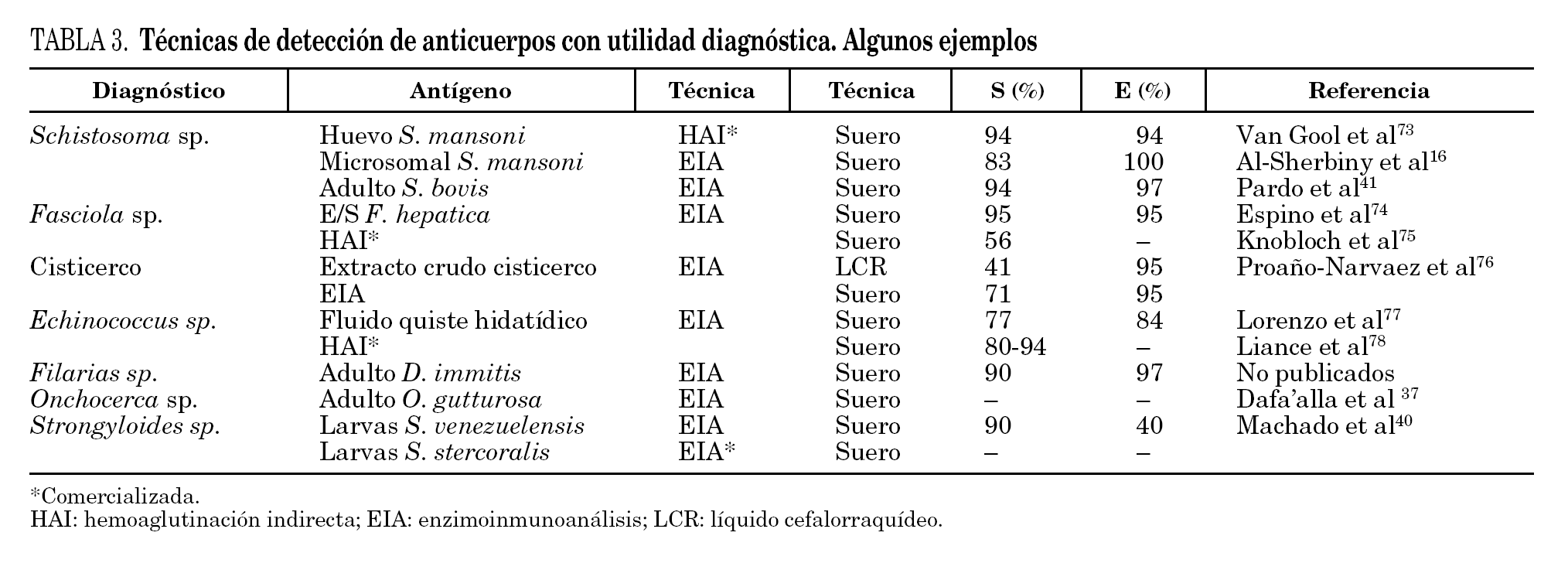
Aunque se han empleado diferentes métodos para la detección de anticuerpos (hemaglutinación indirecta, inmunofluorescencia indirecta, radioinmunoensayo, etc.) el análisis inmunoenzimático (ELISA) ha sido una de las técnicas más desarrolladas. En la realización del ELISA se han utilizado antígenos homólogos (completos y purificados) de cada especie de helmintos. Algunos de los más frecuentemente empleados en el inmunodiagnóstico de las helmintiasis importadas se muestran en la tabla 3. Estos antígenos presentan una alta sensibilidad diagnóstica y aceptable especificidad. El principal inconveniente es la dificultad técnica de mantener ciclos eficaces para la obtención de proteínas parasitarias.
El empleo de antígenos heterólogos para el inmunodiagnóstico de estas helmintiasis ha sido validado en diferentes estudios. Así, el antígeno de Dirofilaria immitis se ha utilizado para el diagnóstico de filariasis tropical36, el antígeno de Onchocerca gutturosa para el diagnóstico de oncocercosis humana37, el antígeno de Strongyloides ratti y S. venezuelensis para el diagnóstico de estrongiloidosis humana38-40, o recientemente el antígeno de Schistosoma bovis para el diagnóstico de esquistosomiasis humana41.
Se han descrito antígenos recombinantes con utilidad diagnóstica para la mayor parte de helmintos tisulares (p. ej., proteínas de fusión de S. mansoni Sm31 y Sm3242, catepsinas de Fasciola hepatica43, proteína Ov20/OvS1 de O. volvulus44 y Ll-SXP-1 de Loa-loa45, Ag B8/1 de Echinococcus granulosus46). Estas pruebas presentan la ventaja inicial de poder producir proteínas sin necesidad de mantener el ciclo artificialmente. Además presentan una alta especificidad, pero la sensibilidad es en general algo más baja que los test serológicos con antígenos nativos complejos y purificados.
Con algunas excepciones, la mayor parte de los tests de inmunodiagnóstico desarrollados para las helmintiasis importadas no han sido comercializados y sólo siguen disponibles en laboratorios especializados.
¿Pueden las técnicas de diagnóstico molecular en el futuro mejorar el rendimiento diagnóstico de estas infecciones?
El empleo de técnicas de biología molecular para el diagnóstico de helmintiasis ha sido la última incorporación al arsenal de métodos de diagnóstico microbiológico. La descripción del genoma no completo de algunas filariasis tropicales y de S. mansoni47 han conducido a la aplicación de estas técnicas en el diagnóstico de estas helmintiasis. La reacción en cadena de la polimerasa (PCR) presenta en principio la ventaja de una alta sensibilidad y especificidad. Así la amplificación de regiones repetidas, como la 15r3 de Loa-loa o la región SspI de W. bancrofti, además de presentar una alta sensibilidad (95 y 88%, respectivamente) tienen una especificidad del 100%48-50. Resultados similares se han detectado con otras filariasis51. La utilidad diagnóstica de la PCR ha sido demostrada también para el diagnóstico de filariasis cutáneas con sensibilidad del 90% en el diagnóstico de O. volvulus52,53.
En un trabajo reciente de Pontes et al, amplificando por PCR una secuencia de 121 pb de S. mansoni en suero y heces, se demostró una alta sensibilidad y especificidad para el diagnóstico de esta infección54,55. Recientemente Sandoval et al amplificando secuencias comunes a partir de la región 28S de S. haematobium, S. mansoni y S. intercalatum, en muestras de orina, han podido realizar el diagnóstico de las 3 especies de esquistosomiasis importada con alta sensibilidad y especificidad56. Estos mismos autores en un modelo de infección experimental con S. mansoni detectaron ADN en orina en la primera semana de la infección, mucho antes de la aparición de huevos en heces, pudiendo constituir una herramienta eficaz en el diagnóstico de la esquistosomiasis aguda57.
Otra aplicación reciente ha sido la realización de PCR para el diagnóstico diferencial entre infección parasitaria por Taenia solium, T. saginata y T. saginata asiatica dada la imposibilidad de diferenciar los huevos de éstas, con técnicas de diagnóstico directo58,59.
En los últimos años, la aplicación de la biotecnología ha traído consigo el diseño de sondas de ADN fijadas en un medio sólido (o arrays de ADN) sobre las cuales se realiza la hibridación. Esta tecnología se ha aplicado al campo de la microbiología en la epidemiología molecular, la patogenia y el diagnóstico. La ventaja potencial en el diagnóstico de los arrays es la posibilidad de detectar mediante multitud de sondas un gran número de microorganismos diferentes, al mismo tiempo que conocer factores de virulencia y de resistencia a antimicrobianos. La principal desventaja radica en la baja sensibilidad que exige realizar la amplificación genética previa60. De momento no existen trabajos publicados del rendimiento de los arrays en el diagnóstico de helmintiasis.
¿Qué estrategias deben utilizarse en la actualidad en el cribado diagnóstico de helmintiasis importadas?
El diagnóstico de sospecha clínica de una helmintiasis importada debe conducir a la realización de tests dirigidos a su diagnóstico. Sin embargo, como hemos señalado anteriormente un alto porcentaje de pacientes que las presentan están asintomáticos o presentan sintomatología inespecífica (fatiga, prurito, lesiones cutáneas, etc.). Hay que añadir además que algunas (especialmente las tisulares y la infección por S. stercoralis) pueden con el tiempo producir graves complicaciones. Realizar un cribado sistemático en todos los pacientes paucisintomáticos o asintomáticos que retornan del trópico puede consumir excesivo tiempo y dinero. Algunos autores abogan por la realización de métodos de diagnóstico parasitológico directos e indirectos, especialmente, en el colectivo de pacientes que presentan eosinofilia teniendo en cuenta el alto valor predictivo negativo para estas enfermedades (85-98%)36,61,62.
Se han establecido diferentes estrategias diagnósticas en función del tipo de paciente (viajero, expatriado, inmigrante) y la procedencia de los mismos. Las técnicas que presentan mejores rendimientos diagnósticos en pacientes procedentes del sudeste asiático son la coprología (incluida cultivo de larvas de S. stercoralis en placa de agar) y la serología de Strongyloides sp.63. En pacientes latinoamericanos es posible que el esquema no varíe del presentado en pacientes asiáticos. En pacientes procedentes del África Subsahariana a estas técnicas se deben añadir la detección de parásitos en orina, la serología para Schistosoma sp. En el subgrupo de pacientes procedentes del África del Oeste a éstas se deben añadir técnicas de diagnóstico de filariasis (test de Knott, pellizco cutáneo y serología)62-64.
Conclusiones
El nuevo escenario epidemiológico en España ha traído consigo un interés creciente en el diagnóstico de las helmintiasis importadas. Los test parasitológicos clásicos son de gran utilidad en la valoración diagnóstica inicial pero presentan como principal limitación una baja sensibilidad en fase aguda de enfermedad o en pacientes con baja intensidad de parasitación. Las técnicas serológicas mejoran la sensibilidad en estos grupos de pacientes, aunque presentan como inconveniente la existencia de reacciones cruzadas y la falta de comercialización. Las técnicas de diagnóstico molecular basadas en PCR están en desarrollo, aunque los resultados preliminares son muy prometedores. Finalmente, es necesario validar estrategias de cribado sistemático para grupos concretos de sujetos asintomáticos recién llegados.
Correspondencia:
Dr. J. Pardo.
Unidad de Enfermedades Infecciosas. Hospital Universitario de Salamanca.
P.º San Vicente, s/n. 37007 Salamanca. España.
Correo electrónico: javipard2@mixmail.com
Manuscrito recibido el 24-1-2006; aceptado el 12-2-2006.