Introducción
El efavirenz y la nevirapina son fármacos inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINN) ampliamente empleados en el tratamiento de la infección por el virus de la inmunodeficiencia humana (VIH) en combinación con otros antirretrovirales, principalmente análogos de nucleósidos (ITIAN). Ambos fármacos se metabolizan en el hígado vía sistema citocromo P-450 y pueden presentar interacciones clínicas con otros fármacos que son sustratos, inductores o inhibidores de este sistema enzimático. En estudios previos se ha observado relación entre las concentraciones plasmáticas de efavirenz y la evolución virológica y el desarrollo de toxicidad sobre el SNC 1-3. En el caso de la nevirapina, se ha observado que valores plasmáticos elevados de fármaco estaban relacionados con una respuesta virológica favorable 4. El objetivo de este estudio fue determinar las concentraciones plasmáticas de efavirenz y de nevirapina en pacientes con coagulopatías congénitas e infección por el VIH y analizar los factores que influyen en ellos.
Métodos
Se evaluaron los pacientes con coagulopatías congénitas e infección por el VIH controlados en los Hospitales Vall d'Hebron y Germans Trias i Pujol de Barcelona que recibían tratamiento con efavirenz o con nevirapina en combinación con otros antirretrovirales. Todos los pacientes se habían coinfectado con el virus de la hepatitis C (VHC). Los pacientes se reclutaron entre junio de 2001 y mayo de 2002 y el estudio finalizó en marzo de 2003. Los valores de efavirenz o de nevirapina se determinaron junto con la carga viral del VIH y el recuento de linfocitos CD4, a intervalos de 4 meses, coincidiendo con la analítica de rutina (hematología y bioquímica). Ambos fármacos se determinaron por cromatografía líquida de alta resolución en fase reversa y con par iónico en dos técnicas diferentes validadas en nuestro laboratorio 5,6.
Los análisis estadísticos se realizaron con el programa SPSS para Windows versión 8.0 (SPSS Inc., Chicago, Illinois, EE.UU.).
Resultados
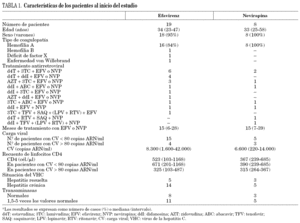
En la tabla 1 se indican las características de los pacientes en el momento de la primera determinación de los valores plasmáticos de ITINN. Se incluyeron 19 pacientes en tratamiento con efavirenz y 8 pacientes en tratamiento con nevirapina y el seguimiento medio del estudio fue de 12 meses.
Efavirenz
Al inicio del estudio 15 pacientes presentaban una carga viral del VIH indetectable (< 80 copias ARN/ml) y 4 casos, que habían presentado fracasos a tratamientos antirretrovirales previos y tenían resistencia parcial o total a varios fármacos, tenían carga viral basal superior a 80 copias ARN/ml. Todos los pacientes recibían una dosis de efavirenz de 600 mg diarios y todos presentaban buena adherencia al tratamiento antirretroviral (> 95%), excepto uno que refería olvidos frecuentes de la medicación. Durante el período de seguimiento, los 15 pacientes con carga viral basal indetectable mantuvieron supresión viral y los 4 pacientes restantes mantuvieron una carga viral superior a 80 copias ARN/ml. No se desarrollaron infecciones oportunistas en ningún paciente y únicamente se observó como efecto adverso asociado al efavirenz insomnio en 1 paciente.
Se realizaron 68 determinaciones de concentraciones plasmáticas de efavirenz (media de 3,6 determinaciones por paciente). La concentración mediana fue 2,88 μg/ml (0,82-5,26 μg/ml), la variabilidad intrapaciente (coeficiente de variación) del 26% y la variabilidad interpaciente del 57%. Las muestras se extrajeron entre las 7 y las 12 h después de la administración del fármaco (mediana de 10 h posdosis). El tiempo de extracción de la muestra no influyó en las concentraciones plasmáticas de fármaco. No se detectó relación entre el peso y la concentración plasmática de efavirenz.
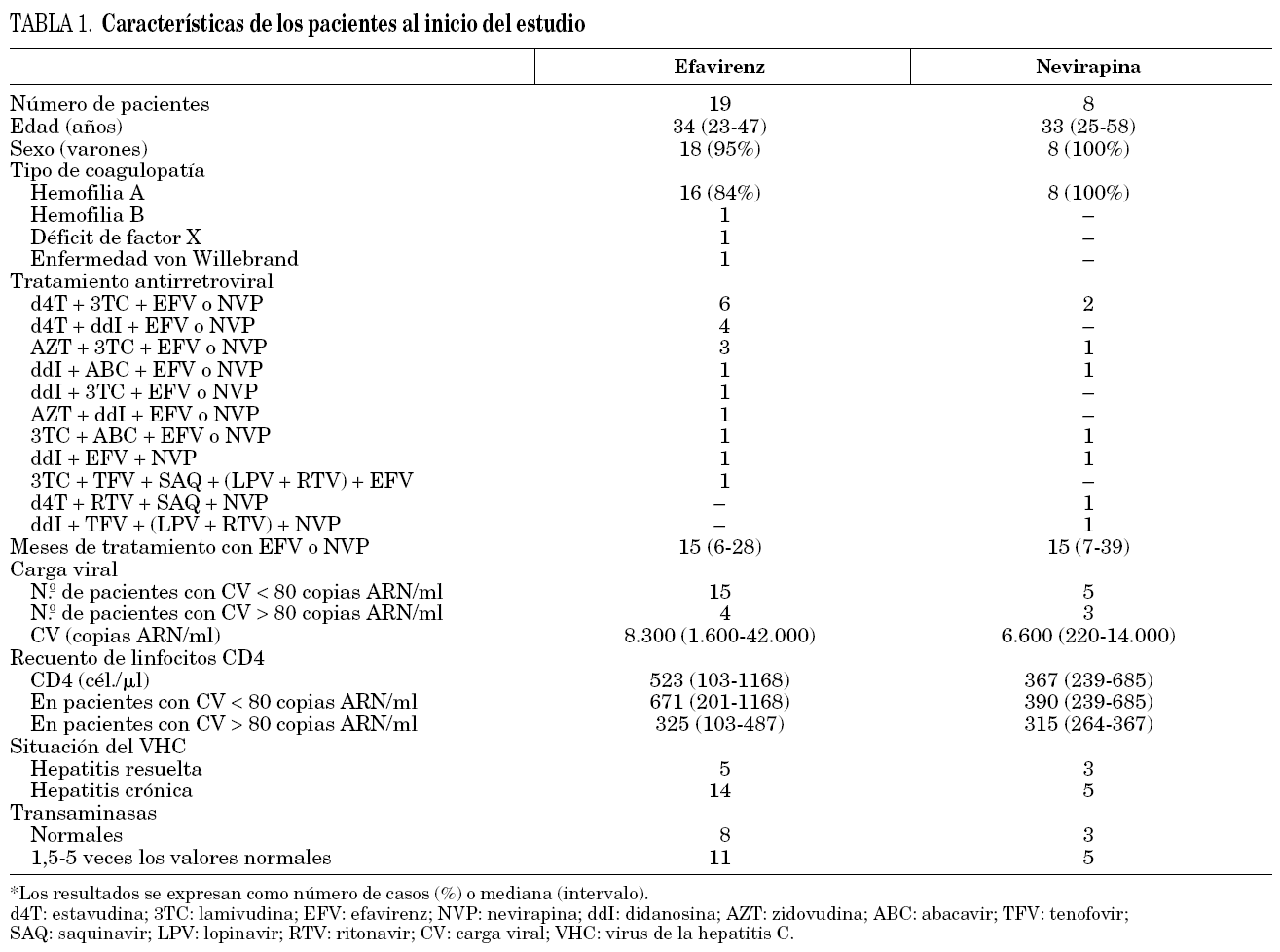
En los pacientes con carga viral indetectable la concentración mediana fue 2,95 μg/ml (intervalo 1,54-5,26 μg/ml) y en los pacientes con carga viral detectable 1,86 μg/ml (0,82-4,88 μg/ml) (p = 0,32). En todos los pacientes con supresión viral se obtuvieron concentraciones de efavirenz superiores a 1 μg/ml en todas las de determinaciones realizadas. En 2 pacientes con carga viral superior a 80 copias ARN/ml se detectaron valores inferiores a 1 μg/ml (uno presentaba mala adherencia al tratamiento y otro recibía tratamiento combinado con efavirenz y nevirapina). En 4 pacientes la concentración mediana de fármaco fue superior a 4 μg/ml y uno de ellos presentó insomnio. Los niveles fueron superiores en los pacientes con transaminasas elevadas respecto a los que tenían transaminasas normales (3,17 μg/ml [0,82-4,95 μg/ml] frente a 2,84 μg/ml [1,54-5,26 μg/ml]; p = NS). Igualmente, las concentraciones obtenidas en pacientes con infección crónica por el VHC fueron superiores a las de los pacientes que habían resuelto la infección (3,07 μg/ml [0,82-4,95 μg/ml] frente a 1,90 μg/ml [1,56-5,26 μg/ml]; p = NS). En estas comparaciones no se incluyó el paciente con mal cumplimiento del tratamiento (fig. 1).
Figura 1. Concentraciones medianas de efavirenz según la evolución virológica de los pacientes y según la situación respecto a la infección por el VHC.
Nevirapina
Cinco pacientes tenían una carga viral basal indetectable y tres una carga viral superior a 80 copias ARN/ml. Todos recibían 200 mg de nevirapina dos veces al día y cumplían correctamente el tratamiento. Durante el período de seguimiento 5 pacientes mostraron supresión viral permanente, un paciente negativizó la carga viral y dos mantuvieron la carga viral superior a 80 copias ARN/ml. No se observaron infecciones oportunistas ni efectos secundarios atribuibles a la nevirapina durante todo el estudio.
Las muestras para la determinación de concentraciones plasmáticas se extrajeron entre las 7 y 12 h posdosis (mediana de 10 h posdosis) y no se observó correlación entre el tiempo de extracción de la muestra y la concentración plasmática de fármaco. Se detectó correlación entre las concentraciones plasmáticas del nevirapina y el peso (r = 0,71; p = 0,05).
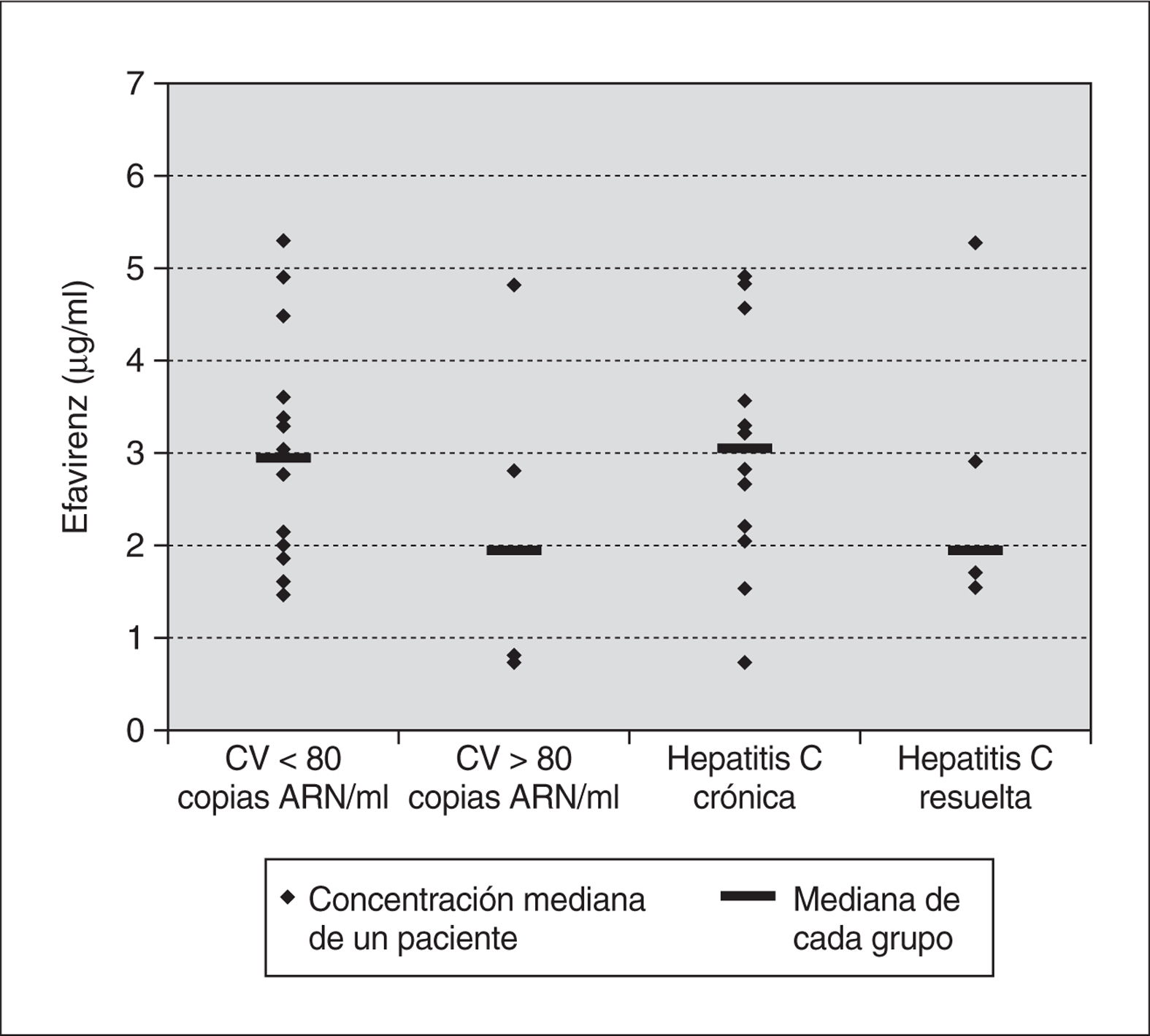
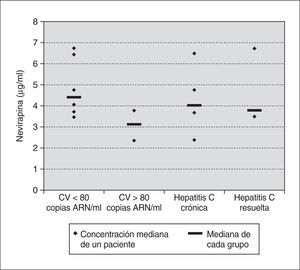
Se determinaron un total de 31 muestras de concentraciones de nevirapina (media de 3,9 determinaciones por paciente). La concentración mediana fue 3,91 μg/ml (2,44-6,72 μg/ml), la variabilidad intrapaciente fue del 23% y la variabilidad interpaciente del 37%. En los 6 pacientes con carga viral indetectable la concentración mediana fue 4,41 μg/ml (3,50-6,72 μg/ml) y en 2 pacientes con carga viral detectable de 3,12 μg/ml (2,44-3,80 μg/ml) (p = 0,18). Únicamente en un paciente, que recibía conjuntamente efavirenz y nevirapina, se detectaron concentraciones de nevirapina inferiores a 3 μg/ml. En 2 pacientes, en tratamiento con inhibidores del citocromo P-450 (sertralina y ritonavir más saquinavir, respectivamente), se obtuvieron concentraciones superiores a 6 μg/ml. Las concentraciones plasmáticas fueron algo superiores en los pacientes infectados por el VHC y transaminasas elevadas en comparación con los que habían resuelto la infección y tenían transaminasas normales, aunque la diferencia fue menor que en el caso del efavirenz (4,02 μg/ml [2,44-6,49 μg/ml] frente a 3,80 μg/ml [3,50-6,72 μg/ml]; p = NS) (fig. 2).
Figura 2. Concentraciones medianas de nevirapina según la evolución virológica de los pacientes y según la situación respecto a la infección por el VHC.
Discusión
Los resultados de nuestro estudio muestran una concentración mediana de efavirenz de 2,88 μg/ml y de nevirapina de 3,91 μg/ml, comparables a las obtenidas en otros estudios realizados en pacientes no hemofílicos infectados por el VIH 2,4. Las concentraciones plasmáticas fueron superiores en los pacientes con carga viral indetectable respecto a las obtenidas en pacientes con carga viral detectable, aunque con un solapamiento de los intervalos entre los dos grupos para ambos fármacos. En todos los pacientes con supresión virológica los valores de efavirenz fueron superiores a 1 mg/ml en todas las determinaciones realizadas, corroborando así el valor sugerido como la mínima concentración necesaria para proporcionar una supresión mantenida del VIH 1,2. En el caso de la nevirapina, en todos los pacientes con supresión virológica se obtuvieron valores superiores a 3 μg/ml.
Se observaron valores bajos de efavirenz (< 1 μg/ml) y de nevirapina (< 3 μg/ml) en un paciente que recibía tratamiento combinado con ambos fármacos, los cuales actúan como inductores del citocromo P-450. En un estudio farmacocinético previo se describió que la concentración mínima de efavirenz disminuía el 36% cuando este fármaco se empleaba conjuntamente con la nevirapina, aunque las concentraciones de nevirapina no se veían alteradas por la coadministración del efavirenz 7. Por otro lado, un paciente con una concentración de efavirenz de 5,26 μg/ml presentó insomnio. Marzolini et al 1 encontraron que la toxicidad sobre el SNC era tres veces superior en pacientes con valores plasmáticos de efavirenz superiores a 4 μg/ml en comparación con los pacientes con valores inferiores y Núñez et al 3, en un estudio realizado en pacientes con insomnio grave de más de 3 meses de duración, encontraron que las concentraciones plasmáticas iguales o superiores a 3,5 μg/ml eran significativamente más frecuentes en los pacientes con insomnio comparados con los controles.
Por último, se observaron valores superiores de fármaco en los pacientes con hepatopatía, aunque las diferencias no fueron significativas. En una cohorte de pacientes tratados con efavirenz, nelfinavir y estavudina se detectaron valores elevados de efavirenz y nelfinavir en 2 pacientes con diferentes grados de disfunción hepática y valores de transaminasas entre 3 y 4 veces los valores normales (concentraciones de efavirenz de 9,7 y 11,5 μg/ml, respectivamente) 8. Por el contrario, en un estudio en que se determinaban las concentraciones plasmáticas de nevirapina en 70 pacientes que recibían combinaciones triples con ITIAN se obtuvieron concentraciones similares en los pacientes con anticuerpos para el VHC y los pacientes negativos para este virus 9.
Los resultados obtenidos apuntan que la monitorización de los valores plasmáticos de ITINN podría tener utilidad cuando existen tratamientos concomitantes con otros fármacos con los cuales se pueden producir interacciones farmacocinéticas o en casos de hepatopatía.
Agradecimientos
Este estudio se ha realizado gracias a una beca de la "Fundació Privada Catalana de l'Hemofília".