Determinar la carga de trabajo y el coste para el laboratorio de microbiología así como el impacto en la flora microbiana y las tendencias de la resistencia bacteriana en el servicio de medicina intensiva (SMI) a partir de la introducción de la descontaminación digestiva selectiva.
MétodosSe cuantificó la carga de trabajo y el coste total de microbiología así como la parte imputada al servicio peticionario en el año anterior y posterior a la introducción del procedimiento. Se valoró el cambio en la flora microbiana y se analizaron las tendencias de resistencia bacteriana durante 12 años en 21 combinaciones centinela antimicrobiano/microorganismo.
ResultadosLa carga de trabajo imputada al SMI aumentó un 10% y el coste un 1,8% en el período posterior a la introducción del procedimiento (diferencias no significativas). El aumento de la carga de trabajo a costa de los cultivos de vigilancia epidemiológica se compensó con disminuciones significativas de broncoaspirados cuantitativos, hemocultivos, exudados, identificaciones y antibiogramas, y serología. El procedimiento se ha asociado a una disminución significativa de aislados de Acinetobacter y a un ascenso significativo de Enterococcus. Se han detectado 3 tendencias significativas de aumento de resistencia, las 3 en Pseudomonas aeruginosa (imipenem, tobramicina y ciprofloxacino).
ConclusionesEn este hospital, la implantación de este procedimiento no ha supuesto un aumento significativo de la carga de trabajo y el coste del laboratorio de microbiología, y se ha asociado a una marcada disminución de Acinetobacter y a un aumento de Enterococcus y de la resistencia a imipenem, tobramicina y ciprofloxacino en P. aeruginosa.
This study determines the workload and cost of implementing selective digestive decontamination in the microbiology laboratory, and reports the impact on microbial flora and bacterial resistance trends in the intensive care unit (ICU).
MethodsThe total microbiological workload and cost were quantified, as well as the part charged to the petitioning service, in the year before and the year after introducing the procedure. Changes in microbial flora were evaluated and bacterial resistance trends were analyzed over 12 years in 21 sentinel antimicrobial/microorganism combinations.
ResultsThe workload ascribed to the ICU increased by 10% and cost increased by 1.8% in the period after introduction of the procedure (non-significant differences). The increased workload resulting from epidemiological surveillance cultures was compensated by significant reductions in quantitative endotracheal aspirate cultures, blood cultures, exudate cultures, identification tests with antibiograms, and serologies. The procedure has been associated with a significant decrease in Acinetobacter isolates and a significant increase in Enterococcus. Three significant trends of increased resistance were detected, all of them in Pseudomonas aeruginosa (imipenem, tobramycin, and ciprofloxacin).
ConclusionsIn our hospital, implementation of selective digestive decontamination did not cause a significant increase in the workload or costs in the microbiology laboratory. Selective digestive decontamination was associated with a significant decrease in Acinetobacter, an increase in Enterococcus, and higher resistance to imipenem, tobramycin and ciprofloxacin in P. aeruginosa.
La implantación de modelos de gestión empresarial en los hospitales ha condicionado que la tendencia de los laboratorios a aumentar el número, la calidad y la rapidez de sus prestaciones se supedite a criterios de eficiencia y a la relación entre coste y efectividad1. Asimismo, el establecimiento progresivo de sistemas de pago por proceso obliga a conocer el coste real y la rentabilidad de cada producto.
La aplicación de nuevos procedimientos en las diferentes áreas y servicios de los hospitales implican continuos cambios en las solicitudes para los laboratorios clínicos, que deben alterar su organización interna en función de estas necesidades.
La descontaminación digestiva selectiva (DDS) es un procedimiento de prevención de la infección para pacientes críticos, introducido por Stoutenbeek et al en 19832, y cuyo propósito es eliminar los microorganismos aerobios potencialmente patógenos del tracto digestivo sin alterar la flora anaerobia3.
A pesar de que el procedimiento de DDS, que combina antibióticos no absorbibles con antibióticos parenterales, disminuye la incidencia de neumonía y la mortalidad en pacientes críticos4–6 y que la literatura médica le asigna un grado de evidencia i con un nivel de recomendación A (clasificación según criterios de la American Thoracic Society/Infectious Disease Society of America [ATS/IDSA])7, no es una medida ampliamente introducida en los servicios de medicina intensiva (SMI)8. Dos son las mayores objeciones a su utilización: escasos análisis de la relación entre coste y efectividad y posible selección de microorganismos resistentes8,9.
Los objetivos de este estudio son los siguientes: a) analizar la repercusión en la carga de trabajo y el coste en el laboratorio de microbiología de la implantación del procedimiento de DDS en el SMI; b) evaluar el impacto en la flora microbiana, y c) estudiar las tendencias de la resistencia bacteriana en el SMI.
Pacientes y métodosCaracterísticas del hospital y del servicio de medicina intensivaEl Hospital Santiago Apóstol de Vitoria es un hospital general público perteneciente a Osakidetza-Servicio Vasco de Salud, referencia para un área de 121.400 habitantes. Durante el período de 1996 a 2007 ha presentado una media de 260 camas instaladas y alrededor de 11.000 ingresos anuales. El SMI tiene 14 camas, con una media anual de 600 ingresos, y es unidad de referencia de Álava para pacientes neurocríticos. Las dos terceras partes de los pacientes críticos atendidos son medicoquirúrgicos.
Períodos de estudioPara analizar la repercusión de la carga de trabajo y el coste en el laboratorio de microbiología, se realizó un estudio retrospectivo observacional de las determinaciones imputables al SMI durante el año anterior (período pre-DDS, del 01-05-2001 al 30-04-2002) y durante el año posterior (período post-DDS, del 01-05-2002 al 30-04-2003) a la implantación de la técnica DDS. Se valoró el impacto en la flora microbiana aislada en las muestras procedentes del SMI en ambos períodos del estudio.
Se han analizado las tendencias de la resistencia bacteriana en 21 combinaciones centinela antimicrobiano/microorganismo procedentes del SMI desde 1996 (año en que se inauguró el servicio) hasta 2007, de acuerdo con las recomendaciones del National Nosocomial Infections Surveillance (NNIS)10. Estas combinaciones han incluido: a) Staphylococcus aureus resistente a meticilina; b) Staphylococcus negativo para la coagulasa resistente a meticilina; c) Enterococcus spp. resistente a vancomicina; d) Escherichia coli resistente a amoxicilina con ácido clavulánico, piperacilina con tazobactam, cefotaxima, ceftazidima, cefepima, gentamicina y ciprofloxacino; e) Klebsiella spp. resistente a cefotaxima y ceftazidima; f) Enterobacter spp. resistente a cefotaxima e imipenem; g) Acinetobacter spp. resistente a imipenem, y h) Pseudomonas aeruginosa resistente a piperacilina con tazobactam, ceftazidima, cefepima, imipenem, tobramicina y ciprofloxacino. Las pruebas de sensibilidad se realizaron por microdilución en placas de 96 pocillos a través del sistema automatizado Sensititre (TREK Diagnostic Systems Ltd, Inglaterra). Los puntos de corte utilizados por este sistema están en concordancia con los propuestos por el Clinical and Laboratory Standards Institute (CLSI) y vigentes durante el período de estudio. Las cepas con sensibilidad intermedia se consideraron resistentes. Para evitar duplicaciones, sólo se incluyeron los primeros aislados obtenidos de cada paciente11.
Técnica de descontaminación digestiva selectivaEl procedimiento de DDS se ha aplicado a pacientes en ventilación mecánica más de 48h y que requirieran sonda nasogástrica, y ha consistido en12:
- •
Aplicación cada 6h de 1g de pasta orofaríngea (cada gramo contiene un 2% de gentamicina, colistina y anfotericina B) y 10ml de solución DDS a través de la sonda nasogástrica (80mg de gentamicina, 100mg de colistina y 500mg de anfotericina B), y
- •
administración de 2g de ceftriaxona intravenosa en dosis única diaria durante los 3 primeros días de inicio de la técnica DDS.
Al ingreso del paciente y 2 veces por semana en días no consecutivos, se tomaron los siguientes cultivos de vigilancia epidemiológica (CVE): frotis faríngeo, frotis rectal, aspirado gástrico y broncoaspirado con técnica estéril de aspiración endotraqueal. Las muestras se sembraron en agar chocolate, agar sangre y agar MacConkey de forma cualitativa para obtener colonias aisladas. La identificación de los aislados bacterianos y los estudios de sensibilidad para identificar patrones de resistencia de especial relevancia clínica en cocos grampositivos (resistencia a meticilina y a glucopéptidos) y bacilos gramnegativos (detección de betalactamasas de espectro extendido y metalobetalactamasas) se realizaron de acuerdo con los procedimientos habituales.
Cálculo de la carga de trabajo y el coste de las pruebas microbiológicasA partir del sistema infórmatico del laboratorio se ha obtenido el total de determinaciones realizadas de cada uno de los procedimientos llevados a cabo en el laboratorio de microbiología y los derivados por éste a otros laboratorios de referencia.
Se calcularon los costes del laboratorio de microbiología suministrados por el departamento de administración y control del hospital a partir de lo siguiente:
- •
costes de personal (incluido personal facultativo, sanitario no facultativo y no sanitario);
- •
costes de material (incluido material sanitario y farmaceútico);
- •
costes estructurales;
- •
costes por utilización de otros servicios, y
- •
costes de amortización.
Posteriormente, se calculó el número total de unidades relativas de coste (URC) producidas en el laboratorio de microbiología mediante el Catálogo de Estudios de Microbiología de la Consellería de Sanitat de la Generalitat Valenciana13 durante el año anterior (período pre-DDS) y durante el año posterior a la aplicación de la DDS (período post-DDS), así como las imputables al SMI. El catálogo, basado en la contabilidad analítica, selecciona un procedimiento de referencia, en este caso el urocultivo, al que asigna el valor de 1 URC, y a partir de éste establece una escala que determina para cada procedimiento su coste en relación con el de referencia.
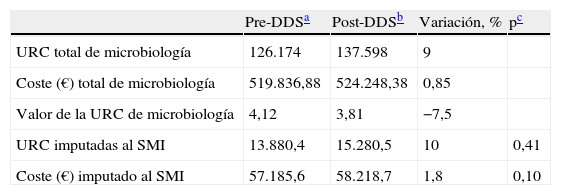
A partir del coste total del laboratorio de microbiología y al dividir entre el número total de URC producidas, se obtuvo el valor de la URC (tabla 1).
Carga de trabajo y coste de la microbiología imputada al servicio de medicina intensiva en los 2 períodos de estudio
| Pre-DDSa | Post-DDSb | Variación, % | pc | |
| URC total de microbiología | 126.174 | 137.598 | 9 | |
| Coste (€) total de microbiología | 519.836,88 | 524.248,38 | 0,85 | |
| Valor de la URC de microbiología | 4,12 | 3,81 | −7,5 | |
| URC imputadas al SMI | 13.880,4 | 15.280,5 | 10 | 0,41 |
| Coste (€) imputado al SMI | 57.185,6 | 58.218,7 | 1,8 | 0,10 |
DDS: descontaminación digestiva selectiva; SMI: servicio de medicina intensiva; URC: unidad relativa de coste.
Posteriormente, se procedió al cálculo de las URC producidas imputables al SMI y del coste de éstas en ambos períodos.
El siguiente paso consistió en la agrupación en 5 subgrupos de los 153 procedimientos que contempla el catálogo: a) muestras respiratorias, que incluyeron broncoaspirado, cepillado bronquial, lavado broncoalveolar, líquido pleural y esputo, y en el año post-DDS se añadieron los CVE; b) pruebas de identificación y antibiogramas; c) hemocultivos; d) líquidos y exudados, y e) serología. Posteriormente se ha calculado la carga de trabajo y el coste que ha supuesto cada uno de los subgrupos en ambos períodos con el fin de evaluar la variación en la distribución de la carga de trabajo y el coste.
Análisis estadísticoLa variación de la carga de trabajo y el coste imputables al SMI así como del número de microorganismos aislados de todas las muestras que remitió el SMI en ambos períodos del estudio se han analizado mediante la comparación de 2 proporciones (muestras independientes) con un intervalo de confianza (IC) del 95%. Para el análisis de la tendencia de resistencia a los antimicrobianos se ha utilizado un modelo de ajuste lineal de las series cronológicas de resistencia, se ha estudiado la significación estadística de los coeficientes de regresión lineal obtenidos (β o pendiente de la recta de ajuste) y se ha aportado en todos éstos los correspondientes IC del 95%. La dirección de la tendencia se indica por el signo del coeficiente de regresión lineal. Un signo negativo indica disminución de los valores de resistencia y un signo positivo indica incremento de los valores de resistencia durante el período de 1996 a 2007. El paquete estadístico SPSS analizó los datos obtenidos. Se consideró significativa una p<0,05.
ResultadosCarga de trabajo y costeLa carga total de trabajo del laboratorio de microbiología se incrementó en un 9% y el coste en un 0,85% en el año posterior a la introducción de la DDS en el SMI. Este aumento de productividad se tradujo en un descenso en el valor de la URC: de 4,12 € en el período pre-DDS a 3,81 € en el período post-DDS (tabla 1). La carga de trabajo microbiológica imputada al SMI aumentó un 10% y el coste un 1,8% en el período post-DDS, aunque las variaciones no fueron estadísticamente significativas (tabla 1). En ambos períodos la carga de trabajo y el coste de las muestras microbiológicas imputadas al SMI representaron el 11% de la carga total de trabajo y coste del laboratorio de microbiología.
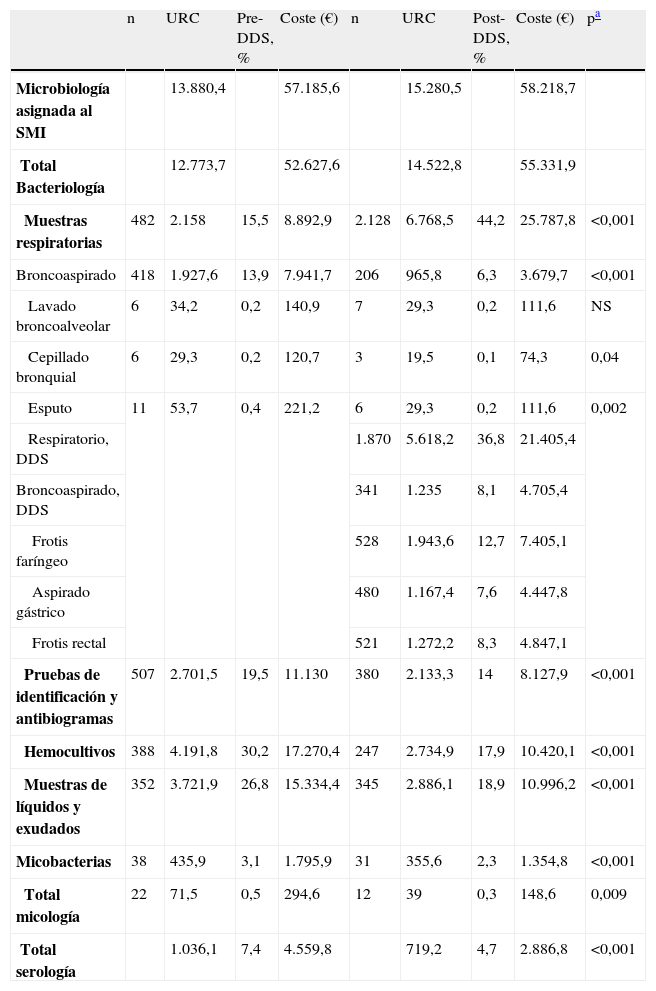
Por el contrario, se observaron variaciones en la distribución del tipo de muestras remitidas desde el SMI (tabla 2), a expensas del aumento de carga de trabajo de los CVE (el 36,8% de la carga de trabajo y del coste imputados al SMI), que se compensó con la disminución estadísticamente significativa de la carga de trabajo derivada de los broncoaspirados cuantitativos (50%), los hemocultivos (35%), las pruebas serológicas (32%), los análisis de líquidos y exudados (22%) y las pruebas de identificación con antibiogramas (21%).
Carga de trabajo y coste del laboratorio de microbiología asignados al servicio de medicina intensiva en los períodos de predescontaminación digestiva selectiva y posdescontaminación digestiva selectiva
| n | URC | Pre-DDS, % | Coste (€) | n | URC | Post-DDS, % | Coste (€) | pa | |
| Microbiología asignada al SMI | 13.880,4 | 57.185,6 | 15.280,5 | 58.218,7 | |||||
| Total Bacteriología | 12.773,7 | 52.627,6 | 14.522,8 | 55.331,9 | |||||
| Muestras respiratorias | 482 | 2.158 | 15,5 | 8.892,9 | 2.128 | 6.768,5 | 44,2 | 25.787,8 | <0,001 |
| Broncoaspirado | 418 | 1.927,6 | 13,9 | 7.941,7 | 206 | 965,8 | 6,3 | 3.679,7 | <0,001 |
| Lavado broncoalveolar | 6 | 34,2 | 0,2 | 140,9 | 7 | 29,3 | 0,2 | 111,6 | NS |
| Cepillado bronquial | 6 | 29,3 | 0,2 | 120,7 | 3 | 19,5 | 0,1 | 74,3 | 0,04 |
| Esputo | 11 | 53,7 | 0,4 | 221,2 | 6 | 29,3 | 0,2 | 111,6 | 0,002 |
| Respiratorio, DDS | 1.870 | 5.618,2 | 36,8 | 21.405,4 | |||||
| Broncoaspirado, DDS | 341 | 1.235 | 8,1 | 4.705,4 | |||||
| Frotis faríngeo | 528 | 1.943,6 | 12,7 | 7.405,1 | |||||
| Aspirado gástrico | 480 | 1.167,4 | 7,6 | 4.447,8 | |||||
| Frotis rectal | 521 | 1.272,2 | 8,3 | 4.847,1 | |||||
| Pruebas de identificación y antibiogramas | 507 | 2.701,5 | 19,5 | 11.130 | 380 | 2.133,3 | 14 | 8.127,9 | <0,001 |
| Hemocultivos | 388 | 4.191,8 | 30,2 | 17.270,4 | 247 | 2.734,9 | 17,9 | 10.420,1 | <0,001 |
| Muestras de líquidos y exudados | 352 | 3.721,9 | 26,8 | 15.334,4 | 345 | 2.886,1 | 18,9 | 10.996,2 | <0,001 |
| Micobacterias | 38 | 435,9 | 3,1 | 1.795,9 | 31 | 355,6 | 2,3 | 1.354,8 | <0,001 |
| Total micología | 22 | 71,5 | 0,5 | 294,6 | 12 | 39 | 0,3 | 148,6 | 0,009 |
| Total serología | 1.036,1 | 7,4 | 4.559,8 | 719,2 | 4,7 | 2.886,8 | <0,001 |
DDS: descontaminación digestiva selectiva; NS: no significativo; SMI: servicio de medicina intensiva; URC: unidad relativa de coste.
En cuanto al impacto sobre la flora microbiana aislada en las muestras procedentes del SMI, alcanzó significación estadística la variación en el número de aislados de los géneros Acinetobacter y Enterococcus. Los aislados de Acinetobacter descendieron del 6,1 al 0,8% y los de Enterococcus aumentaron desde el 10,6 hasta el 27,9% (tabla 3). En este último caso, el aumento se debió al incremento de las 3 especies de Enterococcus que se aíslan con más frecuencia (E. faecalis, E. faecium y E. casseliflavus). El 83% (88 de 106) de los aislados de Enterococcus se obtuvo en los CVE.
Microorganismos aislados en las muestras procedentes del servicio de medicina intensiva en los períodos de predescontaminación digestiva selectiva y posdescontaminación digestiva selectiva
| Pre-DDS | n | % | Post-DDS | n (número de aislados en CVE) | % | p |
| Acinetobacter sp. | 31 | 6,1 | Acinetobacter sp. | 3 (1) | 0,8 | p<0,001 |
| Candida sp. | 45 | 8,9 | Candida sp. | 22 (11) | 5,8 | NS |
| Bacteroides sp. | 7 | 1,4 | Bacteroides sp. | 6 | 1,6 | NS |
| Enterococcus casseliflavus | 1 | 0,2 | E. casseliflavus | 12 (8) | 3,2 | p<0,001 |
| Enterococcus faecium | 0 | 0 | E. faecium | 8 (6) | 2,1 | p<0,001 |
| Enterococcus faecalis | 53 | 10,5 | E. faecalis | 84 (74) | 22,1 | p<0,001 |
| Total Enterococcus | 54 | 10,7 | Total Enterococcus | 106 (88) | 27,9 | p<0,001 |
| Staphylococcus aureus | 46 | 9,1 | S. aureus | 36 (6) | 9,5 | NS |
| Staphylococcus epidermidis | 80 | 15,8 | S. epidermidis | 65 (52) | 17,1 | NS |
| Escherichia coli | 46 | 9,1 | E. coli | 26 (18) | 6,8 | NS |
| Klebsiella | 21 | 4,1 | Klebsiella | 15 (2) | 3,9 | NS |
| Enterobacter | 9 | 1,8 | Enterobacter | 14 (2) | 3,7 | NS |
| Serratia | 12 | 2,4 | Serratia | 4 | 1,1 | NS |
| Citrobacter | 1 | 0,2 | Citrobacter | 4 | 1,1 | NS |
| Pseudomonas aeruginosa | 86 | 17 | P. aeruginosa | 47 (34) | 12,4 | NS |
| Stenotrophomonas | 5 | 1 | Stenotrophomonas | 5 | 1,3 | NS |
| Total | 507 | 100 | Total | 380 | 100 |
CVE: cultivo de vigilancia epidemiológica; DDS: descontaminación digestiva selectiva; NS: no significativo.
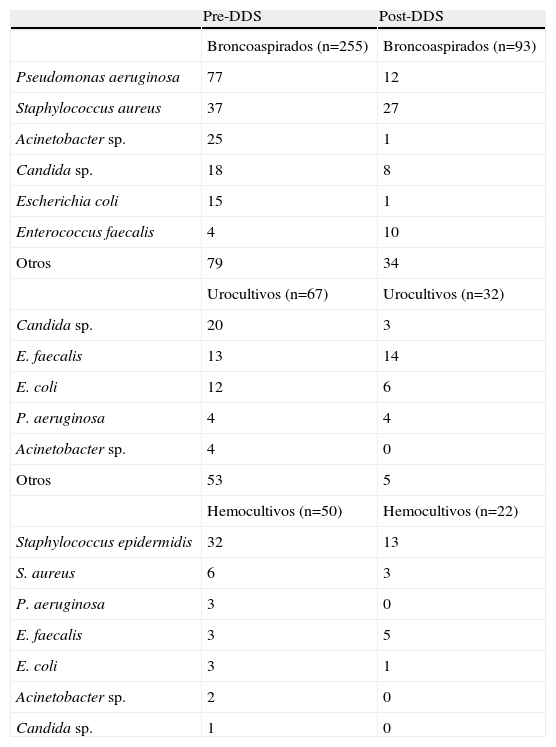
En la tabla 4 se muestra la variación en los microorganismos aislados en muestras clínicas representativas. En el período post-DDS se ha observado una disminución del número total de aislados y en particular de P. aeruginosa, Acinetobacter sp., E. coli y Candida sp. en broncoaspirados; Candida sp., Acinetobacter sp. y E. coli en urocultivos, y Staphylococcus epidermidis en hemocultivos. En este período sólo E. faecalis se ha aislado con más frecuencia en muestras clínicas que en el período pre-DDS.
Microorganismos aislados en broncoaspirados, urocultivos y hemocultivos del servicio de medicina intensiva en los períodos de predescontaminación digestiva selectiva y posdescontaminación digestiva selectiva
| Pre-DDS | Post-DDS | |
| Broncoaspirados (n=255) | Broncoaspirados (n=93) | |
| Pseudomonas aeruginosa | 77 | 12 |
| Staphylococcus aureus | 37 | 27 |
| Acinetobacter sp. | 25 | 1 |
| Candida sp. | 18 | 8 |
| Escherichia coli | 15 | 1 |
| Enterococcus faecalis | 4 | 10 |
| Otros | 79 | 34 |
| Urocultivos (n=67) | Urocultivos (n=32) | |
| Candida sp. | 20 | 3 |
| E. faecalis | 13 | 14 |
| E. coli | 12 | 6 |
| P. aeruginosa | 4 | 4 |
| Acinetobacter sp. | 4 | 0 |
| Otros | 53 | 5 |
| Hemocultivos (n=50) | Hemocultivos (n=22) | |
| Staphylococcus epidermidis | 32 | 13 |
| S. aureus | 6 | 3 |
| P. aeruginosa | 3 | 0 |
| E. faecalis | 3 | 5 |
| E. coli | 3 | 1 |
| Acinetobacter sp. | 2 | 0 |
| Candida sp. | 1 | 0 |
DDS: descontaminación digestiva selectiva.
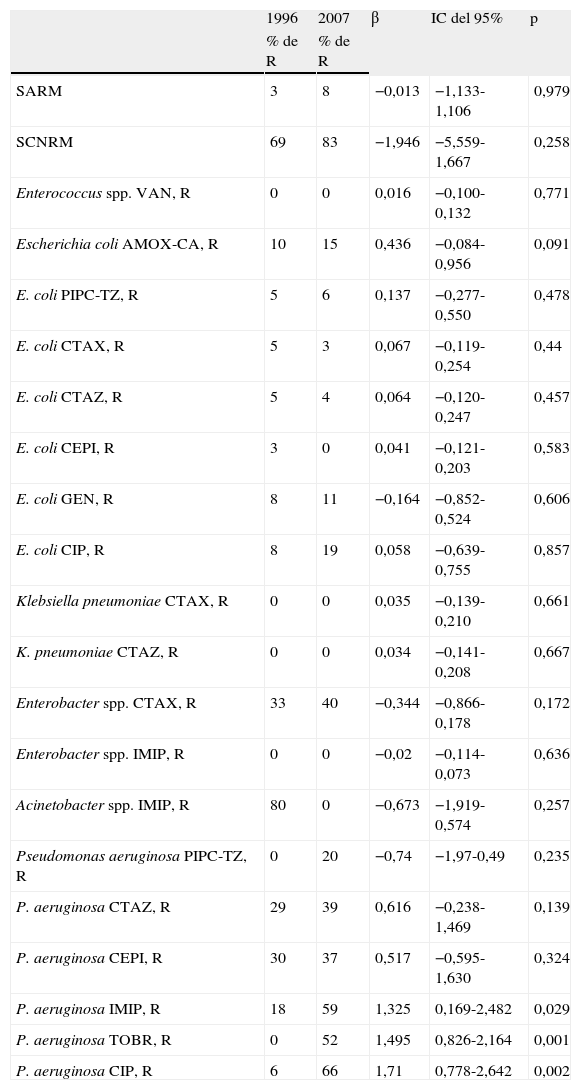
En la tabla 5 se detalla el análisis de la tendencia de las resistencias bacterianas en las 21 combinaciones centinela antimicrobiano/microorganismo. Sólo se han detectado durante el período estudiado (1996 a 2007) 3 tendencias significativas, las 3 en P. aeruginosa. La resistencia a imipenem, tobramicina y ciprofloxacino en este microorganismo ha experimentado incrementos anuales del 1,3, el 1,5 y el 1,7%, respectivamente.
Análisis de tendencia de marcadores de resistencia en aislados del servicio de medicina intensiva (1996–2007)
| 1996 | 2007 | β | IC del 95% | p | |
| % de R | % de R | ||||
| SARM | 3 | 8 | −0,013 | −1,133-1,106 | 0,979 |
| SCNRM | 69 | 83 | −1,946 | −5,559-1,667 | 0,258 |
| Enterococcus spp. VAN, R | 0 | 0 | 0,016 | −0,100-0,132 | 0,771 |
| Escherichia coli AMOX-CA, R | 10 | 15 | 0,436 | −0,084-0,956 | 0,091 |
| E. coli PIPC-TZ, R | 5 | 6 | 0,137 | −0,277-0,550 | 0,478 |
| E. coli CTAX, R | 5 | 3 | 0,067 | −0,119-0,254 | 0,44 |
| E. coli CTAZ, R | 5 | 4 | 0,064 | −0,120-0,247 | 0,457 |
| E. coli CEPI, R | 3 | 0 | 0,041 | −0,121-0,203 | 0,583 |
| E. coli GEN, R | 8 | 11 | −0,164 | −0,852-0,524 | 0,606 |
| E. coli CIP, R | 8 | 19 | 0,058 | −0,639-0,755 | 0,857 |
| Klebsiella pneumoniae CTAX, R | 0 | 0 | 0,035 | −0,139-0,210 | 0,661 |
| K. pneumoniae CTAZ, R | 0 | 0 | 0,034 | −0,141-0,208 | 0,667 |
| Enterobacter spp. CTAX, R | 33 | 40 | −0,344 | −0,866-0,178 | 0,172 |
| Enterobacter spp. IMIP, R | 0 | 0 | −0,02 | −0,114-0,073 | 0,636 |
| Acinetobacter spp. IMIP, R | 80 | 0 | −0,673 | −1,919-0,574 | 0,257 |
| Pseudomonas aeruginosa PIPC-TZ, R | 0 | 20 | −0,74 | −1,97-0,49 | 0,235 |
| P. aeruginosa CTAZ, R | 29 | 39 | 0,616 | −0,238-1,469 | 0,139 |
| P. aeruginosa CEPI, R | 30 | 37 | 0,517 | −0,595-1,630 | 0,324 |
| P. aeruginosa IMIP, R | 18 | 59 | 1,325 | 0,169-2,482 | 0,029 |
| P. aeruginosa TOBR, R | 0 | 52 | 1,495 | 0,826-2,164 | 0,001 |
| P. aeruginosa CIP, R | 6 | 66 | 1,71 | 0,778-2,642 | 0,002 |
β: pendiente de la recta de ajuste; AMOX-CA: amoxicilina con ácido clavulánico; CEPI: cefepima; CIP: ciprofloxacino; CTAX: cefotaxima; CTAZ: ceftazidima; GEN: gentamicina; IC: intervalo de confianza; IMIP: imipenem; PIPC-TZ: piperacilina con tazobactam; R: aislados resistentes; SARM: Staphylococcus aureus resistente a meticilina; SCNRM: Staphylococcus coagulasa negativo resistente a meticilina; TOBR: tobramicina; VAN: vancomicina.
El estudio cuantifica el peso de la carga de trabajo y el coste de las muestras microbiológicas que envía el SMI de este hospital y que significa el 11% de la carga de trabajo y el coste total del laboratorio de microbiología. El valor de 1 URC (valor del urocultivo o procedimiento de referencia) fue de aproximadamente 4 €, algo más elevado que el obtenido por Turrientes et al14 en un hospital madrileño con la misma metodología y Catálogo de Estudios de Microbiología de la Consellería de Sanitat Valenciana.
Los principales resultados de este trabajo han sido los siguientes: a) la implantación del procedimiento de la DDS en el SMI no ha aumentado de forma significativa la carga de trabajo y el coste de las muestras procedentes de este servicio, ya que ha habido una redistribución de los diferentes tipos de muestras microbiológicas recibidas; b) en el período post-DDS se ha observado una disminución significativa de Acinetobacter y un incremento significativo de Enterococcus, y c) durante el período de 12 años analizado se han detectado 3 tendencias significativas de aumento de la resistencia de 21 combinaciones centinela antimicrobiano/microorganismo estudiadas (resistencia a imipenem, tobramicina y ciprofloxacino en P. aeruginosa).
En el SMI de este hospital, Corral et al15 han comunicado una disminución del 80% de neumonía asociada a ventilación mecánica (NAVM) (riesgo relativo [RR] de 0,22; IC del 95%: 0,1 a 0,56) e infección urinaria (RR de 0,2; IC del 95%: 0,05 a 0,82), en el período post-DDS en pacientes con trauma craneal grave y ventilación mecánica. El efecto de la DDS sobre la disminución de las tasas de NAVM e infección urinaria observado en el SMI de este hospital es comparable al observado en otros SMI de España16,17, y es explicable por la asociación de la NAVM a la colonización digestiva, orofaríngea y rectal por microorganismos potencialmente patógenos.
El aumento del capítulo de muestras respiratorias (pasan del 15,5 al 44,2%) se ha debido a los CVE, que representan el 36,8% de la carga de trabajo imputada al SMI en el período post-DDS. Por otra parte, la eficacia de la DDS sobre la prevención de la NAVM se ha traducido en un descenso significativo en el resto de las muestras microbiológicas enviadas en el período post-DDS: los broncoaspirados cuantitativos se han reducido a la mitad, se han remitido un tercio menos de hemocultivos y pruebas serológicas (con frecuencia implicadas en descartar infección respiratoria), las muestras de líquidos y exudados, y las pruebas de identificación y antibiogramas han descendido en torno a un 21%.
En el período post-DDS se han detectado 2 variaciones en la microbiota del SMI. Por una parte, se ha observado la disminución significativa de los aislamientos del género Acinetobacter, tercer microorganismo causante de la NAVM según el estudio ENVIN-HELICS 200718, de forma similar a lo apuntado por Agustí et al19, que observaron un menor número de muestras positivas a Acinetobacter en el grupo de pacientes que recibían la DDS frente al grupo control. Por otra parte, es de destacar el aumento significativo de las 3 especies de Enterococcus (E. faecalis, E. faecium y E. casseliflavus), que representan en torno al 30% de los microorganismos aislados en el período post-DDS. Otros autores16,17,20,21 han descrito en detalle este aumento de la incidencia de colonización e infección por enterococos, y se ha asociado tanto al uso de pautas cortas de cefalosporinas parenterales en el protocolo de la DDS como a la escasa actividad frente a enterococos de los antibióticos tópicos utilizados. Si bien se asume que estos microorganismos grampositivos son poco virulentos, es bien sabido que producen infecciones en los pacientes críticos e inmunodeprimidos21, por lo que se debe hacer un seguimiento cuidadoso de los pacientes en los que se aíslen y establecer medidas para disminuir, en lo posible, la transmisión cruzada.
Por último, uno de los efectos colaterales invocados por los detractores de la DDS es la selección de microorganismos multirresistentes que no son sensibles a los antimicrobianos usados en la técnica. Una revisión de Silvestri y Van Saene en 2006 analizó 36 ensayos clínicos de DDS que incluían información sobre resistencia bacteriana5. En ninguno de éstos se comprobó aumento de la resistencia en bacilos gramnegativos ni se detectaron enterococos resistentes a vancomicina y sólo en unos pocos se observó aumento de la resistencia a meticilina en S. aureus16,22–24 y Staphylococcus negativo para la coagulasa25, que era más patente en aquellas unidades de críticos con alta endemicidad a estos últimos microorganismos. En estos SMI, la adición de vancomicina tópica y en solución a través de sonda nasogástrica al protocolo de la DDS se ha mostrado útil para conseguir disminuir la colonización por S. aureus resistente a meticilina26,27. De igual forma, tampoco se ha comprobado aumento de la resistencia bacteriana en estudios con períodos de seguimiento entre 2 y 6 años27–30.
La reciente descripción en una unidad de críticos holandesa de un pequeño brote que afectó a 4 pacientes con DDS9, en los que se aislaron enterobacterias genéticamente no relacionadas (3 cepas de E. coli y una cepa de Klebsiella pneumoniae), que eran portadoras de plásmidos idénticos con genes que codificaban betalactamasas de espectro extendido tipo CTX-M-15 y SHV-5, ha venido a alertar sobre la necesidad de mantener una estrecha vigilancia epidemiológica en los pacientes con DDS para la detección precoz de microorganismos multirresistentes.
En el presente estudio y durante 12 años, se han detectado 3 tendencias significativas sobre 21 combinaciones centinela analizadas, las 3 en P. aeruginosa (imipenem, tobramicina y ciprofloxacino). Aunque es bien conocido que el consumo de cefalosporinas de tercera generación se ha asociado a la selección de enterobacterias con betalactamasas de espectro extendido y Acinetobacter multirresistente, no se ha probado que favorezcan la selección de P. aeruginosa multirresistente31, y la mayor parte de autores coincide en señalar que la DDS no incrementa la resistencia en betalactámicos y quinolonas29,30,32,33. Por el contrario, en algunos estudios el uso de aminoglucósidos en la DDS se ha asociado a aumentos de la resistencia a este tipo de antibióticos en enterobacterias22,24,30.
En los aislados de P. aeruginosa de este estudio, la sobreexpresión de bombas de expulsión junto con la pérdida de porinas podrían explicar las cifras de resistencia observadas en imipenem, tobramicina y ciprofloxacino, sensiblemente mayores que las reflejadas por el estudio nacional de vigilancia ENVIN-HELICS. Por el contrario, el resto de tasas de resistencia, tanto en grampositivos como en gramnegativos, son inferiores a las reportadas por el citado estudio nacional18.
Limitaciones del estudio1. En este estudio el coste del urocultivo (1 URC o valor de referencia) fue de aproximadamente 4 €. Este coste del valor de referencia debería ser similar al obtenido en hospitales medianos del mismo tamaño que éste, aunque es sabido que las variaciones de los costes de personal (dotación de plantillas) y del catálogo de pruebas ofertadas por los diferentes laboratorios de microbiología pueden hacer impracticable la comparación de costes. Por otra parte, los distintos catálogos de contabilidad analítica utilizados por los servicios de salud para cuantificar la carga de trabajo y los costes de los laboratorios clínicos dificultan la comparación entre centros. A este respecto y aun a sabiendas que hay otras alternativas para calcular la carga de trabajo y el coste del laboratorio de microbiología34,35, se ha optado por el Catálogo de Estudios de Microbiología de la Consellería de Sanitat de la Generalitat Valenciana, por ser un documento de consenso profesional, por la facilidad de manejo de su aplicación informática y porque se ha utilizado en estudios similares de España14.
2. No se han utilizado medios diferenciales destinados a la detección de microorganismos multirresistentes, lo que ha podido infraestimar su prevalencia. Recientemente se ha publicado un documento con recomendaciones específicas en este sentido36.
3. No se ha desarrollado una tipificación molecular de los microorganismos para establecer la relación clonal de los aislamientos, por lo que no se puede descartar la posibilidad de transmisión paciente a paciente, un factor de confusión frecuente en este tipo de estudios.
4. En cuanto al estudio de tendencias de la resistencia bacteriana, son conocidas las limitaciones de este tipo de diseño. Se han preconizado otros diseños más sofisticados, como los análisis de series temporales interrumpidas, para evaluar la tendencia de las series de resistencia37. Sin embargo, estos análisis basados en la unidad temporal del mes en vez del año pueden hacer que en hospitales de mediano o pequeño tamaño las series sean más inestables por escasez de datos disponibles. En todo caso, probablemente el presente trabajo, realizado a partir de datos anuales, pueda ser el punto de partida para el diseño de futuros estudios.
Los autores agradecen a los miembros del Departamento de Contabilidad Analítica de la Consellería de Sanitat de la Generalitat Valenciana su inestimable colaboración, que ha facilitado la realización de este trabajo.