Existen varios métodos para la detección de anticuerpos contra el virus de inmunodeficiencia humana (VIH), y entre estos se encuentra el ELISA tipo sandwich de doble antígeno, muy utilizado en la actualidad. El objetivo de este trabajo es evaluar un péptido sintético monomérico biotinilado de la glucoproteína de transmembrana gp36 del VIH-2, en un ensayo de sandwich, para la detección de anticuerpos contra la esta proteína del VIH-2.
Materiales y métodosPara desarrollar el ensayo se utilizaron placas recubiertas con la proteína recombinante gp36 a 0,5μg/ml y con el péptido sintético gp36(5) a 1μg/ml; la concentración del péptido sintético gp36(5) biotinilado (gp36(5)-B) utilizada fue 0,1μg/ml, preparada con una solución reguladora Tris-BSA-NaCl y el conjugado Estreptavidina-Fosfatasa Alcalina diluido 1:30.000 preparado con la solución PBS-Sacarosa-BSA. Se evaluaron muestras de suero positivas a anticuerpos contra los virus VIH-1 y VIH-2 (88 y 34, respectivamente), 483 muestras negativas procedentes de donantes de sangre y 96 muestras de suero para evaluar la especificidad analítica. Todas las muestras fueron evaluadas en el UMELISA HIV1+2 RECOMBINANT, las que resultaron reactivas se confirmaron por el ensayo confirmatorio DAVIH-BLOT.
ResultadosLas 34 muestras con anticuerpos contra el VIH-2 fueron evaluadas como positivas en ambas variantes de recubrimiento; la mayor especificidad se obtuvo con la variante que empleó el péptido sintético gp36(5) en el recubrimiento. El ensayo sandwich de doble antígeno desarrollado empleando el gp36 (5)-B permite la detección de anticuerpos contra la proteína gp36 del VIH-2.
Among the several existing methods for the detection of antibodies to HIV, the ‘sandwich’ ELISA is currently the most used. This study aims to assess a biotinylated monomeric synthetic peptide of the glycoprotein trans-membrane gp36 from HIV-2, in a sandwich assay, for the detection of antibodies against this HIV-2 protein.
Materials and methodsTo perform the assay, plates coated with recombinant protein gp36 at 0.5μg/mL and synthetic peptide gp36(5) at 1μg/mL were used. The concentration of the biotinylated synthetic peptide (gp36(5)-B) used was 0.1μg/mL prepared with a Tris-BSA-NaCl buffer solution and the Streptavidin- Alkaline Phosphatase conjugate diluted 1:30000 prepared with a PBS-Sucrose-BSA solution. Positive serum samples to antibodies against HIV-1 and HIV-2 viruses (88 and 34, respectively) were tested, with 483 negative samples from blood donors and 96 serum samples to assess the analytical specificity. All the samples were tested using the UMELISA HIV 1+2 RECOMBINANT assay, and all positives were confirmed using a DAHIV-BLOT assay.
ResultsThirty four samples with antibodies against HIV-2 were assessed as positive for both coating variants. The highest specificity was obtained with the variant using the synthetic peptide gp36(5) in its coating. The antigen ‘sandwich’ assay developed by using gp36(5)-B enables the detection of antibodies against gp36 protein of HIV-2
Un virus relacionado con el virus de inmunodeficiencia de los simios (SIV) fue aislado por primera vez 1986 en seropositivos de África Occidental, y hoy se conoce como virus de la inmunodeficiencia humana tipo 2 (VIH-2). Este virus es responsable de epidemias localizadas en países africanos, y existen evidencias de infecciones en otras regiones de Europa, Sudamérica, Estados Unidos, Asia y Australia1. En Cuba se ha reportado la circulación del VIH-22.
Existe una homología conformacional entre la gp41 del VIH-1 y la gp36 del VIH-2, la cual se debe a la formación en ambos casos de un lazo originado por la formación de un puente de disulfuro. Estos enlaces se obtienen por la oxidación de los grupos SH de las moléculas de cisteínas en las secuencias CSGKLIC para la gp41 del VIH-1 y CAFRQVC para la gp36 del VIH-23.
Los anticuerpos contra el VIH-2 reaccionan con las proteínas de las regiones gag y pol del VIH-1 hasta en 80% y solo lo hacen con las proteínas de env hasta en 30%. Por esta razón, proteínas como la gp36 (36kD) del VIH-2, con alta especificidad y potencial inmunogénico4, se han utilizado en el diseño secuencial de péptidos y proteínas recombinantes para el diagnóstico5,6.
Los péptidos sintéticos se utilizan como antígenos en los ensayos inmunoenzimáticos (EIA), ya que pueden imitar epítopos inmunodominantes; además se unen con cierta facilidad a la fase sólida, y se ha descrito que ofrecen a los EIA la posibilidad de obtener mayor sensibilidad y especificidad. El uso de secuencias peptídicas específica de la glucoproteína 36 del VIH-2 como antígeno ofreció una adecuada especificidad y sensibilidad en diversos EIA7,8.
En los últimos años se han desarrollado EIA tipo sandwich (EIA de tercera generación) que emplean antígenos recombinantes o péptidos sintéticos específicos del VIH-1 y del VIH-2. Estos pueden detectar todas las clases de inmunoglobulinas, lo que aumentó la sensibilidad al ser la IgM el primer marcador de seroconversión9.
Por las razones antes expuestas, el objetivo de este trabajo fue evaluar un péptido sintético monomérico biotinilado de la región amino terminal de la glucoproteína de transmembrana gp36 del VIH-2, en un ensayo tipo sandwich (tercera generación) para la detección de anticuerpos contra la gp36 de este virus.
Materiales y métodosMuestras analizadasSe emplearon 4 paneles de sueros:
Primer panel: estaba constituido por 483 muestras de suero procedentes de donantes de sangre, individuos supuestamente sanos.
Segundo panel: incluyó 34 muestras de suero procedentes de individuos infectados con el VIH-2 (tabla 1).
Tercer panel: se preparó con 88 muestras de suero de individuos infectados con el VIH-1.
Cuarto panel: estaba compuesto por 96 muestras de suero procedentes de individuos; dada su naturaleza, pueden interferir en ensayos que detectan anticuerpos al VIH (embarazadas n=24; hemodializados n=24; sueros de pacientes con anticuerpos dirigidos contra el virus de la hepatitis C (VHC positivos) n=24 y sueros de pacientes positivos al antígeno de superficie del virus de la hepatitis B (HBsAg positivos) n=24).
Todos los sueros se conservaron a −20°C hasta su uso.
Síntesis química en fase sólida, purificada, caracterización del péptido gp36(5) del VIH-2El péptido se obtuvo en el Laboratorio de Síntesis de Péptidos del Centro de Inmunoensayo mediante síntesis química en fase sólida, empleando la estrategia Boc en bolsas de polipropileno10,11. Posteriormente se purificó por cromatografía líquida de alta resolución (HPLC) en fase reversa (RP-HPLC, Pharmacia, LKB)12 en una columna RP18 (Pharmacia) (sistema de gradiente A/B de 0 a 60% B) (A TFA 0,1% [v/v] y acetonitrilo 2% [v/v] en H2O; B TFA 0,05% [v/v] en acetronitrilo). La caracterización del péptido se realizó mediante espectrometría de masas MALDI-TOF (Matrix-Assisted Laser Desorption of Ions Time-of-Fight)12-14.
Biotinilación del péptido sintético gp36(5)Después de la síntesis química en fase sólida del péptido sintético se procedió a la biotinilación del mismo en fase sólida con D-biotina y 1-hidroxibenzotriazol (HOBt) disueltos en N,N’-dimetilformamida (DMF), utilizando como activador la N.N’-diisopropilcarbodiimida y las mismas condiciones empleadas en el acoplamiento de los Boc-aminoácidos. Posteriormente se purificó por cromatografía líquida de alta resolución (HPLC) en fase reversa (RP-HPLC, Pharmacia, LKB)12 en una columna RP18 (Pharmacia) (sistema de gradiente A/B de 0 a 60% B) (A TFA 0,1% [v/v] y acetonitrilo 2% [v/v] en H2O; B TFA 0,05% [v/v] en acetonitrilo).
Proteína recombinante gp36La proteína recombinante gp36 que se utilizó en este estudio fue suministrada por el Centro de Ingeniería Genética y Biotecnología de Sancti Spirítus, Cuba. fue obtenida en E. coli, con más de 85% de pureza estimada por electroforesis en gel de poliacrilamida.
Conjugado estreptavidina fosfasata alcalinaLa estreptavidina se conjugó a la fosfatasa alcalina por el método del glutaraldehído en un solo paso descrito por Avramea en 196915.
Recubrimiento de las placasPara el recubrimiento de las placas se empleó la proteína recombinante gp36 0,5μg/ml (variante A) y un péptido gp36(5) (variante B), ambos diluidos en disolución reguladora carbonato-bicarbonato 0,05mol/l; pH 9,6. Las soluciones de dispensaron a razón de 18μl/pozo en placas de poliestireno con capacidad para 30μl por pozo (placas UMELISA Greiner Bio-One, Alemania), se incubaron en cámara húmeda a 45°C durante 4h. Se aspiró la solución de recubrimiento y se lavó una vez con PBS-Tween (8g de NaCl; 1,215g de Na2HPO; 2H2O; 0,2g de KH2PO4; 0,2g de NaN3; 0,5ml de Tween-20: para un volumen de 1.000ml de agua purificada y pH de 7,3-7,5) a razón de 25μl/pozo. El tiempo de permanencia de la solución de lavado fue de 30s. Para preservar el recubrimiento se aplicó la solución de PBS suplementado con albúmina sérica bovina (BSA) al 1% y Tween 20 al 0,05% para la variante B. En las placas de la variante A se añadió a la solución suero de carnero con anticuerpos anti E. coli. El volumen de preservo dispensado fue de 19μl/pozo, las placas se incubaron durante toda la noche entre 20-25°C, se aspiró el preservo y se secaron durante 2h a 37°C para posteriormente sellarlas y conservarlas a 4°C hasta el momento de su evaluación.
UltramicroELISA sandwich para la detección de anticuerpos contra la proteína gp36 del VIH-2. Descripción de la técnicaEs un ensayo inmunoenzimático heterogéneo tipo sandwich de tercera generación que emplea las ventajas de la reacción de alta afinidad entre la estreptavidina y la biotina. En este ensayo se utilizan como fase sólida tiras de ultramicroELISA (10μl por pocillo) revestidas con la proteína recombinante gp36 (variante A) y el péptido sintético gp36(5) (variante B) del VIH-2. Las muestras se incuban en los pocillos de la tira de reacción, y los antígenos en la superficie de las tiras se unen a los anticuerpos presentes en las muestras. A continuación, previo lavado que elimina los componentes de la muestra no fijados, se añade el péptido gp36(5)-biotinilado (gp36(5)-B) a una concentración de 0,1μg/ml diluido en Tris-BSA-NaCl, que se unirá al complejo formado sobre la fase sólida. Una vez eliminados el péptido en exceso, se añade el conjugado estreptavidina/fosfatasa alcalina a la dilución de 1:30.000 en PBS-BSA-sacarosa, y luego de un paso de incubación y lavado se adiciona el sustrato fluorigénico (4-metilumbeliferilfosfato), que será hidrolizado y la intensidad de la fluorescencia emitida permitirá detectar la presencia de anticuerpos dirigidos contra la gp36 en la muestra.
Análisis estadísticosEl programa TONYSTAT se empleó para comprobar la normalidad en ambas variantes de ensayo con las muestras del panel 1, por el método de chi cuadrado para un 95%.
Se construyeron tablas 2×2 y se calcularon los índices de diagnósticos de sensibilidad y especificidad mediante el programa EPIDAT 3.1. Se analizaron en primer lugar los resultados del panel 1 para determinar el nivel de corte y se los combinó con los de los paneles 3 y 4 para el cálculo de la especificidad. Los resultados del panel 2 se utilizaron para calcular la sensibilidad. Los cálculos de sensibilidad y especificidad para ambas variantes de ensayo se realizaron según las fórmulas: sensibilidad=VP/(VP+FN), especificidad=VN/(FP+VN) (tabla 1). Además, se evaluó la concordancia mediante el análisis del índice kappa (κ).
Las muestras fueron evaluadas en el UMELISA HIV 1+2 Recombinant del Tecnosuma Internacional S.A., La Habana, Cuba, para clasificarlas en reactivas o no reactivas, y las reactivas fueron confirmadas por el ensayo DAVIH BLOT (WB) del Laboratorio de Investigaciones del Sida (LISIDA) en Mayabaque, Cuba. Para la realización de estos ensayos se siguieron las instrucciones de los fabricantes.
El nivel de corte se determinó como la media de la fluorescencia de las muestras del panel 1 (X) +2 desviaciones estándar (2*DS) (X+2*DS).
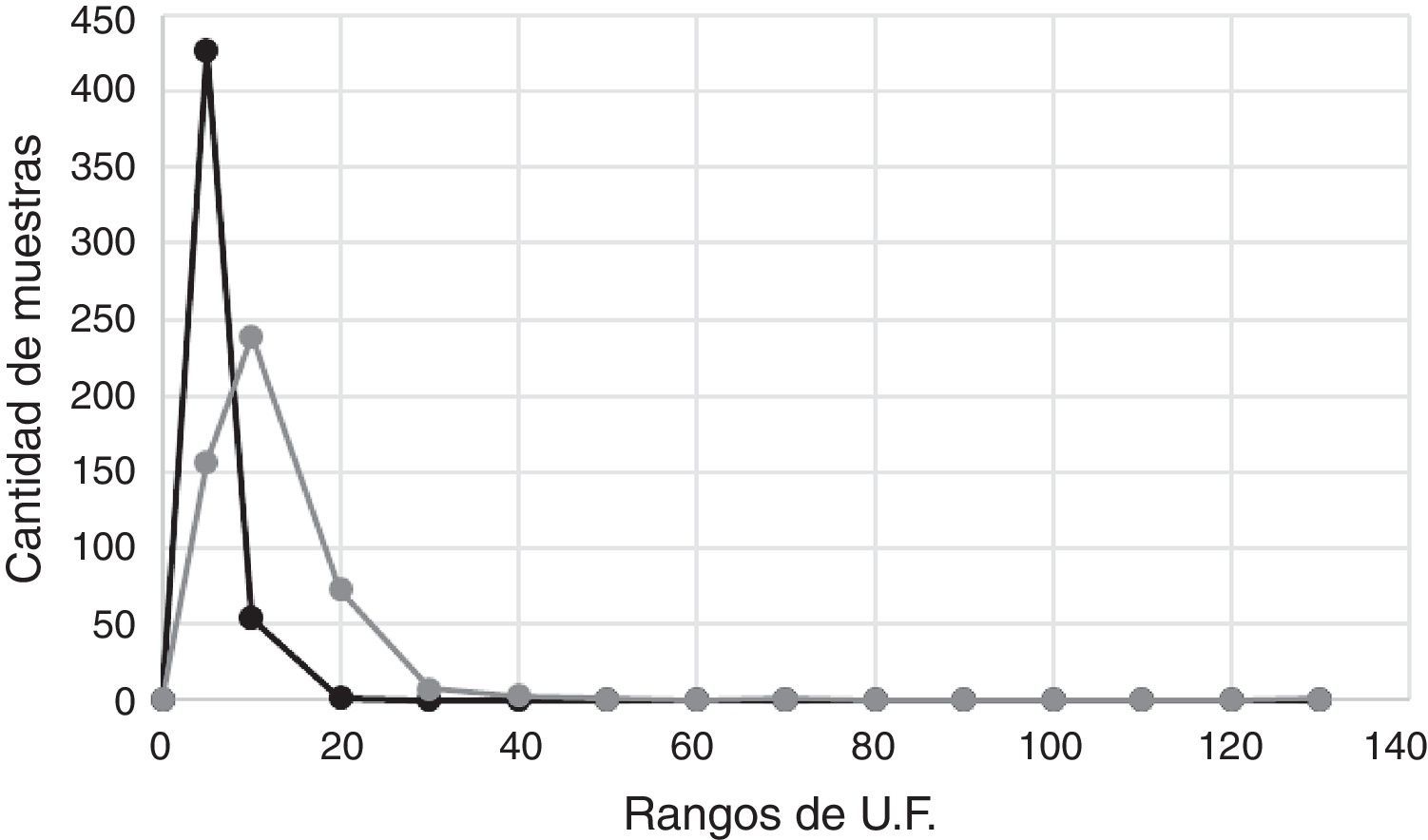
ResultadosComparación de la distribución de los valores de fluorescencia del UMELISA entre las variantes A y BEn la figura 1 se muestran las distribuciones de las unidades de fluorescencia (UF) de las muestras del panel 1 y se comprobó que ambas distribuciones fueron normales según la prueba chi cuadrado para un nivel de confianza del 95%. El valor de fluorescencia del nivel de corte para la variante A fue definido como 23,19 UF y para la variante B de 6,15 UF. En la variante B el 99,58% de las muestras están por debajo de 6,0 UF; sin embargo, en la variante A el 97,10% se encontraron por debajo de 20 UF.
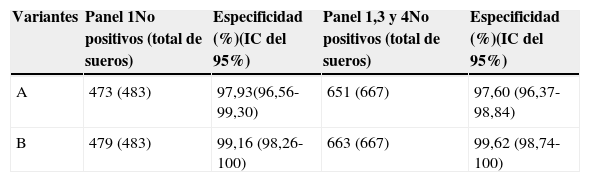
El 100% (34/34) de los sueros de individuos infectados con el VIH-2 fueron reactivos en las 2 variantes. Por otra parte, el 97,93% (651/667) en la variante A y el 99,16% (663/667) de los sueros de los paneles 1, 3 y 4 presentaron resultados negativos (tablas 2 y 3). Las 16 muestras FP de la variante A se distribuyeron de la siguiente manera: 10 en el panel 1 y 3 en el panel 4 (1 embarazada y 2 hemodializados), mientras que las 4 muestras FP en la variante B fueron del panel 1. La concordancia entre las variantes A y B con el WB fue elevada; los índices κ obtenidos fueron 0,80 y 0,94, respectivamente.
Especificidad de las dos variantes de ensayo
| Variantes | Panel 1No positivos (total de sueros) | Especificidad (%)(IC del 95%) | Panel 1,3 y 4No positivos (total de sueros) | Especificidad (%)(IC del 95%) |
|---|---|---|---|---|
| A | 473 (483) | 97,93(96,56-99,30) | 651 (667) | 97,60 (96,37-98,84) |
| B | 479 (483) | 99,16 (98,26-100) | 663 (667) | 99,62 (98,74-100) |
Los EIA para la detección de anticuerpos contra el VIH han evolucionado considerablemente en su formato de ensayo, lo que ha posibilitado un incremento de la sensibilidad y la especificidad. Los EIA de tercera generación utilizan proteínas recombinantes o péptidos sintéticos, en un formato sandwich; este diseño ha permitido detectar todas las clases de inmunoglobulinas, lo que aumentó la sensibilidad al ser la IgM el primer marcador.
En Cuba se detecta el VIH en la segunda mitad de los años ochenta del siglo pasado16. Sin embargo, en 2003 es diagnosticado el décimo paciente con infección por el VIH-22, por lo que podemos afirmar que la seroprevalencia del VIH-2 en Cuba es baja, y es por ello que en este estudio el número de muestras positivas al VIH-2 procedentes de pacientes cubanos fue bajo. Hernández et al.14 también emplearon un bajo número de muestras en la comparación de la antigenicidad de la proteína recombinante gp36 con la misma secuencia peptídica empleada en este trabajo. No obstante el número bajo de muestras, sus características nos permitieron evaluar el desempeño del ensayo.
La diferencia entre los niveles de cortes entre cada variante (23,19 UF para A y 6,15 UF para B) está dada porque el empleo de péptidos sintéticos en el recubrimiento de las placas mejora la especificidad de los ensayos. Además, en otros estudios realizados por los autores de este trabajo donde se comparan placas recubiertas con péptidos sintéticos y proteínas recombinantes se ha observado que los valores de fluorescencia obtenidos con muestras negativas en placas recubiertas con péptidos sintéticos son más bajos, lo que se explica por las bajas reacciones cruzadas que aparecen cuando se utilizan este tipo de moléculas17.
Con ambas variantes del ensayo desarrollado se obtuvo una adecuada sensibilidad y especificidad. Estos resultados coinciden con los obtenidos por Martín et al.18, que desarrollaron un ensayo heterogéneo indirecto para la detección de anticuerpos al VIH-2 empleando el péptido gp36(5) y obtuvieron 100% de sensibilidad y 99,81% de especificidad. Otros investigadores han obtenido valores de sensibilidad y especificidad similares a los nuestros empleando un péptido sintético de la gp36 de 11 aminoácidos mostrando una sensibilidad de 100% y 96,8% de especificidad, con muestras de sueros confirmadas por la reacción en cadena de la polimerasa7.
Nuestros resultados no coinciden con los reportados por Hernández et al.14 en cuanto a la reactividad cruzada frente a muestras del VIH-1; estos autores encontraron un 46% de reactividad cruzada para VIH-1 cuando compararon la antigenicidad del péptido gp36(5) con la proteína recombinante gp36. Sin embargo, en nuestro estudio todas las muestras VIH-1 fueron evaluadas como negativas en la variante A que se empleó en el recubrimiento la proteína recombinante, y esta no coincidencia puede ser porque en nuestro ensayo utilizamos el sistema amplificador estreptavidina/biotina, y se ha informado que este sistema permite trabajar con los reactivos biológicos que participan en la reacción a bajas concentraciones, lo que disminuye las interferencias de los reactivos entre sí y con las muestras, que al ser empleadas sin dilución pueden incrementar en gran medida la ocurrencia de interacciones inespecíficas19.
La mejor concordancia con el WB se obtuvo con la variante B, ya que el valor del índice κ de esta variante se acerca más a 120.
Diferentes factores han sido encontrados como causantes de falsos positivos en ensayos para la detección de anticuerpos contra el VIH: enfermedades autoinmunes, fallos renales, fibrosis quística, multíparas, enfermedades hepáticas, hemodializados, enfermedades autoinmunes, drogadicción, vacunación reciente contra la hepatitis B, entre otros21,22. Es por ello que en las evaluaciones de la especificidad de estos ensayos se incluyen estas muestras. En este trabajo la menor especificidad con este grupo de muestras (panel 4) se obtuvo con la variante A (96,8%), mientras que con la variante B fue de 100%; esto se debe a la alta especificidad que aporta el uso de los péptidos sintéticos.
Con el ensayo sandwich desarrollado se obtuvieron valores de sensibilidad de 100% y >97% de especificidad para ambas variantes, aunque la variante B es superior en especificidad y correlación, lo que demuestra la utilidad de este péptido como antígeno para recubrimiento y conjugado en la detección de anticuerpos contra el VIH-2. Esta afirmación coincide con la de otros investigadores14,18,23.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.