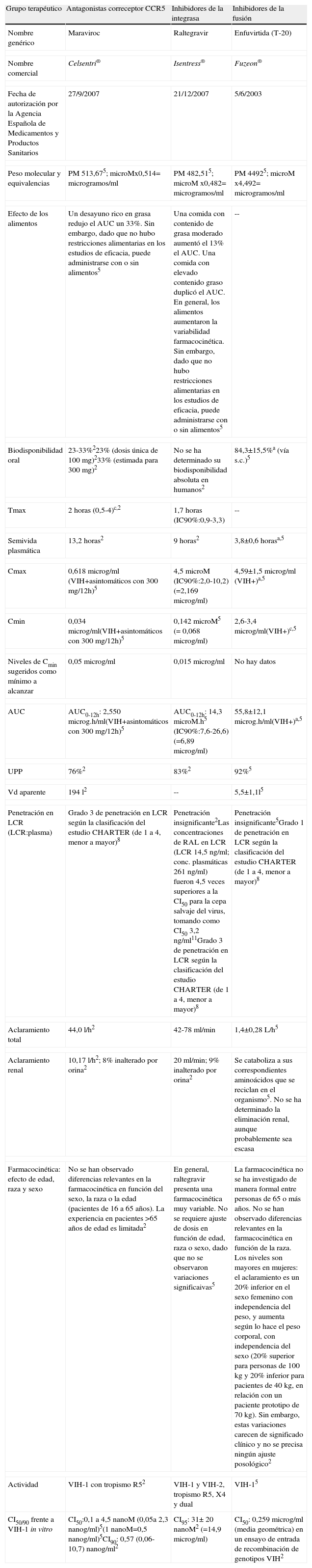
En noviembre de 2010 se encuentran comercializados en España 22 fármacos antirretrovirales (ARV), que pertenecen a 6 clases según su mecanismo de acción: 1) inhibidores de la transcriptasa inversa análogos de nucleósidos y nucleótidos (ITIAN) (abacavir, didanosina, emtricitabina, estavudina, lamivudina, zidovudina y tenofovir), 2) inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINN) (efavirenz, etravirina y nevirapina), 3) inhibidores de la proteasa (IP) (atazanavir, darunavir, fosamprenavir, indinavir, lopinavir, nelfinavir, ritonavir, saquinavir, tipranavir), 4) inhibidores de la entrada (enfuvirtide), 5) inhibidores de los correceptores CCR5 (maraviroc) y 6) inhibidores de la integrasa (raltegravir). Todos ellos se encuentran indicados en el tratamiento de la infección por el VIH-1, en combinación con otros ARV. La mayoría de ellos han demostrado ser también activos frente al VIH-2 (excepto los inhibidores de la transcriptasa inversa no análogos de nucleósidos, enfuvirtide y maraviroc) y algunos son activos frente al virus de la hepatitis B (lamivudina, emtricitabina y tenofovir).
En este artículo se revisan las principales características de los diferentes fármacos y familias de ARV, con sus presentaciones comerciales, dosificación pediátrica y del adulto, ajustes de dosis en insuficiencia renal o hepática, farmacocinética e interacciones, mecanismo de acción, indicaciones de tratamiento, resistencias, efectos adversos y seguridad en el embarazo y lactancia.
Algunas de las características de los ARV son propias de la familia a la que pertenecen y comunes a otros fármacos de la misma clase y otras son individuales y diferentes a las de los otros fármacos de la familia. Todo ello nos permitirá elaborar diferentes regímenes terapéuticos eficaces en función de las peculiaridades del individuo (tolerabilidad, simplicidad, adaptabilidad al estilo de vida) y del escenario clínico (naive, simplificación, rescate, resistencias).
As of November 2010, a total of 22 antiretroviral agents are marketed in Spain. These agents are divided into 6 classes according to their mechanism of action: 1) nucleos(t)ide reverse transcriptase inhibitors (NRTI) (abacavir, didanosine, emtricitabine, stavudine, lamivudine, zidovudine, and tenofovir), 2) non-nucleoside reverse transcriptase inhibitors (NNRTI) (efavirenz, etravirine, and nevirapine), 3) protease inhibitors (PI) (atazanavir, darunavir, fosamprenavir, indinavir, lopinavir, nelfinavir, ritonavir, saquinavir, tipranavir), 4) entry inhibitors (enfuvirtide), 5) coreceptor CCR5 inhibitors (maraviroc), and 6) integrase inhibitors (raltegravir). All 22 agents are indicated for the treatment of HIV-1 infection in combination with other antiretroviral drugs. Most have also proven to be active against HIV-2 (except the NNRTIs, enfuvirtide, and maraviroc) and some are active against hepatitis B virus (lamivudine, emtricitabine, and tenofovir).
The present article reviews the main characteristics of the different antiretroviral agents and classes, namely, commercial presentations, paediatric and adult dosages, dose adjustments in renal and hepatic insufficiency, pharmacokinetics and interactions, mechanism of action, treatment indications, resistance, adverse effects, and safety during pregnancy and breastfeeding.
Some of the characteristics of antiretrovirals are class-specific and common to other agents of the same class, and others are individual and different from those of other drugs in the same class. Knowledge of these characteristics enables us to prepare efficacious therapeutic regimens according to the specific requirements of the patient (tolerability, simplicity, adaptability to lifestyle) and clinical setting (naive, simplification, rescue, resistance).
La disponibilidad de diferentes fármacos activos frente al VIH modificó radicalmente la evolución de la infección, con una reducción espectacular de su morbimortalidad y una eficacia progresiva para controlar la replicación del VIH1. Actualmente la combinación adecuada de diferentes fármacos antirretrovirales (ARV) nos permite controlar la replicación viral y preservar o restaurar el sistema inmune en la gran mayoría de pacientes, de manera que la esperanza de vida se va aproximando cada vez más a la de la población general. A pesar de ello, persisten importantes desafíos tales como la imposibilidad de erradicar el virus del organismo, precisando tratamiento de por vida; la complejidad de algunos regímenes y sus efectos adversos, que pueden dificultar la adherencia terapéutica y conducir a la aparición de resistencias a diferentes fármacos y el elevado coste de estos medicamentos, que dificulta enormemente su administración en los países en vías de desarrollo.
En noviembre de 2010, se encuentran comercializados en España 22 fármacos ARV, que pertenecen a 6 familias o clases según su mecanismo de acción: 1) inhibidores de la transcriptasa inversa análogos de nucleósidos y nucleótidos (ITIAN) (abacavir, didanosina, emtricitabina, estavudina, lamivudina, zidovudina y tenofovir), 2) inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINN) (efavirenz, etravirina y nevirapina), 3) inhibidores de la proteasa (IP) (atazanavir, darunavir, fosamprenavir, indinavir, lopinavir, nelfinavir, ritonavir, saquinavir, tipranavir), 4) inhibidores de la entrada (enfuvirtide), 5) inhibidores de los correceptores CCR5 (maraviroc) y 6) inhibidores de la integrasa (raltegravir). Todos ellos se encuentran indicados en el tratamiento de la infección por el VIH-1, en combinación con otros ARV. La mayoría de ellos han demostrado ser también activos frente al VIH-2 (excepto los inhibidores de la transcriptasa inversa no análogos de nucleósidos, enfuvirtide y maraviroc) y algunos son activos frente al virus de la hepatitis B (lamivudina, emtricitabina y tenofovir). Habitualmente se emplean combinaciones de tres fármacos activos, variables en función de las características individuales y del escenario clínico (naive, rescate, simplificación) y de la posibilidad de resistencia a algunos fármacos. Muy excepcionalmente se utilizan más de tres fármacos. Actualmente se están estudiando algunas combinaciones de dos fármacos e incluso existen ya datos de eficacia de la administración de un IP en monoterapia en determinadas circunstancias.
En este artículo se revisan las principales características de los diferentes fármacos y familias de ARV, con sus presentaciones comerciales, dosificación pediátrica (tabla 1)2–4 y del adulto2,3,5, ajustes de dosis en insuficiencia renal o hepática (tabla 2)6, farmacocinética (tablas 3–6)2,3,5,7–11, interacciones, asociaciones contraindicadas, mecanismo de acción, indicaciones de tratamiento, resistencias, efectos adversos y seguridad en el embarazo y lactancia. Dada la limitada extensión, se revisan solo las características fundamentales, desarrollándose algunos aspectos en profundidad en otros capítulos de la presente monografía (efectos adversos, combinaciones de fármacos en diferentes escenarios clínicos y eficacia de las mismas). Se dan algunos datos de resistencias a los diferentes fármacos, pero la interpretación de los estudios de resistencias es compleja y frecuentemente requiere la pericia de un experto, debiendo incluir además la historia de tratamientos ARV previos y los resultados de estudios de resistencia anteriores. Las mutaciones que confieren resistencia a los diferentes fármacos ARV y la importancia de las mismas (scores) se van actualizando periódicamente12. La información disponible sobre las interacciones de los ARV también se renueva con cierta frecuencia y es aconsejable consultar la información actualizada disponible en páginas web13,14 y otras fuentes15, así como las fichas técnicas de los productos y recomendaciones de los organismos oficiales1–3,5,6.
Dosificación de los antirretrovirales en pediatría2-4
Ajuste de dosis de los antirretrovirales en insuficiencia renal y hepática
| Antirretrovirales | Insuficiencia renal | Hemodiálisis/diálisis peritoneal (HD/CAPD) | Insuficiencia hepática (IH) |
| Inhibidores TI, análogos nucleósido | |||
| Abacavir | No requiere ajuste de dosis | Dosis habitual | IH leve (Child-Pugh 5 a 6): 200 mg c/12h. Utilizar la solución oral de Ziagen® (10 ml c/12h) |
| No administrar Combivir® y Trizivir® en pacientes con Cl <50 ml/min (por separado, ajustar dosis adecuadamente) | HD: administrar independientemente de la sesión de HD, ya que se elimina mínimamente | IH moderada-grave: la seguridad, eficacia y propiedades farmacocinéticas no han sido evaluadas. Evitar en lo posible su uso | |
| ddI (didanosina, cápsulas entéricas) | ≥ 60 kgCl ≥60: 400 mg c/24hCl 30-59: 200 mg c/24hCl 10-29: 125 mg c/24hCl <10: 125 mg c/24h | HD/CAPD: 125 mg c/24h; los días de HD administrar post-HD/CAPD (no requiere suplemento) | Riesgo elevado de toxicidad hepática y descompensaciónEn pacientes cirróticos, no se recomienda el uso de didanosinaEn pacientes en tratamiento del VHC didanosina no debe administrarse conjuntamente con ribavirina |
| <60 kgCl ≥60: 250 mg c/24hCl 30-59: 125 mg c/24hCl 10-29: 125 mg c/24hCl <10: no existen presentaciones adecuadas. Emplear Videx® polvo para solución pediátrica 75 mg/24h | HD/CAPD: no existen presentaciones adecuadas. Emplear Videx® polvo para solución pediátrica 75 mg/24h | ||
| FTC (emtricitabina) | En cápsulasCl ≥50: 200 mg c/24hCl 30-49: 200 mg c/48hCl 15-29: 200 mg c/72hCl <15: 200 mg c/96h | HD: en comprimidos 200 mg c/96h, en solución (10 mg/ml) 60 mg (6 ml) c/24hLos días de HD administrar post-HD | Dosis habitual (no hay datos, pero en base a su mínimo metabolismo hepático, es poco probable que requiera ajuste de dosis) |
| En solución (10 mg/ml)a:Cl ≥50: 240 mg (24 ml) c/24hCl 30-49: 120 mg (12 ml)c/24hCl 15-29: 80 mg (8 ml) c/24hCl <15: 60 mg (6 ml) c/24hTruvada®: no administrar a pacientes con Cl < 30 ml/min | No se ha estudiado en diálisis peritonealTruvada®: no administrar a pacientes en HD (administrar los componentes por separado, ajustando dosis adecuadamente) | ||
| d4T (estavudina) | ≥60 kgCl ≥50: 40 mg c/12hCl 26-49: 20 mg c/12hCl ≤25: 20 mg c/24h | HD: 20 mg c/24h; los días de HD administrar post-HD | Dosis habitual. Utilizar con precaución por el riesgo de toxicidad mitocondrial y esteatosis hepática |
| <60 kgCl ≥50: 30 mg c/12hCl 26-49: 15 mg c/12hCl ≤25: 15 mg c/24h | HD: 15 mg c/24h; los días de HD administrar post-HD | ||
| 3TC (lamivudina) | Cl ≥50: 150 mg c/12h o 300 mg c/24hCl 30-49: 150 mg c/24h (primera dosis de 150 mg)Cl 15-29: 100 mg c/24h (primera dosis 150 mg)Cl 5-14: 50 mg c/24h (primera dosis 150 mg)Cl <5: 25 mg c/24h (primera dosis 50 mg)No administrar Combivir® y Trizivir® si Cl <50 ml/min (administrar los componentes por separado, ajustando dosis adecuadamente) | HD: 25 mg c/24h (primera dosis 50 mg) Los días de la HD, administrar post-HD | Dosis habitual |
| AZT (zidovudina) | Puede acumularse el metabolito glucurónido (GAZT)Cl 10-50: 250-300 mg c/12hCl <10: 250-300 mg c/24h.No administrar Combivir® y Trizivir® en pacientes con Cl <50 ml/min (administrar los componentes por separado, ajustando dosis adecuadamente) | 300 mg c/24hHD/CAPD: no afecta la eliminación de AZT y aumenta la eliminación de GAZT. Por precaución, se recomienda administrar la dosis diaria post-HD/CAPD | Se ha observado una reducción del aclaramiento oral de zidovudina el 32%, 63% y 70%, respectivamente, en pacientes con IH leve, moderada-grave o cirrosis comprobada por biopsia, en comparación con sujetos sin alteración hepáticaAlgunos autores sugieren reducir la dosis a 200 mg c/12h en pacientes con IH grave. Se recomienda monitorizar estrechamente la aparición de toxicidad hematológica |
| Inhibidores TI, análogos nucleótido | |||
| TDF (tenofovir) | Cl ≥ 50: no requiere ajuste de dosisCl 30-49: 300 mg c/48hCl 10-29: 300 mg c/72 a 96hNo hay recomendaciones disponibles para pacientes con Cl <10 sin HD | HD: habitualmente 300 mg una vez por semana, después de una de las sesiones (asumiendo 3 sesiones de diálisis semanales de 4h) | Dosis habitual |
| Inhibidores de la TI, no análogos | |||
| EFV (efavirenz) | No requiere ajuste de dosis | HD: no parece necesario ajustar la dosis | IH leve a moderada: dosis habitual. Dada la elevada variabilidad interindividual, se recomienda monitorizar niveles plasmáticos y aparición de efectos adversos, especialmente a nivel de SNC |
| Atripla®: en pacientes con Cl <50 ml/min, utilizar los principios activos por separado | CAPD: un estudio farmacocinético preliminar indica que no se requiere ajuste de dosis (datos de un solo paciente) | IH grave: datos escasos. Evitar en lo posible su uso/ monitorizar niveles plasmáticos. En un paciente con Child Pugh grado C, la semivida de EFV se duplicó. En dos pacientes con IH (uno de ellos con cirrosis) el AUC de EFV aumentó 4 veces. En 3 pacientes con fibrosis >12 kPa (Fibroscan®) la Cmin fue 2,5 veces superior a la obtenida en 15 pacientes coinfectados por VHC con fibrosis <12kPa. | |
| En otro estudio el 31% de los pacientes cirróticos presentaron unas concentraciones >4.000 ng/ml, en comparación con un 3% en los coinfectados no cirróticos | |||
| NVP (nevirapina) | No requiere ajuste de dosis | HD: los días de HD, se recomienda administrar la dosis después de la HD o un suplemento de 200 mg post-hemodiálisis | IH leve a moderada (Child-Pugh ≤7): dosis habitual. Sin embargo, en pacientes con IH moderada, se recomienda monitorizar estrechamente niveles plasmáticos y aparición de efectos adversos. En un estudio en 4 pacientes con IH moderada (Child-Pugh B), el AUC de NVP aumentó 41%IH grave: evitar en lo posible su uso (hepatotoxicidad)En el estudio NEVADOSE 66% de los pacientes con un mayor grado de fibrosis (F4; Fibroscan®) presentaron una Cmin de NVP por encima del límite superior de normalidad (>6.000 ng/ml). En otro estudio el 50% de los pacientes cirróticos presentaron unas concentraciones > 8.000 ng/ml, en comparación con un 27% en los coinfectados no cirróticosSe ha observado un aumento de riesgo de hepatotoxicidad en pacientes sin tratamiento previo con CD4 >250 céls/μl (mujeres) o >400 céls/μl (hombres) |
| ETR (etravirina) | NRAD | HD/CAPD: por su elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD | IH leve o moderada: no requiere ajuste de dosisIH grave: no hay datos; evitar en lo posible su uso |
| Inhibidores de la proteasa | |||
| ATV (atazanavir) | No requiere ajuste de dosis | HD/CAPD: por su elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD | IH leve: según un estudio en pacientes coinfectados con VHC con IH leve a moderada, el ATV no potenciado (400 mg/24h) puede no llegar a alcanzar la Cmín deseada (6/9 pacientes con niveles subterapéuticos). Se recomienda usar ATV potenciado con RTV (300/100 mg /24h), |
| HD: se recomienda su uso potenciado (ATV/r 300/100) para compensar el descenso de concentración de ATV (reducción del 28% en el AUC de ATV los días sin HD y del 42% los días de HD; la eliminación a través de la HD es de sólo el 2%). Monitorizar niveles plasmáticos cuando sea posible. (Según la ficha técnica del producto no se recomienda el uso de ATV/r en HD por falta de datos) | IH moderada-grave: la AgenciaEuropea del Medicamento desaconseja el uso de atazanavir potenciado en este contexto por falta de datosEn 9 pacientes con fibrosis >12 kPa (Fibroscan®) que recibieron ATV/r, la Cmin fue comparable a la obtenida en 26 pacientes coinfectados por VHC con fibrosis<12 kPa. Un estudio en 12 pacientes coinfectados por VHC tratados con ATV/r, el AUC fue solo un 36% superior en los pacientes cirróticos (n=7)Monitorizar niveles plasmáticos cuando sea posible | ||
| DRV (darunavir) | IR leve, moderada o grave: no requiere ajuste de dosis | HD/CAPD: debido a la elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD | IH leve o moderada: no requiere ajuste de dosisIH grave: no hay datos; evitar en lo posible su uso |
| FPV (fosamprenavir) | No requiere ajuste de dosis | HD/CAPD: debido a su elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD | FPV (no potenciado, sólo en pacientes naive) (Indicacion no autorizada por la EMEA; recomendaciones según ficha técnica americana de Lexiva®):IH leve a moderada (Child-Pugh 5-9): 700 mg c/12hIH grave (Child-Pugh 10-15): 350 mg c/12h, con precauciónSe recomienda la monitorizar niveles plasmáticos cuando sea posibleFPV/r:IH leve (Child Pugh 5-6): FPV 700 mg c/12h + RTV 100 mg c/24hIH moderada (Child Pugh 7-9): FPV 450 mg c/12h + RTV 100 mg c/24hEn IH grave (Child Pugh 10-15): FPV 300 mg c/12h + RTV 100 mg c/24h (usar solución oral de FPV)En un estudio los pacientes cirróticos (n=6) presentaron una Cmin 2 veces mayor y AUC 43% mayor. En otro estudio, en 2 pacientes con fibrosis >12 kPa (Fibroscan®) la Cmin fue comparable a la obtenida en 6 pacientes coinfectados por VHC con fibrosis<12 kPaSe recomienda motorizar niveles plasmáticos cuando sea posible |
| LPV/r (lopinavir/r) | No requiere ajuste de dosis | HD: el AUC de LPV/r en 13 pacientes en HD fue equivalente al de pacientes con función renal normal. No ajuste de dosis.CAPD: no hay datos. Debido a la elevada unión a proteínas plasmáticas de lopinavir y ritonavir, no es de esperar que se elimine en las sesiones de CAPD | En un estudio los pacientes coinfectados por VHC con cirrosis hepática sin signos de IH (n=7) presentaron un aumento del 100% en el AUC y la Cmin de ritonavir, pero sin diferencias en la exposición a lopinavirUn estudio en pacientes con IH leve (n=6) o moderada (n=6) mostró un aumento significativo en la exposición tanto a lopinavir como a ritonavir. Sin embargo, la relevancia clínica de estos cambios no está clara por lo que no se aconseja modificar las dosis de lopinavir en este escenarioSe recomienda monitorizar niveles plasmáticos cuando sea posible |
| RTV (ritonavir) | No requiere ajuste de dosis | HD/CAPD: debido a la elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD | No usar RTV a dosis plenas por el riesgo de hepatotoxicidad |
| Ritonavir como potenciador farmacocinético: | |||
| IH leve a moderada: dosis habitual | |||
| IH grave: no hay datos. Evitar en lo posible su uso | |||
| No se debe administrar ritonavir como potenciador farmacocinético en aquellos pacientes que tengan descompensada la función hepática | |||
| Consultar datos específicos sobre el inhibidor de la proteasa potenciado con el ritonavir | |||
| SQV (saquinavir) | No requiere ajuste de dosis | HD/CAPD: debido a la elevada unión a proteínas plasmáticas de saquinavir, no es de esperar que se elimine en las sesiones de HD/CAPD. Datos de un paciente indican escasa eliminación a través de HD | IH leve-moderada: dosis habitualIH grave: no hay datos. Evitar en lo posible su uso. Contraindicado en pacientes con insuficiencia hepática descompensadaSe recomienda monitorizar niveles plasmáticos cuando sea posible |
| TPV (tipranavir) | No requiere ajuste de dosis. | HD/CAPD: debido a la elevada unión a proteínas plasmáticas de TPV/RTV, no es de esperar que se eliminen en las sesiones de HD/CAPD | Datos limitados. Elevado riesgo de toxicidad hepática: TPV/r se ha relacionado con casos de hepatitis clínica y descompensación hepática, incluyendo algunos casos mortales. Se recomienda un estrecho seguimiento de los pacientes coinfectados por VHB o VHC, por el aumento de riesgo de hepatotoxicidad que presentanIH leve (Child-Pugh A): dosis habitualIH moderada o grave (Child-Pugh B y C): contraindicado |
| Inhibidores de la fusión | |||
| Enfuvirtide (T-20) | No requiere ajuste de dosis | HD: No requiere ajuste de dosis | No hay datos. Algunos autores recomiendan utilizar la dosis habitual |
| Inhibidores correceptor CCR5 | |||
| MVR (maraviroc) | En ausencia de inhibidores potentes del CYP3A4 probablemente no requiera ajuste de dosisSólo se recomienda un ajuste de dosis en pacientes con Cl <80 ml/min y que están recibiendo inhibidores potentes del CYP3A4, como los IP (excepto TPV/r), ketoconazol, itraconazol, claritromicina o telitromicina: en estos casos administrar 150 mg c/24h. Si el Cl es <30 ml/min se recomienda mucha precaución debido al aumento de riesgo de hipotensión posturalCon Cl <80 ml/min y en combinación con FPV/r administrar 150 mg c/12h(Estos ajustes de dosis se recomiendan basándose en los datos de un estudio en insuficiencia renal y simulaciones farmacocinéticas, sin que su seguridad y eficacia hayan sido evaluadas clínicamente, por lo que se recomienda una estrecha monitorización) | HD: en ausencia de inhibidores potentes del CYP3A4 no se requiere ajuste de dosis. En presencia de los mismos, dosificar igual que para Cl <80 ml/min (datos limitados) | Datos de un estudio con dosis únicas de 300 mg MVR. En comparación con los voluntarios con función hepática normal:IH leve: +25% AUCIH moderada: +45% AUCIH grave: no hay datosSe desconoce la importancia clínica que estos aumentos pueden suponerSe ha descrito un caso de posible hepatotoxicidad precedido de una reacción alérgica sistémica |
| Inhibidores de la integrasa | |||
| RAL (raltegravir) | No requiere ajuste de dosis | HD: no es probable que RAL se elimine significativamente a través de la HD. Datos de dos pacientes con ERCA mostraron la ausencia de eliminación de RAL durante una sesión de HD de 4 horas | IH leve-moderada: no requiere ajuste de dosisIH grave: no hay estudios. Utilizar con precaución |
AN: análogos de nucleósidos; ANt: análogos de nucleótidos, CH: cirrosis hepática; Cl: aclaramiento de creatinina en ml/min; ERCA: enfermedad renal crónica avanzada, HD: hemodiálisis; IH: insuficiencia hepática; IP: inhibidores de la proteasa; IR: insuficiencia renal; NN: inhibidores de la transcriptasa inversa no análogos de nucleósidos.
Son fármacos que inhiben la transcriptasa inversa del VIH por un mecanismo competitivo con los nucleósidos/nucleótidos fisiológicos, de los que difieren únicamente en pequeños cambios en la molécula de ribosa. Los ITIAN se incorporan a la cadena de DNA viral, interrumpiendo la elongación de la misma y, como consecuencia, la replicación viral.
Se dividen en análogos de bases púricas: adenosina (didanosina) y guanosina (abacavir) y análogos de bases pirimidínicas: timidina (zidovudina y estavudina) y citidina (emtricitabina, lamivudina). Estos fármacos requieren tres fosforilaciones en el interior de la célula para activarse. En cambio, tenofovir es un análogo de nucleótidos (análogo de adenina), por lo que requiere una fosforilación menos para activarse.
En el metabolismo de los ITIAN no interviene el sistema enzimático del citocromo P450 y estos fármacos son poco susceptibles de padecer interacciones metabólicas relevantes. ZDV y ABC se glucuronidan, por lo que otros fármacos que afecten la glucuronidación pueden modificar sus concentraciones. Sin embargo, las interacciones de los análogos de nucleósidos se deben fundamentalmente a la potenciación de su toxicidad, por ej. anemia con la asociación de AZT a ribavirina, cotrimoxazol, o ganciclovir, entre otros. No se recomienda la asociación de ribavirina y didanosina por aumento del riesgo de toxicidad mitocondrial (pancreatitis, acidosis láctica). En lo posible se evitará también el uso simultáneo de ribavirina con ZDV o d4T por toxicidad hematológica o mitocondrial. Lamivudina, emtricitabina, estavudina y tenofovir se eliminan principalmente por vía renal. Se ha descrito aumento del riesgo de toxicidad renal al asociar tenofovir a algunos inhibidores de la proteasa potenciados con ritonavir. La combinación de tenofovir con otros fármacos nefrotóxicos debe evitarse en lo posible13-15.
La resistencia de clase más característica del VIH a los ITIAN se debe a la aparición de combinaciones variables de las mutaciones denominadas TAM o NAM (tymidine or nucleoside associated mutations)12,16. Son 6 mutaciones en la región del gen pol del VIH que codifica la transcriptasa inversa: M41L, D67N, K70R, L210W, T215Y/F, K219Q/E. El grado de resistencia a los diferentes ITIAN depende del número y de las mutaciones presentes. Además existen unas mutaciones en aquel mismo gen que confieren resistencia concreta a uno o varios ITIAN. Así, la mutación M184V/I confiere resistencia completa a lamivudina y emtricitabina, la L74V es característica de didanosina y la K65R disminuye la sensibilidad a los ITIAN no timidínicos. Con muy poca frecuencia pueden seleccionarse complejos de multirresistencia a los ITIAN. El complejo de la 151 (A62V, V75I, F77L, F116Y, Q151M) afecta a todos los nucleósidos a excepción del tenofovir. El complejo de inserción 69 (M41L, A62V, 69 inser, K70R, L210W, T215Y/F, K219Q/E) afecta a todos los ITIAN.
Los efectos adversos más característicos de los ITIAN aparecen a largo plazo y se relacionan con su toxicidad mitocondrial17. Los mecanismos de disfunción mitocondrial y celular son complejos, destacando entre otros el hecho de que estos fármacos, además de inhibir la transcriptasa inversa viral, pueden inhibir la DNA polimerasa gamma mitocondrial. Aunque por su mecanismo de acción todos los análogos pueden producir toxicidad mitocondrial, se produce con más frecuencia con los análogos de timidina. Dependiendo del fármaco y del tejido implicado, las manifestaciones clínicas pueden ser muy variables: miopatía (zidovudina), neuropatía (estavudina, didanosina, zalcitabina), esteatosis hepática y acidosis láctica (didanosina, estavudina, zidovudina), pancreatitis (didanosina, estavudina) y lipoatrofia periférica (posiblemente todos los análogos pero predominantemente con estavudina y también zidovudina)18,19. La mayoría de los ITIAN tienen algún efecto adverso más o menos característico.
Se han comercializado un total de 8 ITIAN, uno de los cuales (zalcitabina, ddC) se retiró del mercado por su toxicidad y compleja posología. Actualmente están disponibles 7, que por orden alfabético son: abacavir, didanosina, emtricitabina, estavudina, lamivudina, tenofovir y zidovudina.
Abacavir (ABC)Abacavir se comercializa individualmente como Ziagen® comprimidos de 300mg y solución oral con 20mg/ml o en asociación a dosis fijas (combos) con otros ITIAN (Kivexa® comprimidos que contienen lamivudina 300mg y abacavir 600mg; Trizivir® comprimidos con zidovudina 300mg, lamivudina 150mg y abacavir 300mg).
La dosificación habitual de abacavir en el adulto es de 300mg/12h o 600mg/24h. Su dosificación en pediatría se indica en la tabla 1. Puede tomarse con o sin alimentos. No requiere ajuste de dosis en insuficiencia renal (tabla 2). Sus características farmacocinéticas se indican en la tabla 3. Se metaboliza principalmente en el hígado excretándose aproximadamente un 2% de la dosis administrada por vía renal, como compuesto inalterado. Las principales vías metabólicas en el hombre son la glucuronidación y la vía de la alcohol deshidrogenasa. A pesar de ello, su interacción con el etanol no se considera clínicamente relevante. En general, el riesgo de interacción de abacavir con otros fármacos es escaso. En algunos estudios se ha sugerido que abacavir podría disminuir la eficacia de ribavirina frente al VHC20, pero en otros no se ha confirmado esta interacción6.
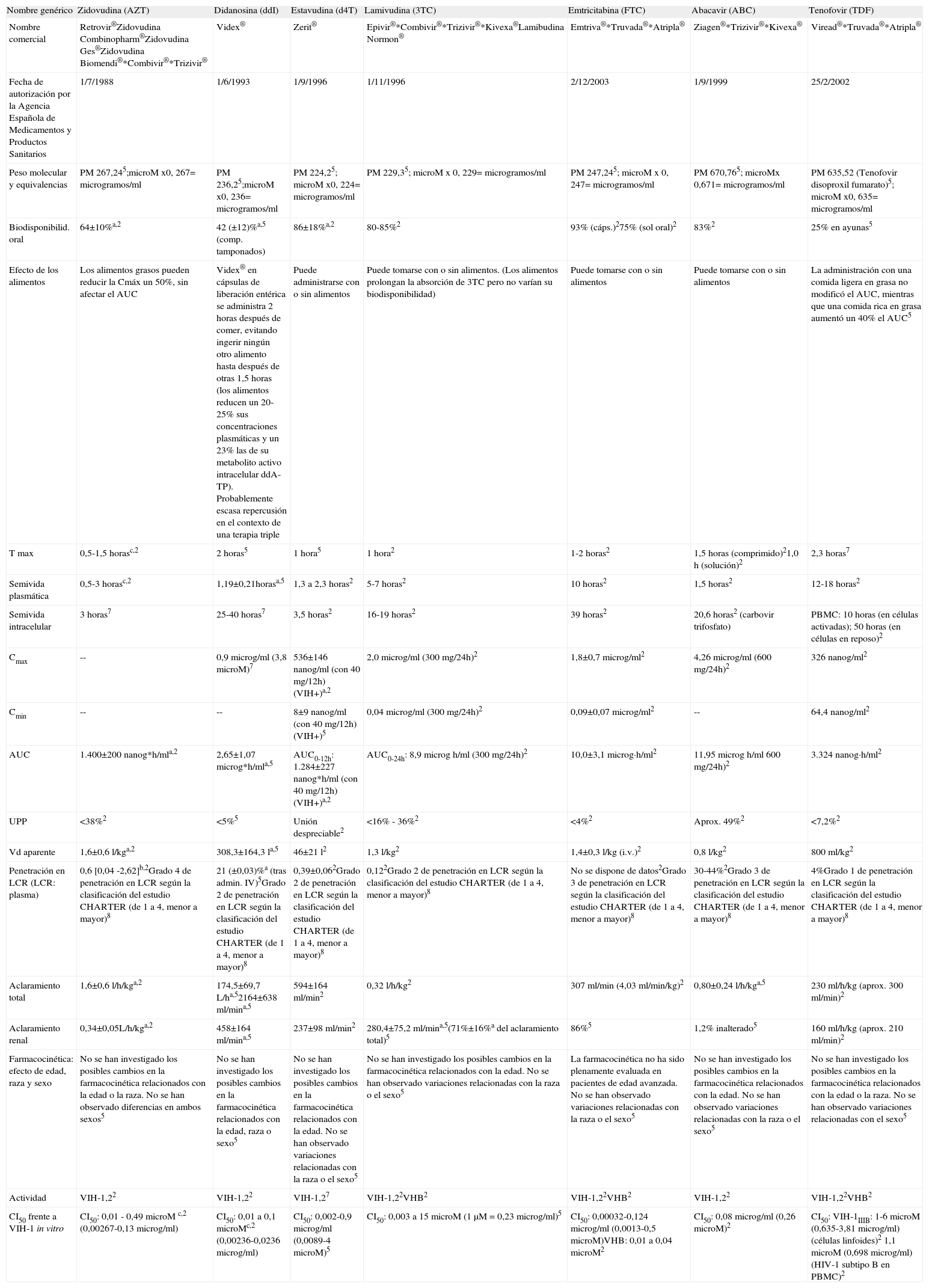
Inhibidores de la transcriptasa inversa análogos de nucleósidos y de nucleótidos (parámetros farmacocinéticos en población adulta)
| Nombre genérico | Zidovudina (AZT) | Didanosina (ddI) | Estavudina (d4T) | Lamivudina (3TC) | Emtricitabina (FTC) | Abacavir (ABC) | Tenofovir (TDF) |
| Nombre comercial | Retrovir®Zidovudina Combinopharm®Zidovudina Ges®Zidovudina Biomendi®*Combivir®*Trizivir® | Videx® | Zerit® | Epivir®*Combivir®*Trizivir®*Kivexa®Lamibudina Normon® | Emtriva®*Truvada®*Atripla® | Ziagen®*Trizivir®*Kivexa® | Viread®*Truvada®*Atripla® |
| Fecha de autorización por la Agencia Española de Medicamentos y Productos Sanitarios | 1/7/1988 | 1/6/1993 | 1/9/1996 | 1/11/1996 | 2/12/2003 | 1/9/1999 | 25/2/2002 |
| Peso molecular y equivalencias | PM 267,245;microM x0, 267= microgramos/ml | PM 236,25;microM x0, 236= microgramos/ml | PM 224,25; microM x0, 224= microgramos/ml | PM 229,35; microM x 0, 229= microgramos/ml | PM 247,245; microM x 0, 247= microgramos/ml | PM 670,765; microMx 0,671= microgramos/ml | PM 635,52 (Tenofovir disoproxil fumarato)5; microM x0, 635= microgramos/ml |
| Biodisponibilid. oral | 64±10%a,2 | 42 (±12)%a,5 (comp. tamponados) | 86±18%a,2 | 80-85%2 | 93% (cáps.)275% (sol oral)2 | 83%2 | 25% en ayunas5 |
| Efecto de los alimentos | Los alimentos grasos pueden reducir la Cmáx un 50%, sin afectar el AUC | Videx® en cápsulas de liberación entérica se administra 2 horas después de comer, evitando ingerir ningún otro alimento hasta después de otras 1,5 horas (los alimentos reducen un 20-25% sus concentraciones plasmáticas y un 23% las de su metabolito activo intracelular ddA-TP). Probablemente escasa repercusión en el contexto de una terapia triple | Puede administrarse con o sin alimentos | Puede tomarse con o sin alimentos. (Los alimentos prolongan la absorción de 3TC pero no varían su biodisponibilidad) | Puede tomarse con o sin alimentos | Puede tomarse con o sin alimentos | La administración con una comida ligera en grasa no modificó el AUC, mientras que una comida rica en grasa aumentó un 40% el AUC5 |
| T max | 0,5-1,5 horasc,2 | 2 horas5 | 1 hora5 | 1 hora2 | 1-2 horas2 | 1,5 horas (comprimido)21,0 h (solución)2 | 2,3 horas7 |
| Semivida plasmática | 0,5-3 horasc,2 | 1,19±0,21horasa,5 | 1,3 a 2,3 horas2 | 5-7 horas2 | 10 horas2 | 1,5 horas2 | 12-18 horas2 |
| Semivida intracelular | 3 horas7 | 25-40 horas7 | 3,5 horas2 | 16-19 horas2 | 39 horas2 | 20,6 horas2 (carbovir trifosfato) | PBMC: 10 horas (en células activadas); 50 horas (en células en reposo)2 |
| Cmax | -- | 0,9 microg/ml (3,8 microM)7 | 536±146 nanog/ml (con 40 mg/12h)(VIH+)a,2 | 2,0 microg/ml (300 mg/24h)2 | 1,8±0,7 microg/ml2 | 4,26 microg/ml (600 mg/24h)2 | 326 nanog/ml2 |
| Cmin | -- | -- | 8±9 nanog/ml (con 40 mg/12h) (VIH+)5 | 0,04 microg/ml (300 mg/24h)2 | 0,09±0,07 microg/ml2 | -- | 64,4 nanog/ml2 |
| AUC | 1.400±200 nanog*h/mla,2 | 2,65±1,07 microg*h/mla,5 | AUC0-12h: 1.284±227 nanog*h/ml (con 40 mg/12h) (VIH+)a,2 | AUC0-24h: 8,9 microg h/ml (300 mg/24h)2 | 10,0±3,1 microg·h/ml2 | 11,95 microg h/ml 600 mg/24h)2 | 3.324 nanog·h/ml2 |
| UPP | <38%2 | <5%5 | Unión despreciable2 | <16% - 36%2 | <4%2 | Aprox. 49%2 | <7,2%2 |
| Vd aparente | 1,6±0,6 l/kga,2 | 308,3±164,3 la,5 | 46±21 l2 | 1,3 l/kg2 | 1,4±0,3 l/kg (i.v.)2 | 0,8 l/kg2 | 800 ml/kg2 |
| Penetración en LCR (LCR: plasma) | 0,6 [0,04 -2,62]b,2Grado 4 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 | 21 (±0,03)%a (tras admin. IV)5Grado 2 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 | 0,39±0,062Grado 2 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 | 0,122Grado 2 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 | No se dispone de datos2Grado 3 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 | 30-44%2Grado 3 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 | 4%Grado 1 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 |
| Aclaramiento total | 1,6±0,6 l/h/kga,2 | 174,5±69,7 L/ha,52164±638 ml/mina,5 | 594±164 ml/min2 | 0,32 l/h/kg2 | 307 ml/min (4,03 ml/min/kg)2 | 0,80±0,24 l/h/kga,5 | 230 ml/h/kg (aprox. 300 ml/min)2 |
| Aclaramiento renal | 0,34±0,05L/h/kga,2 | 458±164 ml/mina,5 | 237±98 ml/min2 | 280,4±75,2 ml/mina,5(71%±16%a del aclaramiento total)5 | 86%5 | 1,2% inalterado5 | 160 ml/h/kg (aprox. 210 ml/min)2 |
| Farmacocinética: efecto de edad, raza y sexo | No se han investigado los posibles cambios en la farmacocinética relacionados con la edad o la raza. No se han observado diferencias en ambos sexos5 | No se han investigado los posibles cambios en la farmacocinética relacionados con la edad, raza o sexo5 | No se han investigado los posibles cambios en la farmacocinética relacionados con la edad. No se han observado variaciones relacionadas con la raza o el sexo5 | No se han investigado los posibles cambios en la farmacocinética relacionados con la edad. No se han observado variaciones relacionadas con la raza o el sexo5 | La farmacocinética no ha sido plenamente evaluada en pacientes de edad avanzada. No se han observado variaciones relacionadas con la raza o el sexo5 | No se han investigado los posibles cambios en la farmacocinética relacionados con la edad. No se han observado variaciones relacionadas con la raza o el sexo5 | No se han investigado los posibles cambios en la farmacocinética relacionados con la edad o la raza. No se han observado variaciones relacionadas con el sexo5 |
| Actividad | VIH-1,22 | VIH-1,22 | VIH-1,27 | VIH-1,22VHB2 | VIH-1,22VHB2 | VIH-1,22 | VIH-1,22VHB2 |
| CI50 frente a VIH-1 in vitro | CI50: 0,01 - 0,49 microM c,2 (0,00267-0,13 microg/ml) | CI50: 0,01 a 0,1 microMc,2 (0,00236-0,0236 microg/ml) | CI50: 0,002-0,9 microg/ml (0,0089-4 microM)5 | CI50: 0,003 a 15 microM (1μM = 0,23 microg/ml)5 | CI50: 0,00032-0,124 microg/ml (0,0013-0,5 microM)VHB: 0,01 a 0,04 microM2 | CI50: 0,08 microg/ml (0,26 microM)2 | CI50: VIH-1IIIB: 1-6 microM (0,635-3,81 microg/ml) (células linfoides)2 1,1 microM (0,698 microg/ml) (HIV-1 subtipo B en PBMC)2 |
aExpresado como media ± DE si no se indica lo contrario.
bExpresado como mediana ± rango intercuartil.
cExpresado como rango.
*Combinaciones de antirretrovirales a dosis fijas: Combivir® (zidovudina/lamivudina 300/150 mg), Trizivir® (zidovudina/lamivudina/abacavir 300/150/300 mg), Kivexa® (abacavir/lamivudina 600/300 mg), Truvada® (emtricitabina/tenofovir 200/245 mg), Atripla® (efavirenz/emtricitabina/tenofovir 600/200/245 mg).
Múltiples mutaciones en el gen pol se asocian a disminución de la sensibilidad a abacavir (K65R, L74V, Y115F, M184V, TAM, complejos de inserción 69 y Q151M)2. En general se necesitan tres o más mutaciones para observar una disminución clínicamente importante de la sensibilidad.
Abacavir es un fármaco generalmente bien tolerado21. No se ha asociado a toxicidad a largo plazo. Los efectos adversos más frecuentes son náuseas, dolor abdominal, malestar general y cefaleas, descritos en alrededor del 7% de los pacientes que han participado en los estudios de desarrollo clínico. El efecto adverso más característico y grave de abacavir es una reacción de hipersensibilidad que aparece en aproximadamente el 5% de pacientes. Suele manifestarse como un síndrome multiorgánico con una erupción cutánea eritematosa que suele aparecer las 6 primeras semanas de tratamiento, aunque puede hacerlo más tardíamente, asociada a síntomas más inespecíficos como fiebre, náuseas, vómitos, malestar, diarrea, mialgias o artralgias. Existe una clara predisposición genética para la hipersensibilidad a abacavir asociada principalmente al haplotipo HLA-B*5701, presentándola más de la mitad de pacientes con este alelo y siendo absolutamente excepcional sin el mismo. En el estudio PREDICT en el grupo en que se realizó el cribado prospectivo no se observó ningún caso de reacción de hipersensibilidad a abacavir confirmada inmunológicamente. Actualmente debe determinarse el HLA B*5701 a todos los pacientes antes de comenzar tratamiento con abacavir6. Si el HLA B*5701 es positivo no se debe prescribir ABC. En caso de sospecha de reacción de hipersensibilidad a abacavir no debe reintroducirse jamás el fármaco por la posibilidad de presentar una reacción muy grave. Algunos estudios han sugerido que abacavir incrementa el riesgo cardiovascular pero otros no han hallado tal asociación. Las guías terapéuticas de GESIDA/PNS indican que no hay datos para concluir que la combinación ABC+3TC incrementa el riesgo de padecer infarto de miocardio6.
Didanosina (ddI)Didanosina fue el segundo ARV disponible. Desde su comercialización ha variado notablemente su presentación farmacéutica para mejorar su posología y su tolerabilidad. Se comercializa en comprimidos tamponados de 25, 50,100 y 150mg. Desde 2004 se encuentra también disponible en cápsulas gastrorresistentes22 de 125, 200, 250 y 400mg y polvo no tamponado para solución oral de 2g (5 o 10mg/ml en función del volumen añadido).
La dosificación habitual en el adulto varía en función del peso: 250mg/día en pacientes de menos de 60kg y 400mg/día en los de 60kg o más. En pediatría, la dosis depende de la superficie corporal, recomendándose en niños ≥ 3 meses 240mg/m2/día (180mg/m2/día de didanosina en combinación con zidovudina) (tabla 1). El laboratorio fabricante recomienda la administración en ayunas; sin embargo la administración de las cápsulas entéricas junto con alimentos no parece que en el contexto de una terapia combinada vaya a tener una repercusión clínica negativa. Debe ajustarse la dosis de didanosina en insuficiencia renal y no se recomienda su uso en pacientes cirróticos debido al elevado riesgo de toxicidad hepática. En pacientes que reciban tratamiento para el VHC, cabe recordar que no debe administrarse conjuntamente con ribavirina por aumento del riesgo de toxicidad (fallo hepático, pancreatitis, neuropatía periférica y acidosis láctica).
Sus características farmacocinéticas se indican en la tabla 3. La vía de eliminación de didanosina es la de las purinas endógenas, por lo que alopurinol puede aumentar sus concentraciones. Con la formulación en cápsulas entéricas las interacciones son escasas. Cabe destacar la interacción con tenofovir, que aumenta su toxicidad, siendo recomendable evitar su asociación y en caso de asociarse se reducirá la dosis de ddI. Didanosina no debe asociarse con estavudina por el elevado riesgo de toxicidad mitocondrial potencialmente grave13–15.
El efecto adverso más característico de didanosina, aunque infrecuente, es la pancreatitis aguda, así como otras manifestaciones atribuibles a toxicidad mitocondrial (neuropatía periférica)18,19.
Emtricitabina (FTC)Emtricitabina se comercializa individualmente como Emtriva® en cápsulas de 200mg y solución oral con 10mg/ml y asociado a dosis fijas de otros ARV (Truvada® comprimidos con emtricitabina 200mg y tenofovir 245mg y Atripla® comprimidos que contienen emtricitabina 200mg, tenofovir 245mg y efavirenz 600mg).
La dosificación recomendada en el adulto es de 200mg/24h (240mg/24h en caso de solución oral). Esta diferencia viene dada por la distinta biodisponibilidad de ambas formulaciones (93% para las cápsulas y del 75% para la solución oral). Su dosificación en pediatría se indica en la tabla 1. Puede administrarse con o sin alimentos. Sus características farmacocinéticas se indican en la tabla 3. Se elimina mayoritariamente por vía renal, mediante filtración glomerular y secreción tubular activa (86% inalterado) y se recomienda ajustar la dosis en caso de insuficiencia renal, por lo que no deben usarse los combos en pacientes con un aclaramiento de creatinina por debajo de 50ml/min2,23.
Es un fármaco muy bien tolerado y no suele asociarse a efectos adversos23. En alrededor del 3% de pacientes en los que se sustituyó lamivudina por emtricitabina se observaron alteraciones del SNC (inestabilidad cefálica…) que obligaron a suspender la FTC.
Estavudina (d4T)Estavudina se comercializa como Zerit® en cápsulas de 20, 30 y 40mg y solución oral con 1mg/ml 200ml. La dosificación recomendada en el adulto es de 30mg/12h en pacientes de menos de 60kg y de 40mg/12h en aquellos que pesen 60kg o más. Algunos estudios aconsejan administrar dosis inferiores (20 o 30mg/12h según peso < o ≥ a 60kg), con las cuales se mantiene la eficacia virológica y disminuye la toxicidad24. En pediatría 0,5mg/kg c/12h para los recién nacidos hasta 13 días y 1mg/kg/12h desde los 14 días hasta que alcancen un peso < 30kg (tabla 1). A partir de los 30kg se dosifican como los adultos. Puede administrarse con o sin alimentos. Sus características farmacocinéticas se indican en la tabla 3. Requiere ajuste de dosis en caso de insuficiencia renal (el 70% se excreta como fármaco inalterado en orina), mientras que no es necesario el ajuste en caso de insuficiencia hepática (tabla 2). Sin embargo, en este último caso, debe emplearse con precaución por el riesgo de toxicidad mitocondrial y esteatosis hepática.
La tolerabilidad y la eficacia iniciales de estavudina son excelentes, por lo que fue un fármaco ampliamente utilizado tras su comercialización. Los últimos años su prescripción ha descendido drásticamente por su relación con la lipoatrofia y otras manifestaciones de toxicidad mitocondrial18,19.
Lamivudina (3TC)Lamivudina es un fármaco muy similar a emtricitabina6. Se comercializa en el tratamiento de la infección por el VIH como Epivir® en comprimidos de 150mg y 300mg y en solución oral con 10mg/ml 240ml. También se encuentra disponible en genérico (Lamivudina Normon® en comprimidos de 150 y 300mg). También está disponible en las siguientes combinaciones a dosis fijas: Combivir® comprimidos (zidovudina 300mg y lamivudina 150mg), Kivexa® comprimidos (lamivudina 300mg y abacavir 600mg) y Trizivir® comprimidos (zidovudina 300mg, lamivudina 150mg y abacavir 300mg).
La dosificación de lamivudina en el adulto es de 150mg/12h o 300mg/24h. En pediatría, la dosificación recomendada de lamivudina en pacientes de 3 meses a 12 años es de 4mg/kg/12h (máximo 150mg/12h) (tabla 1). Puede tomarse con o sin alimentos.
Las presentaciones que se emplean en el tratamiento de la infección por el VHB son Zeffix® comprimidos de 100mg y solución oral con 5mg/ml. La dosificación en el adulto es de 100mg/24h. No se ha establecido seguridad y eficacia de 3TC en población pediátrica para el tratamiento de la infección por el VHB. Si se planea la retirada de 3TC del tratamiento del VIH, cabe considerar la necesidad de mantener un tratamiento adecuado frente al VHB en pacientes con enfermedad hepática crónica por este virus, pues se han observado recaídas después de interrumpir el tratamiento con lamivudina.
Sus características farmacocinéticas se indican en la tabla 3. Lamivudina se elimina principalmente por vía renal (70% inalterado) y su dosis de lamivudina debe reducirse en pacientes con insuficiencia renal, por lo que no deben emplearse las combinaciones a dosis fijas en pacientes con infección por el VIH cuyo aclaramiento de creatinina sea inferior a 50ml/min20.
La barrera genética del fármaco es muy baja y la mayoría de pacientes en los que se produce un fallo virológico con una combinación que incluye lamivudina desarrollan la mutación M184V/I que confiere resistencia completa a la misma12.
Es un fármaco muy bien tolerado y difícilmente puede atribuirse ningún efecto adverso a lamivudina.
Tenofovir (TDF)Tenofovir es actualmente el ITIAN más ampliamente utilizado en la práctica clínica, junto con emtricitabina o lamivudina25. Se comercializa como Viread® comprimidos que contienen 245mg de tenofovir disoproxil, equivalentes a 300mg de la sal (tenofovir disoproxil fumarato). También está disponible en dos asociaciones a dosis fijas: Truvada® (emtricitabina 200mg y tenofovir 245mg) y Atripla® (emtricitabina 200mg, tenofovir 245mg y efavirenz 600mg).
Para la indicación de infección por el VIH o para el tratamiento de la hepatitis B crónica, la dosis recomendada en el adulto es de 245mg de tenofovir disoproxil (1 comprimido)/24h. En pediatría, no se dispone de datos de seguridad y eficacia en pacientes menores de 18 años (tabla 1). Se recomienda administrar tenofovir con alimentos para aumentar la biodisponibilidad. En circunstancias excepcionales, en pacientes que tienen una especial dificultad para tragar, se puede administrar tenofovir deshaciendo el comprimido en al menos 100ml de agua, zumo de naranja o zumo de uva.
En pacientes coinfectados con el VHB se puede producir una exacerbación de la infección por el VHB si se interrumpe el tratamiento con tenofovir.
Sus características farmacocinéticas se indican en la tabla 3. La mayor parte del fármaco se excreta inalterado en orina (70-80%), tanto por filtración como por un sistema de transporte tubular activo, y la dosis debe ajustarse en caso de insuficiencia renal. Al igual que los otros ITIAN es un fármaco con poco potencial de interacciones relevantes, aunque pueden producirse algunas interacciones a priori poco esperables. Así tenofovir aumenta la biodisponibilidad de didanosina, siendo recomendable disminuir su dosis en caso de coadministración, disminuye las concentraciones de atazanavir, no siendo recomendable coadministrarlo con atazanavir no potenciado sin monitorizacion de sus concentraciones plasmáticas y aumenta considerablemente las concentraciones de raltegravir, sin que sea preciso ajustar las dosis. Los inhibidores de la proteasa potenciados aumentan ligeramente las concentraciones de tenofovir sin que sea preciso ajustar las dosis13–15.
La mutación más característica de tenofovir es la K65R, aunque su frecuencia es muy baja incluso en pacientes con fracaso virológico a un régimen con el fármaco. Otras mutaciones que disminuyen la sensibilidad a tenofovir son la K70E, las TAM y el complejo de inserción 6912.
Es un fármaco generalmente muy bien tolerado, con un excelente perfil metabólico y sin potencial toxicidad mitocondrial. La toxicidad renal es su efecto adverso más característico, potenciándose si se coadministra con otros fármacos nefrotóxicos26. También se ha descrito una mayor pérdida de densidad mineral ósea que con otros ITIAN, aunque ello se produce al inicio del tratamiento, sin que parezca progresar tras un seguimiento prolongado y sin que se haya asociado a alteraciones clínicas.
Zidovudina (AZT)Fue el primer fármaco disponible para el tratamiento de la infección por el VIH27. Existen diversas presentaciones comerciales de Retrovir®: cápsulas de 100, 250 y 300mg, solución oral con 10mg/ml y vial i.v. con 10mg/ml. También se encuentra disponible en diversos genéricos: Zidovudina Combino Pharm® EFG (cápsulas de 100, 250 y 300mg y sol. oral 10mg/ml), Zidovudina G.E.S. (cápsulas de 100, 250 y 300mg y sol. para inyección 2mg/ml) y Zidovudina Biomendi (sol. para inyección 2mg/ml). Combivir® comprimidos es una asociación a dosis fijas de zidovudina 300mg y lamivudina 150mg. Trizivir® comprimidos es una asociación a dosis fijas de zidovudina 300mg, lamivudina 150mg y abacavir 300mg.
La dosificación en adultos es de 250-300mg/12h. La dosis recomendada en niños de 3 meses a 12 años es de 360 a 480mg/m2 al día, divididos en 3 o 4 dosis (dosis máxima 200mg/6h). Se puede administrar con o sin alimentos. Sus características farmacocinéticas se indican en la tabla 3. Zidovudina es metabolizada principalmente mediante glucuronidación hepática, aunque el 25% se elimina inalterada por orina y se requiere ajuste de dosis en insuficiencia renal (tabla 2)13–15.
Sus principales efectos adversos son la mielotoxicidad, especialmente la anemia, reversible tras la retirada del fármaco y la pérdida de grasa subcutánea (lipoatrofia), menos importante que con estavudina, pero también estigmatizante y muy difícilmente corregible. Mucho menos frecuentes son otras manifestaciones de toxicidad mitocondrial (miopatía, cardiopatía…)18,19.
Durante mucho tiempo se utilizó ampliamente en la práctica clínica habitual, considerándose que jugaba un papel especial en situaciones clínicas tales como la trombocitopenia asociada al VIH, la profilaxis postexposición y la prevención de la transmisión vertical. Actualmente su uso ha descendido drásticamente en los países desarrollados por la disponibilidad de ITIAN menos tóxicos y de múltiples fármacos de otras familias de ARV6.
Inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINN) (tablas 1, 2 y 4)Son fármacos que inhiben la transcriptasa inversa del VIH por un mecanismo no competitivo. Constituyen un grupo heterogéneo desde el punto de vista molecular y se unen directamente y de manera reversible al centro catalítico de la transcriptasa inversa o en un lugar cercano al mismo, provocando un cambio conformacional en la enzima e inhibiendo su actividad DNA polimerasa, tanto la dependiente del DNA como del RNA. A diferencia de los ITIAN, los ITINN son directamente activos, sin necesidad de ser modificados por enzimas celulares. Son específicos del VIH-1, sin que sean activos frente a cepas del VIH-1 del grupo O, ni frente al VIH-2, ni frente a retrovirus animales.
Son metabolizados fundamentalmente a nivel hepático, con intervención de diferentes isoenzimas del citocromo P450, especialmente de CYP3A4, y también por glucuronoconjugación13-15. Además, son potentes inductores de CYP3A4 y de otras enzimas, pudiendo producirse interacciones metabólicas muy relevantes. En algunos casos pueden comportarse además como inhibidores de algunas isoenzimas, dando lugar a interacciones complejas y difícilmente predecibles. El efecto inductor de los no nucleósidos sobre el CYP3A4 puede dar lugar a reducción de la eficacia de muchos fármacos, como anticonceptivos orales, estatinas o antimicrobianos como claritromicina, itraconazol o ketoconazol. Efavirenz y nevirapina disminuyen considerablemente las concentraciones plasmáticas de metadona, siendo necesario un aumento notable de dosis para evitar o paliar el síndrome de abstinencia a opiáceos. Esta interacción no se observa con etravirina. En el caso de efavirenz, la competición por el CYP3A4 podría producir inhibición del metabolismo y posible aparición de efectos adversos graves y/o potencialmente mortales con algunos fármacos como terfenadina, cisaprida, midazolam, triazolam, pimozida, bepridil o alcaloides ergóticos, por lo que no deben emplearse en combinación. Efavirenz y etravirina también pueden comportarse como inhibidores de las isoenzimas 2C9/19 y es por ello que podrían aumentar el efecto de los fármacos que se eliminan por estas vías como el voriconazol. En otras ocasiones son los fármacos asociados los que modifican los niveles del antirretroviral, como es el caso de carbamacepina o Hypericum (hierba de San Juan), que podrían reducir la eficacia de estos ARV13-15.
Los ITINN de primera generación son fármacos de baja barrera genética, de manera que en los fallos virológicos muy a menudo aparecen mutaciones de resistencia y una sola mutación confiere resistencia de alto grado. La mutación más característica y la primera en aparecer, especialmente con efavirenz, es la K103N. Otras mutaciones asociadas a estos ITINN son L100I, V106A/M, V108I, Y181C/I, Y188C/H/L y G190S/A. Etravirina tiene una barrera genética más elevada (intermedia), requiriendo varias mutaciones para disminuir significativamente su sensibilidad (V90I, A98G, L100I, K101E/H/p, V106I, E138A, V179D/F/T, Y181C/I/V, G190S/A, M230L). Además, la mutación K103N no afecta a etravirina12.
Las reacciones de hipersensibilidad, especialmente en forma de exantema cutáneo, son los efectos adversos más frecuentemente asociados al tratamiento con ITINN, especialmente a nevirapina y etravirina. La hepatotoxicidad también aparece con cierta frecuencia, particularmente con nevirapina. Las alteraciones del SNC son características de efavirenz.
Se han comercializado un total de 4 ITINN: tres de primera generación (delavirdina, efavirenz y nevirapina) y uno de segunda generación (etravirina). Delavirdina, de características completamente diferentes a los restantes, no se ha comercializado en Europa y no se comentará.
Efavirenz (EFV)Efavirenz es un ARV muy ampliamente utilizado en inicio de tratamiento6,28. Se comercializa como Sustiva® en cápsulas de 50, 100 y 200mg y comprimidos de 600mg con cubierta pelicular. Atripla® es una asociación a dosis fijas de emtricitabina 200mg, tenofovir 245mg y efavirenz 600mg.
La dosificación habitual de efavirenz en el adulto es de 600mg/día. Su dosificación en pediatría varía en función del peso: 13-15kg: 200mg/día; 15-20kg: 250mg/día; 20-25kg: 300mg/día; 25-32,5kg: 350mg/día; 32,5-40kg: 400mg/día; > 40kg: 600mg/día. Efavirenz no se ha evaluado en niños menores de 3 años o de peso < 13kg (tabla 1).
Puede tomarse con o sin alimentos. Se recomienda evitar los alimentos de alto contenido graso porque aumentan la absorción de efavirenz. Con objeto de mejorar la tolerancia a las reacciones adversas del sistema nervioso, se recomienda tomar la dosis al acostarse, al menos durante las primeras semanas de tratamiento y en aquellos pacientes que continúen experimentando dichos síntomas.
Sus características farmacocinéticas se indican en la tabla 4. Efavirenz es metabolizado principalmente a través del sistema del citocromo P450 (CYP3A4 y 2B6) a metabolitos hidroxilados con posterior glucuronoconjugación de los mismos. Los metabolitos inactivos se eliminan por vía renal en un 34% (inalterado <1%) y heces 16-61%. No requiere ajuste de dosis en insuficiencia renal ni en insuficiencia hepática de leve a moderada (tabla 2). Es fundamentalmente un inductor del CYP3A4 (in vivo) y del 2B6. También induce la glucuronoconjugación mediada por UGT1A1. In vitro se comporta también como inhibidor del CYP3A4 y de otras isoenzimas del CYP (CYP2C9, 2C19, 2C8)13–15.
Inhibidores de la transcriptasa inversa no análogos de nucleósidos (parámetros farmacocinéticos en población adulta)
| Nombre genérico | Nevirapina (NVP) | Efavirenz (EFV) | Etravirina (ETR) |
| Nombre comercial | Viramune® | Sustiva®*Atripla® | Intelence® |
| Fecha de autorización por la Agencia Española de Medicamentos y Productos Sanitarios | 5/2/1998 | 8/5/1999 | 5/9/2008 |
| Peso molecular y equivalencias | PM 266,305; microM x0,266= microgramos/ml | PM 315,685;microMx0,316= microgramos/ml | PM 435,285;microMx0,435= microgramos/ml |
| Biodisponibilidad oral | 93 ± 9%a,2 (comprimidos)91 ± 8%a (solución oral) | 22% (dosis unica de 600 mg con comida de alto contenido graso)217% (dosis unica de 600 mg con comida normal)2 | No se ha determinado su biodisponibilidad absoluta en humanos2 |
| Efecto de los alimentos | Se puede administrar con o sin alimentos. (Al administrar nevirapina con un desayuno rico en grasas, el grado de absorción fue comparable al observado en condiciones de ayuno) | Evitar las comidas ricas en grasa, pues la biodisponibilidad aumenta un 50% y podría aumentar la toxicidad | Debe administrarse con alimentos. El AUC y la Cmax de la formulación usada en estudios de Fase III (F060) fueron un 51 y un 44% menores cuando se administró en ayunas, y un 25 y 38% menores tras un desayuno alto en fibra (en comparación con un desayuno estándar). Las diferencias en las concentraciones de ETR tras una comida con alto contenido lipídico, tras un desayuno estándar o tras un croissant no fueron clínicamente significativas |
| Tmax | 4 horas2 | 3 - 5 horas2 | 4 horas2 |
| Semivida plasmática | 25-30 horas (tras dosis múltiples)245 horas tras una dosis única. La diferencia se debe a la autoinducción de su propio metabolismo | 40-55 horas (tras dosis múltiples)252-76 horas tras una dosis única. La diferencia se debe a la autoinducción de su propio metabolismo5 | 30-40 horas2 |
| Cmax | 5,74 microg/ml (5,00-7,44) (200 mg/12h)2 | 4,07 microg/ml512,9 ± 3,7 microM (VIH+)a,2 | -- |
| Cmin | 3,73 microg/ml (3,20-5,08) (200 mg/12h)2 | 5,6 ± 3,2 microM (1,77 microg/ml) (VIH+)a,2 | 296,74±377,52 nanog/mL (VIH+)a,5 |
| Niveles de Cmin sugeridos como mínimo a alcanzar | 3,5 microg/ml2 | 1 microg/ml2 | No ha sido determinado |
| AUC | 109,0 microg.h/ml2 (96,0-143,5) (200 mg/12h)2 | 184±73 microM·h (58,14 microg h/ml)a,2 | 4531,53±4543,69 nanog h/ml(VIH+)a,5 |
| UPP | 60%2 | 99,5 - 99,75%2 | 99,9%2 |
| Vd aparente | 1,21±0,09 L/kg (i.v.) | -- | -- |
| Penetración en LCR (LCR:plasma) | 45% ± 5%2Grado 4 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 | 0,69% (entre 0,26 y 1,19%)2 Las concentraciones de EFV en LCR exceden la CI50 para la cepa salvaje del virus: LCR/plasma: 0,005 (IQR 0,0026-0,0076; n=69). CSF/ CI50: 26 (IQR 8-41), tomando CI50 =0,51 ng/ml9Grado 3 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 | No disponible2Grado 2 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 |
| Aclaramiento total | Autoinducción: el aclaramiento oral aparente aumenta de 1,5 a 2 veces tras 2-4 semanas de tratamiento2 | -- | -- |
| Aclaramiento renal | 3% inalterado5 | 1% inalterado5 | La eliminación renal de fármaco inalterado es mínima5 |
| Farmacocinética: efecto de edad, raza y sexo | Sexo: niveles más altos en las mujeres (aclaramiento 13,8% menor). Esta diferencia no se considera clínicamente significativaDado que ni el peso corporal ni el índice de masa corporal (IMC) influyeron en el aclaramiento de nevirapina, la influencia del sexo no puede explicarse por el tamaño corporal. La farmacocinética de la nevirapina en adultos infectados por VIH-1 no parece modificarse con la edad (rango 19-68 años) o raza (negros, hispanos o caucásicos). No ha sido investigada específicamente en pacientes de edad superior a 65 años2 | Datos limitados sugieren que las mujeres y los pacientes asiáticos o provenientes de las islas del Pacífico podrían presentar una mayor exposición a efavirenz; sin embargo, no se han evidenciado diferencias importantes en el perfil de seguridad y eficacia entre hombres y mujeres. No se han realizado estudios farmacocinéticos en ancianosEn pacientes con la variante genética homocigótica G516T de la isoenzima CYP2B6, puede incrementarse la exposición plasmática a efavirenz. Se desconocen las implicaciones clínicas de una asociación de este tipo, sin embargo no puede excluirse la posibilidad de que aumente la frecuencia y la gravedad de las reacciones adversas asociadas a efavirenz2 | La farmacocinética de etravirina no difiere considerablemente en los intervalos de edad (18 a 77 años) evaluados, con 6 sujetos de 65 años o mayores. No se han observado diferencias farmacocinéticas significativas entre hombres y mujeres. El número de mujeres que participaron en los ensayos fue limitado. No se observaron diferencias en función de la raza2 |
| Actividad | VIH-12 | VIH-12 | VIH-12 |
| CI50/90 frente a VIH-1 in vitro | CI50:0,063 microM2 (0,017 microg/ml) | CI90-95: 0,00014-0,0021 microg/ml (0,00046-0,0068 microM)2 | CI50: 0,9 a 5,5 nanoM (0,39-2,39 nanog/ml)2 |
aExpresado como media ± DE si no se indica lo contrario.
bExpresado como mediana ± rango intercuartil.
cExpresado como rango.
Los efectos adversos más característicos de efavirenz son las alteraciones del SNC29 (mareo, somnolencia, insomnio, sueños vívidos, confusión, ansiedad, etc.), presentes en más del 50% de los casos durante las primeras semanas de tratamiento. Aunque suelen remitir en las primeras 2-4 semanas, en algunos casos es necesario interrumpir el tratamiento.
Nevirapina (NVP)Nevirapina se comercializa como Viramune® en comprimidos de 200mg y suspensión con 10mg/ml. Su dosificación en adultos es de 200mg/día durante los primeros 14 días, seguido de 200mg/12h o 400mg/día. En base a la superficie corporal (fórmula de Mosteller), la dosis oral recomendada en pacientes pediátricos de todas las edades es 150mg/m2 una vez al día durante dos semanas, seguido a partir de entonces de 150mg/m2 dos veces al día. La dosis diaria total no debe exceder los 400mg en ningún paciente. En base al peso corporal, la dosis oral recomendada en pacientes pediátricos de hasta 8 años de edad es 4mg/kg una vez al día durante dos semanas, seguido a partir de entonces de 7mg/kg dos veces al día. Para pacientes de 8 años y mayores, la dosis recomendada es 4mg/kg una vez al día durante dos semanas, seguido a partir de entonces de 4mg/kg dos veces al día (tabla 1). Se puede administrar con o sin alimentos.
Sus características farmacocinéticas se indican en la tabla 4. Nevirapina es metabolizada mediante las isoenzimas CYP3A4, 2B6 y 2D6 y por glucuronoconjugación. Se comporta como potente inductor del CYP3A4 (es capaz de autoinducir su propio metabolismo) y del CYP2B6, por lo que puede reducir las concentraciones plasmáticas de los fármacos que se eliminan por esta vía13–15. Los metabolitos se eliminan a través de la orina (80%;3% inalterado) y las heces (10%). No se requiere ajuste de dosis en pacientes con insuficiencia renal ni en pacientes con insuficiencia hepática de leve a moderada y debe evitarse su uso en pacientes con insuficiencia hepática grave por el aumento de riesgo de hepatotoxicidad (tabla 2).
Nevirapina es un fármaco habitualmente bien tolerado a largo plazo. El efecto adverso más frecuente (15-20%) y característico es el exantema cutáneo maculopapular en tronco y raíz de los miembros, que aparece las primeras 4-6 semanas y que a menudo se resuelve sin necesidad de interrumpir el tratamiento (50%). En los casos graves puede aparecer fiebre, afectación de mucosas, pulmonar, hepática o hematológica y en algunos casos síndrome de Stevens-Johnson o necrólisis tóxica epidérmica (< 0,5%). La toxicidad hepática es la segunda en importancia y es más frecuente en pacientes con hepatitis crónica B o C. Un 10% de pacientes presentan un aumento de transaminasas superior a 5 veces, de curso asintomático en alrededor de la mitad de casos, con un pico de incidencia las primeras 6 semanas de tratamiento (mecanismo inmune) y el resto repartido a lo largo del tratamiento (efecto tóxico directo)30,31.
Etravirina (TMC125, ETR)Etravirina se comercializa como Intelence® en comprimidos de 100mg. Su dosificación en el adulto es de 200mg dos veces al día. La prolongada semivida de eliminación de ETR avala su administración una vez al día (400mg) y en la práctica clínica se utiliza en determinadas circunstancias en que se considera importante para el paciente, aunque no está aprobada por las autoridades sanitarias. No se han establecido la seguridad y la eficacia en pacientes menores de 16 años. Debe tomarse con alimentos o bebida energética, para aumentar su biodisponibilidad. Los pacientes que no puedan tragar los comprimidos o que lo prefieran pueden disolverlos en un vaso de agua.
Sus características farmacocinéticas se indican en la tabla 4. Es metabolizada mediante las isoenzimas CYP3A4, 2C9 y 2C19 del citocromo P450 y por glucuronoconjugación. Actúa como inductor del CYP3A4 y como inhibidor del CYP2C9/2C19, pudiendo modificar las concentraciones de los fármacos que son eliminados mediante estas vías metabólicas. Etravirina se elimina fundamentalmente por heces (94%). No se requiere ajuste de dosis en pacientes con insuficiencia renal ni en pacientes con insuficiencia hepática de leve a moderada y debe evitarse su uso en pacientes con insuficiencia hepática grave por falta de datos (tabla 2)13–15.
La principal característica de etravirina es su elevada barrera genética con respecto a los otros ITINN, lo cual permite utilizarla en el rescate de pacientes en los que han fracasado previamente aquellos fármacos12,32,33. En base a ello se considera el primer ITINN de segunda generación.
Etravirina es un fármaco habitualmente bien tolerado, siendo el exantema cutáneo el único efecto adverso destacable. Aparece en alrededor del 15% de pacientes y suele ser leve y generalmente autolimitado, obligando a suspender el tratamiento en menos de la cuarta parte de casos.
Inhibidores de la proteasa (IP) (tablas 1, 2 y 5)Los IP bloquean la proteasa del VIH, impidiendo la maduración de las proteínas virales e inhibiendo de forma potente la replicación viral. La proteasa es una enzima que actúa fragmentando las proteínas precursoras de gag y gag-pol para formar los componentes polipeptídicos virales funcionales. La inhibición de la proteasa no impide que se sinteticen los grandes polipéptidos virales codificados por gag y gag-pol, pero al no fragmentarse no son funcionales y no se producen virus con capacidad infectiva. Los IP tienen una estructura química parecida a los péptidos virales sustrato de la proteasa, con una elevada afinidad para el dominio activo de la misma, inhibiendo su actividad catalítica. Actúan de forma directa, sin necesitar ninguna transformación en la célula34.
Los primeros IP tenían grandes inconvenientes (efectos secundarios, concentraciones plasmáticas en el límite inferior del rango terapéutico, posología compleja) que limitaban enormemente su eficacia terapéutica. Con el descubrimiento del uso del ritonavir a dosis bajas como potenciador de los otros IP, aumentando sus concentraciones plasmáticas por su efecto inhibidor sobre el sistema enzimático del citocromo P450, cambió radicalmente la eficiencia de los fármacos de esta familia34,35.
Los IP se metabolizan fundamentalmente a través del CYP3A4 y son transportados por proteínas como la glucoproteína P. No requieren ajuste de dosis en caso de insuficiencia renal (tabla 2)13–15. En la mayoría de ocasiones se utilizan potenciados con ritonavir, comportándose como potentes inhibidores de CYP3A4 y de otras isoenzimas y proteínas transportadoras. Por este motivo se producen interacciones farmacocinéticas muy relevantes con importantes aumentos de las concentraciones de fármacos tales como los inmunodepresores (ciclosporina, tacrolimus, sirolimus), las estatinas o los antagonistas del calcio, entre otros. Por este motivo, no se recomienda asociar IP potenciados con ritonavir por riesgo de aumento de toxicidad con los siguientes fármacos: alfuzosina, amiodarona, analgésicos opiáceos (dextropropoxifeno, meperidina) antiarrítmicos (encainida, flecainida, propafenona, quinidina), antihistamínicos (terfenadina), benzodiacepinas (cloracepato, diacepam, estazolam, fluracepam, midazolam [por vía oral], triazolam), clozapina, colchicina (en caso de insuficiencia renal o hepática), derivados de la ergotamina, drogas de abuso (éxtasis, metanfetamina), estatinas (lovastatina, simvastatina), halofantrina, lumefantrina, pimozida, piroxicam, sildenafilo (pueden emplearse dosis reducidas para la disfunción eréctil, pero su uso está contraindicado en la hipertensión pulmonar). También se halla contraindicado el uso de los IP potenciados con ritonavir con algunos fármacos inhalados como fluticasona (múltiples casos descritos de síndrome de Cushing) o salmeterol (riesgo de prolongación del intervalo QT). Por otro lado, ritonavir también tiene un efecto inductor de varias isoenzimas del citocromo P450 como el CYP1A2 o 2C9/19, así como de la glucuronidación. Por este motivo, puede reducir la eficacia de algunos fármacos que se eliminan por estas vías como el voriconazol. También los fármacos que se asocian a los ARV pueden modificar los niveles de estos. Por ejemplo, en pacientes coinfectados por VIH y tuberculosis, no debe emplearse rifampicina si están recibiendo IP por riesgo de reducción de la eficacia del tratamiento antirretroviral. Tampoco se recomienda el uso del la hierba de San Juan (Hypericum perforatum) por el mismo motivo. Algunos IP pueden dar una reacción de tipo Antabus® cuando se asocian a disulfiram, metronidazol o sulfonilureas, por su contenido en etanol: RTV en solución oral (43% v/v) y en cápsulas (12% p/p), TPV en cápsulas de (7% p/p) y LPV/r en solución oral de (42% p/p). A diferencia de la solución oral, ni las cápsulas ni los comprimidos de Kaletra® (LPV/r) contienen etanol.
Una característica importante de los IP potenciados es su elevada barrera genética para el desarrollo de resistencias, debiendo acumularse múltiples mutaciones para que el virus sea resistente. Esta elevada barrera genética conduce a dos hechos destacables: 1) en los pacientes que presentan fallo virológico tras un tratamiento inicial con IP en ausencia de mutaciones basales (naive) el virus no suele seleccionar ninguna mutación en la proteasa y 2) en determinadas situaciones resulta eficaz la monoterapia con un IP potenciado, hecho impensable con otras familias de ARV. Cuando ya existen mutaciones de resistencia en la proteasa la barrera genética se reduce y en los fallos virológicos pueden aparecer nuevas mutaciones. En esta situación se ha observado que los IP de última generación, especialmente DRV, ofrecen una barrera genética más elevada que los otros IP34.
Algunos efectos adversos de los IP se han considerado de clase, especialmente las alteraciones digestivas (diarrea, náuseas, vómitos, dolor abdominal) y metabólicas (dislipidemia, resistencia a la insulina, diabetes mellitus)34,36. A pesar de ello, existen diferencias notables entre los diferentes IP. Los IP que con mayor frecuencia se asocian con diarrea y otras alteraciones digestivas de intensidad moderada a grave son nelfinavir, lopinavir/ritonavir (LPV/r), fosamprenavir/r (FPV/r) y tipranavir/r (TPV/r), mientras que con saquinavir/r (SQV/r), atazanavir/r (ATV/r) o darunavir/r (DRV/r) la incidencia es considerablemente inferior. Asimismo, los IP con un mejor perfil metabólico son ATV/r y DRV/r. También se considera un efecto secundario de clase de los IP un aumento del riesgo de hemorragias que se ha observado en los pacientes con hemofilia.
La familia de los IP es la que más ARV nuevos ha aportado a lo largo de la última década, mejorando notablemente la tolerabilidad y la posología. Actualmente están comercializados 9 IP, que por orden alfabético son: ATV, DRV, FPV, indinavir, LPV, nelfinavir, ritonavir (RTV), SQV y TPV. IDV y NFV ya prácticamente no se utilizan en ningún escenario clínico y no se comentarán. Actualmente RTV tampoco se utiliza como fármaco ARV, pero se utiliza a pequeñas dosis infraterapéuticas como potenciador de prácticamente todos los IP. RTV se comercializa como Norvir® en cápsulas de 100mg. Estas cápsulas deben conservarse en la nevera aunque pueden mantenerse a temperatura ambiente (por debajo de 25°C) siempre que se consuman dentro de un periodo de 30 días. Recientemente se ha comercializado la formulación meltrex que permite su conservación a temperatura ambiente, con mayor comodidad para los pacientes. Su dosificación en el adulto como potenciador farmacocinético varía en función del inhibidor de la proteasa con el que se combine, desde 100mg al día en el caso de atazanavir o darunavir (pacientes no pretratados) hasta 200mg cada 12 horas con TPV.
Atazanavir (ATV)Atazanavir se comercializa como Reyataz® en cápsulas duras de 150, 200 y 300mg. En Europa la única dosis aprobada en adultos es de 300mg/24h potenciado con 100mg/24h de RTV. La FDA también autoriza la dosis de 400mg /24h sin potenciar y en Europa esta dosificación también se utiliza en determinadas situaciones clínicas en las cuales no se recomienda o está contraindicado el uso de RTV (alergia, simplificación de tratamiento por dislipidemia u otros efectos adversos con concentraciones elevadas de ATV, siempre en ausencia de mutaciones de resistencia al fármaco)37. En pacientes pediátricos de 6 a 18 años, la dosis recomendada en niños de 15 o más kg y menos de 20kg es de ATV/r 150/100mg/24h, de 20kg hasta < 40kg ATV/r 200/100mg/24h y ≥ 40kg ATV/r 300/100mg/24h (tabla 1). Se recomienda administrarlo con alimentos para mejorar su absorción. Cabe destacar la interacción de atazanavir con todos aquellos fármacos que reducen la acidez gástrica. Atazanavir debe administrarse 2h antes de cualquier antiácido o antihistamínico-H2 (o 12h después de este último) y en general no se recomienda su asociación a inhibidores de la bomba de protones6,38.
Sus características farmacocinéticas se indican en la tabla 5a. Atazanavir se metaboliza fundamentalmente a través de la isoenzima CYP3A4 del citocromo P450 y actúa como inhibidor de esta isoenzima y de otras enzimas tales como la UGT1A1 (enzima encargada de la glucuronoconjugación de la bilirrubina, entre otras). Los metabolitos se eliminan mediante la bilis en forma de metabolitos libres o glucuronidados. Solo un 13% se elimina a través de orina (7% en forma de fármaco inalterado), por lo que no se requiere ajuste de dosis en insuficiencia renal. En insuficiencia hepática leve se recomienda emplear atazanavir potenciado con ritonavir y en IH moderada-grave se desaconseja el uso de atazanavir potenciado por falta de datos (tabla 2).
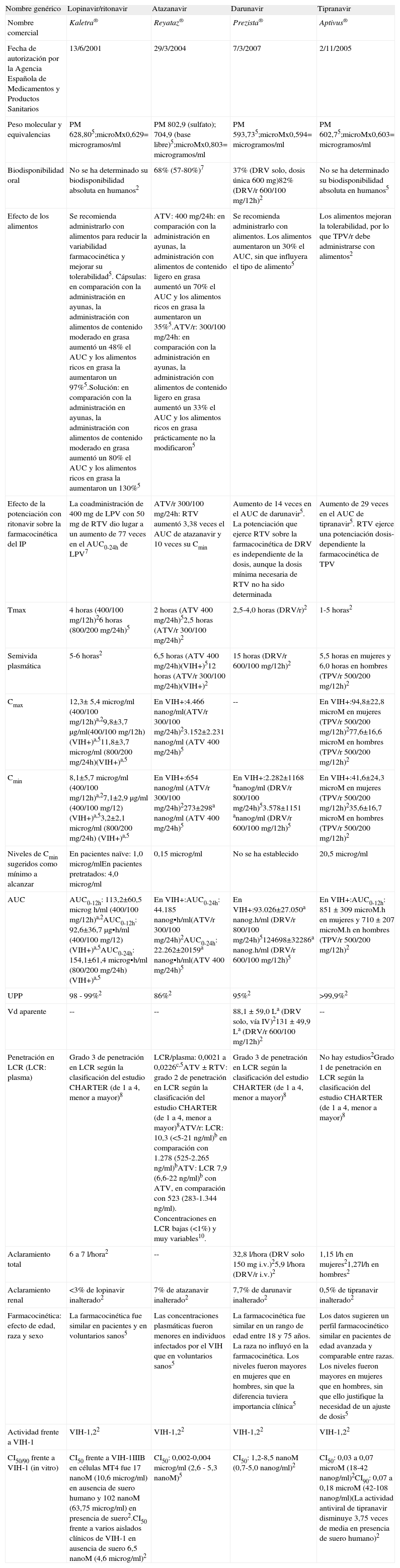
Inhibidores de la proteasa (1.a parte): ritonavir, saquinavir y fosamprenavir (parámetros farmacocinéticos en población adulta)
| Nombre genérico | Ritonavir | Saquinavir | Fosamprenavir |
| Nombre comercial | Norvir® | Invirase® | Telzir® |
| Fecha de autorización por la Agencia Española de Medicamentos y Productos Sanitarios | 1/10/1996 | 4/10/1996 | 22/7/2004 |
| Peso molecular y equivalencias | PM 720,955; microM x0,721= microgramos/ml | PM 766,965; microM x0, 767= microgramos/ml | PM 623,75; microM x0,624= microgramos/ml |
| Biodisponibilidad oral | No se ha determinado su biodisponibilidad absoluta en humanos2 | 4% (1-9%)c en ausencia de RTV2No se ha determinado su biodisponibilidad absoluta de SQV potenciado con RTV en humanos2 | No se ha determinado su biodisponibilidad absoluta en humanos2 |
| Efecto de los alimentos | En presencia de alimentos se reduce el AUC entre un 21 y un 23%5El sabor amargo de Norvir solución puede enmascararse si se mezcla con un batido de chocolate2 | En voluntarios sanos, el AUC aumentó más de 6 veces al tomarlo con una comida grasa, en comparación con su ingesta en ayunas. Se recomienda tomar nelfinavir dentro de las 2 h después de comer5 | Comprimidos: la administración con alimentos no modificó significativamente el AUC, por lo que puede ingerirse con o sin alimentos.Solución oral: en presencia de alimentos el AUC se redujo un 28% en comparación con su ingesta en ayunas. En adultos, se recomienda tomar la solución en ayunas y en los niños con alimentos porque mejora la tolerabilidad5 |
| Efecto de la potenciación con ritonavir sobre la farmacocinética del IP | -- | RTV aumentó alrededor de 30 veces el AUC de SQV. La potenciación que ejerce RTV sobre la farmacocinética de SQV es independiente de la dosis, aunque la dosis mínima necesaria de RTV no ha sido determinada. Es importante administrarlos simultáneamente y con alimentos | FPV/r 700/100 mg/12h: RTV aumentó 2 veces el AUC de FPV y 6 veces su Cmin5 La potenciación que ejerce RTV sobre la farmacocinética de APV es independiente de la dosis de RTV, aunque la dosis mínima necesaria no ha sido todavía determinada |
| Tmax | 2 horas (600 mg en ayunas)54 horas (600 mg con alimentos) | -- | 2 horas (FPV)21,5 horas (IC95%: 0,75;5,0)(FPV/r 700/100 mg/12h)2 |
| Semivida plasmática | 5 horas (100 mg/24h)25 horas (100 mg/12h)24 horas (200 mg/24h)28 horas (200 mg/12h)2 | 7 horas 2 | 7,7 horas (FPV)215 - 23 horas (FPV/r)2 |
| Cmax | En VIH+:0,84±0,39 microg/mla (100 mg/24h)20,89 microg/ml (100 mg/12h)3,4±1,3 microg/mla (200 mg/24h)24,5±1,3 microg/mla (200 mg/12h)2 | En VIH+:5.208 nanog/ml (1.536-14.369)c, (SQV/r 1.000/100 mg/12h con comida rica en grasa)2 | FPV/r 700/100 mg c/12h: 6,08 microg/ml (IC95%: 5,38;6,86)2FPV/r 1.400/100 mg c/24h: 7,93 microg/ml (IC95%:7,25-8,68)5FPV/r 1.400/200 mg c/24h: 7,24 microg/ml (IC95%:6,32-8,28)5 |
| Cmin | En VIH+:0,08±0,04 microg/mla (100 mg/24h)20,22 microg/ml (100 mg/12h)0,16±0,10 microg/mla (200 mg/24h)20,6±0,2 microg/mla (200 mg/12h)2Las Cmin descienden con el tiempo, posiblemente debido a la inducción enzimática, pero parecen estabilizarse al final de 2 semanas2 | En VIH+:1.179 nanog/ml (334-5.176)c(SQV/r 1.000/100 mg/12h con comida rica en grasa)2 | FPV/r 700/100 mg c/12h: 2,12 microg/ml (IC95%:1,77;2,54)2FPV/r 1.400/100 mg c/24h: 0,86 microg/ml (IC95%:0,74-1,01)5FPV/r 1.400/200 mg c/24h: 1,45 microg/ml (IC95%:1,16-1,81)5 |
| Niveles de Cmin sugeridos como mínimo a alcanzar | -- | En pacientes naïve: Cmin 0,050 microg/ml (y AUC0-24h aprox. 20 microg·h/ml)2En pacientes pretratados: Cmin aprox. 0,100 microg/ml (y AUC0-24h 20 microg·h/ml)2 | Pacientes naïve: 0,4 microg/mlPacientes pretratados: 1,2 microg/ml |
| AUC | En VIH+:AUC24h 6,6±2,4 microg h/mla (100 mg/24h)2AUC12h 6,2 microg h/mla (100 mg/12h)2AUC24h 20,0±5,6 microg h/mla (200 mg/24h)2AUC12h 21,92±6,48 microg h/mla (200 mg/12h)2 | En VIH+:AUC0-12h 34.926 nanog·h/ml (11826-105.992)c (SQV/r 1.000/100 mg/12h con comida rica en grasa)2 | FPV/r 700/100 mg c/12h: AUC0-12h 39,6 (IC95%:34,5;45,3) microg h/ml2FPV/r 1.400/100 mg c/24h: AUC0-24h 66,4 microg h/ml (IC95%:61,1-72,1)5FPV/r 1.400/200 mg c/24h: AUC0-24h 69,4 microg.h/ml (IC95%:59,7-80,8)5 |
| UPP | 98-99%2 | 97%2 | 90%2 |
| Vd aparente | 20 - 40 l (dosis unica 600 mg)2 | 700 l (tras 12 mg i.v.)2 | 430 L (6 l/kg asumiendo un peso corporal de 70 kg)2 |
| Penetración en LCR (LCR: plasma) | Grado 1 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 | Insignificante con Invirase 600 mg/8h2SQV±RTV: grado 1 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 | Penetración insignificante2Grado 2 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 |
| Aclaramiento total | 17,2±6,6 L/ha (100 mg/24h)216,1 l/h (100 mg/12h)210,8±3,1 L/ha (200 mg/24h)210,0±3,2 L/ha (200 mg/12h)2 | 1,14 l/h/kg2 | -- |
| Aclaramiento renal | 0,1 l/h2; (3,5±1,8%a inalterado)5 | (1%inalterado)5 | (<1%inalterado)5 |
| Farmacocinética: efecto de edad, raza y sexo | En voluntarios sanos, los niveles plasmáticos fueron un 50% mayores que en pacientes5. Los datos farmacocinéticos indicaron que no es necesario realizar un ajuste de la dosis en pacientes de edad avanzada2 | Las mujeres presentaron mayor exposición a saquinavir que los hombres (incrementos por término medio del 56% del AUC y del 26% de la Cmax). La edad y el peso corporal no pudieron explicar estas diferencias. Los datos limitados de ensayos clínicos controlados realizados con el régimen posológico aprobado no indican que existan diferencias importantes en el perfil de seguridad y eficacia entre hombres y mujeres2No se ha investigado el efecto de la raza ni se ha estudiado en pacientes de edad avanzada5 | No se han observado diferencias en la farmacocinética entre voluntarios sanos y pacientes5. No se ha estudiado la farmacocinética de fosamprenavir en pacientes de edad avanzada2. No se han observado variaciones relacionadas con la edad o la raza5 |
| Actividad | VIH-1,2, aunque en la actualidad se utiliza como potenciador farmacocinético2 | VIH-1,22 | VIH-1,22,5 |
| CI50/90/95 frente a VIH-1 in vitro | -- | CI50: 1-10 nM2 (=0,76-7,6 nanog/ml)CI50 ajustada al suero (50% suero humano) 25-250 nM(=19,2-192 nanog/ml)CI90: 5-50 nM2 (=3,8-38 nanog/ml) | CI50 entre 0,012 a 0,08 microM en células con infección aguda y 0,41 microM en células con infección crónica2 |
Es un fármaco generalmente bien tolerado y en algunos estudios ha sido el que menos a menudo ha debido interrumpirse por efectos secundarios de entre los terceros fármacos de la pauta ARV (IP y ITINN)39. Tiene un excelente perfil metabólico y tolerabilidad gastrointestinal. Su efecto adverso característico es la hiperbilirrubinemia por incremento casi constante de la bilirrubina indirecta que en raras ocasiones obliga a suspender el tratamiento por motivos estéticos (ictericia). También se han descrito casos de litiasis urinaria por depósito de cristales del fármaco.
La mutación de resistencia más característica de ATV, especialmente cuando se usa no potenciado, es la I50L, la cual no confiere resistencia sino hipersusceptibilidad a los otros IP12.
Darunavir (DRV, TMC 114)Darunavir se comercializa como Prezista® en comprimidos de 75, 150, 300mg, 400mg y 600mg. Se emplea siempre potenciado con ritonavir, siendo la dosificación distinta en pacientes adultos sin tratamiento previo o sin mutaciones de resistencia previas (DRV/r 800/100mg c/24h) o en pacientes pretratados (DRV/r 600/100mg c/12h). En pediatría, está indicado en niños previamente tratados entre 6 y 17 años y más de 20kg. La dosis para niños de más de 20kg y menos de 30kg es de DRV/r 375/50mg/12h; más de 30 y menos de 40kg DRV/r 450/60mg/12h y superior o igual a 40kg 600/100mg/12h (tabla 1). Debe tomarse con alimentos.
Sus características farmacocinéticas se indican en la tabla 5b. Es metabolizado principalmente mediante la isoenzima CYP3A4 del citocromo P450 y es inhibidor de la misma, con las correspondientes interacciones metabólicas. Se elimina a través de las heces (79,5%) y de la orina (13,9%). No se requiere ajuste de dosis en insuficiencia renal ni en insuficiencia hepática leve a moderada (tabla 2).
Inhibidores de la proteasa (2.a parte): lopinavir/ritonavir, atazanavir, darunavir y tipranavir
| Nombre genérico | Lopinavir/ritonavir | Atazanavir | Darunavir | Tipranavir |
| Nombre comercial | Kaletra® | Reyataz® | Prezista® | Aptivus® |
| Fecha de autorización por la Agencia Española de Medicamentos y Productos Sanitarios | 13/6/2001 | 29/3/2004 | 7/3/2007 | 2/11/2005 |
| Peso molecular y equivalencias | PM 628,805;microMx0,629= microgramos/ml | PM 802,9 (sulfato); 704,9 (base libre)5;microMx0,803= microgramos/ml | PM 593,735;microMx0,594= microgramos/ml | PM 602,75;microMx0,603= microgramos/ml |
| Biodisponibilidad oral | No se ha determinado su biodisponibilidad absoluta en humanos2 | 68% (57-80%)7 | 37% (DRV solo, dosis única 600 mg)82% (DRV/r 600/100 mg/12h)2 | No se ha determinado su biodisponibilidad absoluta en humanos5 |
| Efecto de los alimentos | Se recomienda administrarlo con alimentos para reducir la variabilidad farmacocinética y mejorar su tolerabilidad5. Cápsulas: en comparación con la administración en ayunas, la administración con alimentos de contenido moderado en grasa aumentó un 48% el AUC y los alimentos ricos en grasa la aumentaron un 97%5.Solución: en comparación con la administración en ayunas, la administración con alimentos de contenido moderado en grasa aumentó un 80% el AUC y los alimentos ricos en grasa la aumentaron un 130%5 | ATV: 400 mg/24h: en comparación con la administración en ayunas, la administración con alimentos de contenido ligero en grasa aumentó un 70% el AUC y los alimentos ricos en grasa la aumentaron un 35%5.ATV/r: 300/100 mg/24h: en comparación con la administración en ayunas, la administración con alimentos de contenido ligero en grasa aumentó un 33% el AUC y los alimentos ricos en grasa prácticamente no la modificaron5 | Se recomienda administrarlo con alimentos. Los alimentos aumentaron un 30% el AUC, sin que influyera el tipo de alimento5 | Los alimentos mejoran la tolerabilidad, por lo que TPV/r debe administrarse con alimentos2 |
| Efecto de la potenciación con ritonavir sobre la farmacocinética del IP | La coadministración de 400 mg de LPV con 50 mg de RTV dio lugar a un aumento de 77 veces en el AUC0-24h de LPV7 | ATV/r 300/100 mg/24h: RTV aumentó 3,38 veces el AUC de atazanavir y 10 veces su Cmin | Aumento de 14 veces en el AUC de darunavir5. La potenciación que ejerce RTV sobre la farmacocinética de DRV es independiente de la dosis, aunque la dosis mínima necesaria de RTV no ha sido determinada | Aumento de 29 veces en el AUC de tipranavir5. RTV ejerce una potenciación dosis-dependiente la farmacocinética de TPV |
| Tmax | 4 horas (400/100 mg/12h)26 horas (800/200 mg/24h)5 | 2 horas (ATV 400 mg/24h)52,5 horas (ATV/r 300/100 mg/24h)2 | 2,5-4,0 horas (DRV/r)2 | 1-5 horas2 |
| Semivida plasmática | 5-6 horas2 | 6,5 horas (ATV 400 mg/24h)(VIH+)512 horas (ATV/r 300/100 mg/24h)(VIH+)2 | 15 horas (DRV/r 600/100 mg/12h)2 | 5,5 horas en mujeres y 6,0 horas en hombres (TPV/r 500/200 mg/12h)2 |
| Cmax | 12,3± 5,4 microg/ml (400/100 mg/12h)a,29,8±3,7μg/ml(400/100 mg/12h)(VIH+)a,511,8±3,7 microg/ml (800/200 mg/24h)(VIH+)a,5 | En VIH+:4.466 nanog/ml(ATV/r 300/100 mg/24h)23.152±2.231 nanog/ml (ATV 400 mg/24h)5 | -- | En VIH+:94,8±22,8 microM en mujeres (TPV/r 500/200 mg/12h)277,6±16,6 microM en hombres (TPV/r 500/200 mg/12h)2 |
| Cmin | 8,1±5,7 microg/ml (400/100 mg/12h)a,27,1±2,9μg/ml (400/100 mg/12)(VIH+)a,53,2±2,1 microg/ml (800/200 mg/24h) (VIH+)a,5 | En VIH+:654 nanog/ml (ATV/r 300/100 mg/24h)2273±298a nanog/ml (ATV 400 mg/24h)5 | En VIH+:2.282±1168 ananog/ml (DRV/r 800/100 mg/24h)53.578±1151 ananog/ml (DRV/r 600/100 mg/12h)5 | En VIH+:41,6±24,3 microM en mujeres (TPV/r 500/200 mg/12h)235,6±16,7 microM en hombres (TPV/r 500/200 mg/12h)2 |
| Niveles de Cmin sugeridos como mínimo a alcanzar | En pacientes naïve: 1,0 microg/mlEn pacientes pretratados: 4,0 microg/ml | 0,15 microg/ml | No se ha establecido | 20,5 microg/ml |
| AUC | AUC0-12h: 113,2±60,5 microg h/ml (400/100 mg/12h)a,2AUC0-12h: 92,6±36,7μg•h/ml (400/100 mg/12)(VIH+)a,5AUC0-24h: 154,1±61,4 microg•h/ml (800/200 mg/24h) (VIH+)a,5 | En VIH+:AUC0-24h: 44.185 nanog•h/ml(ATV/r 300/100 mg/24h)2AUC0-24h: 22.262±20159a nanog•h/ml(ATV 400 mg/24h)5 | En VIH+:93.026±27.050a nanog.h/ml (DRV/r 800/100 mg/24h)5124698±32286a nanog.h/ml (DRV/r 600/100 mg/12h)5 | En VIH+:AUC0-12h: 851 ± 309 microM.h en mujeres y 710 ± 207 microM.h en hombres (TPV/r 500/200 mg/12h)2 |
| UPP | 98 - 99%2 | 86%2 | 95%2 | >99,9%2 |
| Vd aparente | -- | -- | 88,1 ± 59,0 La (DRV solo, vía IV)2131 ± 49,9 La (DRV/r 600/100 mg/12h)2 | -- |
| Penetración en LCR (LCR: plasma) | Grado 3 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 | LCR/plasma: 0,0021 a 0,0226c,5ATV ± RTV: grado 2 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8ATV/r: LCR: 10,3 (<5-21 ng/ml)b en comparación con 1.278 (525-2.265 ng/ml)bATV: LCR 7,9 (6,6-22 ng/ml)b con ATV, en comparación con 523 (283-1.344 ng/ml). Concentraciones en LCR bajas (<1%) y muy variables10. | Grado 3 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 | No hay estudios2Grado 1 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 |
| Aclaramiento total | 6 a 7 l/hora2 | -- | 32,8 l/hora (DRV solo 150 mg i.v.)25,9 l/hora (DRV/r i.v.)2 | 1,15 l/h en mujeres21,27l/h en hombres2 |
| Aclaramiento renal | <3% de lopinavir inalterado2 | 7% de atazanavir inalterado2 | 7,7% de darunavir inalterado2 | 0,5% de tipranavir inalterado2 |
| Farmacocinética: efecto de edad, raza y sexo | La farmacocinética fue similar en pacientes y en voluntarios sanos5 | Las concentraciones plasmáticas fueron menores en individuos infectados por el VIH que en voluntarios sanos5 | La farmacocinética fue similar en un rango de edad entre 18 y 75 años. La raza no influyó en la farmacocinética. Los niveles fueron mayores en mujeres que en hombres, sin que la diferencia tuviera importancia clínica5 | Los datos sugieren un perfil farmacocinético similar en pacientes de edad avanzada y comparable entre razas. Los niveles fueron mayores en mujeres que en hombres, sin que ello justifique la necesidad de un ajuste de dosis5 |
| Actividad frente a VIH-1 | VIH-1,22 | VIH-1,22 | VIH-1,22 | VIH-1,22 |
| CI50/90 frente a VIH-1 (in vitro) | CI50 frente a VIH-1IIIB en células MT4 fue 17 nanoM (10,6 microg/ml) en ausencia de suero humano y 102 nanoM (63,75 microg/ml) en presencia de suero2.CI50 frente a varios aislados clínicos de VIH-1 en ausencia de suero 6,5 nanoM (4,6 microg/ml)2 | CI50: 0,002-0,004 microg/ml (2,6 - 5,3 nanoM)5 | CI50: 1,2-8,5 nanoM (0,7-5,0 nanog/ml)2 | CI50: 0,03 a 0,07 microM (18-42 nanog/ml)2CI90: 0,07 a 0,18 microM (42-108 nanog/ml)(La actividad antiviral de tipranavir disminuye 3,75 veces de media en presencia de suero humano)2 |
aExpresado como media ± DE si no se indica lo contrario.
bExpresado como mediana ± rango intercuartil.
cExpresado como rango.
Es el ARV en general y el IP en particular con una mayor barrera genética al desarrollo de resistencias. El perfil de resistencias es considerablemente diferente al de los IP clásicos y deben acumularse un muy importante número de mutaciones para que disminuya significativamente la sensibilidad al mismo40. Se ha demostrado que en pacientes con virus que ya presentan previamente mutaciones de resistencia en la proteasa, el tratamiento con DRV/r protege tanto a la proteasa como a la transcriptasa inversa frente a la aparición de nuevas mutaciones con respecto al tratamiento con LPV/r. La elevada barrera genética de DRV/r también resulta muy útil ante la posibilidad de administrar monoterapia en determinadas situaciones clínicas, en las cuales ha demostrado no inferioridad con respecto a la triterapia.
Es un fármaco habitualmente muy bien tolerado, con un excelente perfil metabólico y tolerabilidad digestiva y sin unos efectos adversos característicos34,40.
Fosamprenavir (FPV)FPV se comercializa como Telzir® en comprimidos de 700mg de FPV en forma de FPV cálcico (equivalente aproximadamente a 600mg de amprenavir) y suspensión oral (50mg/ml 225ml). La EMEA solo autoriza su uso potenciado con ritonavir. La dosis recomendada en adultos es de 700mg de FPV con 100mg RTV c/12h. Como alternativa en determinadas circunstancias puede administrarse a dosis de 1.400/200mg de FPV/r c/24h o incluso 1.400/100mg. La FDA también ha aprobado en ausencia de resistencia basal su administración sin potenciar a dosis de 1.400mg/12h. Su dosificación en pediatría se indica en la tabla 1. Los comprimidos pueden administrarse con o sin alimentos; la suspensión oral debe administrarse en pacientes pediátricos junto a las comidas41.
Sus características farmacocinéticas se indican en la tabla 5. FPV es un profármaco y, tras su administración por vía oral, es hidrolizado rápidamente en el epitelio intestinal y casi por completo, a amprenavir y fosfato inorgánico antes de alcanzar la circulación sistémica. Amprenavir es metabolizado fundamentalmente a través de la enzima CYP3A4 del citocromo P450. Tanto amprenavir como ritonavir son inhibidores del CYP3A4, por lo que pueden aumentar las concentraciones de los fármacos que son eliminados mediante esta vía metabólica, pero amprenavir también se comporta como inductor de algunos enzimas metabólicos y la combinación con RTV y otros fármacos puede dar lugar a interacciones impredecibles. Menos del 1% se elimina inalterado a través de la orina. FPV no requiere ajuste de dosis en insuficiencia renal, pero sí en insuficiencia hepática (tabla 2).
Una mutación de resistencia característica de FPV es la I50V, que también disminuye la sensibilidad a DRV41.
Sus principales efectos adversos son las alteraciones gastrointestinales y metabólicas (hipertrigliceridemia)34,41. Con poca frecuencia puede observarse una reacción cruzada en pacientes con alergia a sulfonamidas.
Lopinavir/ritonavir (LPV/RTV)Se comercializa en comprimidos que contienen 200mg lopinavir /50mg ritonavir o 100mg lopinavir /25mg ritonavir y en solución de 60ml (400mg lopinavir/100mg ritonavir en cada 5ml). La nueva formulación en comprimidos presenta la ventaja de poderse guardar a temperatura ambiente, mientras que la anterior formulación en cápsulas debía conservarse en la nevera42.
La dosis de Kaletra® recomendada en el adulto es de 2 comprimidos o 5ml de la solución (equivalentes a 400mg de lopinavir y 100mg de ritonavir) dos veces al día. Su dosificación en pediatría (niños mayores de 2 años) es de 230/57,5mg/m2, dos veces al día, hasta un máximo de 400/100mg dos veces al día. La dosis de 230/57,5mg/m2 podría ser insuficiente en algunos niños a los que se les administra con nevirapina o efavirenz. En estos pacientes debería considerarse un aumento de la dosis de Kaletra a 300/75mg/m2 (tabla 1). Puede administrarse con o sin alimentos.
Sus características farmacocinéticas se indican en la tabla 5. Es metabolizado mediante la isoenzima CYP3A4. Inhibe el CYP3A4 in vitro. In vivo induce su propio metabolismo (CYP3A4), los CYP2C9 y 2C19 y la glucuronoconjugación. Se elimina por vía renal (< 3% inalterado) y heces 83% (20% inalterado). No se requiere ajuste de dosis en insuficiencia renal y en insuficiencia hepática se ha descrito aumento de sus concentraciones aunque la importancia clínica no está clara y no se recomienda ajustar la dosis (tabla 2).
Se ha utilizado ampliamente en la práctica clínica habitual y sus principales efectos adversos son las alteraciones gastrointestinales y metabólicas34.
Saquinavir (SQV)Se comercializa como Invirase® en comprimidos de 200mg y 500mg. La dosis recomendada en adultos es de SQV 1.000mg con 100mg de ritonavir cada 12 horas. En determinadas circunstancias se administra una vez al día a dosis de 2.000/100mg (SQV/r) o 1.500/100mg. No se ha establecido la seguridad y eficacia de SQV en la población menor de 16 años. Debe administrarse con comidas grasas para mejorar su absorción.
Sus características farmacocinéticas se indican en la tabla 5. Es metabolizado fundamentalmente a través de la enzima CYP3A4 del citocromo P450 y actúa como inhibidor muy débil de esta isoenzima, dependiendo sus interacciones metabólicas fundamentalmente del potenciador RTV. Se elimina mediante las heces (81-88%) y la orina (1-3%). No se requiere ajuste de dosis en pacientes con insuficiencia renal ni insuficiencia hepática leve a moderada, mientras que no se recomienda en los que presenten insuficiencia hepática grave descompensada (tabla 2).
Es un fármaco habitualmente bien tolerado, siendo sus principales efectos adversos las alteraciones digestivas y metabólicas, aunque menos frecuentes que con otros IP tales como LPV/r o FPV/r34.
Tipranavir (TPV)TPV está indicado únicamente en pacientes con fallos terapéuticos previos. Se comercializa como Aptivus® en cápsulas de 250mg. Debe conservarse en nevera, aunque puede mantenerse a temperatura ambiente (< 25°C) si se consume antes de 60 días después de abrir el frasco por primera vez. Su dosificación en adultos es de 500mg de TPV con 200mg de ritonavir cada 12 horas. La dosis pediátrica se indica en la tabla 1. Debe administrarse con alimentos para aumentar su biodisponibilidad.
Sus características farmacocinéticas se indican en la tabla 5. Se metaboliza a través del citocromo P450 3A4. In vivo y en estado de equilibrio es un inductor de CYP2C9, CYP1A2 y de la glucuronidación, inductor leve de la glucoproteína P e inhibidor del CYP3A4 y 2D6. Debido al efecto antagónico de inhibición del CYP3A4 e inducción de la glucoproteína P, es difícil predecir el efecto neto de TPV/r sobre fármacos que sean sustratos de ambos. No requiere ajuste de dosis en insuficiencia renal (tabla 2).
Tiene un perfil de resistencias considerablemente diferente al de los IP clásicos y una barrera genética más elevada. Cuando estuvo disponible se utilizó en los pacientes infectados por virus multirresistentes y actualmente tiene todavía algunas indicaciones en este escenario, pero tras la comercialización de DRV el uso de TPV es muy limitado.
Los efectos adversos más importantes de TPV son las alteraciones gastrointestinales y metabólicas, así como la hepatotoxicidad, más importantes que con los otros IP. Se recomienda un estrecho seguimiento de los pacientes coinfectados por VHB o VHC, por el aumento de riesgo de hepatotoxicidad que presentan34,43.
Inhibidores de la fusión. Enfuvirtida (ENF, T20) (tablas 1, 2 y 6)Solo disponemos de un inhibidor de la fusión: enfuvirtida.
Inhibe la fusión de la cubierta viral del VIH con la membrana celular, impidiendo la penetración del contenido viral en los linfocitos. Su actividad frente al VIH es independiente de correceptor utilizado (CCR5 y/o X4) y su perfil de resistencias es completamente diferente al de los otros ARV. Su disponibilidad fue muy importante para los pacientes con virus multirresistentes, especialmente cuando apareció TPV/r, que permitió elaborar un régimen con al menos dos fármacos plenamente activos. La barrera genética de ENF es baja y si no se acompaña de otros fármacos activos rápidamente aparecen mutaciones de resistencia, perdiendo su eficacia44.
ENF se comercializa como Fuzeon® en jeringas de 90mg y debe administrarse por vía subcutánea. La dosificación en adultos es de 90mg cada 12h. En pediatría no está aprobado en niños menores de 6 años. Entre los 6 y los 16 años, 2mg/kg (máx. 90mg) cada 12h vía subcutánea (tabla 1).
Sus características farmacocinéticas se indican en la tabla 6. La biodisponibilidad tras su administración subcutánea es del 80%. Se elimina mediante catabolismo de sus aminoácidos constituyentes y no es sustrato ni influye en la actividad de ninguno de los sistemas metabólicos de los otros ARV, por lo que no es susceptible de presentar interacciones metabólicas relevantes. No se requiere ajuste de dosis en insuficiencia hepática ni probablemente tampoco en insuficiencia renal (tabla 2).
Antagonistas del correceptor CCR5, inhibidores integrasa e inhibidores de la entrada (parámetros farmacocinéticos en población adulta)
| Grupo terapéutico | Antagonistas correceptor CCR5 | Inhibidores de la integrasa | Inhibidores de la fusión |
| Nombre genérico | Maraviroc | Raltegravir | Enfuvirtida (T-20) |
| Nombre comercial | Celsentri® | Isentress® | Fuzeon® |
| Fecha de autorización por la Agencia Española de Medicamentos y Productos Sanitarios | 27/9/2007 | 21/12/2007 | 5/6/2003 |
| Peso molecular y equivalencias | PM 513,675; microMx0,514= microgramos/ml | PM 482,515; microM x0,482= microgramos/ml | PM 44925; microM x4,492= microgramos/ml |
| Efecto de los alimentos | Un desayuno rico en grasa redujo el AUC un 33%. Sin embargo, dado que no hubo restricciones alimentarias en los estudios de eficacia, puede administrarse con o sin alimentos5 | Una comida con contenido de grasa moderado aumentó el 13% el AUC. Una comida con elevado contenido graso duplicó el AUC. En general, los alimentos aumentaron la variabilidad farmacocinética. Sin embargo, dado que no hubo restricciones alimentarias en los estudios de eficacia, puede administrarse con o sin alimentos5 | -- |
| Biodisponibilidad oral | 23-33%223% (dosis única de 100 mg)233% (estimada para 300 mg)2 | No se ha determinado su biodisponibilidad absoluta en humanos2 | 84,3±15,5%a (vía s.c.)5 |
| Tmax | 2 horas (0,5-4)c,2 | 1,7 horas (IC90%:0,9-3,3) | -- |
| Semivida plasmática | 13,2 horas2 | 9 horas2 | 3,8±0,6 horasa,5 |
| Cmax | 0,618 microg/ml (VIH+asintomáticos con 300 mg/12h)5 | 4,5 microM (IC90%:2,0-10,2)(=2,169 microg/ml) | 4,59±1,5 microg/ml (VIH+)a,5 |
| Cmin | 0,034 microg/ml(VIH+asintomáticos con 300 mg/12h)5 | 0,142 microM5 (= 0,068 microg/ml) | 2,6-3,4 microg/ml(VIH+)c,5 |
| Niveles de Cmin sugeridos como mínimo a alcanzar | 0,05 microg/ml | 0,015 microg/ml | No hay datos |
| AUC | AUC0-12h: 2,550 microg.h/ml(VIH+asintomáticos con 300 mg/12h)5 | AUC0-12h: 14,3 microM.h5 (IC90%:7,6-26,6)(=6,89 microg/ml) | 55,8±12,1 microg.h/ml(VIH+)a,5 |
| UPP | 76%2 | 83%2 | 92%5 |
| Vd aparente | 194 l2 | -- | 5,5±1,1l5 |
| Penetración en LCR (LCR:plasma) | Grado 3 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 | Penetración insignificante2Las concentraciones de RAL en LCR (LCR 14,5 ng/ml; conc. plasmáticas 261 ng/ml) fueron 4,5 veces superiores a la CI50 para la cepa salvaje del virus, tomando como CI50 3,2 ng/ml11Grado 3 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 | Penetración insignificante5Grado 1 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor)8 |
| Aclaramiento total | 44,0 l/h2 | 42-78 ml/min | 1,4±0,28 L/h5 |
| Aclaramiento renal | 10,17 l/h2; 8% inalterado por orina2 | 20 ml/min; 9% inalterado por orina2 | Se cataboliza a sus correspondientes aminoácidos que se reciclan en el organismo5. No se ha determinado la eliminación renal, aunque probablemente sea escasa |
| Farmacocinética: efecto de edad, raza y sexo | No se han observado diferencias relevantes en la farmacocinética en función del sexo, la raza o la edad (pacientes de 16 a 65 años). La experiencia en pacientes >65 años de edad es limitada2 | En general, raltegravir presenta una farmacocinética muy variable. No se requiere ajuste de dosis en función de edad, raza o sexo, dado que no se observaron variaciones significaivas5 | La farmacocinética no se ha investigado de manera formal entre personas de 65 o más años. No se han observado diferencias relevantes en la farmacocinética en función de la raza. Los niveles son mayores en mujeres: el aclaramiento es un 20% inferior en el sexo femenino con independencia del peso, y aumenta según lo hace el peso corporal, con independencia del sexo (20% superior para personas de 100 kg y 20% inferior para pacientes de 40 kg, en relación con un paciente prototipo de 70 kg). Sin embargo, estas variaciones carecen de significado clínico y no se precisa ningún ajuste posológico2 |
| Actividad | VIH-1 con tropismo R52 | VIH-1 y VIH-2, tropismo R5, X4 y dual | VIH-15 |
| CI50/90 frente a VIH-1 in vitro | CI50:0,1 a 4,5 nanoM (0,05a 2,3 nanog/ml)5(1 nanoM=0,5 nanog/ml)5CI90: 0,57 (0,06-10,7) nanog/ml2 | CI95: 31± 20 nanoM2 (=14,9 microg/ml) | CI50: 0,259 microg/ml (media geométrica) en un ensayo de entrada de recombinación de genotipos VIH2 |
aExpresado como media ± DE si no se indica lo contrario.
bExpresado como mediana ± rango intercuartil.
cExpresado como rango.
Las reacciones en lugar de la inyección son los efectos secundarios más frecuentemente asociados al uso de ENF, presente en la mayoría de pacientes, generalmente de intensidad leve o moderada, pero constituyen la principal causa de interrupción del tratamiento44.
Actualmente disponemos de múltiples nuevos fármacos más cómodos (vía oral) y mejor tolerados que ENF que nos permiten elaborar regímenes eficaces en cualquier escenario clínico, de manera que el uso de ENF es muy limitado en la práctica clínica.
Antagonistas de los correceptores CCR5: maraviroc (MVC) (tablas 1, 2 y 6)Solo disponemos de un inhibidor de los correceptores CCR5: maraviroc.
MVC está indicado en el tratamiento de la infección por el VIH-1 con tropismo CCR5 detectable mediante test tropismo validado y en combinación con otros fármacos ARV. Actúa bloqueando la entrada del VIH a las células humanas. No es eficaz frente a virus con tropismo dual, mixto o X445.
MVC se comercializa como Celsentri® en comprimidos de 150 y 300mg. La dosis indicada en el adulto es de 150mg, 300mg o 600mg dos veces al día, dependiendo de las interacciones con la terapia antirretroviral y con otros medicamentos. En pediatría no se han establecido la seguridad y la eficacia en pacientes menores de 16 años (tabla 1). Puede administrarse con o sin alimentos.
Sus características farmacocinéticas se indican en la tabla 6. MVC es sustrato de CYP3A4, pero no es inhibidor ni inductor del mismo. Los inhibidores e inductores de CYP3A4 alteran profundamente los parámetros farmacocinéticos de MVC, recomendándose cambios en su dosis, sin que MVC modifique significativamente las concentraciones de otros fármacos. En general se ajustarán las dosis como sigue: 150mg/12h cuando se administra con inhibidores del CYP3A4 como por ejemplo IP/r (con excepción de TPV/r y FPV/r); 600mg BID cuando se administra con fármacos inductores como EFV o rifampicina (con excepción de NVP), en ausencia de inhibidores potentes, en cuya presencia predomina el efecto inhibidor y se administrarán 150mg BID; 300mg BID con otros fármacos (incluyendo TPV/r, FPV/r y NVP). MVC requiere ajuste de dosis en insuficiencia renal en caso de asociarse a inhibidores potentes del CYP3A4 y se han descrito aumentos de sus concentraciones plasmáticas en pacientes con insuficiencia hepática, aunque se desconoce la posible importancia clínica que ello pueda suponer (tabla 2).
El perfil de resistencias de MVC es completamente diferente al de los otros ARV. Hasta el momento se han descrito dos mecanismos principales de resistencia. El primero y más frecuente es la emergencia de virus con tropismo X4 preexistentes como población minoritaria al inicio del tratamiento. El segundo mecanismo resulta de la selección de mutaciones en diferentes regiones de la envoltura (gp 120) que impiden la interacción entre el virus y el receptor CCR546.
Es un fármaco habitualmente muy bien tolerado, con un excelente perfil metabólico y de tolerabilidad digestiva y sin efectos adversos particulares45.
Inhibidores de la integrasa: raltegravir (RAL, MK 0518) (tablas 1, 2 y 6)Solo disponemos de un inhibidor de la integrasa: raltegravir. Próximanente se comercializará elvitegravir, otro inhibidor de la integrasa con unas características considerablemente diferentes a las de RAL, pero que no se comentará en este capítulo. También están en fases avanzadas de desarrollo nuevos inhibidores de la integrasa de segunda generación, con un perfil de resistencias diferentes a los dos de primera generación47–49.
RAL actúa bloqueando la actividad de la enzima integrasa, evitando la integración del virus en el DNA celular47. Está indicado en el tratamiento de la infección por el VIH-1, VIH-2, tropismo R5, X4 y dual, en combinación con otros fármacos ARV.
Se comercializa como Isentress® comprimidos de 400mg. La dosis recomendada en el adulto es de 400mg dos veces al día. No se han establecido la seguridad y la eficacia en pacientes menores de 16 años (tabla 1). Puede tomarse con o sin comidas.
Sus características farmacocinéticas se indican en la tabla 6. RAL no es sustrato ni influye en la actividad del citocromo P450. Se metaboliza por glucuronidación (UGT1A1), sin inhibir ni inducir esta enzima. Los inhibidores e inductores de UGT1A1 modifican los parámetros farmacocinéticos de RAL, pero en la mayoría de los casos no se recomiendan cambios en su dosificación por el amplio margen terapéutico de este fármaco. Solo debería valorarse aumento de dosis de RAL a 800mg c/12h en caso de asociación con rifampicina. No requiere ajuste de dosis en pacientes con insuficiencia renal o hepática leve a moderada (tabla 2).
Tiene un perfil de resistencias completamente diferente al de los otros ARV47–50. La resistencia aparece por mutaciones en el gen de la integrasa en posiciones próximas al centro catalítico, por tres vías: Q148HKR, N155HS o Y143R. Para que se produzca una disminución significativa de la sensibilidad al fármaco debe asociarse alguna otra mutación complementaria a cualquiera de las anteriores.
RAL es un fármaco habitualmente muy bien tolerado, con un excelente perfil metabólico y de tolerabilidad digestiva50.
En definitiva, actualmente disponemos de un elevado número de fármacos ARV con características muy diferentes (posología, tolerabilidad, perfil de resistencias, interacciones, etc.), que dependen por una parte de la familia o clase a la que pertenecen, siendo comunes a otros fármacos de la misma clase, mientras que otras son individuales y diferentes a las de los otros fármacos de la familia. Todo ello nos permitirá elaborar diferentes regímenes terapéuticos eficaces en función de las peculiaridades del individuo (tolerabilidad, simplicidad, adaptabilidad al estilo de vida) y del escenario clínico (naive, simplificación, rescate, resistencias).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nota: sección acreditada por el SEAFORMEC. Consultar preguntas de cada artículo en: http://www.elsevier.es/eimc/formacion.