Capnocytophaga canis es un bacilo gramnegativo anaerobio facultativo capnofílico. Pertenece a la familia Flavobacteriaceae y forma parte de la microbiota comensal orofaríngea de perros y gatos mayoritariamente, junto con Capnocytophaga canimorsus y Capnocytophaga cynodegmi.
Presentamos el caso de un paciente de 72 años que acudió por clínica de astenia y pérdida de 10kg en los últimos meses sin fiebre ni otra clínica acompañante. Desde hacía 3 meses presentaba, además, vómitos persistentes junto con episodios alternantes de diarrea acuosa y deposiciones normales. Como antecedentes destacaban diabetes mellitus 2, así como linfoma centrofolicular estadio IV en 2007 con respuesta completa tras 6 ciclos de R-CHOP y 2 años de tratamiento de mantenimiento. Posteriormente hubo progresión varios años después con instauración de R-CHOP y R-Bendamustina, que fueron interrumpidos por inicio de flutter auricular.
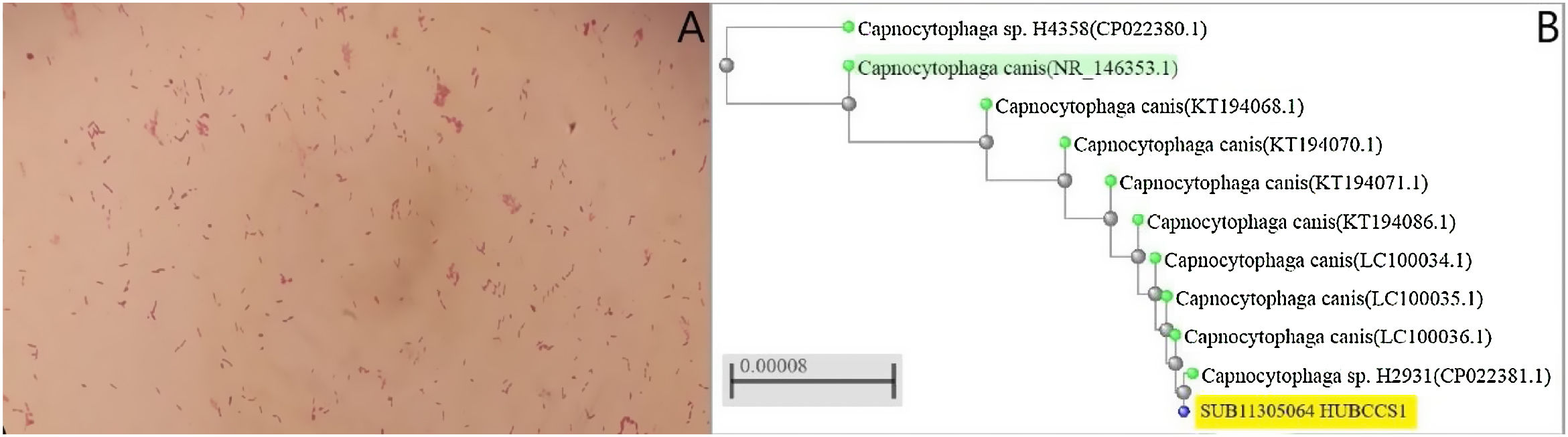
En analítica de sangre destacaba PCR de 159,64mg/L [0-5] con 5,15×103μL leucocitos [4,5-11], con radiografías de tórax y abdomen normales. Veinticuatro horas después de ingresar presentó un pico febril de 38,6°C y se extrajeron muestras de hemocultivo y coprocultivo. Los frascos anaerobios fueron positivos a las 52h y a las 107h, visualizándose bacilos gramnegativos fusiformes (fig. 1A). Se realizaron resiembras en agares MacConkey, Brucella, chocolate y TSA +5% sangre carnero (BDTM), y se incubaron en condiciones de microaerofilia (5% de CO2) y anaerobiosis. Tras 10 días no se visualizó crecimiento. Tras 48h, se detectó Campylobacter jejuni en el «Enteric Bacterial Panel» del sistema BD MAXTM que posteriormente creció en agar Campy BAP (BDTM), resultando sensible a macrólidos. El paciente fue tratado con azitromicina oral (500mg/24h durante 3 días). Además, se realizó tomografía computarizada de cuerpo completo en la que únicamente se observaron adenopatías inguinales y en cadena iliaca externa de hasta 16mm. Dada la sintomatología y el resultado del coprocultivo, este episodio fue considerado como gastroenteritis y bacteriemia transitoria por C. jejuni, siendo dado de alta y completando 3 días más de tratamiento con azitromicina oral.
A) Se observan bacterias gramnegativas con forma de bastón después de 3 días de incubación crecidas en los dos frascos anaeróbicos del hemocultivo. B) Árbol filogenético obtenido tras comparar las secuencias de varias cepas de C. canis con la secuencia de la cepa del presente caso (número de acceso: SUB11305064 HUBCCS1) mediante el método de neighbor joining. Nuestra cepa tenía un 99,57% de coincidencia de identificación con las cepas cercanas (CP022381.1, LC100034.1, LC100035.1 o LC100036.1, pertenecientes a los artículos de Oldham y Duncan1 y Suzuki et al.2) y un 99% con la cepa de referencia (C. canis type strain LMG29146, resaltada en verde en la figura 1B) demostrándose la similitud entre ellas.
Se extrajo muestra del hemocultivo para secuenciar el gen 16S del ARNr (material adicional), siguiendo el protocolo propuesto por Oldham y Duncan, y se obtuvo una secuencia de 463pb, que fue analizada mediante BLASTR (versión 2.13.0, disponible en: https://blast.ncbi.nlm.nih.gov/Blast.cgi)1. Se identificó Capnocytophaga canis con una coincidencia de identificación del 99,57% con cepas aisladas previamente de infecciones, y un 99% con la cepa de referencia (resaltada en verde en la fig. 1B)2,3. Dado que el paciente ya había sido dado de alta no se decidió realizar ninguna otra exploración complementaria.
Un año después volvió a ingresar por shock séptico y empiema por Pasteurella multocida, que produce infección tras mordeduras, arañazos o contacto con la saliva de gatos. Tras reinterrogar al paciente, este refirió haber acogido un gato callejero 2 años antes, que le mordía y arañaba frecuentemente. Entonces se tomó en consideración el hallazgo de C. canis del año anterior. La secuencia obtenida anteriormente tras secuenciación 16S del ARNr fue registrada en GenBank (número de acceso: SUB11305064 HUBCCS1) del NIH/NCBI. Se construyó un árbol filogenético mediante BLASTR (NCBI tree view) con el método de neighbor joining, utilizando los alineamientos por pares de secuencias y basado en secuencias parciales del gen 16S de entre 853 y 1440pb o genoma completo según las cepas (fig. 1B).
C. canis crece con concentraciones del 5-10% de CO2 o en anaerobiosis. Presenta un crecimiento fastidioso y lento (de 48h a 6 días) y no crece en medios como el agar McConkey. C. canis, C. canimorsus y C. cynodegmi son capaces de producir infección en humanos4–6.
Uno de los factores de virulencia descrito recientemente en C. canimorsus es la cápsula de polisacáridos (CPS), que parece protegerlo frente a la acción bactericida del suero humano y que le permite producir enfermedad invasiva7. Renzi et al. caracterizaron varios aislados de muestras clínicas humanas y de perros sanos, encontrándose que algunas cepas de C. canis y C. cynodegmi también presentaban CPS8.
Suzuki et al. caracterizaron 3 casos de C. canis en 2016 de pacientes sépticos, y también se ha descrito un caso de shock séptico causado por este microorganismo en 20202,9–11. En 3 de los casos se encontró que los pacientes eran grandes bebedores y, además, uno de ellos era asplénico, siendo factores de riesgo relacionados anteriormente con infecciones por C. canimorsus7. En nuestra institución esta es la segunda vez que reportamos un caso de infección por C. canis.
Como conclusión, C. canis ha demostrado su capacidad para producir infecciones en humanos. Hay que descartar una infección por esta especie especialmente en pacientes inmunodeprimidos si hay contacto con animales (mordeduras, arañazos o contacto con su saliva) e instaurar un tratamiento antibiótico rápidamente para evitar consecuencias fatales.
FinanciaciónLa presente carta no ha recibido ayudas económicas.
Contribuciones de los autoresDomingo Fernández Vecilla: escribió la carta científica, revisó bibliografía.
Estíbaliz Ugalde Zárraga: ayudó con el diagnóstico molecular (secuencia en GenBank), revisó el caso y la bibliografía.
Mikel Joseba Urrutikoetxea Gutiérrez: revisó el caso, ayudó a modificarlo y revisó la bibliografía.
Felicitas Elena Calvo Muro: ayudó con el diagnóstico, revisó y sugirió cambios para el caso.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.