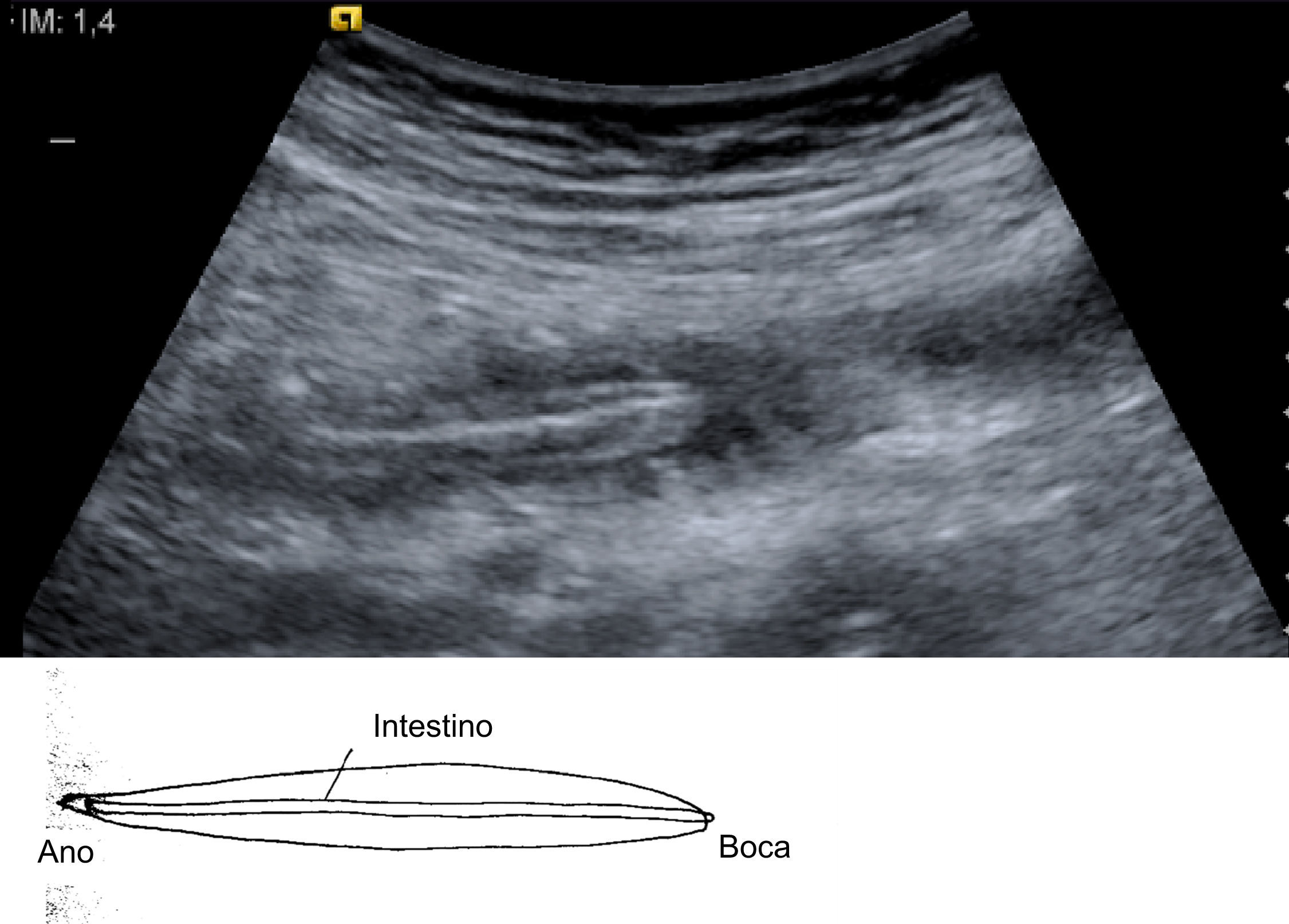
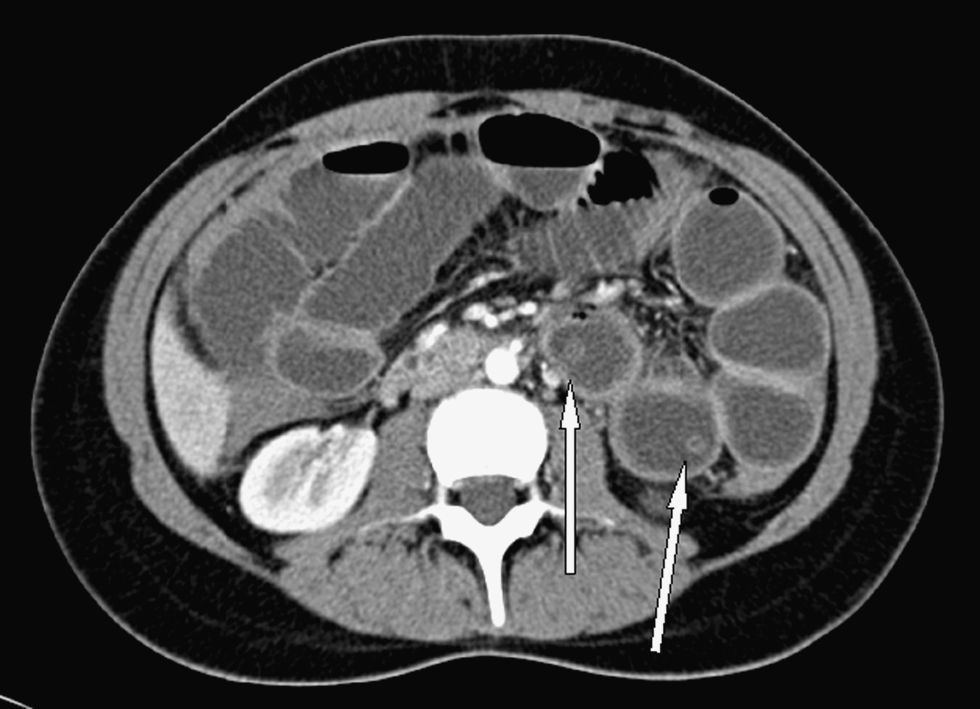
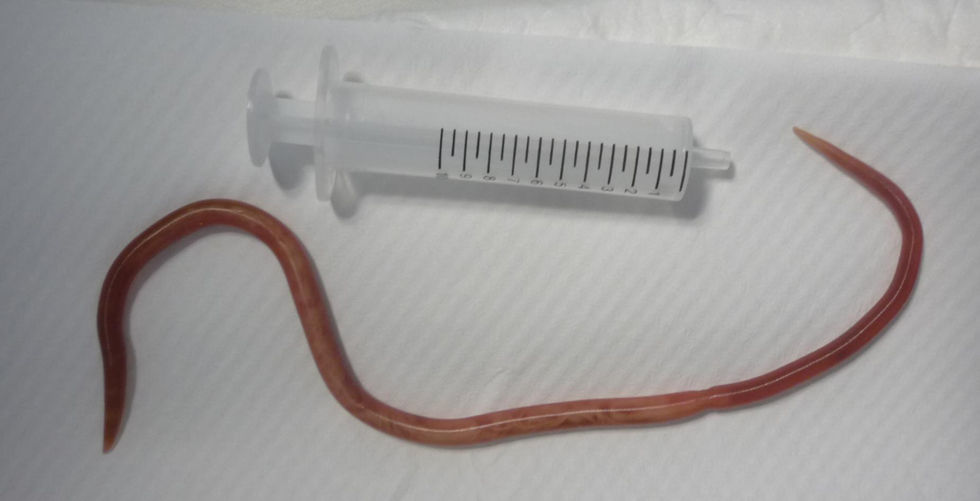
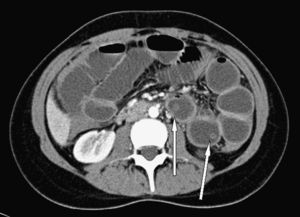
Mujer de 21 años natural de Paraguay, residente en España desde hacía 8 meses, que 6 meses antes de ingresar había acudido a la consulta para estudio y tratamiento de su infección por VIH. La paciente no había tenido ninguna infección oportunista. En ese momento presentaba una carga viral de 347.000copias/ml y un recuento de linfocitos CD4 de 70células/mm3. Un mes después comenzó tratamiento prolongado por vía oral con efavirenz (600mg/24h), emtricitabina (200mg/24h), tenofovir (300mg/24h) y cotrimoxazol (800/160mg 3 veces por semana). Tras 2 meses de tratamiento, la carga viral era indetectable y los linfocitos CD4 se incrementaron hasta 137células/mm3. Tres meses después, la paciente acudió a urgencias por fiebre elevada (40°C), dolor abdominal difuso y vómitos biliosos de 36h de evolución. El abdomen estaba distendido, doloroso de manera difusa con defensa en fosa ilíaca derecha y con ruidos peristálticos muy disminuidos. En la analítica destacaba leucocitosis de 18.280 leucos (el 92% neutrófilos, el 5% monocitos, el 2% linfocitos). Una ecografía puso de manifiesto una imagen indicativa de helminto en el interior del intestino (fig. 1). En una tomografía computarizada (TC) abdominal se evidenció una colección pélvica de 10×5,5cm que englobaba al apéndice vermiforme, que se encontraba engrosado, y dilatación de asas de intestino delgado, se comprobó que existía una estructura intraluminar tubular de unos 30cm de longitud y 0,4cm de diámetro en el yeyuno proximal (fig. 2). A continuación se decidió realizar una exploración laparoscópica de la cavidad abdominal y se observó apendicitis gangrenosa perforada y peritonitis purulenta con absceso en la fosa ilíaca derecha. Se procedió a apendicectomía y al aspirado de contenido del absceso. El tratamiento antibiótico pautado fue piperacilina/tazobactam (4,5/8g por vía intravenosa), que se mantuvo 10 días. En el cultivo del absceso se aislaron Escherichia coli y Bacteroides fragilis. Tres días después de la intervención, la paciente presentó un acceso de tos y posteriormente vómito con posterior expulsión de un helminto de color anaranjado no segmentado de 30cm de longitud (fig. 3).
En el laboratorio de microbiología se confirmó que el parásito correspondía a una hembra adulta de Ascaris lumbricoides. Por eso se prescribió albendazol (400mg) en una dosis única por vía oral que fue bien tolerada. El examen anatomopatológico demostró inflamación aguda del apéndice con perforación, pero sin evidenciar estructuras parasitarias en su interior. También se realizó un examen de parásitos en heces de la primera deposición después de la intervención, que tampoco permitió detectar huevos de parásitos. Durante el postoperatorio, la paciente se recuperó completamente y fue dada de alta al décimo día de ingreso, y continuó con amoxicilina/clavulánico (500/125mg cada 8h) por vía oral hasta completar 14 días de tratamiento antibiótico. La paciente permaneció asintomática durante el seguimiento posterior en la consulta. El recuento de linfocitos CD4 en la primera consulta después del alta fue de 285células/mm3 y la carga viral permaneció indetectable.
ComentarioA. lumbricoides es el nematodo intestinal que con más frecuencia afecta al hombre1. La parasitación por Ascaris suele remitir durante el primer año después de salir de la región endémica al producirse la muerte del parásito, fenómeno que no parece depender del estado inmunitario del paciente2,3. Entre las complicaciones intraabdominales relacionadas con la infestación por Ascaris, destacan los cuadros de obstrucción o perforación intestinal, dilatación de la vía biliar, absceso hepático, pancreatitis y apendicitis3. En el caso presentado, la ecografía y la TC evidenciaron la existencia del parásito en el intestino delgado pero no en la proximidad del apéndice3. La ausencia de hallazgos indicativos en el examen anatomopatológico indica que la infestación por Ascaris pudo no participar en la génesis de la apendicitis y que la coincidencia temporal de ambas infecciones podría haber sido un fenómeno casual.
Aunque se han descrito casos de esquistosomiasis y estrongiloidiasis que empeoraron tras el inicio de tratamiento antirretroviral, no se han reportado casos de síndrome de reconstitución inmune en pacientes portadores de Ascaris4; su sintomatología depende, en la mayoría de los casos, de la obstrucción mecánica de distintas estructuras del aparato digestivo2,3. El conocimiento de la presentación clínica habitual de las infestaciones más frecuentes puede ayudar a establecer una sospecha diagnóstica adecuada en pacientes procedentes de zonas endémicas. Así, conviene señalar que la enfermedad producida por Capillaria philippinensis se caracteriza por diarrea crónica acuosa, alteraciones electrolíticas y malnutrición5. La infestación por Angiostrongylus cantonensis suele cursar con meningitis eosinofílica, focalidad neurológica y defectos visuales5. La causada por Strongyloides stercolaris puede producir dolor abdominal, diarrea, anorexia, náuseas y vómitos4. En inmunodeprimidos existe el riesgo de hiperinfestación con sepsis o meningitis por enterobacterias que se transportan en la superficie externa del parásito tras penetrar por la pared intestinal4. Sin embargo, A. lumbricoides está considerado como un parásito no “oportunista”. Por esto, aunque se haya indicado que el deterioro inmunitario producido por el VIH podría incrementar el riesgo de presentar infestación por este parásito, se considera que la infestación por Ascaris se comporta en los pacientes VIH+ de modo similar a lo observado en inmunocompetentes6,7.
Algunos autores han considerado un posible efecto inmunomodulador de los parásitos intestinales, relacionado con una intensa respuesta Th2 (respuesta mediada por linfocitos cooperadores tipo 2) en detrimento de la respuesta Th1, que favorecería la replicación viral y una disminución en el recuento de linfocitos CD48,9. Sin embargo, un metaanálisis reciente no ha demostrado que la eliminación de los parásitos intestinales tenga una influencia relevante en la cifra de CD4 o en la progresión de la infección por VIH10.