Fundamentos: Las determinaciones microbiológicas de la carga viral de los virus de la inmunodeficiencia humana de tipo 1 (VIH-1), de la hepatitis C (VHC) y de la hepatitis B (VHB) son fundamentales para el seguimiento y control de los pacientes infectados por estos virus. Los laboratorios de microbiología disponen de herramientas que garantizan la fiabilidad de sus resultados; entre ellas se encuentran los programas de intercomparación externos, como el Programa de Control de Calidad de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). En este artículo se muestra el análisis de resultados del Programa de Control de Calidad SEIMC de Carga Viral de estos virus, incluyendo el genotipado del VHC, realizado durante el año 2016.
Métodos y resultados: En el control del VIH-1 se remitieron 5 estándares, de los cuales uno (plasma humano seronegativo) no contenía el virus y los otros 4 consistían en plasma de 3 pacientes virémicos distintos en un intervalo de concentraciones entre 2 y 5 log10 copias/ml. Una parte considerable de los laboratorios obtuvo de uno a varios resultados fuera de los límites aceptables (media ± 0,25 log10 copias/ml), en función del estándar y del método empleado, con un término medio del 40% de los centros. En los controles de VHC y VHB se remitieron 2 estándares con diferente contenido del virus. La mayor parte de los participantes, el 86,5% en el caso del VHC y el 85,6% en el del VHB, obtuvo ambos resultados dentro de los límites de la media ± 1,96 DE log10 UI/ml.
Conclusiones: Los resultados obtenidos ponen de manifiesto la utilidad de los controles externos para asegurar la calidad de los resultados analíticos. Debido a la variabilidad interlaboratorio, es aconsejable utilizar el mismo método y el mismo laboratorio en el seguimiento de los pacientes.
Información sobre el suplemento: Este artículo forma parte del suplemento titulado «Programa de Control de Calidad Externo SEIMC. Año 2016», que ha sido patrocinado por Roche, Vircell Microbiologists, Abbott Molecular y Francisco Soria Melguizo, S.A.
© 2019 Elsevier España, S.L.U. y Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. Todos los derechos reservados.
Background: Human immunodeficiency virus type 1 (HIV-1) and hepatitis B (HBV) and C virus (HCV) viral load determinations are among the most important markers for the follow-up of patients infected with these viruses. Microbiology laboratories have a variety of tools to ensure the accuracy of the results obtained, including external quality control programmes such as that of the Spanish Society of Infectious Diseases and Clinical Microbiology (SEIMC). This article summarises the results of the 2016 SEIMC External Quality Control Programme for HIV-1, HCV, and HBV viral loads.
Methods and results: In the HIV-1 programme, a total of 5 standards were sent. One standard consisted of seronegative human plasma, while the remaining 4 contained plasma from 3 different viremic patients, in the range of 2-5 log10 copies/mL. A significant proportion of the laboratories (40% on average) obtained values out of the accepted range (mean ± 0.25 log10 copies/mL), depending on the standard and on the method used for quantification. The HBV and HCV programme consisted of 2 standards with different viral load contents. Most of the participants, 86.5% in the case of HCV and 85.6% in the case of HBV, obtained results that were all within the accepted range (mean ± 1.96 SD log10 UI/mL).
Conclusions: Data from this analysis reinforce the utility of proficiency programmes to ensure the quality of the results obtained by a particular laboratory. Due to the marked interlaboratory variability, it is advisable to use the same method and the same laboratory for patient follow-up.
Supplement information: This article is part of a supplement entitled «SEIMC External Quality Control Programme. Year 2016», which is sponsored by Roche, Vircell Microbiologists, Abbott Molecular and Francisco Soria Melguizo, S.A.
© 2019 Elsevier España, S.L.U. and Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. All rights reserved.
La determinación de la carga viral del virus de la inmunodeficiencia humana de tipo 1 (VIH-1), del virus de la hepatitis B (VHB) y del virus de la hepatitis C (VHC) es una de las funciones primordiales del laboratorio de microbiología molecular. Para ello, los laboratorios suelen emplear sistemas comerciales, pero su eficacia diagnóstica es difícil de evaluar con la sola experiencia de cada centro. El Programa de Control de Calidad de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) dispone de controles externos de carga viral de los virus VIH-1, VHC y VHB. Estos son de participación anónima y voluntaria, y están a disposición de los profesionales que desarrollan su actividad en el laboratorio e, indirectamente, de los clínicos que atienden a los pacientes infectados por esos virus. Además, el control de carga viral del VHC incluye la realización de su genotipado.
En este artículo se resumen las principales conclusiones y enseñanzas derivadas del análisis conjunto de los resultados remitidos por los participantes en la edición del año 2016.
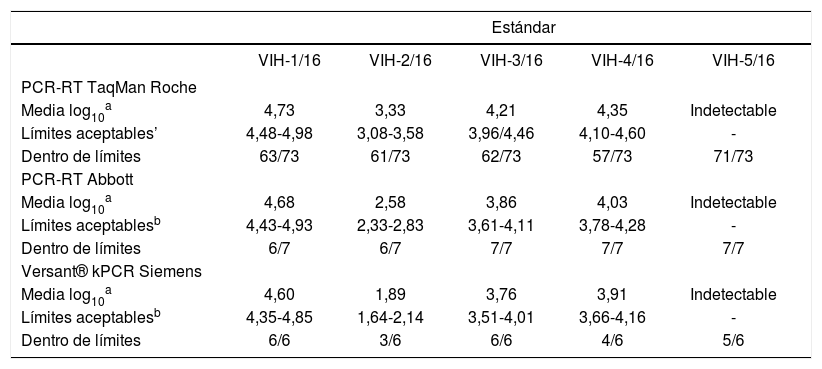
Control de calidad del VIH-1Características del material remitidoEn la ronda correspondiente al año 2016 se remitieron a los participantes 5 estándares de plasma congelado, denominados VIH-1/16, VIH-2/16, VIH-3/16, VIH-4/16 y VIH-5/16, de los cuales se había analizado y valorado el contenido en ácido ribonucleico (ARN) del VIH-1. Cuatro de ellos contenían cantidades conocidas de ARN y fueron obtenidos de plasma procedente de distintos pacientes con viremia para buscar contenidos teóricos dentro de un intervalo de 2-5 unidades logarítmicas. El estándar VIH-5/16 se preparó con plasma de un paciente seronegativo. Las muestras se analizaron, antes de su envío, en 3 laboratorios diferentes mediante distintos métodos comerciales de reacción en cadena de la polimerasa real time (PCR-RT), lo que confirma los valores teóricos.
Una vez preparados los estándares, se mantuvieron congelados a –80 °C hasta su envío a los participantes, que se realizó con nieve carbónica y asegurando entregas en menos de 24 horas.
Criterios de evaluaciónPara demostrar la especificidad de las determinaciones se contaba con el estándar VIH-5/16 como control negativo (plasma seronegativo). En este caso, se consideraron válidos aquellos resultados que se notificaron por debajo del límite de detección de la técnica utilizada, por lo que cualquier cuantificación se correspondería con un resultado falso positivo. En todos los casos, se eliminaron los valores extremos y aberrantes para el cálculo de la media1. El criterio de aceptación se fijó en la media de resultados notificados por los participantes de cada estándar mediante cada uno de los métodos ± 0,25 log102-8.
Resultados del control del VIH-1Se envió el material de control a 102 participantes, de los cuales 91 remitieron respuesta (89,2%). El método más empleado fue la PCR-RT Taqman® de Roche (81,3%), seguido por la PCR-RT de Abbott (7,7%), la kPCR de Siemens (6,6%), la PCR-RT de Qiagen (2,2%) y el resto de participantes (2,2%) comunicaron otras técnicas distintas (NASBA-RT Nuclisens de bioMérieux y PCR-RT in house). Todos los participantes emplearon técnicas de PCR-RT.
En la tabla 1 se resumen los resultados de cada método comercial. Desde el punto de vista de la especificidad, los resultados fueron buenos aunque en total 3 de los centros comunicaron valores cuantificables para el estándar negativo (VIH-5/16), todos ellos por posible error de transcripción de los resultados en la página web o por error de etiquetado de las muestras, ya que en su lugar se notificó otro de los estándares como negativo. En cuanto a la variabilidad de los resultados, la mayor parte de los que se encuentran fuera del intervalo de aceptación se correspondieron con el estándar VIH-4/16. Asimismo, de la tabla 1se puede deducir la existencia de una variabilidad intermétodo, que se confirma cuando se analizan los resultados individuales de los participantes (no se muestran), de modo que los valores obtenidos con el mismo estándar utilizando 2 métodos distintos no son siempre comparables. Estos resultados, en su conjunto, son similares a los obtenidos en el Programa de Control de Calidad SEIMC de otros años3-8.
Control del virus de la inmunodeficiencia humana 1 (V1H-1): análisis de los resultados dentro de limites según el método comercial utilizado
| Estándar | |||||
|---|---|---|---|---|---|
| VIH-1/16 | VIH-2/16 | VIH-3/16 | VIH-4/16 | VIH-5/16 | |
| PCR-RT TaqMan Roche | |||||
| Media log10a | 4,73 | 3,33 | 4,21 | 4,35 | Indetectable |
| Límites aceptables’ | 4,48-4,98 | 3,08-3,58 | 3,96/4,46 | 4,10-4,60 | - |
| Dentro de límites | 63/73 | 61/73 | 62/73 | 57/73 | 71/73 |
| PCR-RT Abbott | |||||
| Media log10a | 4,68 | 2,58 | 3,86 | 4,03 | Indetectable |
| Límites aceptablesb | 4,43-4,93 | 2,33-2,83 | 3,61-4,11 | 3,78-4,28 | - |
| Dentro de límites | 6/7 | 6/7 | 7/7 | 7/7 | 7/7 |
| Versant® kPCR Siemens | |||||
| Media log10a | 4,60 | 1,89 | 3,76 | 3,91 | Indetectable |
| Límites aceptablesb | 4,35-4,85 | 1,64-2,14 | 3,51-4,01 | 3,66-4,16 | - |
| Dentro de límites | 6/6 | 3/6 | 6/6 | 4/6 | 5/6 |
PCR-RT: reacción en cadena de la polimerasa real time.
En cuanto a los métodos de PCR-RT, el comercializado por Roche (Taqman®) obtiene el 13,82% de resultados fuera del límite de aceptación; el de Abbott, el 5,7%, y el de Siemens, el 20,0%; con todo, hay que tomar estos 2 últimos datos con mucha cautela, pues el número de participantes que utilizaron estos métodos es muy bajo (de 7 a 6, dependiendo de la técnica).
En total, hubo un centro que no comunicó bien ninguno de los 5 estándares recibidos. Además, el 18% de los participantes falló en el estándar VIH-2/16, el 13% en los estándares VIH-1/16 y VIH-3/16, el 21% en el estándar VIH-4/16 y el 3% en el VIH-5/16.
Comentarios y conclusiones al control del VIH-1En términos generales, los resultados que se presentan en este artículo dan una idea de la variabilidad que se puede obtener en el laboratorio en la práctica diaria y con una prueba de importante trascendencia como es la carga viral del VIH-1. Cuando se observa la variabilidad intermétodo (incluso si se eliminan los resultados extremos y aberrantes), esta se aproxima y, en ocasiones, supera las 0,5 unidades logarítmicas, el valor límite usado en la práctica clínica para establecer un cambio importante de carga viral, lo que refuerza la conveniencia de no cambiar de laboratorio en el seguimiento habitual de los pacientes.
Es importante señalar que el porcentaje de valores que se situó fuera del intervalo de aceptación de ± 0,25 log10 copias/ml alrededor de la media para cada técnica fue relativamente alto y que la mayor experiencia se obtuvo con la técnica PCR-RT Roche. El resto de métodos fueron empleados por pocos centros, por lo que las conclusiones obtenidas a partir del análisis de sus datos deben ser tomadas con cautela.
Cuando se analizó la especificidad, los resultados no fueron muy buenos, aunque este hecho pudo estar relacionado con errores de tipo pre-o posanalítico, y no con errores del método analítico empleado.
A modo de resumen, estos resultados pueden considerarse aceptables y coherentes con lo esperado a pesar de algunas desviaciones, que muestran la posibilidad de obtener resultados erróneos en cualquier laboratorio. Por ello es necesario introducir acciones de control interno y externo que reduzcan la aparición de dichas desviaciones; entre ellas, la participación en ejercicios de intercomparación externos2-11, como los representados por el Programa de Control de Calidad Externo SEIMC.
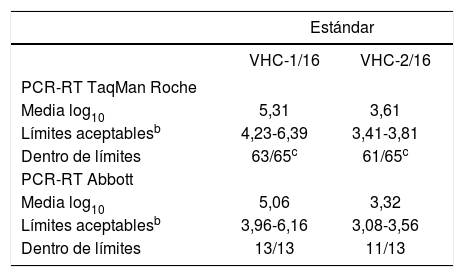
Control de calidad del VHCCaracterísticas del material remitidoEn el control de carga viral del VHC se remitieron 2 estándares de plasma congelado (VHC-1/16 y VHC-2/16) obtenidos de 2 pacientes distintos con viremia por el VHC para buscar unos contenidos aproximados en UI/ml preestablecidos. Una vez realizadas las alícuotas, se conservaron a una temperatura de –80 °C hasta el momento de su envío, que se hizo en nieve carbónica y con entregas inferiores a las 24 h. Ambos estándares, previamente a su envío, habían sido analizados por 2 laboratorios expertos diferentes, cada uno de los cuales empleó un método comercial diferente, por lo que se confirmaron los valores teóricos aproximados. También se solicitó la realización del genotipado a todos los participantes que en sus centros dispusieran de dicha técnica. En esta ocasión, el genotipado se debía realizar con el estándar VHC-1/16 y su valor asignado fue genotipo 2, realizado por PCR-RT de Abbott (genotipo 2) e hibridación inversa INNOLiPA-Versant, Siemens-(genotipo 2a/2c). De este modo, se consideraron respuestas válidas todas las que se comunicaron dentro del genotipo 2 (incluyendo los diferentes subtipos).
Criterios de evaluaciónLos 2 estándares se analizaron de forma cuantitativa (log10 UI/ml) comparando los resultados individuales obtenidos por cada participante respecto al intervalo de confianza del 95% (media ± 1,96 DE) de todos los que utilizaron su mismo método comercial12,13. Al igual que con el control del VIH-1, para el cálculo de la media y de la desviación estándar se excluyeron los valores extremos y aberrantes1.
Resultados del control del VHCEn este control se remitieron muestras a 102 laboratorios, de los cuales respondieron 89 (87,2%). De ellos, 64 realizaron también el genotipado del VHC, lo que representa el 71,9% del total de participantes que enviaron la hoja de respuesta.
La técnica utilizada mayoritariamente por los participantes para la realización de la carga viral fue la amplificación por PCR-RT, especialmente con el sistema comercial Taqman® de Roche (66 centros, el 74,1%). Trece participantes (14,6%) utilizaron la PCR-RT de Abbott; 4, la kPCR Versant de Siemens (4,5%); 3, la PCR-RT de Qiagen Diagnostics (3,4%); 2, una PCR-RT in house (PCR de desarrollo propio), y uno, una PCR-RT de Veris (Beckman-Coulter).
La tabla 2 resume los datos del total de participantes. La variabilidad fue similar en términos de desviación respecto a la media en ambos estándares (VHC-1/16 y VHC-2/16). Cuando se comparan todos los resultados comunicados, independientemente de la técnica empleada, se encuentra dentro del intervalo de aceptación el 93,2%. Cabe destacar que en 3 de las ocasiones en que ambos estándares se encuentran dentro del intervalo de aceptación (100%), uno de ellos deja de estarlo (50%) cuando se comparan solo con los de su mismo método. De forma general y, una vez eliminados los valores aberrantes, los resultados obtenidos fueron considerados buenos.
La tabla 3 resume los resultados comparados por cada una de las técnicas con la media de los que usan su mismo método aunque los resultados de las técnicas empleadas por un bajo número de participantes deben tomarse con prudencia. En general, los valores obtenidos quedaban comprendidos dentro del margen aceptable (intervalo de confianza del 95% de la media de los participantes por cada técnica), lo que destaca que, puesto que la técnica de PCR-RT Taqman® de Roche fue la más ampliamente utilizada (66 participantes), las conclusiones que de ella se derivan son las más coherentes. Mediante esta técnica, 6 de los 130 resultados analizados (4,6%) quedaron fuera del intervalo de aceptación, de los cuales 2 se obtuvieron con el estándar VHC-1/16 y 4 con el VHC-2/16. Solo un centro presentó ambos estándares fuera de los límites de aceptación. Cabe destacar que, en la gran mayoría de las ocasiones, se obtienen resultados dentro del intervalo aceptable.
Control del virus de la hepatitis C (VHC): análisis de los resultados dentro de limites según el método comercial utilizadoa
| Estándar | ||
|---|---|---|
| VHC-1/16 | VHC-2/16 | |
| PCR-RT TaqMan Roche | ||
| Media log10 | 5,31 | 3,61 |
| Límites aceptablesb | 4,23-6,39 | 3,41-3,81 |
| Dentro de límites | 63/65c | 61/65c |
| PCR-RT Abbott | ||
| Media log10 | 5,06 | 3,32 |
| Límites aceptablesb | 3,96-6,16 | 3,08-3,56 |
| Dentro de límites | 13/13 | 11/13 |
DE: desviación estándar.
Un centro no comunicó resultado en este estándar.
En cuanto al resto de métodos, cabe resaltar que el sistema PCR-RT de Abbott fue empleado por 13 centros. De los 26 valores informados, 2 estaban fuera del intervalo de aceptación, lo que representó que el 92,3% del total de valores informados de ambos estándares se situaran dentro de dicho intervalo. Por lo que respecta a los resultados que quedaron fuera de dicho intervalo, los 2 se correspondieron con el estándar VHC-2/16 (estándar de menor carga).
No se muestran los datos de los métodos kPCR Versant de Siemens, la PCR-RT de Qiagen y la PCR-RT in house porque fueron empleados por muy pocos centros.
Aunque no es posible establecer un análisis estadístico de correlación de valores, las medias obtenidas con las PCR-RT Taqman® de Roche y la de Abbott fueron bastante homogéneas y, en conjunto, podríamos afirmar que los métodos son razonablemente comparables entre sí.
De los 89 participantes que contestaron al control, 64 realizaron el genotipado del VHC (71,9%). Todos informaron un genotipo 2 o un subtipo dentro del genotipo 2 de acuerdo con las posibilidades del método empleado.
El método que se utilizó de forma mayoritaria por los participantes fue la hibridación inversa (64,1%), seguido de la PCR-RT (28,1%) y la secuenciación (7,8%). De los 39 participantes que emplearon el sistema de INNOLiPA HCV-Versant, Siemens-, 37 usaron la versión 2.
La marca comercial más empleada fue INNOLiPA HCV de Siemens (60,9%). Con ella, la mayoría de los genotipos informados se correspondieron con 2a/2c (87,2%). La técnica Linear Array HCV de Roche fue usada por el 3,1% de los participantes y todos ellos notificaron el genotipo 2. Respecto a los equipos basados en una PCR-RT, con todos ellos se informó un genotipo 2, mientras que mediante secuenciación el genotipo más informado fue el 2c (80,0%). Los datos se muestran en la tabla 4.
Análisis de los resultados del genotipado del VHC (estándar VHC-1/16)
| Método | Marca | Genotipo 2a/2ca | Genotipo 2ca | Genotipo 2a | Totalb |
|---|---|---|---|---|---|
| Hibridación inversa | INNOLiPA HCV vi (Siemens) | 2(100) | - | - | 2 (3,1) |
| INNOLiPA HCV v2 (Siemens) | 32 (86,5) | - | 5 (13,5) | 37 (57,8) | |
| Linear array HCV (Roche) | - | - | 2 (100,0) | 2 (3,1) | |
| PCR-RT | Abbott RT HCV | - | - | 12 (100,0) | 12 (18,8) |
| Cobas HCV GT (Roche) | - | - | 5 (100,0) | 5 (7,8) | |
| Desarrollo propio | - | - | 1 (100,0) | 1 (1,6) | |
| Secuenciación | Desarrollo propio | 1 (20,0) | 4 (80,0) | - | 5 (7,8) |
| Total | - | 35 (54,7) | 4 (6,2) | 25 (39,1) | 64 (100) |
Desde el punto de vista de valoración general de los resultados, los que se presentan en este artículo deben ser considerados como buenos y coherentes con lo esperado. La mayor parte de los participantes incluyen sus resultados individuales dentro del intervalo de aceptación (IC del 95%). Además, no se detectaron resultados falsamente negativos aunque 2 participantes no aportaron resultado alguno de los estándares por problemas técnicos.
Por lo que se refiere al análisis por técnicas comerciales empleadas en la carga viral, no es posible obtener datos concluyentes debido a la utilización mayoritaria de determinado método. Respecto a la detección del genotipo, los resultados se consideran buenos dado que todos los centros lo informaron dentro del genotipo 2.
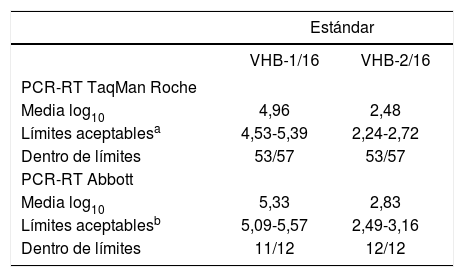
Control de calidad del VHBCaracterísticas del material remitidoEn el control de carga viral del VHB se remitieron 2 estándares de plasma congelado (VHB-1/16 y VHB-2/16) obtenidos de 2 pacientes distintos con viremia por el VHB para buscar unos contenidos aproximados en UI/ml preestablecidos. Una vez realizadas las alícuotas, se conservaron a una temperatura de –80 °C hasta el momento de su envío, que se hizo en nieve carbónica y con entregas inferiores a las 24 h. Ambos estándares habían sido analizados, previamente a su envío, por 2 laboratorios diferentes, cada uno de los cuales empleó un método comercial diferente, y se confirmaron los valores teóricos aproximados.
Criterios de evaluaciónLos 2 estándares se analizaron de forma cuantitativa (log10 UI/ml), comparando los resultados individuales obtenidos por cada participante respecto al intervalo de confianza del 95% (media ± 1,96 DE) de todos los que utilizaron su mismo método comercial12,13. Al igual que con el control del VIH-1 y del VHC, para el cálculo de la media y de la desviación estándar se excluyeron los valores extremos y aberrantes1.
Resultados del control VHBEn este control se remitieron muestras a 88 laboratorios, de los que 77 respondieron, lo que representa un porcentaje de participación del 87,5%. Como sucede con los otros controles e carga viral (VIH-1 y VHC), el método informado por la gran mayoría de los participantes fue la PCR-RT por el sistema Cobas Taqman® de Roche (57 centros, el 74%); seguida a distancia por la PCR-RT de Abbott (12 participantes, 15,6%) y la kPCR de Versant (Siemens; 4 centros, 5,2%). Por último, 2 participantes realizaron la PCR-RT de Qiagen (2,6%), uno una PCR-RT por el sistema Veris (Beckman Coulter) y otro una PCR-RT de desarrollo propio (1,3%).
La tabla 5 resume los datos del total de participantes. La variabilidad fue algo mayor, en términos de desviación respecto a la media, para el estándar VHB-2/16 (estándar de menor carga viral). Del total de resultados informados, se encontraban dentro del intervalo de aceptación alrededor del 91%. Cabe destacar que 3 participantes obtuvieron ambos valores fuera del intervalo aceptable. En todas las ocasiones, excepto una (resultado falsamente negativo), se detecta carga viral en ambos estándares. En general, una vez eliminados los resultados aberrantes, estos fueron buenos.
Control del virus de la hepatitis B (VHB): resultados comparados sobre el total de participantes, con independencia de la técnica utilizada”
| Estándar | ||
|---|---|---|
| VHB-1/16 | VHB-2/16 | |
| Media log10 | 5,05 | 2,52 |
| Media log10 ± 1,96 DE | 4,54-5,55 | 2,08-2,96 |
| Dentro de límites | 72/77 | 68/77 |
DE: desviación estándar.
a Expresados en log10 UI/ml.
La tabla 6 resume los resultados comparados por las técnicas empleadas mayoritariamente con la media de los que utilizan su misma técnica. No se muestran los datos de los sistemas Versant (Siemens), Qiagen, Veris (Beckman Coulter) ni de la PCR-RT de desarrollo propio porque fueron empleados por muy pocos centros. En general, los valores obtenidos quedaban comprendidos dentro del margen aceptable (intervalo de confianza del 95% de la media de los participantes por cada técnica). Puesto que la técnica de PCR-RT Taqman® de Roche fue la más ampliamente utilizada, las conclusiones que de ella se derivan son las más coherentes. Mediante esta técnica, un total de 8 resultados de los 114 notificados (7,0%) quedaron fuera del intervalo de aceptación, de los cuales 4 se obtuvieron con el estándar VHB-1/16 y los otros 4 con el VHB-2/16, aunque se detectó carga viral en todas las ocasiones. Además, uno de los centros participantes no presentó ninguno de sus valores dentro del intervalo de aceptación.
Control del virus de la hepatitis B (VHB): análisis de los resultados dentro de límites según el método comercial utilizado”
| Estándar | ||
|---|---|---|
| VHB-1/16 | VHB-2/16 | |
| PCR-RT TaqMan Roche | ||
| Media log10 | 4,96 | 2,48 |
| Límites aceptablesa | 4,53-5,39 | 2,24-2,72 |
| Dentro de límites | 53/57 | 53/57 |
| PCR-RT Abbott | ||
| Media log10 | 5,33 | 2,83 |
| Límites aceptablesb | 5,09-5,57 | 2,49-3,16 |
| Dentro de límites | 11/12 | 12/12 |
DE: desviación estándar.
En cuanto al sistema de PCR-RT de Abbott, 11 de los 12 participantes que emplean esta técnica tienen ambos valores dentro del intervalo de aceptación (91,7%). El centro restante obtiene el 50% de los valores dentro del intervalo de aceptación. El estándar fuera de intervalo se correspondió con el código VHB-1/16.
Comentarios y conclusiones al control del VHBDesde el punto de vista de valoración general de los resultados, los presentados en este artículo deben ser considerados como aceptables y coherentes con lo esperado. En prácticamente todas las ocasiones se detecta carga viral y se observa solo un resultado falsamente negativo. Además, en esta edición no se han detectado errores de transcripción de los datos en la web o del etiquetado de los estándares (error de la fase posanalítica o de la fase preanalítica).
La mayor parte de los participantes incluyen sus resultados individuales dentro del intervalo de aceptación (IC del 95%). No obstante, es importante que los laboratorios de forma individual mantengan un alto grado de vigilancia sobre la calidad de sus resultados en el día a día y, en caso necesario, introduzcan las medidas correctoras oportunas. Por lo que se refiere al análisis por técnicas comerciales, no es posible obtener datos concluyentes debido a la utilización mayoritaria de determinado método.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Programa de Control de Calidad Externo SEIMC. Año 2016», que ha sido patrocinado por Roche, Vircell Microbiologists, Abbott Molecular y Francisco Soria Melguizo, S.A.