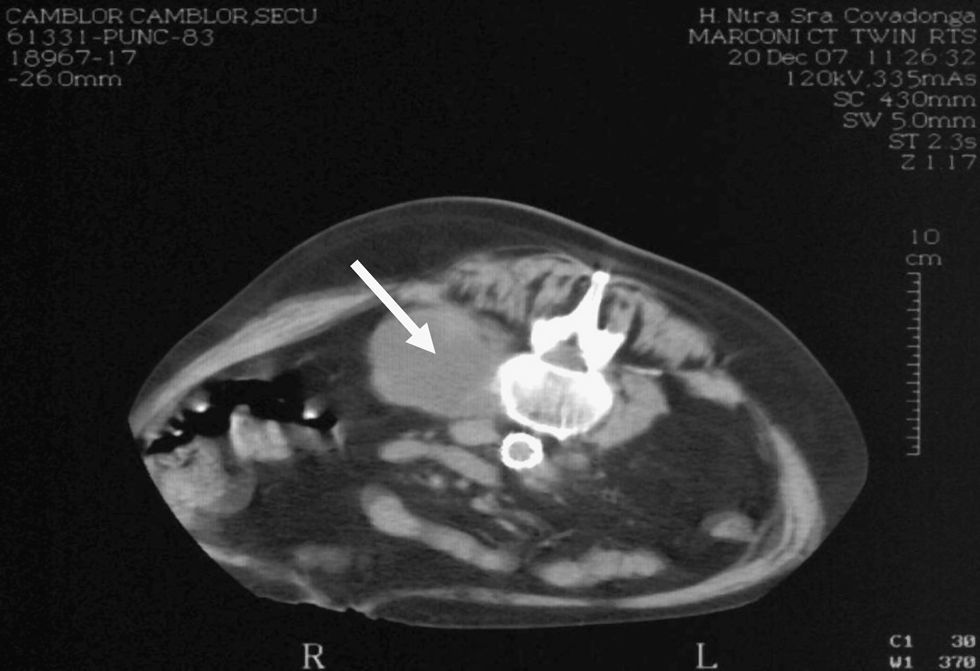
Los nuevos tratamientos inmunitarios (interferón, citocinas, antifactor de necrosis tumoral, bacilo de Calmette y Guérin [BCG]) han supuesto un gran avance terapéutico en la lucha contra los tumores, pero no están exentos de morbilidad. Aquí presentamos un caso clínico debido a complicaciones infecciosas de uno de estos tratamientos. Paciente de 83 años, diabético e hipertenso, tratado 7 años antes por carcinoma urotelial de vejiga con resección transuretral e instilaciones mensuales de BCG (81mg/sesión) —la última 5 años antes del ingreso— y recidiva tumoral tratada con cistoprostatectomía radical y derivación tipo Bricker 2 años después. El paciente refería un síndrome general de 3 meses de evolución con pérdida de 20kg y dolor abdominal, pero sin fiebre. Al ingreso se demostraron en ecografía y en tomografía computarizada (TC) abdominal un absceso del psoas derecho y 2 colecciones, una proximal al proceso uncinado pancreático (4 × 2cm) y otra paraaórtica izquierda (3 × 2cm) (fig. 1). La analítica era anodina, excepto la velocidad de sedimentación globular de 73mm en la primera hora, y la proteína C reactiva de 9,46μg/d. Tras extraerse hemocultivo y urinocultivo, y ante la sospecha de absceso retroperitoneal piogénico, se comenzó tratamiento empírico con meropenem en dosis de 1g/8h por vía intravenosa (VIV) más teicoplanina en dosis de 400mg/24h por VIV durante10 días. Los cultivos y la prueba de Mantoux (2 unidades de tuberculina de derivado proteico purificado) fueron negativos. Se descartaron espondilodiscitis dorsolumbar y endocarditis bacteriana tras la resonancia magnética y la ecocardiografía transtorácica. Se intentó una punción guiada por TC, pero sólo se extrajeron 30ml de pus del absceso del psoas derecho, que mostró un cultivo negativo para bacterias. Se procedió al drenaje quirúrgico y se extrajo una importante cantidad de pus tras la lumbotomía derecha, y se observaron bacilos resistentes al ácido y al alcohol en la tinción de Ziehl-Nielsen de la muestra. Ante la sospecha de tuberculosis, se inició tratamiento oral con rifampicina en dosis de 600mg/d, isoniazida en dosis de 300mg/d y etambutol en dosis de 1.200mg/d. Ante la posibilidad que los abscesos fuesen debido a Mycobacterium bovis por el tratamiento con BCG previo, se evitó administrar pirazinamida. El paciente toleró bien el tratamiento, se mantuvo apirético y los marcadores biológicos se fueron normalizando. Se mantuvieron los drenajes lumbares durante 22 días hasta que se observó una significativa reducción de las colecciones en los estudios de imagen. Tres semanas después del drenaje, Microbiología confirmó el crecimiento de M. bovis tipo BCG en cultivo de Löwenstein. Se le dio de alta con el tratamiento tuberculostático ya mencionado, que se mantuvo 12 meses y con el que mostró mejoría clínica, pero persistió una fístula lumbar derecha abierta que drenaba pus estéril con bacilo de Koch y con cultivo de Löwenstein de éste, reiteradamente negativos.
La instilación de BCG intratumoral es el tratamiento de elección en los carcinomas in situ y transicional superficial de vejiga. Es el primer tratamiento inmunitario celular con actividad antitumoral demostrada y atribuida a la activación de citocinas con actividad antiangiogénica1. Su tasa de complicaciones locales y sistémicas depende no sólo de la dosis (mayor con BCG: más de 80mg/sesión que de 40mg/sesión) sino también de la técnica y de la profundidad de instilación, y de las condiciones del huésped; aunque relativamente frecuentes (del 3 al 55%), estas complicaciones son generalmente de escasa relevancia, como astenia, fiebre, artralgias, artritis o síndrome miccional2. Más graves pero muy poco frecuentes son el síndrome de Reiter, la hepatitis, la neumonitis, la sepsis o el vitíligo. Por último se describe que del 0,001 al 0,0001% de los casos de tuberculosis por M. bovis BCG que afectan a cualquier parte del organismo1,3, la mayoría lo hace en forma miliar3,4 pero también como tuberculosis primaria, linfadenitis mediastínica5, absceso del psoas6, aneurisma micótico de aorta abdominal1, epididimitis, hepatitis granulomatosa, espondilodiscitis, coriorretinitis o virus de la parotiditis.
El Mycobacterium BCG es un subtipo de M. bovis que, con Mycobacterium tuberculosis, Mycobacterium africanum, Mycobacterium microti, Mycobacterium caprae y Mycobacterium canetti, puede infectar al hombre. La secuencia genómica entre M. tuberculosis y M. bovis coincide en un 99,95%7. Este último puede infectar al ganado bovino, a otros animales y a los humanos; su subespecie BCG es menos virulenta y produce sólo el 3% de las muertes por tuberculosis. El M. bovis puede entrar en nuestro organismo por: a) ingestión de leche o productos lácteos no pasteurizados de vacas con mastitis tuberculosa, que da lugar a la afectación extrapulmonar principalmente digestiva, pero también linfadenopática, osteoarticular y genitourinaria; b) inhalación con infección pulmonar, y c) diseminación hematogénica, linfática o por contigüidad en inmunodeprimidos, en niños vacunados por BCG y muy raramente en pacientes tratados con M. bovis BCG por tumores vesicales, como nuestro caso. El diagnóstico de la infección por M. bovis BCG recae en la identificación microbiológica. El M. bovis BCG crece más lentamente que el M. tuberculosis, es también aerobio y sus colonias tienen aspecto disgónico y no cromógeno. Desde el punto de vista bioquímico, lo inhibe la hidracida del ácido tiofeno-2-carboxílico, muestra fuerte actividad ureasa y es resistente a pirazinamida y a cicloserina (esto último lo diferencia de M. bovis común). La reacción en cadena de la polimerasa, que inicialmente nos permitía distinguir entre M. tuberculosis y los otros tipos de micobacterias, actualmente nos permite reconocer loci cromosómicos más precisos para caracterizar a cada especie8. El tratamiento se realiza con 3 o 4 tuberculostáticos administrados 6 a 12 meses y depende del lugar de la afectación y de la gravedad de la enfermedad. Los tuberculostáticos más habituales de inicio son la rifampicina, isoniazida y etambutol, y puede añadirse o no estreptomicina durante 2 meses para continuar posteriormente con los 2 primeros de 4 a 10 meses más. Otros antibióticos con actividad frente a M. bovis BCG son levofloxacino, claritromicina, amikacina, capreomicina, y ácido p-aminosalicílico9. Se están ensayando en roedores y humanos pautas de profilaxis primaria con quinolonas previas a la instilación vesical con M. bovis BCG para disminuir sus efectos secundarios10.
En resumen, ante un paciente que ha recibido tratamiento con BCG para una neoplasia de vejiga, que desarrolla un cuadro febril o constitucional, debemos considerar la posibilidad, infrecuente pero real, de una enfermedad tuberculosa por M. bovis BCG.