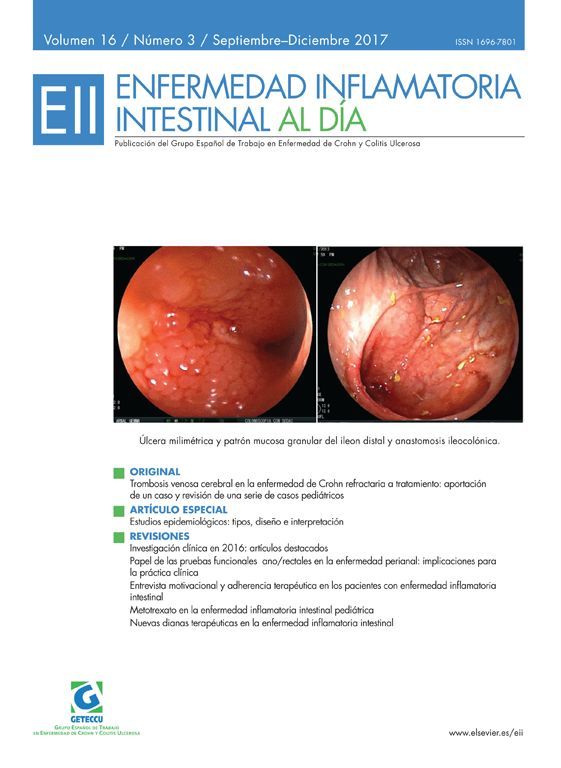
La enfermedad perianal compleja afecta con relativa frecuencia a los pacientes con enfermedad de Crohn y está asociada a una elevada morbilidad y a una disminución significativa en la calidad de vida, tanto en pacientes adultos como pediátricos. Asimismo, constituye una importante carga económica para el sistema sanitario debido a la complejidad y coste de su tratamiento. El objetivo de esta revisión es proporcionar una aproximación actualizada de esta entidad, repasando aspectos de su epidemiología, diagnóstico y alternativas terapéuticas médicas y quirúrgicas disponibles. Asimismo, se revisarán nuevas opciones de tratamiento emergentes. Es imprescindible un abordaje médico-quirúrgico adecuado y una valoración multidisciplinar de estos pacientes.
Complex perianal disease frequently affects patients with Crohn's disease, and it is associated with high morbidity and a significant impairment in patients’ quality of life, both in adult and pediatric patients. It also constitutes a significant economic burden to the healthcare system due to its complexity and cost of treatment. The aim of this review is to provide an updated approach of this entity, reviewing aspects of its epidemiology, diagnosis and medical and surgical therapeutic alternatives. In addition, new emerging treatment options are discussed. A medical and surgical coordinated approach and a multidisciplinary assessment of these patients is mandatory.
El conocimiento y manejo de la enfermedad de Crohn (EC) han avanzado notablemente: los agentes biológicos, la inmunosupresión, la prevención de efectos secundarios y la mejora en la cirugía han aportado importantes avances. Sin embargo, en ciertos casos la EC se manifiesta con toda su crudeza y complejidad. Uno de los mejores ejemplos es la enfermedad perianal (EPA) compleja.
Definición e importancia del problema de la enfermedad perianal complejaLa prevalencia de la EPA varía entre 21 y 54%: es más frecuente en pacientes con enfermedad cólica aislada que en pacientes con ileítis (41 y 12% respectivamente en la serie de Hellers et al.1). Es considerada indicador de mal pronóstico y se asocia a un mayor consumo de recursos2,3. Carecemos de una definición clara de EPA compleja. Las guías2 aportan indicaciones para su tratamiento, sin definirla claramente. Usaremos la definición de Sandborn4 de fístula compleja como aquella que es alta (interesfinteriana, transesfinteriana, extraesfinteriana o supraesfinteriana en su origen) o con presencia de múltiples orificios externos, con abscesificación, trayecto rectovaginal, estenosis anorrectal o una EC activa en el recto. Estas fístulas complejas son más rebeldes y recurrentes. En un estudio de era prebiológica, 87 pacientes con EC fistulizante se siguieron durante 6 años; el 65% tenían EPA y el 80% de las fístulas eran complejas. El 14% de los pacientes no mostró mejoría y la mitad de los que presentaban fístulas complejas requirieron estoma, resección o proctectomía. Las fístulas complejas tardaron una mediana de 2,6 años en curar5. En otro estudio las fístulas simples presentaron mejores tasas de curación que las complejas (88,2 vs. 64,6%), que precisaron más derivaciones fecales o amputación rectal (63,8 vs. 26,7% y 25,5 vs. 6,7% respectivamente)6. Esto se reproduce en la EC pediátrica, en que el 30% presentará EPA. En un análisis retrospectivo el 19,7% de los pacientes pediátricos con EPA presentaron fístulas complejas y tuvieron el doble de probabilidad de recibir cirugía de cualquier tipo, con ingresos más largos y mayores costes7.
En general, los costes asociados a la EPA compleja son mayores3, correspondiendo el 75% al tratamiento médico (biológicos). Deben considerarse los costes indirectos, que en muchas ocasiones no son analizados. La calidad de vida también se afecta profundamente en pacientes con EPA8.
Clasificación y diagnósticoLa anamnesis sobre la EPA deberá incidir en los síntomas de dolor anal al defecar, drenaje purulento, prurito, fiebre y sangrado. Algunos pacientes presentarán antecedentes de abscesos drenados. Su diagnóstico diferencial incluye hidradenitis supurativa, tuberculosis, infección por VIH, linfogranuloma venéreo, actinomicosis perianal, traumatismos, carcinoma anal y quistes dermoides posrectales.
La clasificiaión de la EPA es imprescidible para su buen manejo. La clasificación de Parks de las fístulas se basa en las relaciones anatómicas del trayecto fistuloso con los esfínteres anales, describiendo 5 tipos: superficial, interesfinteriana, transesfinteriana, supraesfinteriana y extraesfinteriana9. La propuesta por Sandborn et al., es más sencilla de utilizar, y divide las fístulas en simples y complejas4, como se decribió anteriormente.
Existen diferentes métodos para medir la actividad de la EPA, siendo el Perianal Disease Activity Index el que mejor valora función y calidad de vida. Evalúa 5 elementos: drenaje, dolor y restricción de actividades, limitación de actividad sexual, tipo de enfermedad perianal y grado de induración (tabla 1). Este índice ha sido validado10. Otra forma de evaluar la actividad es la llamada «evaluación del drenaje fistuloso». Se clasifican las fístulas como «abiertas» si drena material purulento espontáneamente o por compresión. Si en dos visitas consecutivas se observa una reducción igual o mayor al 50% en el número de drenajes, se considera que existe respuesta al tratamiento, y se denomina remisión cuando no existe drenaje fistuloso en ese periodo. En ocasiones, a pesar del cierre del drenaje externo, los cambios pueden persistir en el trayecto. Por ello se recomienda resonancia magnética (RM) o ecografía endoanal (EE) para monitorizar el tratamiento11.
Índice de actividad de enfermedad perianal (PDAI)
| Puntos | |
|---|---|
| Descarga | |
| Ausente | 0 |
| Mínimo mucoso | 1 |
| Moderado moco o pus | 2 |
| Importante | 3 |
| Incontinencia fecal | 4 |
| Dolor/restricción de actividades | |
| No restricción de actividades | 0 |
| Escaso malestar, no restricción | 1 |
| Moderado malestar, algunas limitaciones | 2 |
| Marcado malestar y restricción | 3 |
| Importante dolor y limitación | 4 |
| Restricción actividad sexual | |
| No restricción de actividad sexual | 0 |
| Restricción leve | 1 |
| Limitación moderada | 2 |
| Limitación marcada | 3 |
| Limitación total | 4 |
| Tipo en enfermedad perianal | |
| Ausente/colgajos cutáneos | 0 |
| Fisura anal o desgarro mucoso | 1 |
| < 3 fístulas perianales | 2 |
| ≥ 3 fístulas perianales | 3 |
| Ulceración esfínter anal | 4 |
| Grado de induración | |
| No induración | 0 |
| Induración mínima | 1 |
| Induración moderada | 2 |
| Induración marcada | 3 |
| Fluctuación/absceso | 4 |
Las pruebas de imagen son imprescindibles para definir la anatomía, descartar abscesos, y planificar y monitorizar el tratamiento. La RM pélvica es de elección en fístulas complejas, por su precisión y por la diferenciación entre tejidos fibróticos y de granulación activa, además de ser no invasiva y libre de radiación. Su especificidad varía entre 76 y 100%12. La EE es buena alternativa por ser sencilla y permitir gran resolución en la visualización de los esfínteres y el espacio interesfinteriano. Sin embargo, la EE es muy dependiente del operador, no se puede hacer si existen estenosis rectales y tiene escasa precisión en regiones superiores al esfínter externo y la fosa isquiorrectal. Un metanálisis comparó la RM con la EE en la valoración de la fístula perianal13 y encontró sensibilidades similares para la RM (0,87; IC 95%: 0,63-0,96) y la EE (0,87; IC 95%: 0,70-0,95) pero mayor especificidad para la RM (0,69; IC 95%: 0,51-0,82 frente a 0,43, IC 95%: 0,21-0,69).
La exploración bajo anestesia (EBA) es considerada como la técnica de elección cuando se realiza por cirujanos experimentados y es uno de los pilares del diagnóstico de la EPA, con sensibilidad superior al 90%14. Además, permite realizar terapéutica como el drenaje de abscesos, colocación de sedales o fistulotomías. Si se sospecha absceso, la EBA no debe retrasarse esperando a la RM pélvica. Varios estudios han comparado la RM, la EE y la EBA para el diagnóstico de la EPA compleja. En un estudio prospectivo se observó una sensibilidad del 87, 91 y 91% respectivamente, y combinando la EBA con la RM o la EE se alcanzó una precisión diagnóstica del 100%14. Otro estudio encontró que la RM era más sensible (0,97; IC 95%: 0,92-1,01) que la exploración física (0,75; IC 95%: 0,65-0,86) pero comparable a la EE (0,92; IC 95%: 0,85-0,99) para la diferenciación de EPA simple y compleja15. Sin embargo, en la revisión que se hace en este trabajo no se distinguió si la exploración clínica fue realizada en la consulta o bajo anestesia en quirófano.
La proctosigmoidoscopia debe realizarse a todos los pacientes con EPA compleja para valorar gravedad de la inflamación y descartar complicaciones como estenosis o neoplasias16. La presencia de proctitis se ha asociado con menores tasas de curación de las fístulas y mayor necesidad de proctectomía5.
La fistulografía y la TC no se utilizan habitualmente ya que son pruebas que radian y presentan bajo rendimiento16. La fistulografía puede ser dolorosa y diseminar la infección.
TratamientoEs importante recalcar una serie de aspectos clave. La afectación perianal en la EC es frecuente, y puede existir una desproporción entre los síntomas, la agresividad y la extensión. Es crucial la exploración de la región perianal en todos los pacientes con sospecha o EC confirmada, e imprescindible determinar la extensión y la actividad de la enfermedad luminal y en especial la presencia o no de actividad rectal. Es preciso descartar abscesos y drenarlos quirúrgicamente para disminuir el riesgo de complicaciones sépticas. Los corticoides no desempeñan ningún papel en el manejo de la EPA. Finalmente, el abordaje será multidisciplinar, con implicación de gastroenterólogos, cirujanos y radiólogos.
Tratamiento quirúrgicoLa implicación del cirujano es imprescindible en el estudio de la EPA y el drenaje de abscesos perianales. En fases iniciales los gestos quirúrgicos evitarán la destrucción de tejido muscular perianal para conservar la función anal. Si hay absceso, será suficiente la inserción de drenajes simples, dejando la colocación de sedales para un segundo tiempo, pues prevendrán la recurrencia del absceso, una vez controlada la infección y estudiada la anatomía de la fístula. Los sedales pueden mantenerse el tiempo que se considere necesario, debiendo decidirse su retirada preferentemente de forma consensuada entre gastroenterólogo y cirujano. La ausencia de respuesta al tratamiento o la aparición de nuevos síntomas pueden hacer necesario repetir la EBA, especialmente antes de escalar el tratamiento o de considerar terapias experimentales.
Cuando la complejidad de la EPA es elevada y existe una importante destrucción tisular o sepsis pélvica, puede optarse por una ileostomía terminal temporal que permita la curación de las fístulas y abscesos, con reconstrucción posterior del tránsito cuando sea posible.
La cirugía puede ser el único recurso en el abordaje de pacientes refractarios a tratamiento médico. Existen técnicas como la ligadura del trayecto fistuloso interesfinteriano o el colgajo de avance, cuyas descripciones detalladas se encontrarán en otras revisiones17. Es importante reiterar que deben ser siempre realizadas por un equipo experimentado.
La derivación fecal definitiva con estoma puede ser la única alternativa en pacientes con EPA agresiva18. La decisión de proctectomía en estos enfermos debe ser individualizada. Los posibles efectos secundarios, como la disfunción eréctil en varones o aparición de un sinus perineal persistente, deben tenerse en cuenta. La persistencia de inflamación rectal (manifestada en ocasiones como pioderma periestomal), la posibilidad de malignización y el mantenimiento de algunas fístulas en presencia de muñón rectal apoyarían la realización de una proctectomía.
Tratamiento médicoPocos estudios abordan específicamente el tratamiento médico de la EPA compleja y los criterios de respuesta y remisión son, con frecuencia, heterogéneos.
AntibióticosEl uso de antibióticos como mero tratamiento de la sepsis perianal es de pura lógica y debe ser precoz para evitar la destrucción tisular. En nuestra opinión, se empleará preferentemente amoxicilina-clavulánico o la combinación de metronidazol y ciprofloxacino.
Como tratamiento primario, los antibióticos se usan ampliamente, pero con discrepancias en sus indicaciones y empleo. Han demostrado mejorar los síntomas, pero no se suele lograr una curación completa en monoterapia. La evidencia se basa en cortas series de casos, ensayos no controlados y un único estudio aleatorizado sobre 25 pacientes, comparando la eficacia de ciprofloxacino, metronidazol y placebo durante 10 semanas en el tratamiento de la fístula por EC19, observando que la remisión y respuesta fue bastante mejor para el ciprofloxacino aunque no se alcanzó la significación estadística. Los agentes más usados son el metronidazol (20mg/kg/día o 750-1.000mg/d) y ciprofloxacino (1.000-1.500mg/d). No existen recomendaciones uniformes sobre su duración, que suele prolongarse hasta 8-12 semanas. Un estudio aleatorizado abordó el tratamiento con ungüento de metronidazol al 10% frente a placebo aplicado durante 4 semanas, con disminución del drenaje como único efecto20.
InmunomoduladoresTiopurinasNo disponemos de ensayos específicos sobre las tiopurinas en la EPA compleja. Un metanálisis dirigido a evaluar su eficacia en la inducción de la remisión en la EC, describió una mejoría significativa de las fístulas perianales (OR 4,44, IC 95% 1,5-13,20)21. Generalmente, su beneficio no es evidente hasta pasadas semanas o incluso meses, y por ello se combinan con antibióticos o anti-TNF. Dejaco et al.22 evaluaron en un estudio prospectivo abierto con 56 pacientes el uso combinado de antibioterapia (ciprofloxacino o metronidazol durante 8 semanas) y azatioprina objetivando una tasa de respuesta mayor en aquellos pacientes que se mantuvieron con azatioprina después de la suspensión del antibiótico (48 vs. 15%, p=0,03). Estudios de tiopurinas en combinación con IFX indican que podrían mejorar el grado y la duración de la respuesta inducida por este23. Las guías de enfermedad perianal recomiendan la antibioterapia con drenaje quirúrgico inicial y tiopurinas como tratamiento de mantenimiento2, pero esto probablemente debe dejar paso al uso precoz de agentes anti-TNF, combinados o no con ellas.
Inhibidores de calcineurinaTacrolimus. El tacrolimus (0,2mg/kg/d) demostró beneficio en el tratamiento de las fístulas perianales en un estudio controlado (43 vs. 8%, p<0,05) pero sin lograr el cierre24. En otro estudio, la combinación de tacrolimus y tiopurinas logró respuesta completa en 7 de 11 pacientes con EPA refractaria25. En un estudio más reciente sobre tacrolimus en EC grave refractaria o intolerante a agentes anti-TNF, un tercio de los pacientes con fístulas perianales presentaron mejoría del débito de la fístula26, asociándose los niveles de tacrolimus 10-15ng/ml con mayor respuesta. El tacrolimus podría considerarse alternativa de rescate en pacientes no respondedores a anti-TNF antes de cirugías mutilantes. Su uso tópico no ha demostrado buenos resultados27.
Ciclosporina. Dada la escasa evidencia disponible, la ciclosporina no puede considerarse como una alternativa terapéutica validada.
OtrosEl metotrexato no ha sido evaluado en el contexto específico de la EPA compleja y no puede ser recomendado. Se ha descrito cierto beneficio del micofenolato mofetilo y de la talidomida, sin que a día de hoy puedan considerarse alternativas terapéuticas.
Agentes biológicosAnti-TNFLos fármacos anti-TNF disponen de la mejor evidencia científica para el tratamiento de la EPA compleja. Existe cierta preocupación acerca del riesgo de complicaciones sépticas locales durante el tratamiento (abscesos perianales en el 11%)28. Es importante descartar absceso y, de existir, drenarlo antes de iniciar el tratamiento anti-TNF.
Aún existen aspectos de su uso que requieren de una evaluación adicional, como la necesidad de asociar antibióticos, tiopurinas o sedales para un mayor beneficio terapéutico. La asociación de ciprofloxacino a IFX consigue mejores resultados combinado que IFX en monoterapia29. Lo mismo ocurre con la combinación de adalimumab (ADA) y ciprofloxacino frente a la monoterapia con ADA (65 vs. 33%, p=0,009)30.
Las guías recomiendan los anti-TNF como terapia de segunda línea en la inducción y mantenimiento en pacientes refractarios a antibioterapia y tiopurinas2, pero la realidad es que la mayoría de los expertos apuesta hoy por una estrategia «top-down», considerando los anti-TNF como tratamiento inicial de elección en pacientes con EPA compleja16, siendo la antibioterapia y las tiopurinas tratamientos coadyuvantes.
Infliximab. IFX es el único tratamiento médico que ha demostrado eficacia en inducir el cierre de las fístulas perianales complejas en un ensayo clínico específicamente, aleatorizado y controlado con placebo en el que IFX (5 o 10mg/kg/día en las semanas 0, 2 y 6) alcanzó respuesta en el 62% de los pacientes comparado con 26% en el grupo placebo. También, el IFX fue superior al placebo en lograr el cierre completo de las fístulas (55 vs. 13%)28. Posteriormente, se demostró la eficacia de IFX como tratamiento de mantenimiento (5mg/kg cada 8 semanas durante un año) en pacientes con respuesta previa a la inducción con IFX: cese completo del débito de las fístulas en el 36% de los pacientes en la semana 54, frente al 19% en el grupo placebo (p=0,009)31. Estos resultados han sido avalados por estudios no controlados posteriores32. Asimismo, el tratamiento de mantenimiento con IFX reduce significativamente las hospitalizaciones y las cirugías33.
Parece existir disociación entre la remisión clínica y la persistencia de actividad en pruebas de imagen. Estudios con RM o ecoendoscopia revelan que la curación de las fístulas ocurre en una minoría de pacientes (18 vs. 54% con cierre clínico), pues en la mayoría persiste el trayecto fistuloso34. Esto explica la elevada tasa de recurrencia al interrumpir el tratamiento tras un año en pacientes con fístulas complejas en remisión clínica, sugiriendo la necesidad de tratamientos más prolongados y el uso de pruebas de imagen antes de suspender IFX.
Adalimumab. El papel de ADA en el tratamiento de las fístulas perianales ha sido evaluado como objetivo secundario en tres ensayos clínicos. En el más reciente, la remisión clínica de las fístulas en la semana 56 fue significativamente mayor en el grupo tratado con ADA (33 vs. 13% p<0,02)35. Un estudio retrospectivo posterior diseñado para evaluar la efectividad de ADA en el tratamiento de las fístulas perianales en 46 pacientes que no habían recibido previamente IFX objetivó remisión completa en el 72% de los pacientes a los 6 meses y en el 41% a los 12 meses36. Otro estudio retrospectivo multicéntrico objetivó una tasa de remisión del 50% en pacientes con enfermedad perianal previamente tratados con IFX37.
Certolizumab pegol. No hay ensayos clínicos específicos sobre certolizumab pegol en la EPA, pero su eficacia en mantenimiento fue evaluada como objetivo secundario en un estudio que demostró su superioridad frente a placebo (36% de los pacientes en mantenimiento con certolizumab lograron el cierre completo de las fístulas frente al 17% del grupo placebo, p=0,038)38.
Otros tratamientos biológicosLa evidencia actual disponible acerca de vedolizumab en la enfermedad perianal es escasa. Un estudio aleatorizado controlado con placebo diseñado para evaluar la eficacia de vedolizumab en la EC objetivó una tasa de cierre de fístulas activas significativamente más elevada en el grupo de tratamiento (41,2 vs. 11%)39.
Otros tratamientosUn número importante de pacientes no logran una mejoría significativa de su enfermedad a pesar del uso de fármacos biológicos y de técnicas quirúrgicas convencionales. En los últimos años han surgido nuevos tratamientos con oportunidad de mejora para los casos refractarios, que representan una esperanza en un escenario clásicamente frustrante para paciente y médico; no obstante, la evidencia que les da soporte es escasa y procede de estudios con alto riesgo de sesgo.
Células madre mesenquimales (CMM)Son células de origen no hematopoyético, multipotencial, fibroblastoides y con propiedades inmunomoduladoras40. Se han podido aislar a partir de médula ósea, cordón umbilical y tejido adiposo. En la EPA compleja se han probado CMM procedentes de médula ósea y tejido adiposo de origen tanto autólogo como alogénico y ya se dispone de ensayos clínicos fase II que apoyan su seguridad y eficacia para una determinada subpoblación41. La vía más utilizada ha sido la inyección intralesional de CMM, con un único trabajo que empleó la vía intravenosa42. Los sujetos incluidos eran muy heterogéneos en sus características basales y también lo fueron en la posología y duración del tratamiento. La gran mayoría eran refractarios a tiopurinas y anti-TNF y tenían fístulas complejas. Las tasas de cierre de la fístula oscilan desde 37 al 85%40,41. Una limitación importante para la expansión de la técnica, más allá de consideraciones económicas y logísticas para su implementación, ha sido la falta de seguimiento a largo plazo. En 2015 Ciccocioppo et al. publicaron los resultados de su serie de 10 pacientes recogidos de forma prospectiva durante un período 7 años. La probabilidad de supervivencia libre de recaída de la fístula fue del 88% a un año, 50% a los 2 años, y el 37% a los 5 años sin ningún efecto adverso43. Probablemente dos ensayos clínicos multicéntricos fase III en marcha ayudarán a contestar preguntas clave como el tipo de CMM de elección, la dosis de células requeridas, número de inyecciones y efectividad a largo plazo.
Oxígeno hiperbáricoEl tratamiento con oxígeno hiperbárico consiste en introducir al paciente en un habitáculo presurizado con oxígeno al 100%, aumentando así la PO2 arterial y la oxigenación tisular. La base que fundamenta su uso propone que el aumento de O2 en zonas hipóxicas de intestino y región perianal favorecería la curación y cicatrización. Se ha descrito que este tratamiento ejerce funciones antiinflamatorias reduciendo los niveles de IL1, IL2 y TNF-alfa y estimulando la expresión de proteínas clave en la tolerancia a la hipoxia44.
En el año 2014, Dulai et al. llevaron a cabo una revisión sistemática de la literatura sobre la utilidad de esta terapia en la EII44. Incluyeron 40 pacientes con EPA, la mayoría de ellos refractarios al tratamiento convencional con fármacos. La tasa global de éxito fue del 88% (18/40 con curación completa, 17/40 con curación parcial); es preciso resaltar la falta de una definición uniforme de repuesta, la heterogeneidad en la evaluación de los síntomas, la variabilidad en el número de sesiones y el hecho de que dos pacientes abandonaran el tratamiento por aparición de efectos adversos. Desde entonces no se han dado a conocer estudios de relevancia. Los efectos secundarios son poco frecuentes (incidencia de 1/1.000 sesiones), pero se ha descrito neumotórax, miopía, convulsiones, claustrofobia, perforación timpánica e incluso perforación intestinal44.
Tapón biológicoEsta modalidad terapéutica intenta disminuir los efectos secundarios de los abordajes quirúrgicos clásicos, especialmente la incontinencia. Existen dos modelos comercializados. En el año 2006 Johnson et al. fueron los primeros en publicar los resultados del tapón biológico Surgisis® en pacientes sin EII, un xenoinjerto de submucosa de intestino delgado porcino de morfología cónica45. El tapón GORE BioA® goza de menor difusión y está compuesto de materiales sintéticos; en uno de sus extremos tiene acoplado un disco que facilita la fijación en el orificio interno de la fístula. En el primer ensayo clínico multicéntrico se incluyeron 106 pacientes con enfermedad leve o inactiva, aleatorizados a ser tratados con Surgisis® versus retirada del sedal sin medidas adicionales sin encontrar diferencias estadísticamente significativas de eficacia o efectos adversos entre ambos grupos46.
LáserEl tratamiento con láser de CO2 para lograr el cierre del trayecto fistuloso surgió hace más de dos décadas, buscando conservar el mecanismo esfinteriano y convertirse en una alternativa para casos complejos. Giamondo et al. en 2015 realizaron un análisis unicéntrico y retrospectivo de 45 pacientes tratados con esta técnica, dos de ellos padecían EC y evolucionaron favorablemente47.
Inyección de pegamentos de fibrinaSe trata de la inyección de material biológico rico en precursores de la fibrina que ocluya la fístula y estimule la coagulación intralesional, activando la fibrinólisis y los mecanismos de cicatrización y reparación tisular. El trabajo más destacado es un ensayo clínico multicéntrico en el que se incluyeron 77 pacientes con un CDAI<250 y fístulas entre el ano y la vulva, vagina o periné. Tras 2 meses de seguimiento la tasa de remisión fue del 38 versus 16% en el grupo placebo48. Es un tratamiento bien tolerado, que no altera la continencia y es fácilmente reproducible. Los datos disponibles sugieren una eficacia modesta. Solo debería utilizarse en fístulas no contaminadas, bien drenadas y sin inflamación local.
Malignización de fístulas perianalesLa degeneración neoplásica del epitelio fistuloso tiene un origen multifactorial: inflamación crónica, inmunosupresión mantenida y procarcinogénicos como el tabaco o el virus del papiloma49. El subtipo más frecuente es el adenocarcinoma mucinoso originado en las criptas glandulares. Se han descrito casos de carcinoma escamoso49. Es una entidad rara (prevalencia 0,004-0,7%) y que suele aparecer en pacientes con EPA de más de 15 años de evolución49. Sus síntomas son inespecíficos y poco floridos (dolor con la defecación, supuración serohemorrágica a través del orificio fistuloso o el ano, sensación de masa, prurito, síndrome constitucional). La mayoría de los tumores se diagnostican en estadios avanzados. Su pronóstico suele ser malo con alta tasa de recurrencia posquirúrgica, especialmente si los ganglios linfáticos perirrectales están afectados. Ante la aparición de estos síntomas en un escenario de enfermedad de larga evolución se debe considerar la realización de una RMN e incluso una EBA. De hecho, a pesar de la ausencia de evidencia, algunos autores defienden la vigilancia sistemática anual en sujetos con enfermedad de más de 10 años de duración50. No disponemos de ensayos clínicos que permitan configurar un esquema terapéutico. La resección con linfadenectomía, que suele tener una morbilidad considerable, es de elección. Algunos defienden el empleo de quimiorradioterapia preoperatoria o adyuvante, aunque su efectividad está en entredicho.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.