Comparar la eficacia, la eficiencia y la seguridad de 2 formulaciones de hierro (Fe) parenteral concomitantemente en pacientes con enfermedad inflamatoria intestinal: Fe-carboximaltosa vs. Fe-sacarosa.
MétodosAnálisis retrospectivo de 72 pacientes sometidos a tratamiento con Fe intravenoso. Indicaciones de tratamiento: hemoglobinemia<10g/dL y/o ferritinemia<100μg/L. La necesidad de transfusión de concentrados de hematíes fue registrada, suponiendo el cierre inmediato del seguimiento del paciente. Protocolo de administración: Fe-carboximaltosa (40 pacientes): dosis máxima 1.000mg en perfusión durante 15min; Fe-sacarosa (32 pacientes): dosis máxima 200mg en perfusión de 1h.
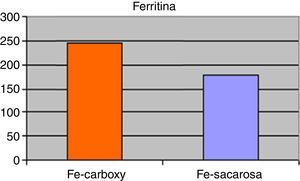
ResultadosNo existieron diferencias significativas en niveles medios de hemoglobinemia (Fe-carboximaltosa 10,78 ± 2,06mg/dL vs. Fe-sacarosa 10,14±2,33mg/dL), hematocrito (Fe-carboximaltosa 32,15±3,24% vs. Fe-sacarosa 30,47±4,53%), VCM (Fe-carboximaltosa 72,40±7,72 fL vs. Fe-sacarosa 69,54±8,46 fL) y HCM (Fe-carboximaltosa 25,43±6,22 pg/dL vs. Fe-sacarosa 23,75±5,93 pg/dL). Los niveles de ferritinemia medios fueron superiores en el grupo de Fe-carboximaltosa (246,74±17,83μg/L vs. 179,52±21,36μg/L; p=0,023). Los eventos adversos registrados en la administración de Fe-carboximaltosa fueron inferiores (2 reacciones urticariformes) frente al Fe-sacarosa (23 casos de dolor abdominal y cefalea); p<0,001. Requirieron transfusión de concentrado de hematíes 2 en grupo Fe-carboximaltosa y 5 en grupo Fe-sacarosa; p=0,062. Ratio de dosis administradas Fe-sacarosa/Fe-carboximaltosa=3,39 dosis/paciente; p<0,05. Con ello, la aplicación del tratamiento con Fe-carboximaltosa supuso un ahorro de 948,46 €/paciente.
ConclusionesEl tratamiento con Fe-carboximaltosa presenta un perfil de eficacia no inferior al Fe-sacarosa, ofreciendo una superior repleción de los depósitos sistémicos con un perfil de seguridad superior. Asimismo, en relación con su posología, se presenta como un tratamiento más eficiente, permitiendo la reducción del número de dosis/paciente, requerimientos transfusionales y coste global del tratamiento.
To compare effectiveness, efficiency and safety of two parenteral iron formulations in patients with inflammatory bowel disease: ferric-carboximaltose vs ferric-sacarose.
MethodsRetrospective analysis of 72 patients undergoing intravenous iron treatment. Indications of treatment: hemoglobin<10g/dL and or ferritininemia<100μg/L. The need of transfusion of red blood cells pools was registered, meaning the immediate closure of the follow-up of the patient. Iron protocol administration: ferric-carboximaltose (40 patients): maximum dose 1000mg in 15minutes perfusion; ferric-sacarose (32 patients): maximum dose 200mg in 1 hour perfusion.
ResultsThere were no significant differences in average levels of haemoglobin (Ferric-carboxymaltose 10.78±2.06mg/dL vs. Ferric-sucrose 10.14±2.33mg/dL), haematocrit (ferric-carboxymaltose 32.15±3.24% vs. ferric-sucrose 30.47±4.53%), MCV (ferric-carboxymaltose 72.40±7.72 fL vs. ferric-sucrose 69.54±8.46 fL) and MCH (ferric-carboxymaltose 25.43±6.22 pg/dL vs. ferric-sucrose 23.75±5.93 pg/dL). Average ferritin levels were higher in ferric-carboxymaltose group (246.74±17.83μg/L vs. 179.52±21.36μg/L; P=.023).
Adverse events registered in the administration of ferric-carboxymaltose were lower (2 urticarial reactions) vs. al ferric-sucrose (13 stomachache and headache cases); p<0.001. 2 patients with ferric-carboxymaltose required blood transfusion vs. 6 patients with Ferric-sucrose group; p=0.062. The number of administered dosages was significantly higher in ferric-sucrose group in a ratio ferric-sucrose/ferric-carboxymaltose of 3.39 dosages/patient. Ferric-carboxymaltose application reduced treatment cost in €948.46/patient.
ConclusionsTreatment with intravenous ferric-carboxymaltose shows an effectiveness profile not inferior to ferric-sucrose. Higher repletion of systemic stock and a better security profile. Related to posology, treatment shows to improve efficiency, reducing dosages, blood transfusion and cost per patient.
La anemia constituye una de las manifestaciones extraintestinales más prevalentes de la enfermedad inflamatoria intestinal (EII) que conlleva un empeoramiento de la calidad de vida de estos pacientes. Siendo de difícil control y presentando en ocasiones limitada respuesta al tratamiento convencional, su patogenia es comúnmente multifactorial, pudiendo explicarse por factores como la malnutrición, la malabsorción, el bloqueo de la eritropoyesis por la situación inflamatoria crónica, las pérdidas microhemorragias mantenidas e incluso hemólisis1. Aunque los anteriores trastornos son también responsables de la carencia de vitaminas B12 y ácido fólico implicadas en la hematopoyesis, el déficit de hierro (Fe) es muy frecuente en estos pacientes, siendo la ferropenia el perfil más habitual en las características de la anemia de los pacientes con EII1,2.
La falta de evidencia establecida y estrategias protocolizadas en el tratamiento de la anemia ferropénica se suma a las manifestaciones de la propia enfermedad, llevando, en consecuencia, a un aumento de la morbilidad, un incremento de los requerimientos transfusionales, un mayor número de ingresos para tratamiento y un aumento de la estancia media hospitalaria global a lo largo del curso clínico de la enfermedad3.
La estrategia de tratamiento, además de la terapia transfusional ante situaciones de anemia severa y/o falta de respuesta, puede no ser única y debe ajustarse a los mecanismos causales predominantes en el curso clínico de cada paciente. Así, partiendo de un adecuado control de la actividad inflamatoria en fase de remisión, debe valorarse la suplementación de ácido fólico/folínico, vitamina B12 (oral o parenteral) y agentes eritropoyéticos como la eritropoyetina (EPO)4. Para la corrección de la ferropenia existen diferentes formulaciones farmacológicas para suplementar el déficit de Fe, cuya variación de efecto y vía de administración residen en el dextrano asociado. Habiendo demostrado la superioridad de la suplementación parenteral sobre la vía oral tanto en efecto como en tolerancia, existe aún hoy controversia acerca de la superioridad de los resultados ofrecidos por diferentes formulaciones farmacológicas5.
En el presente artículo describimos nuestra experiencia mediante un estudio comparativo de 2 formulaciones de Fe parenteral más utilizadas en la actualidad: Fe sacarosa (alternativa «clásica») vs. Fe carboximaltosa (de más reciente incorporación) de pacientes con EII en remisión sostenida de la actividad inflamatoria.
ObjetivosComparar la eficacia, la eficiencia y la seguridad de 2 formulaciones de Fe parenteral: Fe-carboximaltosa vs. Fe-sacarosa, concomitantemente al tratamiento en pacientes enfermos de enfermedad de Crohn y colitis ulcerosa en remisión sostenida de la actividad inflamatoria en nuestra unidad.
Material y métodoEstudio retrospectivo descriptivo tipo casos y controles con pacientes consecutivos entre junio del 2011 y febrero del 2012, sometidos a tratamiento con Fe por vía intravenosa en la Unidad de Hospital de Día, con un seguimiento de 6 meses. Durante este periodo, ambas formulaciones estuvieron disponibles para su administración indistintamente, quedando a criterio del facultativo responsable su prescripción. Cuarenta pacientes recibieron Fe-carboximaltosa (casos) frente a 32 que recibieron Fe-sacarosa (controles).
Debido al diseño retrospectivo del estudio, no alterando el curso clínico ni modificando la actitud terapéutica de los pacientes incluidos, no se solicitó consentimiento informado para su participación. La realización del estudio fue aprobada por reunión multidisciplinar del servicio de Gastroenterología del centro con la aprobación del Comité de Ética.
Las indicaciones de inicio de terapia con Fe parenteral fueron: hemoglobinemia<10g/dL y/o ferritinemia<100μg/L, así como situaciones de malabsorción y pacientes con ferropenia e intolerancia o falta de respuesta al Fe por vía oral.
Fueron excluidos de nuestro estudio todos los pacientes que siguieron tratamiento asociado con Fe por vía oral, así como aquellos con intolerancia a Fe por vía intravenosa. Asimismo, fueron excluidos aquellos pacientes sin remisión de su EII mantenida, definida como escala de Mayo parcial ≤ 2 puntos o índice de Harvey-Bradshaw<6 puntos, respectivamente, para colitis ulcerosa y enfermedad de Crohn, durante el periodo de seguimiento. No fueron excluidos los pacientes con tratamiento concomitante de EPO. La transfusión de concentrados de hematíes fue registrada como evento adverso y supuso el cierre del seguimiento del paciente.
Los protocolos de administración de las formulaciones de Fe parenteral de acuerdo con sus respectivas fichas técnicas fueron:
- –
Fe-carboximaltosa: 1.000mg en perfusión de 15 min, una vez por semana.
- –
Fe-sacarosa: 200mg en perfusión de 2h, 2 veces por semana.
La duración del tratamiento/n.° de dosis administradas fue variable según los requerimientos/respuesta individual de cada paciente. Otras variables analizadas fueron niveles medios de hemoglobinemia, hematocrito, volumen corpuscular medio (VCM), hemoglobina corpuscular media (HCM) y ferritinemia registrados a lo largo del seguimiento; número de dosis del fármaco, coste global del tratamiento y tolerancia/eventos adversos.
Las variables cuantitativas fueron expresadas como media±desviación estándar y las cualitativas como porcentaje. El contraste de hipótesis fue realizado con el test t de Student para las variables cuantitativas y test exacto de Fisher para las cualitativas, con nivel de significación (p) menor al 5%.
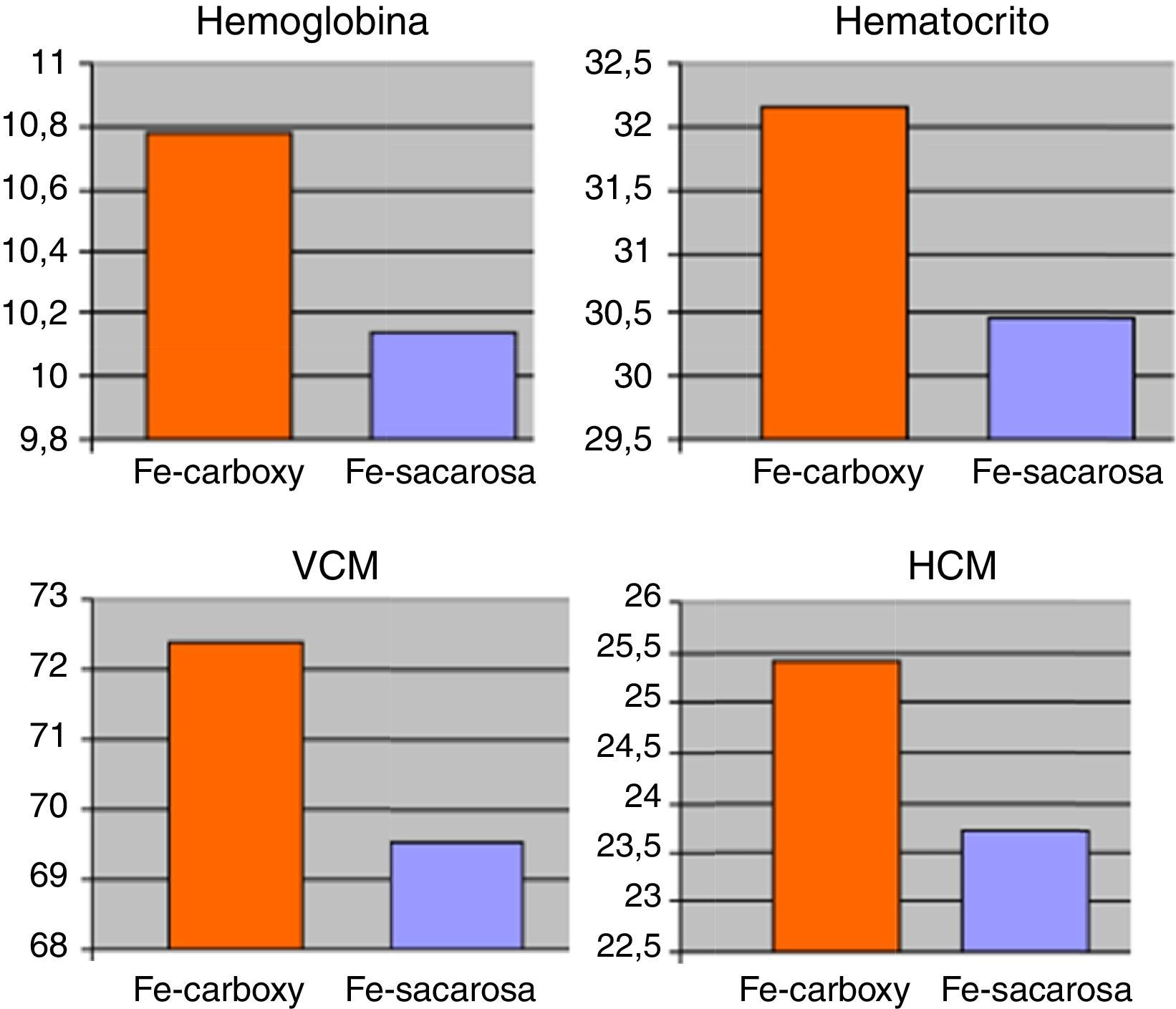
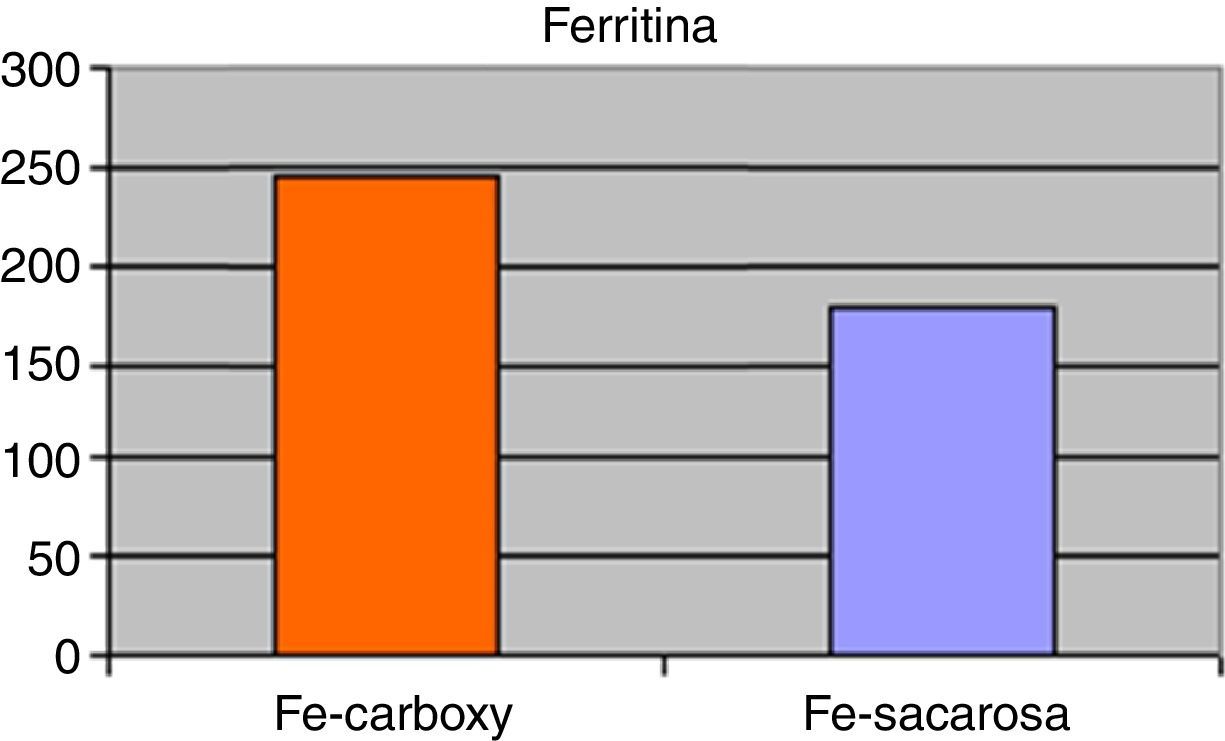
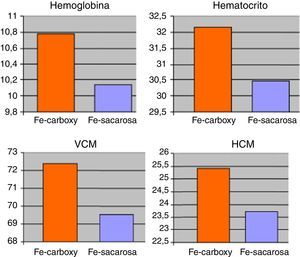
ResultadosSetenta y dos pacientes incluidos en el estudio sobre la base de los criterios anteriormente mencionados. Las características demográficas y clínicas de los mismos quedan resumidas en la tabla 1. El 88,89% de los pacientes completaron el seguimiento (8 pacientes presentaron interrupción del seguimiento debido a 2 casos de brote de reagudización de la enfermedad y 6 pacientes que precisaron transfusión de concentrados de hematíes). A nivel analítico, no existieron diferencias significativas en los niveles medios de hemoglobina, hematocrito, VCM o HCM en comparación con los presentados al inicio del tratamiento. No obstante, existieron clínicamente diferencias ligeras en relación a una leve mejoría de los anteriores parámetros referidos para ambos grupos de tratamiento entre el inicio y el final del seguimiento. Los niveles al final del periodo de tratamiento de hemoglobinemia (Fe-carboximaltosa 10,78±2,06mg/dL vs. Fe-sacarosa 10,14±2,33mg/dL), hematocrito (Fe-carboximaltosa 32,15±3,24% vs. Fe-sacarosa 30,47±4,53%), VCM (Fe-carboximaltosa 72,40±7,72 fL vs. Fe-sacarosa 69,54±8,46 fL) y HCM (Fe-carboximaltosa 25,43±6,22 pg/dL vs. Fe-sacarosa 23,75±5,93 pg/dL) tampoco presentaron diferencias significativas entre los 2 grupos de tratamiento al cierre del seguimiento (fig. 1). Los niveles de ferritinemia medios presentaron un incremento significativo respecto de los hallados al inicio del estudio y, asimismo, fueron superiores en el grupo de Fe-carboximaltosa (246,74±17,83μg/L vs. 179,52±21,36μg/L; p=0,023) (fig. 2). No existieron diferencias significativas en los niveles de hemoglobinemia, hematocrito, VCM y HCM entre las formulaciones de Fe utilizadas considerando independientemente los pacientes de Crohn y colitis ulcerosa.
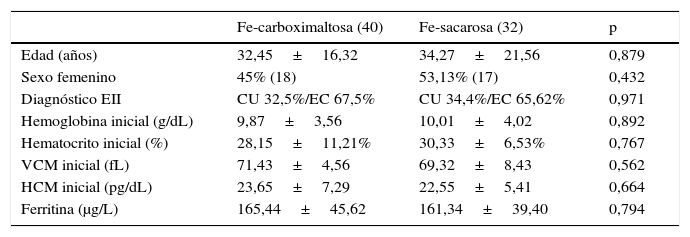
Variables clínico-demográficas al inicio del estudio
| Fe-carboximaltosa (40) | Fe-sacarosa (32) | p | |
|---|---|---|---|
| Edad (años) | 32,45±16,32 | 34,27±21,56 | 0,879 |
| Sexo femenino | 45% (18) | 53,13% (17) | 0,432 |
| Diagnóstico EII | CU 32,5%/EC 67,5% | CU 34,4%/EC 65,62% | 0,971 |
| Hemoglobina inicial (g/dL) | 9,87±3,56 | 10,01±4,02 | 0,892 |
| Hematocrito inicial (%) | 28,15±11,21% | 30,33±6,53% | 0,767 |
| VCM inicial (fL) | 71,43±4,56 | 69,32±8,43 | 0,562 |
| HCM inicial (pg/dL) | 23,65±7,29 | 22,55±5,41 | 0,664 |
| Ferritina (μg/L) | 165,44±45,62 | 161,34±39,40 | 0,794 |
CU: colitis ulcerosa; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; HCM: hemoglobina corpuscular media; VCM: volumen corpuscular medio.
Las variables cuantitativas han sido expresadas como media +/- DS.
Niveles medios de los parámetros analíticos hemoglobina (en g/dL), hematocrito (en %), volumen corpuscular medio (VCM) (en fL) y hemoglobina corpuscular media (HCM) (en pg/dL) de los pacientes sometidos a tratamiento parenteral con hierro (Fe) carboximaltosa vs. Fe sacarosa, a lo largo del seguimiento.
Los eventos adversos registrados en la administración de Fe-carboximaltosa fueron inferiores (1,44% de las administraciones [2/139 dosis] reacciones urticariformes) frente al Fe-sacarosa (6,10% de las administraciones [23/383 dosis] con predominio de dolor abdominal/cefalea); p<0,001. Requirieron transfusión 2 en el grupo Fe-carboximaltosa y 6 en el de Fe-sacarosa, p=0,062, que supusieron cierre del seguimiento. No existieron pérdidas por descompensación de la actividad inflamatoria de la enfermedad. El número de dosis administradas fue significativamente superior en el grupo de Fe-sacarosa con 11,97 dosis/paciente frente al Fe-carboximaltosa con 3,48 dosis/paciente, suponiendo una ratio Fe-sacarosa/Fe-carboximaltosa de 3,43 dosis/paciente. A pesar del coste superior por vial de tratamiento, la aplicación del tratamiento con Fe-carboximaltosa supuso un ahorro de 948,46 €/paciente. No se computaron a tal efecto los costes del desplazamiento y del tiempo de ocupación de los pacientes en un sillón de hospital de día, siendo más frecuente para el Fe-sacarosa que para el Fe-carboximaltosa.
DiscusiónLa anemia ferropénica asociada a la EII comporta una complicación frecuente de la evolución de clínica de estos pacientes, siendo de difícil control y comportando un notable incremento de la morbilidad y la aplicación de medidas terapéuticas adicionales1,2. Dado el curso crónico de la enfermedad, es de vital importancia su corrección sostenida para corregir la sintomatología de fatiga y astenia derivada de la anemia que se añade a la afectación del estado general que puede acompañar al curso clínico de la EII, con medidas basadas en la menor necesidad de visitas hospitalarias5, así como el consumo de recursos sanitarios más eficiente posible6,7. Todo ello puede contribuir a una mejor calidad de vida8,9 de este subgrupo de pacientes.
Entre las formulaciones de Fe parenteral aplicadas al tratamiento de la anemia ferropénica figuran diferentes alternativas, tratándose de introducir nuevos trasportadores polisacarídicos más estables, eficaces y con mejor perfil de tolerancia, como recientemente el Fe carboximaltosa10,11.
En concordancia con nuestro estudio, la ECCO12 recomienda en las guías clínicas del 2015 la suplementación de Fe en todos los pacientes con EII para la corrección de la hemoglobinemia y/o los depósitos sistémicos. La administración parenteral constituye una alternativa eficaz en los casos de mala tolerancia al tratamiento oral, necesidad de reposición intensiva o con asociación de agentes eritroestimulantes.
En nuestra experiencia, sin demostrarse superioridad significativa, el perfil de eficacia y de requerimientos transfusionales fue comparable entre ambas formulaciones, aunque con una tendencia clínica relevante de mantenimiento de niveles superiores de corrección de la anemia ferropénica para los pacientes sometidos a Fe-carboximaltosa. Probablemente, la naturaleza multifactorial13-15 de la anemia hayan limitado la manifestación clínica de la corrección de la anemia a pesar de una mejor repleción de los depósitos de Fe sistémico16. No obstante, el perfil de seguridad17 de dicha formulación fue superior en lo que se refiere a eventos adversos registrados. Además de la buena tolerancia a la administración, la formulación parenteral de Fe-carboximaltosa puede ofrecer ventajas sobre otro tipo de formulaciones parenterales y por vía oral en relación con un potencial efecto eritroestimulante en relación con la alta dosificación de Fe en un corto periodo18,19. Desde el punto de vista económico, la aplicación de Fe-carboximaltosa resulta más eficiente en términos de coste-efectividad y coste-utilidad al reducir el consumo de recursos sanitarios y el número de dosis administradas (y, por ende, visitas al centro hospitalario) para cumplir los objetivos de tratamiento.
El reducido tamaño muestral ha supuesto una probable limitación en el estudio, justificándose en que se trata de la experiencia de una institución durante un periodo limitado debido a la reciente disponibilidad de uno de los fármacos estudiados. No obstante, dicho estudio reduce sesgos importantes en el estudio de la anemia asociada a la EII, como es el grado de control de la actividad inflamatoria y la concomitancia de tratamiento con Fe por vía oral, seleccionando solo a aquellos pacientes con tratamiento parenteral exclusivo a fin de objetivar la respuesta al mismo lo más aisladamente posible. Así, ha permitido analizar adecuadamente el perfil de seguridad de ambas formulaciones, así como la eficiencia de su eventual aplicación sistemática.
ConclusionesEl tratamiento con Fe-carboximaltosa para el tratamiento concomitante de la anemia ferropénica en pacientes con enfermedad inflamatoria intestinal presenta un perfil de eficacia no inferior al Fe-sacarosa, ofreciendo una superior repleción de depósitos sistémicos y perfil de seguridad superior. En relación con su posología, se presenta como un tratamiento más eficiente, permitiendo la reducción del número de dosis/paciente, transfusiones y coste del tratamiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.