La enfermedad inflamatoria intestinaI (EII) se comporta como una enfermedad sistémica, pudiendo presentar eventos tromboembólicos que, aunque poco frecuentes, pueden aumentar en los pacientes con EII y condicionar un importante impacto en su morbimortalidad.
Se ha objetivado que mientras la EII se encuentra activa, se producen alteraciones en el sistema de coagulación, induciendo así un estado de hipercoagulabilidad y un riesgo de desarrollar eventos trombóticos no presente en pacientes con EII no activa.
Es imprescindible identificar a aquellos pacientes con más riesgo de desarrollar un evento trombótico para poder instaurar la profilaxis adecuada precozmente.
Se presentan a continuación varios casos de pacientes con diagnóstico de EII que desarrollaron complicaciones vasculares en el curso de su enfermedad y se revisa la literatura existente.
Inflammatory bowel disease (IBD) is a systemic chronic disease, which in some cases is associated with thromboembolic events. Although these events are uncommon, they are increased in patients with IBD and increase morbidity and mortality.While IBD is active there are modifications in the coagulation system, thus inducing a hypercoagulable state and a risk of developing thrombotic events which are not present in patients with inactive IBD.It is essential to identify which patients have a higher risk of developing a thrombotic event and establish appropriate prophylaxis as early as possible.We present some cases of patients diagnosed with IBD who developed vascular complications in the course of their disease and we review the existing literature.
La enfermedad inflamatoria intestinal (EII) es una enfermedad crónica de etiología desconocida que, favorecida por diferentes factores (ambientales, infecciosos, etc.), afecta a pacientes genéticamente predispuestos.
La prevalencia de la EII en España se estima en alrededor de 87-110 casos/100.000 habitantes-año. La incidencia de colitis ulcerosa (CU) en nuestro medio está en torno a 3,8 casos/100.000 habitantes-año. Las cifras correspondientes para la enfermedad de Crohn (EC) tienen un valor medio de 1,9 casos/100.000 habitantes-año1.
La EII no solo afecta al tubo digestivo, sino que se comporta como una enfermedad sistémica en la que la aparición de eventos tromboembólicos (ETE) es una manifestación poco frecuente, pero conocida2.
Aunque se han postulado muchas teorías, parece que la EII en sí misma es un factor de riesgo independiente para el desarrollo de ETE, existiendo un riesgo entre 1,5-3,5 mayor respecto a la población general3.
Se ha objetivado que mientras la EII se encuentra activa, se producen alteraciones en el sistema de coagulación; aumentan los factores procoagulantes como el factor v y viii, aparece trombocitosis; y descienden los factores anticoagulantes como la antitrombina iii, la proteína C y la proteína S4,5, induciendo así un estado de hipercoagulabilidad no presente en pacientes con EII inactiva. Otras alteraciones hematológicas como la hiperhomocisteinemia o la anemia, alteraciones electrolíticas o el tratamiento corticoideo también se han relacionado con un aumento del riesgo trombótico5.
La asociación de la EII con otros factores de riesgo protrombóticos, como pueden ser la inmovilización prolongada, la necesidad de intervención quirúrgica (IQ), la deshidratación o el ser portador de catéteres centrales, aumenta el riesgo de trombosis5. Por todo ello, es imprescindible identificar a aquellos pacientes con más riesgo de desarrollar un ETE para poder instaurar la profilaxis adecuada precozmente.
Según las Guías de Práctica Clínica actuales, los pacientes hospitalizados por un brote de EII deben recibir profilaxis con heparina de bajo peso molecular (HBPM)6; sin embargo, en la práctica clínica apenas el 65% de los gastroenterólogos reconocen realizar una quimioprofilaxis adecuada4.
Se presentan varios casos de pacientes con diagnóstico de EII que desarrollaron complicaciones vasculares en el curso de su enfermedad y se revisa la literatura existente.
Caso clínico 1: trombosis venosa profundaMujer diagnosticada a los 21 años de EC ileocolónica A2 L3 B3, que comenzó como brote inflamatorio asociado a manifestaciones extraintestinales (artralgias y eritema nodoso). Se inició tratamiento con 5-ASA, requiriendo hasta 3 ingresos hospitalarios sucesivos por brotes inflamatorios que precisaron de corticoterapia sistémica. A los 23 años (2 años tras el diagnóstico) requiere IQ por enfermedad fistulizante complicada con absceso en íleon distal, realizándose resección de 8cm de íleon terminal con anastomosis íleo-ileal termino-terminal e iniciándose tratamiento inmunosupresor para evitar recidiva posquirúrgica. Sin embargo, posteriormente precisa de 4 ingresos hospitalarios por recidiva inflamatoria de la enfermedad a nivel de la anastomosis quirúrgica, complicándose a los 25 años con una nueva fístula que requirió, además de corticoterapia sistémica, antibioterapia intravenosa.
Durante dicho ingreso, comienza con dolor y edema de miembro inferior izquierdo, por lo que ante la sospecha de trombosis venosa profunda (TVP) se solicita ecografía-doppler que confirma la presencia de trombosis venosa a nivel de la vena poplítea izquierda. Se inicia anticoagulación con HBPM para continuar con anticoagulación oral (ACO) de mantenimiento, con buena evolución clínica y resolución de la TVP.
Se ha observado que el riesgo general de TVP en pacientes con EII frente a la población general está aumentado, con un RR en torno al 2,57,8, sin haberse encontrado diferencias estadísticamente significativas entre los pacientes con CU frente a EC7.
En el estudio realizado por Huerta et al. en 2007 se analizan los factores de riesgo relacionados con la aparición de TVP y tromboembolismo pulmonar (TEP). Recogieron 3.544 casos de TVP y 10.000 controles y analizaron la incidencia de diferentes factores de riesgo. Entre los pacientes diagnosticados de una TVP encontraron que 56 eran pacientes con diagnóstico previo de EII frente a 62 controles con EII que no desarrollaron eventos trombóticos. En este estudio se objetivó que los pacientes con EII tenían un riesgo aumentado de desarrollar TVP frente a los controles, con una OR de 1,97 (IC 95% 1,30-2,74)9.
Además, los pacientes con un primer episodio de TVP tienen un riesgo aumentado de presentar un segundo episodio frente a la población sin EII (recurrencia a 5 años 33 vs. 22%)8. Se han relacionado 2 factores que aumentan esta posible recurrencia: el sexo masculino y la menor edad al diagnóstico del primer evento7.
Esto cambia en pacientes en los que el evento trombótico tiene lugar tras una intervención quirúrgica (17% de riesgo de nuevo evento a los 5 años), siendo el riesgo de recurrencia similar que en pacientes sin EII8.
Caso clínico 2: tromboembolismo pulmonarVarón diagnosticado a los 19 años de EC ileocolónica A2 L3 B3, iniciándose tratamiento con 5-ASA. Durante su evolución presenta mal control de la enfermedad, con múltiples (5) ingresos por actividad, desarrollando corticorrefractariedad y apareciendo trayecto fistuloso desde sigma con absceso de psoas izquierdo secundario, precisando colectomía subtotal con anastomosis ileosigmoidea. Posteriormente inicia tratamiento inmunosupresor (azatioprina) con abandono posterior de los controles por parte del paciente. Sin embargo, 13 años tras el diagnóstico, a sus 32 años, ingresa por cuadro oclusivo secundario a recidiva de la enfermedad en la anastomosis y complicada con trayectos fistulosos, por lo que se inicia tratamiento con anti-TNF (IFX), consiguiendo respuesta parcial. Se mantiene pauta de IFX junto con azatioprina, reingresando 8 meses después del inicio del tratamiento biológico por un nuevo cuadro suboclusivo. Durante dicho ingreso, presenta disnea y dolor en el hemitórax derecho, realizándose angio-TC pulmonar que evidencia TEP bilateral. En la ecografía doppler se observó TVP parcial de la vena femoral común y de la vena femoral superficial izquierdas, por lo que se inició anticoagulación inicialmente con HBPM y posteriormente con ACO.
Se realizó estudio de hipercoagulabilidad, que puso de manifiesto un déficit de proteína C y S y antitrombina iii y plasminógeno en situación de agudización, siendo normal en condiciones basales, recomendando la realización de profilaxis en situaciones agudas. Sin embargo, en este paciente se decidió mantener anticoagulación profiláctica de forma indefinida.
En este caso, la propia actividad de su EC promovió las alteraciones procoagulantes existentes, que desaparecieron cuando la enfermedad fue controlada.
Diferentes estudios han demostrado una mayor incidencia de TEP en pacientes diagnosticados de EII. Huerta et al., en el estudio antes mencionado, recogieron 3.006 casos de TEP y 10.000 controles y analizaron la incidencia de diferentes factores de riesgo. Entre los pacientes diagnosticados de un TEP encontraron que 50 tenían diagnóstico previo de EII frente a 62 pacientes controles con EII que no desarrollaron ETE. En este estudio se objetivó un riesgo aumentado de desarrollar TEP en los pacientes diagnosticados de EII, con una OR de 1,97 (IC 95% 1,15-2,74)9.
En un metaanálisis realizado recientemente por Fumery et al. en 2014, se recogen 3 estudios (uno danés y 2 americanos) en los que se comparan 55.496 pacientes con EII frente a 549.176 controles, objetivando un riesgo aumentado de TEP de 2,53 (IC 95% 1,95-3,28) en pacientes diagnosticados de EII7.
Tras un evento trombótico en pacientes diagnosticados de EII, las Guías de Práctica Clínica actuales recomiendan instaurar tratamiento anticoagulante durante al menos 3 meses, siendo necesario llevarlo a cabo de forma indefinida cuando el evento trombótico se repite en el paciente6.
Caso clínico 3: trombosis venosa cerebralMujer de 43 años diagnosticada a los 22 de CU izquierda, iniciándose tratamiento con salazopirina con buena evolución, sin ingresos posteriores.
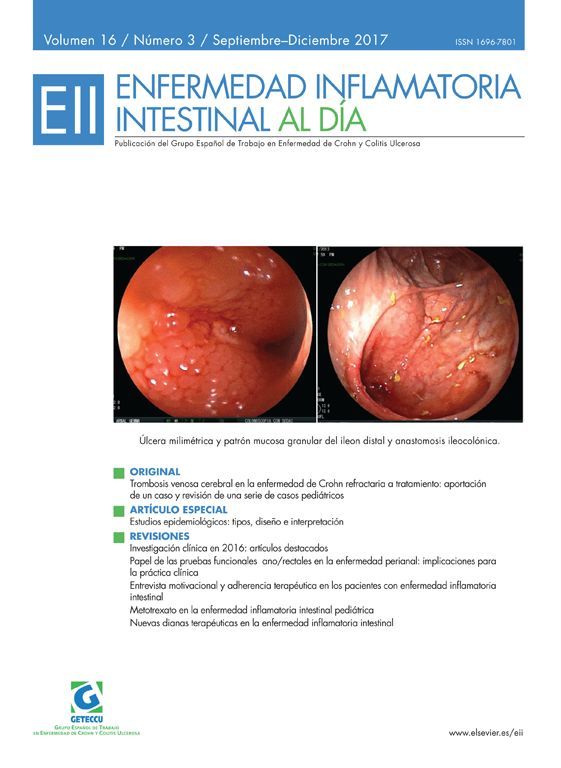
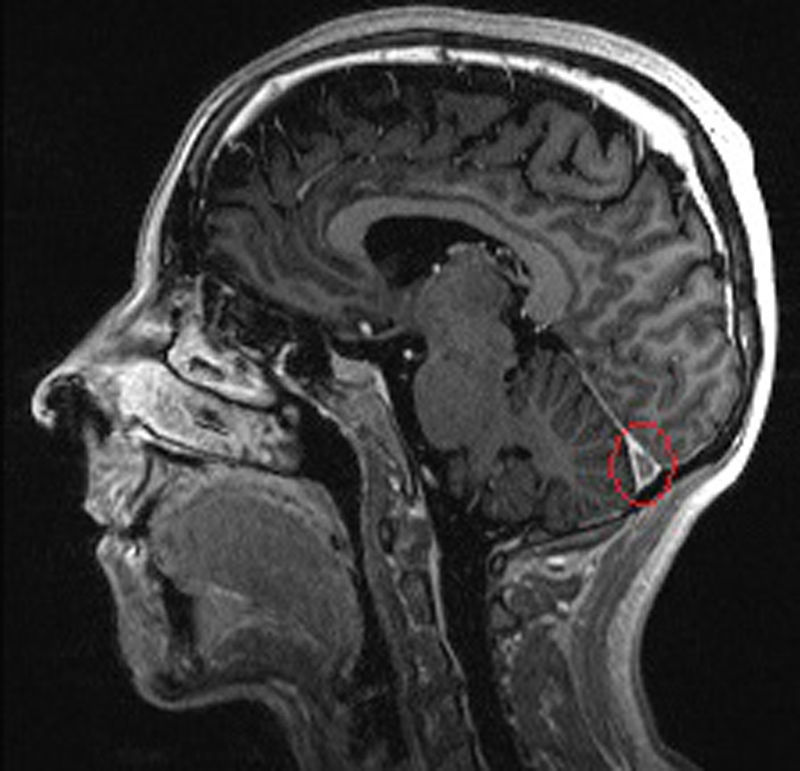
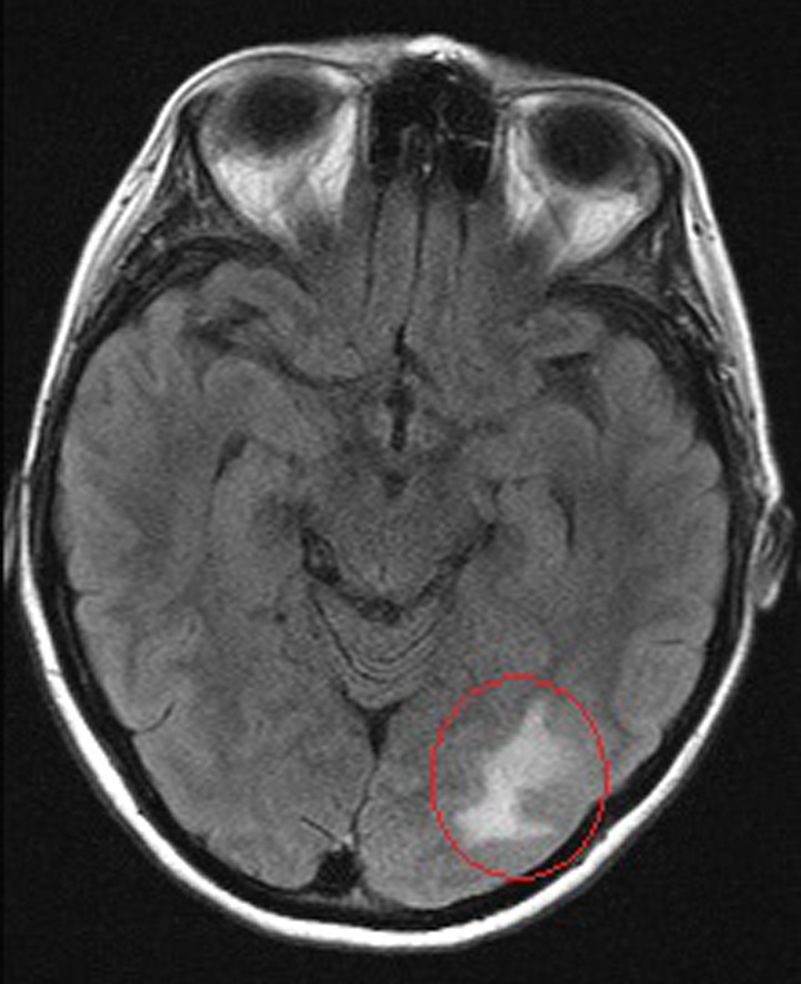
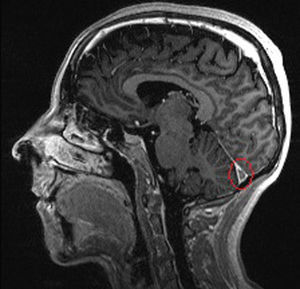
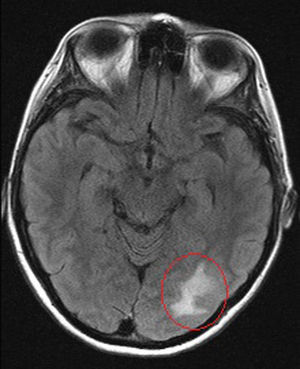
A los 39 años de edad ingresa en el Servicio de Neurología por cuadro de cefalea holocraneal y alteraciones visuales; fotopsias y disminución de la agudeza visual. Se realizó analítica (PCR 80,7mg/l, VSG 43mm/h, fibrinógeno 726, Hb 7,1g/dl, hematocrito 24%) y RM cerebral (fig. 1), evidenciando un defecto de repleción en la tórcula secundario a trombosis venosa cerebral que afectaba al seno transverso y sigmoide, junto con un infarto venoso occipital izquierdo (fig. 2). Ante estos hallazgos se inició anticoagulación con HBPM y se completó el estudio hematológico, descartando hipercoagulabilidad.
Ante la sospecha clínico-analítica se realizó colonoscopia, confirmando la presencia de brote moderado de CU, y se inició tratamiento corticoideo sistémico y con 5-ASA tópico, con buena evolución. Se mantuvo ACO durante 6 meses, y tras su suspensión permaneció asintomática y sin recidiva tanto de su CU como de las manifestaciones neurológicas tras el episodio.
La incidencia de complicaciones neurológicas en la EII varía desde un 0,2 hasta un 35,7% según las series10, y afecta de manera similar a pacientes tanto con CU como con EC.
La trombosis venosa cerebral ha sido descrita más frecuentemente en pacientes diagnosticados de CU frente a EC10,11, siendo el seno sagital superior la localización más frecuente10. La manifestación más habitual suele ser la cefalea, aunque pueden aparecer paresias, parestesias, afasia, etc. En aproximadamente un tercio de los pacientes se pueden encontrar alteraciones de la coagulación, como mutaciones del Factor V Leiden, hiperhomocisteinemia o anticuerpos anticardiolipina positivos11. Sin embargo, en aproximadamente dos tercios no se encuentra etiología que explique el evento. Por ello, aunque esta sea una manifestación poco frecuente, hay que tenerla en cuenta en pacientes con alteraciones neurológicas diagnosticados de EII, fundamentalmente en momentos de actividad de su EII.
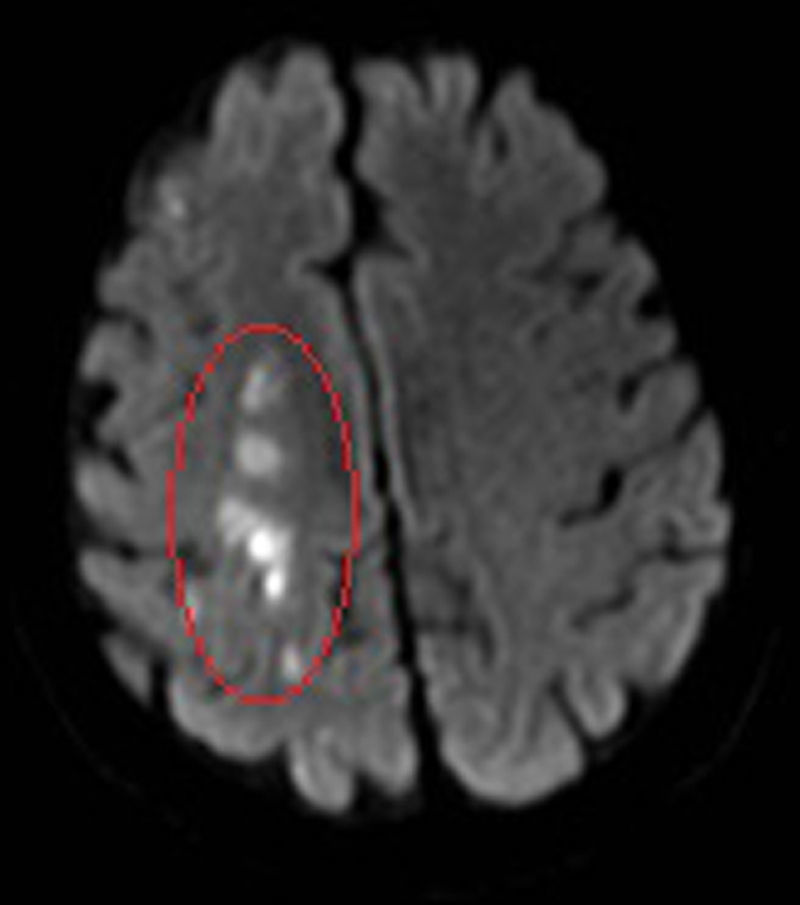
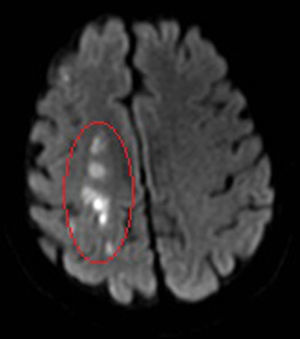
Caso clínico 4: ictus isquémicoVarón diagnosticado a los 50 años de EC ileocolónica A3 L3 B1 por brote moderado-severo al comienzo, iniciándose tratamiento corticoideo sistémico y azatioprina, con mal control de la enfermedad. Fumador de 6 cigarros/día, sin otros factores de riesgo cardiovascular. Dos meses tras el diagnóstico ingresa en Neurología por hemiparesia izquierda secundaria a ictus isquémico agudo-subagudo en territorio de la arteria cerebral media derecha (fig. 3; RM: imagen potenciada en difusión en la que se observa infarto frontoparietal derecho). Se realiza estudio de autoinmunidad, electrocardiograma, ecocardiograma, eco-doppler de miembros inferiores y TAC de troncos supraaórticos, sin que se evidenciara la etiología del ictus. Se instaura tratamiento antiagregante (ácido acetil salicílico 100mg/día), recuperando progresivamente el déficit neurológico en las primeras 48h.
Durante el ingreso se objetiva mal control de EC con 3-4 deposiciones/día, dolor abdominal, anemización (Hb 7,5g/dl, hematocrito 24%), trombocitosis (826.000 plaquetas), elevación de reactantes de fase aguda (PCR 69mg/l, fibrinógeno 646mg/dl) y datos de desnutrición (albúmina 2,5g/dl). Se realiza colonoscopia, evidenciándose signos de actividad moderada pancolónica, por lo que se inicia tratamiento corticoideo sistémico y biológico, con una adecuada respuesta clínico-analítica.
Actualmente, un año tras el ictus, ha recuperado completamente el déficit motor, continúa antiagregado y en tratamiento con adalimumab, con EC en remisión.
En la última década se han realizado numerosos estudios que analizan el riesgo de desarrollar ictus isquémico en los pacientes con EII.
En el estudio retrospectivo de cohortes de Berstein et al., de 200812, se recogen 8.060 pacientes diagnosticados de EII (EC y CU) y 80.489 controles, observando un aumento de la incidencia de ictus solo en los pacientes con EC, con un RR de 1,32 (IC 95% 1,05-1,66). Otro estudio prospectivo (Barclay et al., 201013), en el que se hizo un seguimiento prospectivo durante 5 años de pacientes pediátricos diagnosticados de EII, se observó un mayor riesgo de ETE cerebrales en niños con EC.
El estudio de casos y controles de Andersohn et al., de 201014, analizó 8.054 casos de EC frente a 161.078 controles estratificando el riesgo de ictus isquémico por edad y sexo. No se observó aumento del riesgo al considerar a toda la población en su conjunto, pero el análisis estratificado por edad sí evidenció un aumento del riesgo de padecer ictus isquémico en los sujetos menores de 50 años (OR 2,93; IC 95% 1,44-5,98).
En el lado opuesto encontramos un metaanálisis recientemente publicado por Fumery et al. (2014), en el que incluyen 3 estudios con un total de 8.866 pacientes diagnosticados de EII comparados con 97.043 controles7. Se estudió la incidencia de ictus en ambos grupos, no encontrando diferencias estadísticamente significativas entre los pacientes con EII frente a los controles, con un RR de 0,79 (IC 95% 0,51-1,23).
Caso clínico 5: infarto agudo de miocardioMujer diagnosticada a los 24 años de EC ileocolónica A2 L3 B3 en 1985 y en tratamiento de mantenimiento con 5-ASA. Abandonó el seguimiento y el tratamiento y reingresa a los 43 años por cuadro suboclusivo secundario a brote inflamatorio, con buena respuesta a corticoterapia sistémica. Reingresó posteriormente hasta en 4 ocasiones por episodios suboclusivos.
Reingresó a los 26 años del diagnóstico, a los 50 años, por nuevo cuadro suboclusivo refractario a tratamiento médico, precisando IQ con resección ileocecal con anastomosis ileocolónica. Dado su comportamiento corticorrefractario y la presencia de enfermedad fistulizante se inicia tratamiento combinado (infliximab y azatioprina).
Era exfumadora de 4-5 cigarrillos/día desde los 50 años, sin otros factores de riesgo cardiovascular ni antecedentes familiares de enfermedad cardiovascular. Ingresa en el Servicio de Cardiología a los 53 años por episodio de dolor torácico, evidenciándose infarto agudo de miocardio (IAM) con oclusión de la arteria descendente posterior, procediéndose a la revascularización y colocación de un stent.
La asociación de la EII con eventos isquémicos cardiacos es controvertida.
En un estudio de cohortes realizado por Yarur et al. (2011)15 se recogen 356 pacientes con EII y 712 controles. Entre los pacientes con EII había una menor prevalencia de los factores de riesgo cardiovasculares habituales (hipertensión arterial, diabetes mellitus, dislipidemia y obesidad), existiendo diferencias significativas con los controles (p<0,01). Sin embargo, los pacientes diagnosticados de EII tenían un mayor recuento de leucocitos y plaquetas, así como anemia, existiendo también diferencias estadísticamente significativas frente a los controles (p<0,01).
Al analizar los eventos cardiovasculares en estos sujetos, se vio que los pacientes con EII tenían mayor riesgo (HR 2,85; IC 95% 1,82-4,46), persistiendo tras realizar el ajuste según la presencia de los factores de riesgo cardiovascular habituales (HR 4,08; IC 95% 2,69-6,70) y los factores de riesgo no tradicionales (HR 2,62; IC 95% 1,50-4,57).
A pesar de los resultados de este estudio, se han realizado numerosos metaanálisis en los que no se encuentra asociación entre IAM y EII. En el metaanálisis realizado por Fumery et al. (2014) se recogen 7 estudios con un total de 65.419 pacientes con EII que han tenido un IAM, y 4.864.442 controles con IAM. En el estudio estadístico se objetiva un RR de 1,23 (IC 95% 0,94-1,62), descartando diferencias en el riesgo que presentan los pacientes con EII de padecer estos eventos7.
DiscusiónLa EII es una enfermedad crónica de etiología desconocida que afecta a pacientes genéticamente predispuestos. Dado que se comporta como una enfermedad sistémica, presenta manifestaciones extraintestinales, como son los ETE, que aunque poco frecuentes, pueden aumentar de forma considerable (incremento de riesgo de 1,5-3,5) en los pacientes con EII con respecto a la población general y condicionar un importante impacto en la morbimortalidad2,3,6.
Se han postulado varias teorías, concluyendo que la propia EII es un factor de riesgo independiente para el desarrollo de ETE.
Se ha objetivado que durante los brotes de actividad de la EII se producen alteraciones en el sistema de coagulación, aumentando los factores procoagulantes, como el v y el viii, y descendiendo los factores anticoagulantes, como la antitrombina iii, la proteína C y la proteína S4,5, produciendo un estado de hipercoagulabilidad no presente en pacientes con EII no activa. Además, es común la presencia de trombocitosis con la sobreexpresión en las plaquetas de diferentes marcadores, como el CD-40 ligando, la p-selectina o el GP53, produciendo un estado de activación plaquetario con un potencial aumento del riesgo de agregación plaquetaria (objetivado en estudios in vitro)16. Otras alteraciones hematológicas, como la hiperhomocisteinemia o la anemia, alteraciones electrolíticas o el tratamiento corticoideo también se han relacionado con un aumento del riesgo trombótico5.
La asociación de la EII con otros factores de riesgo protrombóticos, como pueden ser la inmovilización prolongada, la necesidad de IQ, la deshidratación o el ser portador de catéteres centrales, aumenta el riesgo de trombosis5. Por todo ello, es imprescindible identificar a aquellos pacientes con más riesgo de desarrollar un ETE para poder instaurar la profilaxis adecuada precozmente.
Como se ha descrito en la literatura, los eventos más frecuentes son la TVP de miembros inferiores, seguida del TEP. Sin embargo, es importante recordar que los eventos trombóticos pueden ocurrir en otras regiones y desarrollarse así trombosis venosas en territorio esplénico, portal, cerebral o mesentérico.
Las guías clínicas actuales recomiendan identificar aquellos pacientes con mayor riesgo de desarrollar un evento trombótico con el fin de realizar una adecuada profilaxis. Por lo tanto, aquellos pacientes con actividad de la enfermedad, antecedentes previos de trombosis, desnutrición, necesidad de cirugía, ingresados en los que se prevé un encamamiento prolongado y aquellos que precisan la colocación de un catéter venoso central deberán recibir profilaxis antitrombótica de manera precoz.
En caso de desarrollarse un evento trombótico será necesario instaurar anticoagulación (inicialmente HBPM para posteriormente pasar a ACO) y mantenerla durante al menos 3 meses6. Además, en los pacientes con un segundo episodio habría que valorar mantener el tratamiento anticoagulante de manera indefinida.
Se debe tener en cuenta que a pesar de que los pacientes hospitalizados suelen ser aquellos con mayor severidad de la enfermedad y con mayor riesgo de aparición de estos eventos, y que en la práctica clínica apenas el 65% de los gastroenterólogos reconocen realizar una quimioprofilaxis adecuada4,6, diferentes estudios han demostrado también una elevada presencia de estas manifestaciones en pacientes con EII activa en seguimiento ambulatorio17.
Además, hay que recordar que aunque lo más frecuente es que se produzcan cuando la enfermedad está activa y la afectación intestinal es extensa, estos fenómenos también pueden ocurrir en periodos de remisión17. Por otro lado, no hay que olvidar que en pacientes con CU y colectomía posterior, pese a no tener clínica colónica, la base genética e inflamatoria no queda eliminada, existiendo casos descritos en la literatura de eventos trombóticos en pacientes colectomizados.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.