La endoscopia gastrointestinal ha evolucionado significativamente; la endoscopia permite evaluar el tracto gastrointestinal, realizar el diagnóstico, seguimiento y tratamiento de múltiples enfermedades, incluyendo el Esófago de Barrett. La Asociación Mexicana de Endoscopia Gastrointestinal (AMEG) decidió realizar una revisión sistemática, sobre el papel actual de la endoscopia en el esófago de Barrett (EB).
La metodología usada consistió en realizar una revisión sistemática de la literatura médica. Se invitó a un grupo de expertos, a quienes durante las reuniones regionales se les asignó un tema específico a desarrollar.
A cada experto se le recomendó realizar una búsqueda bibliográfica en PubMed y otras bases de datos electrónicas, donde debían seleccionar los manuscritos más importantes de acuerdo a su relevancia clínica, calidad y nivel de evidencia. Se seleccionaron aquellos con el grado más alto de evidencia, jerarquizando de la siguiente manera: revisiones sistemáticas previas, ensayos clínicos controlados aleatorizados doble ciego, ensayos clínicos, cohortes, casos y controles, series de casos, reportes de casos y finalmente, opinión de expertos publicados en los últimos 10 años. Después de diversas revisiones y común acuerdo, se redactó la versión final que se presenta a continuación.
Technical advances and evolution in the gastrointestinal endoscopy has been significant in recent years. Endoscopy allows evaluating the gastrointestinal tract, perform surveillance, diagnosis and treatment of several disorders including Barrett´s esophagus (BE).
The "Asociación Mexicana de Endoscopia Gastrointestinal" (AMEG) decided to elaborate a systematic review on the current role of endoscopic techniques in Barrett´s esophagus. Experts in endoscopy were invited to participate. During each AMEG Regional meeting, every expert was assigned a specific topic to elaborate on. Experts were advised to perform a bibliographical search of manuscripts published in the last 10 years using PubMed and other electronic databases and to select manuscripts according to their relevance, quality and evidence level. Manuscripts with higher level of evidence were selected. Selection was made in the following order: systematic reviews, controlled clinical trials, cohorts, case-controls, cases series and expert opinion. During the regional meeting a first draft was written and after several reviews by every expert a final draft was achieved which is featured next.
Pagina nueva 1
Introducción
La endoscopia gastrointestinal ha evolucionado significativamente; además de permitir evaluar el tubo digestivo, es una herramienta más dentro de toda la tecnología disponible, para el adecuado manejo y vigilancia de diversas enfermedades.
La Asociación Mexicana de Endoscopia Gastrointestinal (AMEG) decidió realizar una serie de revisiones sistemáticas sobre el papel actual de la endoscopia en diversas patologías, con la finalidad de proponer y sugerir guías para el manejo, tratamiento y adecuado uso de la endoscopia en diversas enfermedades o situaciones.
La metodología usada consistió en realizar una revisión sistemática de la literatura médica. De forma tal, que durante las reuniones regionales se invitó a un grupo de expertos, a quienes se les asignó un tema específico a desarrollar, utilizando literatura médica actual publicada en los últimos 10 años. Durante la búsqueda bibliográfica se identificó e incluyeron aquellos informes y manuscritos con alto nivel de evidencia, priorizando y jerarquizando de la siguiente manera: revisiones sistemáticas previas, ensayos clínicos controlados aleatorizados doble ciego, ensayos clínicos, cohortes, casos y controles, series de casos, reportes de casos y finalmente, opinión de expertos. Durante la reunión regional, los expertos en cada tema se reunieron, expusieron la revisión realizada y se elaboró el primer borrador de las guías, el cual fue presentado a los asistentes de la reunión y abierto a discusión. Las sugerencias se agregaron al borrador; el cual posteriormente se envió a revisión de contendido y gramática vía electrónica, a los expertos que participaron en su elaboración. Después de varias revisiones y común acuerdo, se redactó la versión final que se presenta a continuación.
Esófago de Barrett
Antecedentes
En 1906, Norman Barrett describió la presencia de epitelio columnar en el esófago, lo que posteriormente (en 1950), fue conocido como esófago de Barrett (EB).1
Esta se considera una condición premaligna, que sigue la secuencia de metaplasia, displasia y neoplasia, con un riesgo anual de progresión a cáncer entre 0.1% a 0.3%.2
Definición
El EB se define como la presencia de metaplasia de epitelio columnar que predispone a cáncer, y que reemplaza el epitelio normal del esófago. Este puede sospecharse por los hallazgos macroscópicos durante una endoscopia, y se confirma por los hallazgos histológicos observados en biopsias. Endoscópicamente, se sospecha por la presencia de una mucosa esofágica anormal de color usualmente asalmonado de extensión variable, que se prolonga proximalmente a partir de los pliegues gástricos que delimitan la unión esófago-gástrica (UEG).3
Histológicamente, se define como la presencia de epitelio metaplásico de tipo intestinal con células caliciformes, que reemplaza el epitelio plano estratificado normal del esófago.
Existe discusión sobre la relevancia e importancia de encontrar epitelio cardial, por arriba de la UEG. De acuerdo a reportes recientes, esto es anormal y predispone a malignidad, sin embargo, el riesgo real se desconoce, pues la mayor parte de la información disponible se basa en estudios realizados en sujetos con metaplasia intestinal, por lo cual no se pueden establecer recomendaciones y no se debe usar el término "esófago de Barrett" para describir estos casos.4,5
¿En quién sospechar EB?
En pacientes con enfermedad por reflujo gastroesofágico (ERGE) crónico (más de cinco años), sujetos mayores de 50 años de edad, raza blanca, historia familiar de cáncer de esófago, género masculino, índice de masa corporal elevado, son factores de riesgo definitivos para desarrollar EB. Aunque con pocos estudios disponibles, sujetos con múltiples factores de riesgo se benefician de realizar una endoscopia de tamizaje, no así la población general sin factores de riesgo. Lo anterior, se justifica considerando que 40% o más de los sujetos con adenocarcinoma esofágico no tienen antecedentes de ERGE, sólo el 5% de los pacientes con cáncer de esófago se conocían previamente con diagnóstico de EB, y la cantidad de pacientes con ERGE es mayor al número de adeno-carcinoma esofágico.
Evaluación endoscópica
Una vez que se diagnostica EB, se debe evaluar la extensión y la presencia de lesiones focales como úlceras, nódulos o placas, precisando su localización y midiendo la distancia desde los dientes incisivos hasta el inicio de la lesión.
La extensión se indica utilizando la clasificación de Praga,6,7 que considera la afección circunferencial y la extensión máxima longitudinal, mediante las letras C y M. Se deben desechar definiciones como EB corto, largo, ultracorto, pues carecen de relevancia clínica. Aunque existen reportes que indican que la posibilidad de encontrar metaplasia intestinal incrementa en aquellos casos con longitud mayor de 3 cm,8 el riesgo incrementado de desarrollo de cáncer no depende de la longitud de la metaplasia.9,10
Métodos auxiliarles en la evaluación del EB
Además de la evaluación con luz blanca, se recomiendan emplear técnicas como filtros de luz, luz de banda angosta11,12 (NBI, por sus siglas en inglés), magnificación digital, magnificación óptica, microscopía confocal, autofluorescencia y tinciones vitales (lugo, índigo carmín, ácido acético, azul de metileno),13-16 que permiten una mejor caracterización endoscópica de la mucosa. Sin embargo, hasta ahora estas técnicas no han demostrado incrementar la detección de displasia, y aunque se puede prescindir de ellas durante la evaluación estándar, aparentemente ayudan a identificar áreas sospechosas de lesiones de alto riesgo, dirigiendo así la toma de biopsias tanto en sujetos con displasia conocida o con irregularidades de la mucosa.
Cromoendoscopia digital
Se ha estudiado la detección de zonas con displasia mediante el uso de cromoendoscopia digital, sin embargo, los resultados no han sido alentadores, pues existe gran variabilidad inter e intra observador, así como inter ensayos.
El examen con NBI combinado con microscopía confocal, ha reportado una sensibilidad de 92% y especificad de 76%-86% para detección de displasia.17,18 La autofluorescencia a pesar de tener una sensibilidad reportada de 80% a 100%, tiene sólo un valor predictivo positivo (VPP) de 60%.19 Al parecer la combinación de estas técnicas, mejora la precisión diagnóstica. Por lo que su uso rutinario aunque recomendable, aún no se considera indispensable.
Tinciones vitales
El ácido acético y el índigo carmín han demostrado ser útiles en la evaluación y caracterización endoscópica del EB.
El ácido acético realza y hace más evidente el patrón mucoso, mientras que el índigo carmín agrega contraste óptico, que permite identificar con mayor facilidad lesiones poco evidentes con luz blanca.20 Por lo que su uso rutinario es recomendable en todos los pacientes.
El azul de metileno, aunque de gran utilidad por su absorción y potencial carcinogénico, está contraindicado.
Vigilancia y manejo
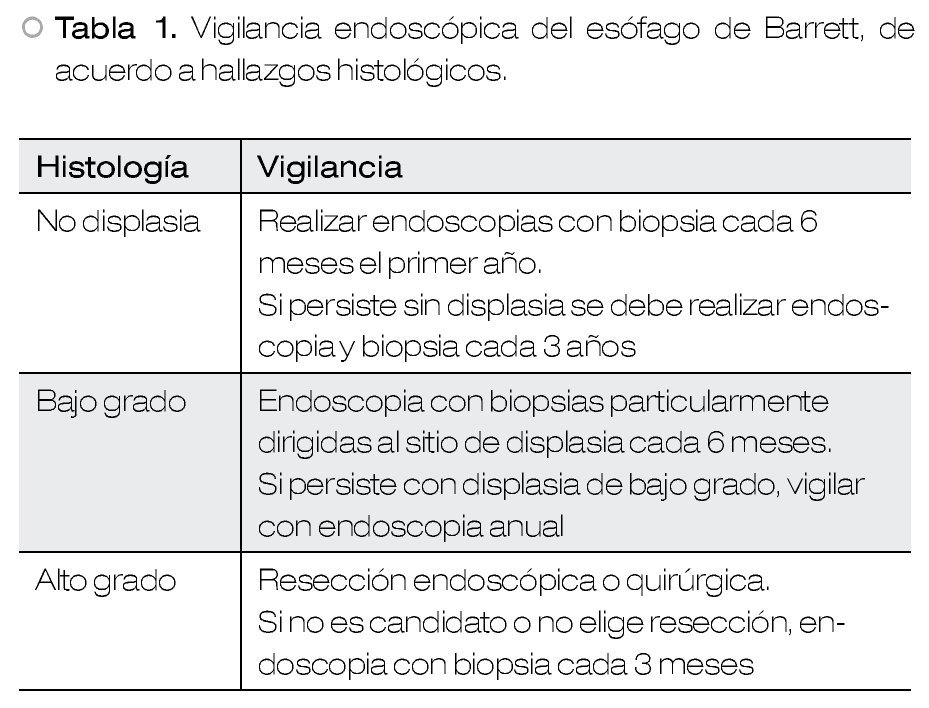
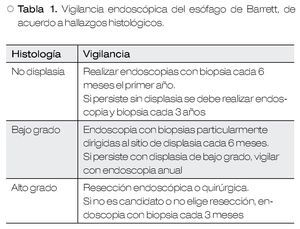
Recientemente, se ha reportado un riesgo de cáncer entre 0.1% a 0.3% anual, en sujetos con EB.2 Debido a este potencial de evolución a malignidad, se recomienda vigilancia periódica, cuya frecuencia depende de la presencia y grado de displasia21 (Tabla 1).
En casos con esofagitis aguda, no se deben tomar biopsias, pues la presencia de inflamación puede provocar diagnósticos falsos positivos de displasia. Se debe dar tratamiento médico para ERGE, y una vez cicatrizada la mucosa, se tomarán las biopsias.
• Displasia de bajo grado
Se recomienda repetir endoscopia a los seis meses, además de agregar tratamiento con inhibidor de bomba de protones.
Si desaparece la displasia de bajo grado, se realiza la vigilancia de sujetos sin displasia. En caso de persistir la displasia de este tipo, su pueden realizar "macro biopsias" del sitio afectado mediante resección endoscópica, para una mejor caracterización en Centros y por personal experto.
• Displasia de alto grado
Antes de cualquier maniobra endoscópica, esta patología debe ser confirmada por un segundo patólogo experto y confiable.22,23
Una vez confirmada preferentemente se debe realizar resección endoscópica, dependiendo del diagnóstico final, se decidirá si se requiere extender el tratamiento endoscópico (displasia de alto grado), que consiste en repetir la endoscopia en tres meses y realizar nueva resección de la zona afectada, o enviar a etapificación y tratamiento médico-quirúrgico (cáncer).24-26
Aquellos casos que rechacen la resección endoscópica, deberán vigilarse con endoscopia y biopsias cada tres meses.
Toma de biopsias
Se recomienda seguir los lineamientos descrito en el Consenso de Seattle, que consiste en tomar biopsias aleatorias de los cuatro cuadrantes esofágicos cada 2 cm, en casos sin displasia y sin irregularidades de la mucosa.27 En aquellos casos con displasia ya conocida, se deben tomar biopsias de los cuatro cuadrantes, cada centímetro. Además, se deben tomar biopsias dirigidas en lesiones sospechosas (úlceras, nódulos, placas), colocando cada segmento en frascos separados.28
En caso de contar con técnicas que permitan estudiar el patrón de criptas, se deben tomar biopsias dirigidas de áreas que sugieran alta probabilidad de displasia, de acuerdo a la clasificación de Endo (tipo III y IV).29
Acerca de la solicitud y las biopsias
A partir de la definición de EB, se advierte que la solicitud del estudio histopatológico debe incluir además de los datos generales del paciente (nombre, edad, género):
• Datos clínicos: síntomas "esofágicos", enfermedades concomitantes y fármacos empleados por el paciente.
• Datos endoscópicos: aspecto macroscópico de la mucosa.
• Sitio exacto de la toma de las biopsias.
Las biopsias enviadas para estudio histopatológico deberán estar inmersas en formol al 10%, preferentemente amortiguado, y debidamente etiquetadas (nombre del paciente y sitio de la toma), por lo que en caso de lesiones de gran longitud, se deberá enviar múltiples recipientes. En caso de biopsias del cardias gástrico anatómico (pliegues gástricos), deberá también ser informado.
Hallazgos histológicos en EB
Microscópicamente, la metaplasia intestinal está representada por epitelio columnar con células caliciformes. Esta metaplasia puede ser completa o incompleta, y tiende a adquirir un aspecto velloso con presencia de criptas.
Como se ha mencionado previamente, es indispensable la presencia de células caliciformes, estas con la tinción de hemotoxilina & eosina pueden mostrar coloración ligeramente basófilica en la vacuola, lo cual la hace distinta a las células seudocaliciformes. Con PAS Azul Alciano pH 2.5, la vacuola en la célula caliciforme es azul intenso, debido a la presencia de mucinas ácidas.
Displasia en EB, aspectos de anatomía patológica
La displasia en Barrett se clasifica en bajo y alto grado. En ambas, se observa incremento en el número de glándulas con distorsión de la arquitectura, incremento en la densidad celular y falta de maduración superficial, similar a lo observado en los adenomas.
La displasia de bajo grado presenta distorsión arquitectural moderada de las glándulas, nucleomegalia leve e hipercromatismo nuclear con la polaridad conservada y aisladas mitosis.30
La displasia de alto grado presenta distorsión acentuada de la arquitectura glandular, pleomorfismo celular marcado con abundantes mitosis, pérdida en la polaridad nuclear con disminución en la producción de mucina.
Las biopsias indefinidas para neoplasia presentan maduración en la superficie celular, así como datos histológicos de inflamación activa.
Es importante recordar que los criterios para diferenciar displasia de bajo y alto grado se basan en el grado de distorsión arquitectónica y citológica, y que estás son descripciones subjetivas, por lo que no existen definiciones exactas para diferenciarlas, lo que puede provocar errores en la clasificación.
La displasia de bajo grado suele ser sobrediagnosticada, especialmente en casos nuevos con esofagitis.31 Es por esto que el diagnóstico de displasia en EB, debe ser confirmado por al menos dos patólogos con experiencia en patología esofágica.32,33
Características del reporte histopatológico
El reporte histopatológico deberá incluir:
• Sitio de la biopsia.
• Grado de displasia (sin displasia, indefinido para displasia, con displasia de bajo grado y con displasia de alto grado).
• Otros hallazgos (esofagitis por reflujo, esofagitis infecciosas, carditis con o sin metaplasia intestinal).
Tratamiento
Aún y cuando es posible realizar tratamiento endoscópico del EB, no es claro si estas terapias lo erradican completamente y previenen el desarrollo de adenocarcinoma.34 El manejo adecuado de EB depende de la presencia de displasia, por lo que los programas de vigilancia son sumamente importantes para así limitar el desarrollo a cáncer en EB.
La esofagectomía ha sido tradicionalmente considerada como el tratamiento de elección para el EB con displasia alto grado.35 Sin embargo, debido a la elevada morbilidad quirúrgica, los avances y buenos resultados de la terapia ablativa endoscópica (terapia fotodinámica TFD, radiofrecuencia RF, mucosectomía), actualmente la cirugía no se recomienda como primera opción; posiblemente la cirugía de mínima invasión podría ser una mejor opción, pero se requiere de ensayos clínicos aleatorizados.36
Terapias ablativas
En una revisión sistemática de Cochrane en estudios aleatorizados, controlados, se compararon las distintas terapias en EB.37 Se evaluó la eficacia de medicamentos, cirugía y tratamiento endoscópico para eliminar EB con o sin displasia, y prevenir con dichas terapias la progresión a cáncer. Se evaluó la capacidad de erradicación de EB y displasia a 12 meses, así como la reducción en el número de pacientes con progresión a cáncer a cinco años. Tres investigadores revisaron 16 estudios con un total de 1 074 pacientes. Se observó que el tratamiento médico o quirúrgico dirigidos a reducir los síntomas de reflujo, no induce reducción del EB o displasia.
Las terapias endoscópicas tales como TFD con ácido aminolevulínico o porfimero de sodio, coagulación con argón plasma (CAP) y ablación con RF, inducen regresión de EB y displasia.35,38 Los datos para TFD fueron heterogéneos con una media de erradicación de 51% para EB, y entre 56% a 100% para displasia, dependiendo del régimen de tratamiento. La variabilidad en el tratamiento con TFD fue dependiente del fármaco utilizado, fuente y dosis de luz.35,39 La ablación con RF logró la erradicación en 82% y 94% para EB y displasia, respectivamente.35
En términos generales, los tratamientos endoscópicos son bien tolerados. Sin embargo, algunos se asociaron a quemaduras (CAP, TFD), así como fotosensibilidad y estenosis (TFD).
Las terapias ablativas han tenido un aumento en el manejo de displasia con EB, los datos actuales favorecen el uso de RF cuando se compara con TFD (menos complicaciones), en erradicar EB y displasia.40-42 Sin embargo, faltan estudios controlados a largo plazo (estudios clínicos aleatorizados, controlados) para evaluar la reducción de cáncer. Un abordaje con RF escalonada sugiere ser costo efectivo, y tener pocos efectos colaterales.43-45
Resección endoscópica de la mucosa
Ell y colaboradores lograron erradicar el EB con displasia o cáncer intraepitelial, en 97% y 59% en sujetos considerados de bajo y alto riesgo, respectivamente. Después de 12 meses, la recurrencia o presencia de lesiones metacrónicas fue 13.6% y 17.1%, respectivamente.46
Los mismos autores consiguieron remisión local en 99% de sujetos con EB y adenocarcinoma de esófago temprano, después de tres procedimientos de resección endoscópica de la mucosa (REM) en promedio, sin reportar complicaciones y con una sobrevida a cinco años de 98%.47
Los resultados de la REM son similares a los obtenidos con resección quirúrgica transtorácica con lifandenectomía en el tratamiento de EB con cáncer; según lo reportado en 114 pacientes, se logró remisión completa en todos los pacientes del grupo quirúrgico y en el 98.7% del grupo de REM, sin embargo, la cirugía se asocia a más complicaciones mayores comparada con REM (32% vs. 0%) y una mortalidad a 90 días mayor (2.6% vs. 0%, respectivamente), no obstante, la recurrencia fue mayor en pacientes tratados con REM.48
Recientemente, se realizó un consenso internacional mediante el método Delphi sobre el manejo de la displasia y cáncer temprano en EB.49 Se revisaron 11 904 estudios (80% de acuerdo). Se estableció consenso en 81 de 91 declaraciones, a pesar del bajo nivel de evidencia disponible en los estudios. Las conclusiones clínicas más relevantes fueron que: 1) Los especímenes de la REM son mejores que las biopsias para estadificar y evaluar las lesiones, 2) es importante realizar un mapeo cuidadoso y determinar el tamaño de las áreas de displasia, 3) los pacientes que reciben terapia ablativa o cirugía necesitan vigilancia endoscópica, 4) la endoscopia de alta resolución es necesaria para un adecuado diagnóstico, 5) en la displasia de alto grado se prefiere el tratamiento endoscópico sobre la vigilancia, 6) en la displasia de alto grado se prefiere la terapia endoscópica sobre la cirugía, 7) la combinación de REM y ablación con RF es la terapia más efectiva, y 8) después de la resección endoscópica de lesiones con displasia de alto grado, se debe realizar ablación en todas la áreas con EB.
Puntos a recordar
• El EB se define y diagnostica histológicamente como la presencia de epitelio metaplásico de tipo intestinal con células caliciformes, que reemplaza el epitelio plano estratificado normal del esófago.
• Endoscópicamente, se sospecha por la presencia de una mucosa esofágica anormal de color usualmente asalmonado, que se extiende proximalmente a partir de los pliegues gástricos que delimitan la UEG.
• El EB es una condición premaligna que sigue la secuencia de metaplasia, displasia y neoplasia, con un riesgo anual de cáncer reportado entre 0.1% a 0.3%.
• Se consideran factores de riesgo para desarrollar EB: ERGE crónico (más de cinco años), sujetos mayores de 50 años de edad, raza blanca, historia familiar de cáncer de esófago, género masculino, índice de masa corporal elevado.
• En sujetos con múltiples factores de riesgo se recomienda realizar una endoscopia de tamizaje: esto no aplica a la población general sin factores de riesgo.
• La extensión del EB se indica utilizando la clasificación de Praga o método C-M.
• Debido al potencial de malignidad del EB, se recomienda vigilancia endoscópica periódica, cuya frecuencia depende de la presencia y grado de displasia.
• Para la toma de biopsias durante el diagnóstico y seguimiento, se recomienda tomar biopsias aleatorias de los cuatro cuadrantes esofágicos cada 2 cm, en casos sin displasia y sin irregularidades de la mucosa.
• En aquellos casos con displasia ya conocida, se deben tomar biopsias de los cuatro cuadrantes, cada centímetro. Además, se deben tomar biopsias dirigidas en lesiones sospechosas.
• En casos con esofagitis aguda, no se deben tomar biopsias. Se debe dar tratamiento médico para ERGE, y una vez cicatrizada la mucosa se tomarán las biopsias.
• La presencia de displasia, especialmente de alto grado, debe ser confirmada de manera independiente por dos patólogos expertos y confiables.
• El ácido acético y el índigo carmín han demostrado ser útiles en la evaluación y caracterización endoscópica del EB, por lo que su uso es recomendable.
• Además de la evaluación con luz blanca se pueden y recomiendan emplear técnicas como filtros de luz, NBI, cromoendoscopia digital, endoscopia de aumento o endoscopia confocal, de estar disponibles.
• Los especímenes de la REM son mejores que las biopsias para estadificar y evaluar las lesiones.
• Los pacientes que reciben terapia ablativa o cirugía, necesitan vigilancia endoscópica
• En casos con displasia de alto grado, se prefiere el tratamiento endoscópico sobre la vigilancia y cirugía.
• Después de la resección endoscópica de lesiones con displasia de alto grado, se debe realizar ablación en todas las áreas con EB.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.