Estudiar la asociación del espesor del tejido adiposo epicárdico (TAE) con los niveles plasmáticos de adrenomedulina en pacientes con síndrome metabólico (SM).
MetodologíaSe seleccionaron 21 sujetos, 12 de sexo femenino y 9 de masculino, entre 22 y 58 años, con diagnóstico de SM según la Federación Internacional de Diabetes (IDF), y 19 controles, comparables en edad y sexo. Se midieron glicemia, lípidos y adrenomedulina plasmática. Se determinaron espesor del TAE, masa del ventrículo izquierdo y espesor íntima-media carotídeo mediante ecocardiografía transtorácica.
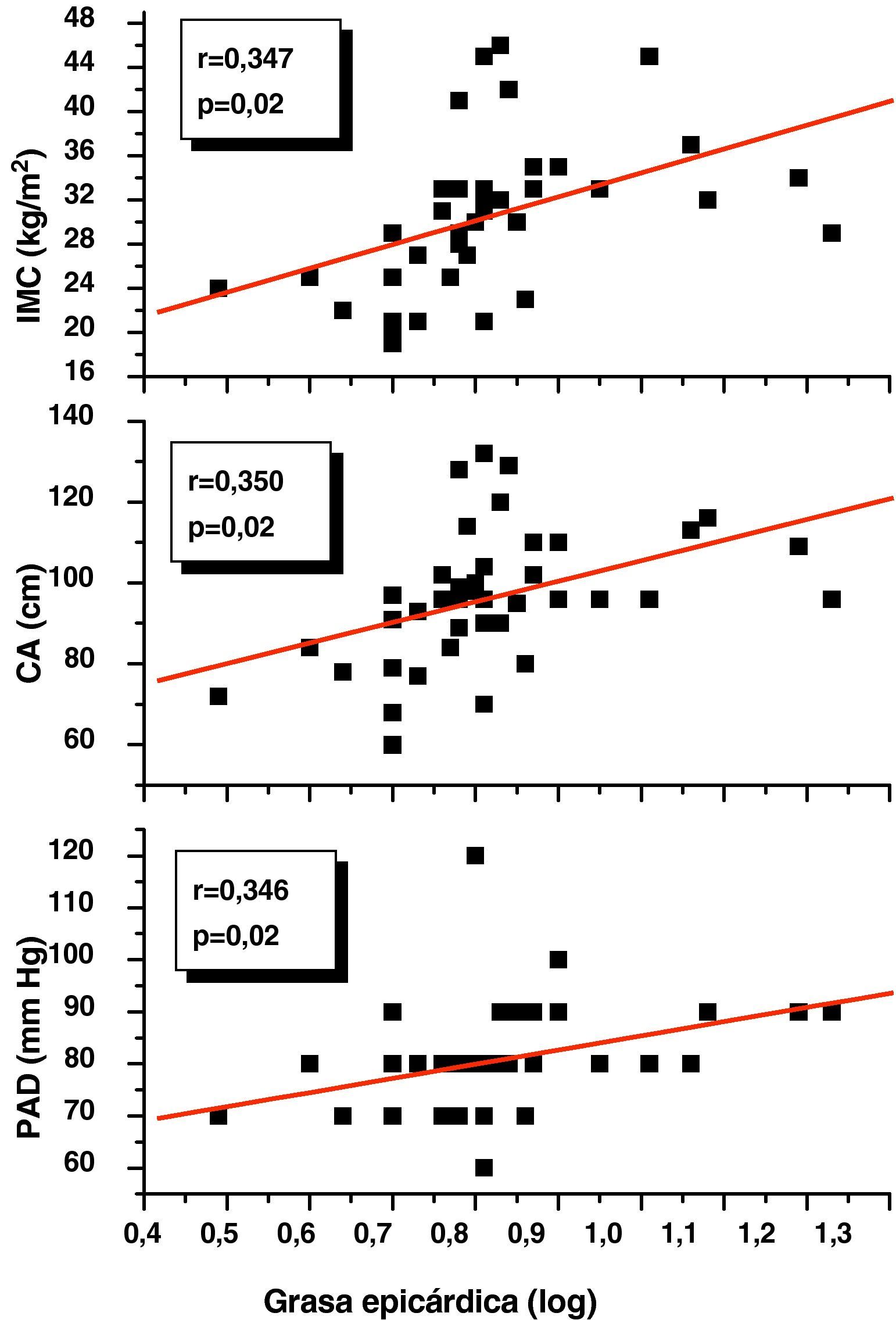
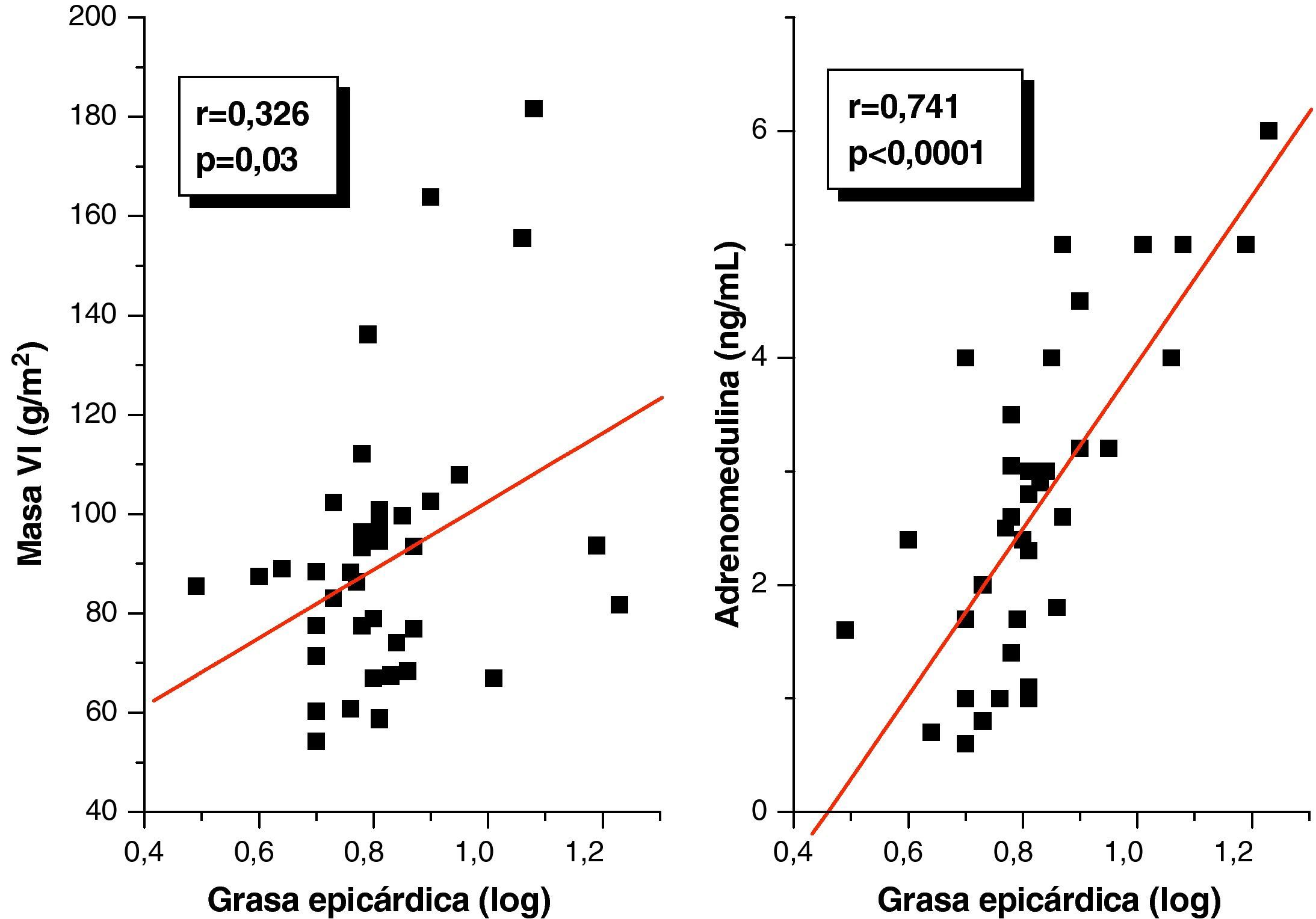
ResultadosNo hubo diferencias estadísticamente significativas en edad, sexo y talla entre ambos grupos, y el peso, IMC, circunferencia abdominal (CA), presión arterial sistólica (PAS) y diastólica (PAD) fueron significativamente más altos (p=0,0001) en el grupo con SM. Este grupo presentó niveles significativamente más altos de glicemia (p=0,001), colesterol total (p=0,01), C-LDL (p=0,03), C-VLDL (p=0,005), triglicéridos (p=0,002), cociente Tg/C-HDL (p=0,0001) y adrenomedulina (3,49±1,21 vs 1,69±0,92 ng/mL; p=0,0001) y más bajos de C-HDL (p=0,02) que el grupo control. El espesor del TAE en los pacientes con SM fue significativamente más alto que en el grupo control (8,45±3,14 vs 5,43±0,96mm; p=0,0001), y mostró una correlación positiva con IMC (r=0,347; p=0,02), CA (r=0,350; p=0,02), PAD (r=0,346; p=0,02) y adrenomedulina (r=0,741; p=0,0001). En el análisis de regresión lineal múltiple, la adrenomedulina fue la variable explicativa del espesor del TAE (R2=0,550; p=0,0001).
ConclusiónEn este limitado grupo de pacientes existe una asociación significativa entre espesor de TAE y niveles plasmáticos de adrenomedulina, los cuales pudieran ser utilizados como biomarcadores de SM.
To assess the association between epicardial adipose tissue thickness (EAT) and plasma adrenomedullin plasma levels in patients with metabolic syndrome (MS).
MethodsTwenty-one patients (12 females and 9 males) with MS according to the International Diabetes Federation guidelines, aged 22-58 years, were enrolled into the study and compared to 19 age-matched control subjects without MS. Plasma glucose, lipid, and adrenomedullin levels were assessed. EAT, left ventricular mass, and carotid intima-media thickness were evaluated by transthoracic two-dimensional echocardiography.
ResultsNo statistically significant differences were found between the groups in age, sex, and height. Body weight, abdominal circumference (AC), body mass index (BMI), systolic blood pressure (SBP), and diastolic blood pressure (DBP) were significantly higher (p=0.0001) in MS patients; this group also showed significantly higher glucose (p=0.001), total cholesterol (p=0.01), LDL-C (p=0.03), VLDL-C (p=0.005), triglyceride (p=0.002), Tg/HDL ratio (p=0.0001), and plasma adrenomedullin (3.49±1.21 vs 1.69±0.92 ng/mL; p=0.0001) levels and lower HDL-C (p=0.02) levels as compared to the control group. EAT was significantly thicker in MS patients compared to the control group (8.45±3.14 vs 5.43±0.96; p=0.0001), showed a positive correlation to BMI (r=0.347; p=0.02), AC (r=0.350; p=0.02), DBP (r=0.346; p=0.02), and adrenomedullin levels (r=0.741; p=0.0001). In multiple linear regression analysis, adrenomedullin was the only parameter associated to EAT (R2=0.550; p=0.0001).
ConclusionIn this small patient group, a statistically significant association was found between EAT and plasma adrenomedullin levels, which may be considered as a potential biomarker of MS.
El síndrome metabólico (SM) se relaciona con múltiples factores de riesgo cardiovascular, y es identificado por la presencia de al menos tres alteraciones metabólicas: obesidad abdominal, hipertensión arterial, glicemia alterada en ayuna o intolerancia a los carbohidratos, así como dislipidemia aterogénica caracterizada por hipertrigliceridemia y disminución de lipoproteínas de alta densidad (C-HDL)1.
El reconocimiento del adipocito como un órgano endocrino altamente complejo, capaz de secretar una serie de moléculas bioactivas denominadas en conjunto adipocitoquinas, ha despertado enorme interés en el tejido adiposo, particularmente en la adiposidad visceral, la cual se asocia con un mayor riesgo cardiometabólico2–4. De hecho, el incremento de la adiposidad visceral constituye una característica que define al SM, y a pesar de que en los últimos años el interés científico se ha centrado en el estudio de la grasa visceral intra-abdominal, también algunos depósitos de grasa visceral extra-abdominal como la grasa epicárdica, han sido estudiados y se han abierto campo como marcadores noveles de riesgo cardiovacular5.
El tejido adiposo epicárdico (TAE) evoluciona del tejido adiposo pardo durante la embriogénesis, y en la edad adulta tiende a ubicarse en los surcos auriculoventricular e interventricular extendiéndose hacia el ápex. Focos menores de grasa se encuentran localizados a nivel subepicárdico a lo largo de la pared libre de las aurículas5. Este tejido tiene características específicas que la diferencian de otros depósitos de grasa visceral: el tamaño del adipocito es menor con respecto a la grasa abdominal y la síntesis y catabolismo de ácidos grasos es mayor, por lo cual se ha propuesto que la grasa epicárdica podría actuar como un buffer que sirve para proteger al corazón contra la cardio-lipotoxicidad generada por los ácidos grasos libres6. Además, el adipocito epicárdico puede jugar un papel tanto beneficioso como deletéreo para el corazón a través de la secreción de adipocitoquinas, entre ellas adrenomedulina. Este es un péptido de 52 aminoácidos que posee propiedades vasodilatadoras, antioxidantes, angiogénicas y anti-inflamatorias que podrían ejercer un efecto protector sobre la vasculatura coronaria, en virtud de su proximidad con las mismas y con el miocardio adyacente7. Esta hormona se ha utilizado como un marcador de severidad y evolución de patologías como insuficiencia cardíaca, insuficiencia renal y aterosclerosis8; sin embargo, su relación con el SM y el tejido adiposo epicárdico ha sido poco estudiada. Algunos autores han encontrado un mayor espesor de grasa epicárdica en pacientes con SM9,10, y de igual forma Kita et al11 han demostrado un incremento en los niveles plasmáticos de adrenomedulina en pacientes con múltiples factores de riesgo cardiovascular. Por otra parte, evidencia reciente señala que los pre-adipocitos epicárdicos y las células estromales expresan adrenomedulina y sus receptores, por lo cual pudiera existir una fuerte relación entre ambos marcadores de riesgo cardiometabólico12.
El objetivo de este trabajo fue estudiar la relación entre las variables ecocardiográficas, espesor del TAE, masa del ventrículo izquierdo y espesor íntima media carotideo y los componentes antropométricos y clínicos del SM, así como su asociación con los niveles plasmáticos de adrenomedulina como biomarcadores del SM. Se espera que los pacientes con SM presenten un mayor espesor de TAE así como también de niveles plasmáticos de adrenomedulina.
Material y métodosDiseño del estudio y sujetosEn base al objetivo propuesto se diseñó un estudio observacional, transversal, comparativo analítico, en el que se seleccionaron 21 sujetos, 12 de sexo femenino y 9 de masculino, con un rango de 22 a 58 años, con un índice de masa corporal (IMC) entre 27 y 46 Kg/m2, los cuales cumplían con al menos tres de los criterios para el diagnóstico de SM según la Federación Internacional de Diabetes (IDF)1: circunferencia abdominal (CA) >80cm en mujeres y >90cm en hombres, presión arterial >130/85mm Hg, glicemia en ayunas >100mg/dl, niveles plasmáticos de triglicéridos >150mg/dl y lipoproteína de alta densidad (C-HDL) <50mg/dl en mujeres y <40mg/dl en hombres. Estos sujetos se compararon con 19 controles, 10 de sexo femenino y 9 de masculino, de edades similares y que no cumplían con tres de los criterios ya mencionados de SM. Todos los sujetos estudiados eran procedentes de Ciudad Bolívar – Estado Bolívar, Venezuela. Se excluyeron del estudio aquellos sujetos con dislipidemias familiares y endocrinopatías tales como diabetes mellitus tipo 2, hipotiroidismo, síndrome de Cushing, acromegalia, así como cualquier comorbilidad o ingestión de medicamentos (glucocorticoides, hipolipemiantes, etc.) capaz de afectar los parámetros metabólicos. Cabe destacar que este estudio fue realizado de acuerdo a los lineamientos propuestos por la Declaración de Helsinki y todos los sujetos dieron su consentimiento por escrito para participar en el mismo.
Variables antropométricas y clínicasEl peso y la talla fueron medidos con los sujetos en ayuna y vistiendo sólo su ropa interior. El IMC fue calculado como el peso dividido entre la talla al cuadrado, y fue usado como un marcador de obesidad si era mayor a 30 Kg/m2. La CA fue medida con los sujetos de pie, a nivel de una línea media entre el borde inferior de la última costilla y las crestas ilíacas, y fue expresada en centímetros. La presión arterial se midió en el brazo derecho, después de 10 minutos en posición sentada, por método auscultatorio, con un tensiómetro de mercurio estándar.
Variables bioquímicasSe tomó una muestra de sangre de la vena antecubital, en ayuno no menor de 8 horas, para la determinación de glicemia y lípidos sanguíneos (colesterol total, triglicéridos y C-HDL), los cuales se realizaron por métodos enzimáticos con un autoanalizador Bayer Express Plus® con reactivos de Wiener (Buenos Aires, Argentina). La lipoproteína de baja densidad (C-LDL) se estimó a través de la ecuación de Friedewald LDL=colesterol total – [C-HDL+(triglicéridos/5)], y el colesterol de la lipoproteína de muy baja densidad (C-VLDL) se obtuvo dividiendo triglicéridos/5.
Los niveles plasmáticos de adrenomedulina se determinaron mediante método inmunoenzimático, utilizando para ello un kit de ELISA especialmente diseñado para tal fin (DRG International Inc, New Jersey, USA), con un coeficiente de variación interensayo del 10% e intraensayo del 5%.
Variables ecocardiográficasA cada sujeto se le realizó un ecocardiograma trans-torácico bidimensional (2D), utilizando para ello los equipos Mylab 50 Exvision Esaote® y Mylab CVX Esaote® (Esaote, Genova Italia) por técnica estándar con los pacientes en decúbito lateral izquierdo. Para la medición se utilizó la técnica validada por Iacobellis et al13. Los ecocardiogramas fueron interpretados por dos cardiólogos diferentes, evidenciando buena reproducibilidad en las medidas y garantizando así la validez de las mediciones.
Ecocardiográficamente, el TAE se identifica como el espacio ecolúcido entre la pared externa del miocardio y la capa visceral del pericardio. Este espesor es medido perpendicularmente sobre la pared libre del ventrículo derecho al final de la sístole en 3 ciclos cardíacos usando una vista en eje paraesternal largo o paraesternal corto. La medición sobre la pared libre del ventrículo derecho fue realizada por dos razones: 1) este punto se reconoce anatómicamente como el de mayor espesor de grasa epicárdica, y 2) el eje paraesternal largo y paraesternal corto permite las medidas más exactas de tejido adiposo epicárdico sobre el ventrículo derecho, con una óptima orientación del cursor en cada vista.
La masa del ventrículo izquierdo fue determinada de igual forma en eje paraesternal largo, mediante la fórmula anatómicamente validada de Devereux et al14, y ésta posteriormente se indexó con la superficie corporal del paciente. Por su parte el espesor íntima media carotídeo fue medido en el eje longitudinal del vaso, en tres puntos de la arteria carótida común (1/3 proximal, 1/3 medio y 1/3 distal) usando para ello una sonda lineal vascular y posteriormente se obtuvo un promedio de las tres medidas, tomando como valor de espesor íntima media carotídeo el valor más alto entre las dos carótidas de ambos lados.
Los datos fueron tomados en una ficha elaborada para tal fin y el estudio fue aprobado por el Comité de Ética en Investigación de la Institución.
Análisis estadísticoLas variables continuas son presentadas en media±desviación estándar y las variables categóricas en número y porcentaje. Se utilizó el test chi cuadrado para determinar si existían diferencias en relación al sexo entre los grupos. Para determinar la diferencia entre los promedios de las variables continuas entre sujetos con y sin SM, se aplicó la prueba t de student para datos independientes a aquellas variables que tuvieron una distribución normal, y la prueba U de Mann-Whitney para aquellas que tuvieron una distribución diferente a la normal (espesor de TAE, presión arterial sistólica y diastólica). Se realizó una matriz de correlación de Pearson, y además un análisis de regresión lineal simple y múltiple, tomando a la grasa epicárdica como variable dependiente, con el fin de determinar cual variable tenía más peso sobre ella. Para el análisis estadístico se utilizó el programa SPSS versión 15.0 para Windows y se consideró estadísticamente significativo cuando p≤0,05.
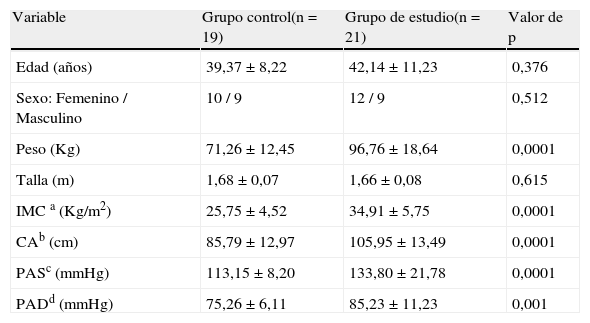
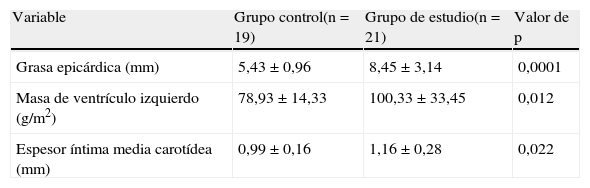
ResultadosEn la tabla 1 se presentan los datos antropométricos y clínicos de los participantes del grupo control y de estudio. Se observa que no hubo diferencias estadísticamente significativas en edad, sexo y talla entre ambos grupos. El peso, IMC, circunferencia abdominal (CA), presión arterial sistólica (PAS) y diastólica (PAD) fueron significativamente más altos (p=0,0001) en el grupo con SM.
Variables antropométricas y clínicas del grupo control y el grupo de estudio (pacientes con síndrome metabólico)
| Variable | Grupo control(n=19) | Grupo de estudio(n=21) | Valor de p |
| Edad (años) | 39,37±8,22 | 42,14±11,23 | 0,376 |
| Sexo: Femenino / Masculino | 10 / 9 | 12 / 9 | 0,512 |
| Peso (Kg) | 71,26±12,45 | 96,76±18,64 | 0,0001 |
| Talla (m) | 1,68±0,07 | 1,66±0,08 | 0,615 |
| IMC a (Kg/m2) | 25,75±4,52 | 34,91±5,75 | 0,0001 |
| CAb (cm) | 85,79±12,97 | 105,95±13,49 | 0,0001 |
| PASc (mmHg) | 113,15±8,20 | 133,80±21,78 | 0,0001 |
| PADd (mmHg) | 75,26±6,11 | 85,23±11,23 | 0,001 |
Los datos son presentados como la X±DE. Sexo en número.
aIMC: índice de masa corporal, b CA: circunferencia abdominal, c PAS: presión arterial sistólica, d PAD: presión arterial diastólica.
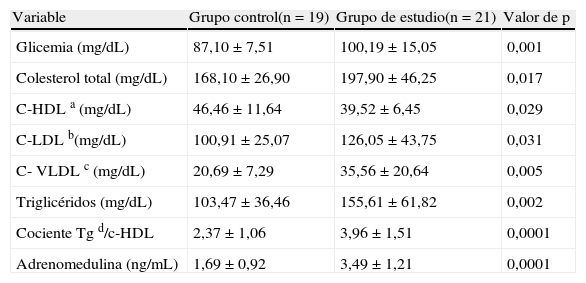
Por su parte, al comparar las variables bioquímicas entre los participantes (tabla 2), como era de esperar, el grupo de estudio presentó niveles plasmáticos significativamente más altos de glicemia (p=0,001), colesterol total (p=0,01), C-LDL (p=0,03), C-VLDL (p=0,005), triglicéridos p=0,002), cociente Tg/HDL (p=0,0001) y adrenomedulina (p=0,0001), y más bajos de C-HDL (p=0,02) comparado con el grupo control.
Variables bioquímicas del grupo control y el grupo de estudio (pacientes con síndrome metabólico)
| Variable | Grupo control(n=19) | Grupo de estudio(n=21) | Valor de p |
| Glicemia (mg/dL) | 87,10±7,51 | 100,19±15,05 | 0,001 |
| Colesterol total (mg/dL) | 168,10±26,90 | 197,90±46,25 | 0,017 |
| C-HDL a (mg/dL) | 46,46±11,64 | 39,52±6,45 | 0,029 |
| C-LDL b(mg/dL) | 100,91±25,07 | 126,05±43,75 | 0,031 |
| C- VLDL c (mg/dL) | 20,69±7,29 | 35,56±20,64 | 0,005 |
| Triglicéridos (mg/dL) | 103,47±36,46 | 155,61±61,82 | 0,002 |
| Cociente Tg d/c-HDL | 2,37±1,06 | 3,96±1,51 | 0,0001 |
| Adrenomedulina (ng/mL) | 1,69±0,92 | 3,49±1,21 | 0,0001 |
Los datos son presentados como la X±DE.
aC-HDL: lipoproteína de alta densidad, b C-LDL: lipoproteína de baja densidad, c C-VLDL: lipoproteína de muy baja densidad. Tg d: triglicéridos.
En la tabla 3 se presentan los datos ecocardiográficos de los participantes, donde se observa que tanto el espesor del TAE (p=0,0001), como la masa del ventrículo izquierdo (p=0,01) y el espesor íntima media carotídeo (p=0,02) fueron significativamente mayores en el grupo de estudio comparado con el grupo control.
Variables ecográficas del grupo control y el grupo de estudio (pacientes con síndrome metabólico)
| Variable | Grupo control(n=19) | Grupo de estudio(n=21) | Valor de p |
| Grasa epicárdica (mm) | 5,43±0,96 | 8,45±3,14 | 0,0001 |
| Masa de ventrículo izquierdo (g/m2) | 78,93±14,33 | 100,33±33,45 | 0,012 |
| Espesor íntima media carotídea (mm) | 0,99±0,16 | 1,16±0,28 | 0,022 |
Los datos son presentados como la X±DE.
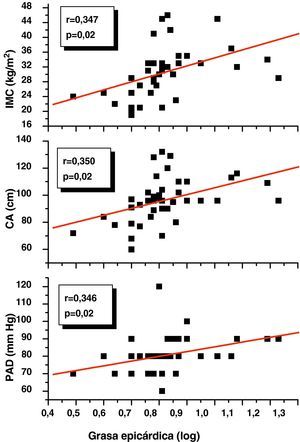
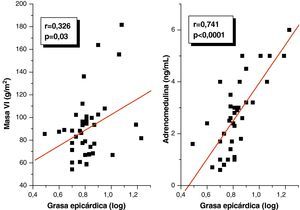
En el análisis de correlación de Pearson se encontró que la variable grasa epicárdica medida en mm, mostró una correlación positiva estadísticamente significativa con el IMC (r=0,347; p=0,02), la CA (r=0,350; p=0,02) y la PAD (r=0,346; p=0,02) (fig. 1). De igual forma, en la figura 2 se evidencia que el espesor del TAE mostró una correlación positiva estadísticamente muy significativa con los niveles plasmáticos de adrenomedulina (r=0,741; p=0,0001) y la masa del ventrículo izquierdo (r=0,326; p=0,03).
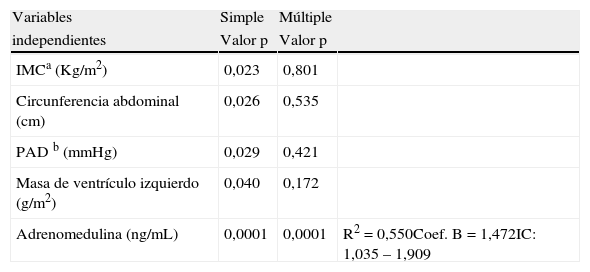
Se realizó el análisis de regresión lineal para determinar las variables explicativas del espesor del tejido adiposo epicárdico como variable dependiente en la muestra estudiada. En el análisis de regresión lineal simple, se encontró que fueron significativas el IMC, la CA, la PAD, la masa del ventrículo izquierdo y los niveles plasmáticos de adrenomedulina (tabla 4). En el análisis de regresión lineal múltiple se observó que las variables IMC, CA, PAD y masa de ventrículo izquierdo, perdieron su significancia estadística, mientras que la adrenomedulina plasmática continuó manteniendo la significancia (p=0,0001), quedando ésta como la variable explicativa del espesor del TAE, con un R cuadrado de 0,550, esto es, una explicación del 55% del valor del espesor del TAE.
Análisis de regresión lineal simple y múltiple de las variables relacionadas con la presentación de espesor de grasa epicárdica como variable dependiente
| Variables | Simple | Múltiple | |
| independientes | Valor p | Valor p | |
| IMCa (Kg/m2) | 0,023 | 0,801 | |
| Circunferencia abdominal (cm) | 0,026 | 0,535 | |
| PAD b (mmHg) | 0,029 | 0,421 | |
| Masa de ventrículo izquierdo (g/m2) | 0,040 | 0,172 | |
| Adrenomedulina (ng/mL) | 0,0001 | 0,0001 | R2=0,550Coef. B=1,472IC: 1,035 – 1,909 |
a IMC: índice de masa corporal, b PAD: presión arterial diastólica.
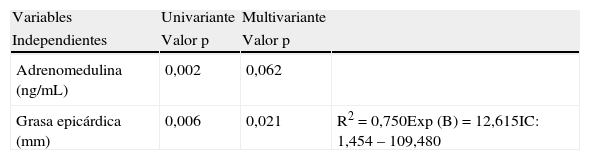
Se aplicó un análisis de regresión logística con la presencia o no de SM como variable dependiente y TAE y adrenomedulina como variables independientes, para averiguar cuál de ellas se asocia mejor con el SM, en la muestra estudiada. Cuando se realizó el análisis univariante, se encontró que fueron significativas tanto la adrenomedulina como el espesor de la grasa epicárdica (tabla 5). En el análisis de regresión multivariante se comprobó que la variable adrenomedulina perdió su significancia estadística, mientras que la variable grasa epicárdica continuó manteniendo la significancia (p=0,021), quedando ésta como la variable explicativa del SM, con un R cuadrado de 0,750, esto es una explicación del 75% de los casos y un Exp(B) u Odds Ratio de 12,615 y un intervalo de confianza de 1,454-109,480.
Análisis de regresión logística uni y multivariante de las variables adrenomedulina y grasa epicárdica con la presentación del síndrome metabólico como variable dependiente
| Variables | Univariante | Multivariante | |
| Independientes | Valor p | Valor p | |
| Adrenomedulina (ng/mL) | 0,002 | 0,062 | |
| Grasa epicárdica (mm) | 0,006 | 0,021 | R2=0,750Exp (B)=12,615IC: 1,454 – 109,480 |
Un cuerpo creciente de evidencia15 señala que la grasa visceral puede ser un predictor independiente de riesgo metabólico. Los estudios de imágenes han demostrado una mayor exactitud en la cuantificación del tejido adiposo en diferentes compartimientos corporales, en relación con índices antropométricos como la CA16. Particularmente, los procedimientos de ultrasonido constituyen excelentes métodos para la predicción de grasa visceral abdominal, con la ventaja de tener menor costo con respecto a las técnicas de resonancia magnética y tomografía axial computarizada13.
Nuestros resultados coinciden con lo señalado en otros estudios que muestran que la grasa epicárdica medida por ecocardiografía se relaciona con los componentes antropométricos y clínicos del SM9,10. De hecho, encontramos una buena correlación entre espesor del TAE y el IMC, CA y PAD, lo cual parece confirmar que la obesidad es un factor predisponente para el aumento del TAE17. Al respecto, resultan novedosas recientes investigaciones que han propuesto al TAE como blanco terapéutico de diferentes intervenciones en pacientes obesos, demostrando que el espesor de la grasa epicárdica disminuye en mayor medida y con más rapidez con programas de pérdida de peso en relación a otros parámetros antropométricos clásicos como el IMC y la CA18,19. Además, nuestros resultados muestran que la distribución de la grasa, y particularmente la grasa abdominal medida indirectamente por la CA, se correlaciona con el espesor del TAE, tal y como ha sido descrito por Iacobellis et al20, quienes demostraron que la grasa epicárdica se incrementa significativamente con el aumento de la CA (p=0,001), estableciendo además puntos de corte de grasa epicárdica para hombres y mujeres asociados con CA aumentada (≥9,5mm y ≥7,5mm, respectivamente).
Por otra parte, la buena correlación entre TAE y PAD puede ser explicada en el contexto del mecanismo fisiopatológico de resistencia insulínica. En tal sentido, se ha descrito, en modelos animales, que la tasa de liberación de ácidos grasos por el adipocito epicárdico es del doble respecto a la grasa perirenal, sugiriendo una alta actividad lipolítica, la cual probablemente se deba a varios mecanismos, entre ellos, el reducido efecto anti-lipolítico de la insulina en este tejido, y el aumento en la expresión de receptores β-adrenérgicos, especialmente receptores β-3, cuya estimulación pudiera activar la vía lipolítica6. Estas observaciones sugieren que el TAE es un tejido con alta resistencia insulínica, y la relación entre resistencia insulínica, adiposidad visceral e hipertensión arterial es bien conocida21.
En nuestro estudio se observó una buena correlación entre el espesor de TAE y la masa del ventrículo izquierdo, tal y como ha sido descrito por otros autores22,23. Iacobellis et al22 demostraron que la masa del ventrículo izquierdo se correlaciona con la cantidad de TAE, y esta correlación es independiente del IMC y la edad, pero al igual que en nuestro estudio, no se puede establecer una relación causa y efecto entre el TAE y la masa del ventrículo izquierdo, pero varios mecanismos pudieran explicar esta correlación. Es posible asumir que el incremento de la grasa visceral pudiera afectar de forma directa el gasto del ventrículo izquierdo y el volumen sistólico para perfundir la masa corporal incrementada, y además las propiedades bioquímicas del tejido adiposo visceral como alta tasa de liberación de ácidos grasos, actividad β adrenérgica y resistencia insulínica pudieran contribuir a la hipertrofia del ventrículo izquierdo 22. En tal sentido, al ser la grasa epicárdica un tejido con alta resistencia insulínica, pudiera favorecer la activación en la célula miocárdica de la vía de la proteinquinasa asociada a mitógenos (MAPK, del inglés mitogen-activated protein kinase) y adicionalmente la activación del sistema renina angiotensina, particularmente la angiotensina II, cuya acción sobre los receptores AT1 es capaz de producir proliferación celular miocárdica, y a nivel de la capa glomerular de la corteza suprarrenal, estimular la síntesis y secreción de aldosterona produciendo reabsorción de agua y sodio, expansión del volumen extracelular y por último hipertrofia del ventrículo izquierdo24–26; sin embargo, con la evidencia disponible en la actualidad no es posible explicar las razones por las cuales esta correlación se pierde en el sexo femenino.
Al realizar el análisis de regresión lineal múltiple se encuentra que la adrenomedulina plasmática fue la principal variable explicativa del espesor de la grasa epicárdica. En tal sentido, se ha descrito que los pre-adipocitos del tejido adiposo epicárdico sintetizan adrenomedulina, y que las células estromales cercanas a los adipocitos expresan los receptores para este péptido12. Resulta interesante, que Isumi et al27 han demostrado que la adrenomedulina puede actuar como un factor proliferante para pre-adipocitos, lo cual sugiere que en el TAE, la adrenomedulina pudiera regular a través de un mecanismo autocrino o paracrino la multiplicación de los pre-adipocitos, y por ende la masa grasa epicárdica. La relación inversa también es válida; la evidencia sugiere que en condiciones patológicas, en las cuales opera un aumento del espesor de TAE, este tejido actúa como fuente importante de adipocitoquinas pro-inflamatorias como TNF-α, el cual es capaz de inducir de forma paracrina la síntesis y secreción de adrenomedulina28,29. Por otra parte, al efectuar el análisis de regresión logística con la presencia de SM como variable dependiente, se encontró que el espesor del TAE estuvo mejor asociado a SM que la adrenomedulina, lo cual ratifica lo expuesto anteriormente, en referencia a la fuerte asociación que existe entre la medición ecocardiográfica de este tejido y los componentes del SM 9,10. El aumento en los niveles plasmáticos de adrenomedulina en pacientes con SM puede obedecer a la presencia en estos pacientes de hipertensión arterial, obesidad e hiperglicemia, situaciones en las cuales se ha demostrado un aumento posiblemente compensatorio de este péptido7,8.
Hasta donde tenemos conocimiento, no existen estudios previos donde se evaluara la asociación entre niveles plasmáticos de adrenomedulina y espesor del TAE en pacientes con SM; sin embargo, la relación entre ambas variables si se ha estudiado en pacientes con enfermedad arterial coronaria, encontrando resultados parcialmente contradictorios. Iacobellis et al30 describieron una disminución en la expresión de adrenomedulina por parte del TAE de pacientes con enfermedad arterial coronaria, mientras que Silaghi et al12 encontraron una mayor expresión de adrenomedulina por parte de este tejido en la misma situación clínica. Las razones para estas diferencias pudieran estar en que el grupo de pacientes estudiados por Iacobellis et al, era de mayor edad y más delgados que los estudiados por Silaghi et al, siendo plausible que la edad y la masa grasa interfieran en la expresión de esta adipocitoquina por parte del TAE.
Con base en nuestros resultados, se concluye que en este limitado grupo de pacientes, existe una asociación significativa entre espesor del TAE y niveles plasmáticos de adrenomedulina, los cuales podrían servir como marcador de SM. Serían necesarios más estudios, sobre todo prospectivos, para valorar si TAE y/o adrenomedulina se asocian a la aparición de enfermedad cardiovascular, y si aportan información adicional a los factores de riesgo clásicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.