Definir un punto de corte de espesor de tejido adiposo epicárdico (TAE) medido por ecocardiografía asociado con los componentes del síndrome metabólico (SM) en sujetos venezolanos.
MetodologíaSe seleccionaron 52sujetos de entre 20 y 65años con diagnóstico de SM según la Federación Internacional de Diabetes y 45controles, comparables en edad y sexo. Se midieron glucemia y lípidos plasmáticos. Se determinaron el espesor del TAE y la masa del ventrículo izquierdo mediante ecocardiografía.
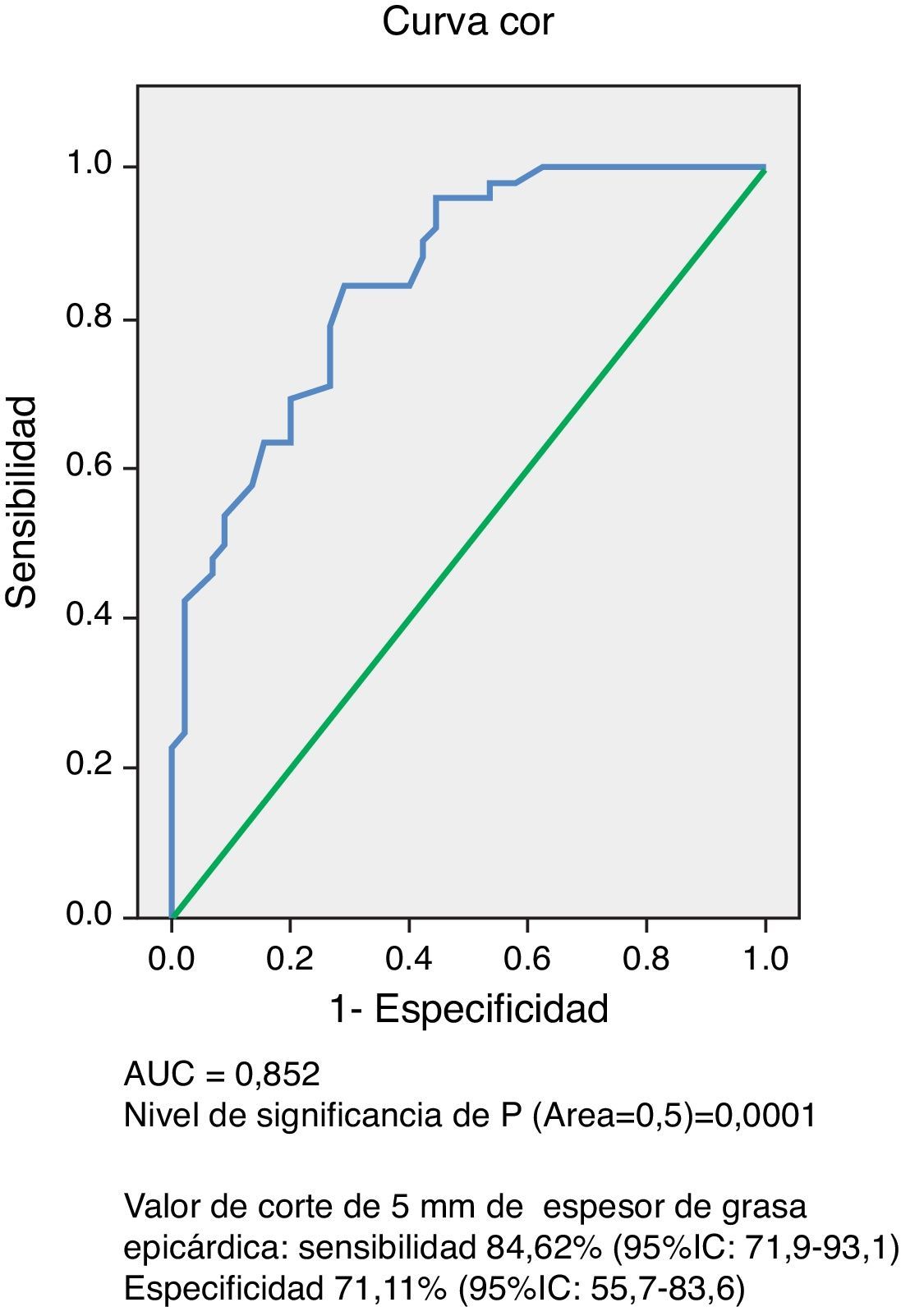
ResultadosNo hubo diferencias significativas en edad y sexo entre ambos grupos, y el peso, el índice de masa corporal, la circunferencia abdominal, la presión arterial sistólica y la diastólica fueron significativamente más altos (p=0,0001) en el grupo con SM. Este grupo presentó niveles significativamente más altos de glucemia en ayunas (p=0,0001), colesterol total (p=0,002), c-LDL (p=0,007), c-noHDL (p=0,0001), triglicéridos (p=0,0001), cociente triglicéridos/c-HDL (p=0,0001) y más bajos de c-HDL (p=0,0001) que el grupo control. El espesor del TAE (p=0,0001) y la masa del ventrículo izquierdo (p=0,017) fueron significativamente mayores en el grupo con SM. La curva operador receptor (COR) demostró un AUC de 0,852 (p=0,0001), con un poder del test de 0,99. El valor de 5mm de TAE mostró una sensibilidad del 84,62% (IC95%: 71,9-93,1) y una especificidad del 71,11% (IC95%: 55,7-83,6) para predecir SM. La odds ratio de presentar SM en esta población por tener un espesor de TAE ≥5mm fue de 8,25 (IC95%: 3,15-21,56; p=0,0001).
ConclusiónUn valor de TAE ≥5mm presenta una buena sensibilidad y especificidad para predecir SM en población venezolana.
To define an echocardiographically-assessed cut-off point for epicardial adipose tissue (EAT) thickness associated to metabolic syndrome (MS) components in Venezuelan subjects.
MethodsFifty-two subjects aged 20-65years diagnosed with MS according to International Diabetes Federation criteria and 45sex- and age-matched controls were selected. Blood glucose and plasma lipids were tested; EAT thickness and left ventricular mass were measured by echocardiography.
ResultsNo significant age and sex differences were found between the two groups. Body weight, body mass index, waist circumference, and systolic and diastolic blood pressure were significantly higher (P=.0001) in the MS group. This group showed significantly higher levels of fasting blood glucose (P=.0001), total cholesterol (P=.002), LDL-C (P=.007), non-HDL-C (P=.0001), triglycerides (P=.0001), Tg-HDL-C ratio (P=.0001), and lower HDL-C levels (P=.0001) as compared to the control group. EAT thickness (P=.0001) and left ventricular mass (P=.017) were significantly higher in the MS group. The ROC curve showed an AUC of 0.852 (P=.0001) with a power of the test of 0.99. A 5-mm EAT thickness showed a sensitivity of 84.62% (95%CI: 71.9-93.1) and a specificity of 71.11% (95%CI: 55.7-83.6) for predicting MS. The odds ratio of this population for experiencing MS due to an EAT ≥5mm was 8.25 (95%CI: 3.15-21.56; P=.0001).
ConclusionAn EAT value ≥5mm has good sensitivity and specificity for predicting MS in the Venezuelan population.
El tejido adiposo epicárdico (TAE) evoluciona del tejido adiposo pardo durante la embriogénesis, y en la edad adulta tiende a ubicarse en los surcos auriculoventricular e interventricular extendiéndose hacia el ápex1, sin que exista fascia o tejidos similares que separen la grasa epicárdica del miocardio e inclusive de los vasos coronarios, lo cual sugiere que existe una interacción importante entre estas estructuras1,2.
Este tejido tiene una serie de propiedades bioquímicas que lo diferencian de otros depósitos de grasa visceral. Entre ellas destacan su elevada tasa de captación y liberación de ácidos grasos libres, lo cual resulta de particular importancia, ya que el miocardio usa y metaboliza ácidos grasos mediante el proceso de β-oxidación, siendo este el responsable del 50-70% de la energía del músculo cardíaco3. Además, la expresión de proteína desacoplante 1 (UCP1, del inglés uncoupling protein 1) en el TAE es mayor que en otros depósitos de grasa, lo cual sugiere que este tejido podría servir para defender al miocardio y las arterias coronarias contra la hipotermia4; sin embargo, la propiedad que le confiere mayor interés clínico y científico es su capacidad de servir como fuente de adipocitoquinas, que pueden difundir a las arterias coronarias mediante un mecanismo de secreción paracrino o vasocrino con efectos beneficiosos o perjudiciales, dependiendo del contexto metabólico del paciente2.
En la actualidad no están claros los factores que modulan el perfil metabólico del TAE, pero se postula que un mecanismo dependiente de la masa de este tejido es el principal regulador de sus acciones endocrinas. Esta hipótesis ha encontrado mayor sustento en un metaanálisis que incluyó 2.872pacientes, en los cuales se demostró que el espesor y el volumen del TAE es mayor en sujetos con enfermedad arterial coronaria, y que los pacientes en el tercil más alto de TAE fueron más propensos a presentar enfermedad coronaria con respecto a aquellos en el tercil más bajo5.
De igual forma, un metaanálisis reciente que incluyó 2.027sujetos, de los cuales 1.030 tenían síndrome metabólico (SM), demostró que el espesor del TAE es significativamente mayor en pacientes con SM en comparación con sujetos control (diferencia estandarizada de las medias de 1,15mm, IC95%: 0,78-1,53; p=0,0001)6. El análisis de subgrupos mostró que esta diferencia es independiente de los criterios utilizados para definir SM, pero varía dependiendo del grupo étnico6. Al respecto, Iacobellis et al.7 describieron en una muestra de 246sujetos caucásicos de Europa que un valor de espesor de TAE≥9,5mm en hombres y 7,5mm en mujeres incrementa la sensibilidad y la especificidad para predecir SM. Este hallazgo destaca la importancia de la medición ecocardiográfica del TAE como marcador de adiposidad visceral y herramienta diagnóstica de creciente utilidad en la estratificación del riesgo cardiometabólico; sin embargo, debido a las diferencias raciales en la distribución del tejido adiposo visceral es necesario el estudio del TAE y su relación con el SM en cada población, por lo cual nos proponemos definir un punto de corte de espesor de TAE medido por ecocardiografía asociado con los componentes antropométricos, clínicos y bioquímicos del SM en sujetos venezolanos.
Material y métodosDiseño del estudio y sujetosEn base al objetivo propuesto se diseñó un estudio observacional, analítico, transversal, en el que se seleccionaron 52sujetos consecutivos, 31 de sexo femenino y 21 masculino, con un rango de 20 a 65años, los cuales cumplían con al menos 3 de los criterios diagnósticos de SM según la Federación Internacional de Diabetes (IDF)8: circunferencia abdominal (CA) ≥80cm en mujeres y ≥90cm en hombres, presión arterial ≥130/85mmHg, glucemia en ayunas ≥100mg/dl, niveles plasmáticos de triglicéridos ≥150mg/dl y colesterol ligado a lipoproteínas de alta densidad (c-HDL) <50mg/dl en mujeres y <40mg/dl en hombres. Estos sujetos se compararon con 45controles, 29 de sexo femenino y 16 de masculino, de edades similares, sin SM. Todos los sujetos estudiados eran de Venezuela, 39 de ellos procedentes de Ciudad Bolívar, ubicada en la región sur del país, y 58 de la ciudad de Mérida, localizada en los Andes venezolanos. Se excluyeron del estudio los sujetos con hiperlipidemias primarias y endocrinopatías tales como diabetes mellitus, hipotiroidismo, síndrome de Cushing, acromegalia, así como cualquier comorbilidad o ingestión de medicamentos (glucocorticoides, hipolipemiantes, metformina, anticonvulsivantes) capaces de afectar los parámetros metabólicos. Se destaca que este estudio fue aprobado por el Comité de Ética de cada institución y se realizó siguiendo los planteamientos propuestos por la Declaración de Helsinki. Todos los sujetos dieron su consentimiento por escrito para participar en el mismo.
Variables antropométricas y clínicasEl peso y la talla se obtuvieron con los sujetos en ayunas y vistiendo solo su ropa interior. El índice de masa corporal (IMC) se calculó como el peso dividido entre la talla al cuadrado. La CA se midió con los sujetos de pie, a nivel de una línea media entre el borde inferior de la última costilla y las crestas ilíacas, y se expresó en centímetros. La presión arterial se determinó en el brazo derecho, después de 10min de reposo en posición sentada, por método auscultatorio, con un tensiómetro de mercurio estándar.
Variables bioquímicasSe tomó una muestra de sangre de la vena antecubital en en ayuno no menor de 8h, para la determinación de glucemia y lípidos sanguíneos (colesterol total, triglicéridos y c-HDL), los cuales se obtuvieron por métodos enzimáticos con un autoanalizador Hitachi 911® y reactivos de la casa comercial Cienvar. El colesterol ligado a lipoproteínas de baja densidad (c-LDL) se estimó a través de la ecuación de Friedewald, donde c-LDL=colesterol total–[c-HDL+(triglicéridos/5)].
Variables ecocardiográficasA cada sujeto se le realizó un ecocardiograma transtorácico bidimensional (2D), utilizando para ello el equipo Vivid 7® (GE Healthcare, Wauwatosa, Estados Unidos) por técnica estándar con los pacientes en decúbito lateral izquierdo. Simultáneamente se registró un electrocardiograma en todos los sujetos. Para la medición del TAE se utilizó la técnica validada por Iacobellis et al.9. Los ecocardiogramas fueron interpretados por un cardiólogo ecocardiografista a fin de garantizar la validez de las mediciones.
Ecocardiográficamente, el TAE se identificó como el espacio ecolúcido entre la pared externa del miocardio y la capa visceral del pericardio. Este espesor se midió perpendicularmente sobre la pared libre del ventrículo derecho al final de la sístole en 3 ciclos cardíacos usando una vista en eje paraesternal largo o paraesternal corto. La medición se realizó sobre la pared libre del ventrículo derecho por 2 razones: a)este punto se reconoce anatómicamente como el de mayor espesor de grasa epicárdica, y b)los ejes paraesternal largo y paraesternal corto permiten las medidas más exactas de TAE sobre el ventrículo derecho, con una óptima orientación del cursor en cada vista10.
La masa del ventrículo izquierdo se determinó de igual forma en el eje paraesternal largo, mediante la fórmula anatómicamente validada de Devereux et al.11, y esta posteriormente se ajustó con la superficie corporal del paciente.
Análisis estadísticoLas variables continuas son presentadas en media±desviación estándar y las variables categóricas en número absoluto y porcentaje. Se utilizó la prueba chi cuadrado para determinar si existían diferencias en relación con el sexo entre los grupos. Para determinar la diferencia entre los promedios de las variables continuas entre sujetos con y sin SM, se aplicó la prueba t de Student para datos independientes a aquellas variables que tuvieron una distribución normal, y la prueba U de Mann-Whitney para las que tuvieron una distribución diferente a la normal.
Para obtener el punto de corte de espesor de TAE para predecir SM en esta población se construyó la curva operador receptor (COR); para ello, se clasificó a los sujetos en pacientes con y sin SM. Se consideró un área bajo la curva (AUC) óptima de1, mientras que un AUC menor de 0,5 se consideró un test con muy poca validez, y se calculó el poder del test para este tamaño de muestra. Se empleó el índice de Youden para determinar el punto de corte óptimo a partir de la curva COR, calculado a través de la fórmula IY=(sensibilidad+especificidad)−1. Se determinó el riesgo (odds ratio) de presentar SM con el valor de grasa epicárdica obtenido. Para los análisis estadísticos se utilizaron el programa SPSS versión 15.0 para Windows y el programa MedCalc versión 9.3.7.0. Se consideró estadísticamente significativo un valor de p≤0,05.
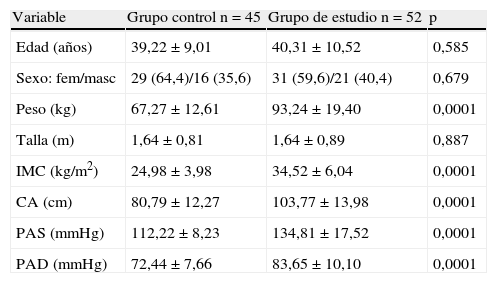
ResultadosEn la tabla 1 se presentan los datos antropométricos y clínicos de los participantes. El grupo control estuvo formado por 45sujetos, el 64,4% de sexo femenino y el 35,6%, masculino, con una edad promedio de 39,22±9,01años y un IMC de 24,98±3,98kg/m2. Por su parte, el grupo de estudio estuvo conformado por 52sujetos, el 59,6% de sexo femenino y el 40,4%, masculino, con una edad promedio de 40,31±10,52años y un IMC de 34,52±6,04kg/m2. Se observa que no hubo diferencias estadísticamente significativas en edad, sexo y talla entre ambos grupos, mientras que el peso, el IMC, la CA, la presión arterial sistólica (PAS) y la diastólica (PAD) fueron significativamente más altos (p=0,0001) en el grupo con SM.
Variables antropométricas y clínicas del grupo control y el grupo de estudio (pacientes con síndrome metabólico)
| Variable | Grupo control n=45 | Grupo de estudio n=52 | p |
| Edad (años) | 39,22±9,01 | 40,31±10,52 | 0,585 |
| Sexo: fem/masc | 29 (64,4)/16 (35,6) | 31 (59,6)/21 (40,4) | 0,679 |
| Peso (kg) | 67,27±12,61 | 93,24±19,40 | 0,0001 |
| Talla (m) | 1,64±0,81 | 1,64±0,89 | 0,887 |
| IMC (kg/m2) | 24,98±3,98 | 34,52±6,04 | 0,0001 |
| CA (cm) | 80,79±12,27 | 103,77±13,98 | 0,0001 |
| PAS (mmHg) | 112,22±8,23 | 134,81±17,52 | 0,0001 |
| PAD (mmHg) | 72,44±7,66 | 83,65±10,10 | 0,0001 |
CA: circunferencia abdominal; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Las variables continuas son presentadas como la X±DE, y las categóricas, como n (%).
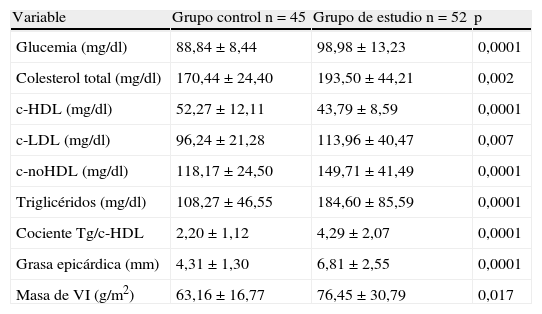
Al comparar las variables bioquímicas y ecocardiográficas entre los participantes (tabla 2), el grupo de estudio presentó, como era de esperar, niveles plasmáticos significativamente más altos de glucemia en ayunas (p=0,0001), colesterol total (p=0,002), c-LDL (p=0,007), c-noHDL (p=0,0001), triglicéridos (p=0,0001), cociente triglicéridos/c-HDL (p=0,0001), y más bajos de c-HDL (p=0,0001) comparado con el grupo control. De igual forma, el espesor del TAE (p=0,0001) y la masa del ventrículo izquierdo (p=0,017) fueron significativamente mayores en el grupo de sujetos con SM.
Variables bioquímicas y ecocardiográficas del grupo control y el grupo de estudio (pacientes con síndrome metabólico)
| Variable | Grupo control n=45 | Grupo de estudio n=52 | p |
| Glucemia (mg/dl) | 88,84±8,44 | 98,98±13,23 | 0,0001 |
| Colesterol total (mg/dl) | 170,44±24,40 | 193,50±44,21 | 0,002 |
| c-HDL (mg/dl) | 52,27±12,11 | 43,79±8,59 | 0,0001 |
| c-LDL (mg/dl) | 96,24±21,28 | 113,96±40,47 | 0,007 |
| c-noHDL (mg/dl) | 118,17±24,50 | 149,71±41,49 | 0,0001 |
| Triglicéridos (mg/dl) | 108,27±46,55 | 184,60±85,59 | 0,0001 |
| Cociente Tg/c-HDL | 2,20±1,12 | 4,29±2,07 | 0,0001 |
| Grasa epicárdica (mm) | 4,31±1,30 | 6,81±2,55 | 0,0001 |
| Masa de VI (g/m2) | 63,16±16,77 | 76,45±30,79 | 0,017 |
c-HDL: colesterol ligado a lipoproteínas de alta densidad; c-LDL: colesterol ligado a lipoproteínas de baja densidad; Tg: triglicéridos; VI: ventrículo izquierdo.
Las variables continuas son presentadas como la X±DE.
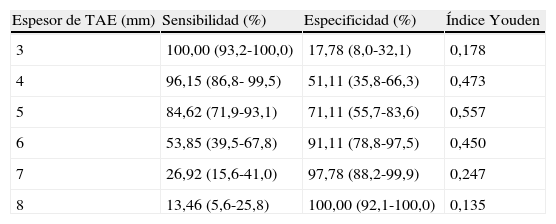
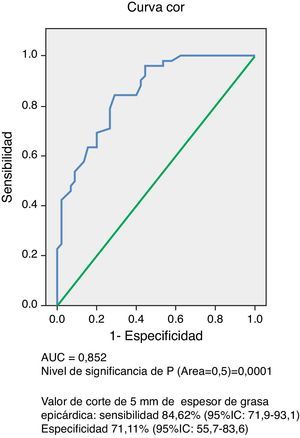
El análisis de la curva COR (fig. 1) demostró un AUC de 0,852 (p=0,0001), lo cual indica una muy buena precisión de la prueba. El poder del test para un error alfa de 0,05, un intervalo de confianza del 95% y esta muestra conformada por 45 sujetos control y 52 con SM, fue de 0,99. En la tabla 3 se resumen la sensibilidad y la especificidad de diferentes valores de espesor de TAE medido para predecir SM, siendo el valor de corte de 5mm el que obtuvo mayor índice de Youden, con una sensibilidad del 84,62% (IC95%: 71,9-93,1) y una especificidad del 71,11% (IC95%: 55,7-83,6) para predecir SM en esta población de hombres y mujeres venezolanos.
Sensibilidad y especificidad de diferentes valores de espesor de tejido adiposo epicárdico (TAE) medido por ecocardiografía para predecir síndrome metabólico basado en el análisis de la curva operador receptor
| Espesor de TAE (mm) | Sensibilidad (%) | Especificidad (%) | Índice Youden |
| 3 | 100,00 (93,2-100,0) | 17,78 (8,0-32,1) | 0,178 |
| 4 | 96,15 (86,8- 99,5) | 51,11 (35,8-66,3) | 0,473 |
| 5 | 84,62 (71,9-93,1) | 71,11 (55,7-83,6) | 0,557 |
| 6 | 53,85 (39,5-67,8) | 91,11 (78,8-97,5) | 0,450 |
| 7 | 26,92 (15,6-41,0) | 97,78 (88,2-99,9) | 0,247 |
| 8 | 13,46 (5,6-25,8) | 100,00 (92,1-100,0) | 0,135 |
Datos en porcentaje (IC 95%).
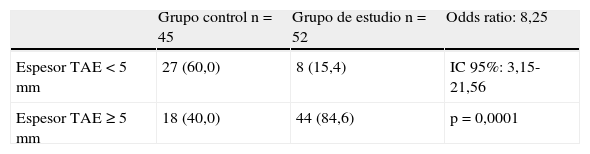
En la tabla 4 se muestra la distribución de los sujetos del grupo control y del grupo de estudio según el espesor de TAE; la mayoría de los pacientes con SM, el 84,6% (44 pacientes), presentaron un espesor ≥5mm, y la mayoría de los controles, el 60% (27 sujetos), tuvieron un espesor <5mm. El riesgo (odds ratio) de presentar SM en esta población por tener un espesor de TAE ≥5mm fue de 8,25, con un intervalo de confianza del 95% de 3,15-21,56 y p=0,0001.
Distribución de los sujetos del grupo control y del grupo de estudio, según el espesor del tejido adiposo epicárdico (TAE<5mm o ≥5mm)
| Grupo control n=45 | Grupo de estudio n=52 | Odds ratio: 8,25 | |
| Espesor TAE <5mm | 27 (60,0) | 8 (15,4) | IC95%: 3,15-21,56 |
| Espesor TAE ≥5mm | 18 (40,0) | 44 (84,6) | p=0,0001 |
Datos en n (%).
En nuestro país no existen estudios previos que definan puntos de corte de espesor de TAE asociados con los factores de riesgo antropométricos, clínicos y bioquímicos del SM. Los resultados de este estudio sugieren que un espesor de TAE≥5mm se asocia con riesgo de presentar SM. Previamente, este mismo valor de corte se ha asociado en otra población con cambios cardiovasculares tanto morfológicos como funcionales que incluyen agrandamiento de la aurícula izquierda, aumento de la masa del ventrículo izquierdo, disfunción diastólica y menor fracción de eyección12.
Nuestros resultados difieren de los descritos por Iacobellis et al.7, quienes encontraron en sujetos caucásicos que un valor de corte de TAE de 9,5mm y 7,5mm incrementa la sensibilidad y la especificidad para predecir SM en hombres y mujeres, respectivamente. Estas diferencias son consistentes con los hallazgos de Pierdomenico et al.6, quienes demostraron que la diferencia en espesor de TAE entre sujetos con y sin SM varía según el grupo étnico, siendo esta significativamente mayor en sujetos caucásicos, seguido de los hispanos, turcos y asiáticos. De igual forma, Alexopoulos et al.13 encontraron diferencias significativas en el volumen de grasa epicárdica cuantificada mediante tomografía computarizada entre caucásicos (96±44ml) e hispanos (54±17ml). Las razones para estas diferencias se desconocen, pero posiblemente obedezcan a variabilidades raciales en la cantidad y la distribución del tejido adiposo visceral, tal como ha sido reportado previamente en algunos grupos étnicos14.
Recientemente, Cabrera-Rego et al.15 encontraron en la población cubana que un valor de corte de grasa epicárdica ≥4,9mm presenta una sensibilidad del 85% y una especificidad del 75% para predecir resistencia a la insulina (índice HOMA-IR≥2,6). Estos resultados son similares a los obtenidos en nuestro estudio y posiblemente ello se deba a que la población cubana pertenece al mismo grupo étnico que la venezolana (hispanos); sin embargo, es necesario destacar que los estudios no son totalmente comparables, ya que no todos los sujetos con SM presentan resistencia a la insulina. Además, Reaven16 establece un marcado contraste entre los términos, ya que la resistencia a la insulina no identifica un diagnóstico clínico en particular, sino que constituye la expresión bioquímica de un fenómeno fisiopatológico que incrementa el riesgo de presentar enfermedades tan diversas como hipertensión esencial, síndrome de ovario poliquístico, apnea obstructiva del sueño e incluso ciertas formas de cáncer, mientras que el SM se considera una herramienta diagnóstica más que un concepto fisiopatológico, y tiene como finalidad identificar a un conjunto de individuos (algunos de ellos insulinorresistentes) con elevado riesgo cardiovascular.
Se destaca que se han definido valores de corte de grasa epicárdica asociados a otras patologías. Ahn et al.17 demostraron que un espesor de TAE≥3,0mm se asoció independientemente con la presencia de enfermedad arterial coronaria tanto en hombres como en mujeres de Corea, y de igual forma Natale et al.18 describieron que un espesor de TAE≥7,0mm se asoció con la presencia de aterosclerosis subclínica tanto en hombres como en mujeres de Europa. Más aún, un menor espesor de TAE (4,5mm) demostró una buena sensibilidad y especificidad para detectar baja reserva de flujo coronario en mujeres turcas19, mientras que un espesor de grasa epicárdica ≥6,5mm predijo la aparición de una respuesta hipertensora en sujetos normotensos sometidos a prueba de esfuerzo en la misma población20.
Por otra parte, Iacobellis et al.21 han demostrado que los sujetos obesos presentan mayor masa del ventrículo izquierdo que los sujetos normales. Este hallazgo, observado también en nuestro estudio, posiblemente sea debido a una respuesta adaptativa del ventrículo izquierdo al depósito difuso de grasa en sujetos con SM. Además, se ha demostrado previamente en sujetos de Ciudad Bolívar que existe una correlación significativa entre el espesor del TAE y la masa del ventrículo izquierdo22. Varios mecanismos podrían explicar esta asociación, entre ellos: a)el TAE en cantidades excesivas constituye una carga para el corazón, lo cual podría conllevar a remodelado cardíaco compensatorio12; b)el incremento en el TAE se asocia con un mayor contenido lipídico intramiocárdico y, por ende, con esteatosis miocárdica y lipotoxicidad, que podrían provocar adaptaciones estructurales y funcionales adversas incluyendo cardiomiopatía23,24, y c)el TAE puede afectar la morfología cardíaca a través del efecto tanto local como sistémico de las adipocitoquinas que sintetiza, ya que algunas de ellas son capaces de inducir remodelado cardíaco2,25. Además, a nivel sistémico el TAE podría producir resistencia a la insulina, la cual serviría como intermediario entre la grasa visceral y la hipertrofia del ventrículo izquierdo a través de la acción mitogénica directa de la insulina en la célula miocárdica, la activación del sistema nervioso simpático y el sistema renina-angiotensina26.
La medición de la CA ciertamente constituye el marcador más práctico y económico de grasa visceral; con todo, esta medida puede sobrevalorar el riesgo individual de cada sujeto, ya que incluye el tejido adiposo subcutáneo, el cual no se asocia con mayor riesgo cardiometabólico27, mientras que la medición ecocardiográfica del TAE constituye una medida objetiva y no invasiva de un depósito de grasa visceral que, además, ha demostrado reflejar el contenido de grasa visceral intraabdominal independientemente del grado de obesidad y de la edad28. Además, la medición del TAE se ha abierto campo no solo como herramienta diagnóstica sino también como blanco terapéutico de diferentes intervenciones29-31, y dado que los estudios ecocardiográficos son realizados de rutina en sujetos con riesgo cardiovascular, la medición del TAE puede ser llevada a cabo sin ningún costo adicional, ya que no requiere preparación especial y es realizada en las vistas ecocardiográficas (paraesternal largo o paraesternal corto) utilizadas para la determinación de otros parámetros cardíacos tradicionales.
En este estudio todas las mediciones ecocardiográficas del TAE fueron realizadas por un solo observador, pero la mayoría de los estudios clínicos han demostrado una excelente concordancia interobservador (rango de 0,90-0,98), lo cual indica una buena reproducibilidad y confiabilidad de la técnica7,18,32. A pesar de ello, existe la limitante de que la medición ecocardiográfica del TAE constituye solo una medida lineal en una única localización y, por tanto, podría no reflejar el volumen total de la grasa epicárdica, para lo cual serían necesarias otras técnicas de imagen, como la tomografía computarizada o la resonancia magnética.
En conclusión, el principal aporte de este estudio es que provee herramientas útiles para predecir SM en la población venezolana a través de la medición ecocardiográfica del TAE; sin embargo, se requieren estudios prospectivos que permitan evaluar la aparición de episodios cardiovasculares en los sujetos con un espesor ≥5mm.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.