Comparar las concentraciones de lípidos y lipoproteínas entre mujeres obesas y no obesas con diagnostico de síndrome del ovario poliquístico (SOPQ) tratadas con metformina durante 6 meses.
MétodosSe seleccionaron 65 mujeres con diagnóstico de SOPQ. Se analizaron la presencia de obesidad, concentraciones séricas de colesterol, triglicéridos, colesterol unido a lipoproteínas de alta densidad (HDL) y colesterol unido a lipoproteínas de baja densidad (LDL) antes y después de 6 meses de tratamiento con metformina. Las mujeres se dividieron en dos grupos: 34 mujeres obesas (grupo A; índice de masa corporal >27kg/m2) y 31 mujeres no obesas (grupo B; índice de masa corporal <27kg/m2).
ResultadosLas mujeres del grupo A mostraron diferencias estadísticamente significativas en el índice de masa corporal, relación cintura cadera, colesterol, triglicéridos, LDL y HDL comparado con el grupo B (p<0,05). En las mujeres obesas se observaron reducciones significativas en las concentraciones séricas de triglicéridos y LDL (p<0,05), mientras que las concentraciones séricas de HDL aumentaron igualmente en forma significativa (p<0,05) después de 6 meses de tratamiento con metformina. En las mujeres no obesas ninguna de estas modificaciones en el perfil lipídico fueron consideradas estadísticamente significativas (p=ns).
ConclusiónEl uso de metformina durante 6 meses produce modificaciones en las concentraciones de triglicéridos, LDL y HDL comparado con los valores iniciales en mujeres obesas con SOPQ mientras que las mujeres no obesas no presentaron modificaciones significativas en las concentraciones de lípidos y lipoproteínas.
To compare lipid and lipoprotein concentrations between obese and non-obese women with a diagnosis of polycystic ovary syndrome (PCOS) treated with metformin for 6 months.
MethodsSixty-five women with a diagnosis of PCOS were included. The presence of obesity, serum concentrations of cholesterol, triglycerides, high-density lipoprotein cholesterol (HDL-c) and low-density lipoprotein cholesterol (LDL-c) were recorded before and after 6 months of metformin treatment. The women were divided in two groups of 34 obese women (group A; body mass index >27kg/m2) and 31 non-obese women (group B; body mass index (<27kg/m2).
ResultsSignificant differences in body mass index, waist-hip ratio, cholesterol, triglycerides, LDL-c and HDL-c were found in group A compared with group B (p<0.05). In obese women, serum triglyceride and LDL-c concentrations were significantly reduced (p<0.05), while serum concentrations of HDL-c were significantly increased (p<0.05) after 6 months of treatment. In non-obese women, none of these lipid profile modifications were considered significant (p=ns).
ConclusionMetformin use for 6 months modified triglyceride, LDL-c and HDL-c concentrations compared with initial values in obese women with PCOS while no significant modifications in lipid or lipoprotein concentrations were observed in non-obese women.
El síndrome del ovario poliquístico (SOPQ) es una condición heterogénea caracterizada por anovulación crónica y hiperandrogenismo. Generalmente esta asociado con resistencia a la insulina e hiperinsulinemia, especialmente en mujeres obesas1,2. La alteración de la sensibilidad a la insulina en el síndrome ha demostrado estar íntimamente relacionada con el incremento de grasa abdominal, independientemente del índice de masa corporal3.
Las anomalías metabólicas y las secuelas del SOPQ son similares a las del síndrome metabólico4. Las mujeres con SOPQ son obesas, generalmente debido a la acumulación excesiva de grasa central2,5. Existen complicaciones a largo plazo que podrían incluir un incremento en el riesgo de diabetes mellitus tipo 2, aterosclerosis, enfermedad cardiaca coronaria e infarto del miocardio6–9.
La hiperinsulinemia crónica conduce al aumento de la esteroidogénesis de andrógenos ováricos, y a la disminución de globulina fijadora de hormonas sexuales con el aumento de la testosterona libre10. El hiperandrogenismo promueve la foliculogénesis y un desarrollo endometrial anormal. Numerosas investigaciones asocian a la hiperinsulinemia, no solo como la causa del trastorno ovulatorio, sino como un factor de mal pronóstico y de riesgo para dislipidemia, trombosis, diabetes y cáncer de endometrio, vinculándolo también con un aumento del porcentaje de abortos en los embarazos de las mujeres con SOPQ5,8.
Las mujeres con SOPQ tienen un perfil aterogénico caracterizado por bajas concentraciones de HDL y altas concentraciones de triglicéridos y LDL comparado con mujeres de su misma edad4,7,10,11. Además, la presencia de obesidad abdominal, insulinoresistencia y dislipidemia predispone a enfermedades cardiovasculares5.
Los nuevos hallazgos en la relación de insulinoresistencia, hiperinsulinemia compensatoria y desarrollo de ovarios poliquísticos llevó al uso de insulinomiméticos, agentes sensibilizadores a la insulina. La metformina, una biguanida antihiperglicémica, ha sido utilizada durante décadas en el tratamiento de la diabetes mellitus tipo 212,13. En los pacientes diabéticos, el tratamiento con metformina ha demostrado tener efectos benéficos sobre las concentraciones de lípidos circulantes, disminuyendo las concentraciones de triglicéridos plasmáticos y el LDL, y al mismo tiempo aumentando las concentraciones de HDL y la relación HDL-LDL, de forma independiente a las modificaciones en el perfil glicémico14. Otras de sus acciones incluyen la inhibición de la producción de glucosa hepática y un incremento de la sensibilidad periférica a la insulina13. Sin embargo, existen pocos estudios con relación específica a los efectos del tratamiento con metformina en mujeres obesas y no obesas con SOPQ.
El objetivo de la investigación fue comparar el perfil lipídico entre mujeres obesas y no obesas con diagnóstico de SOPQ tratadas con metformina durante 6 meses.
Material y métodosEntre septiembre 2006–septiembre 2009, se incluyeron en el estudio 65 mujeres que asistieron a la consulta de Medicina Interna, Endocrinología y Ginecología del Hospital Central «Dr. Urquinaona» con diagnóstico de SOPQ. El comité de ética del hospital aprobó el estudio y se obtuvo consentimiento por escrito de todas las pacientes.
El diagnóstico de SOPQ se confirmó por los siguientes criterios: evidencia de oligo anovulación (menos de 6 periodos menstruales en el año previo), signos clínicos o bioquímicos de hiperandrogenismo (concentraciones de testosterona plasmática por encima del límite superior normal y relación LH (lutoprina): FSH (folitropina) anormal >2) y ovarios normales o aumentados de tamaño (>10ml) con la presencia de microquistes subcapsulares (en número de 12 o más) de 2–9 milímetros de diámetro en la evaluación ecográfica12,13. Se excluyeron las mujeres con enfermedad tiroidea o suprarrenal, presencia de hiperprolactinemia, aquellas mujeres que no aceptaron a participar en el estudio o que no asistieron a las consultas de seguimiento del tratamiento.
Se seleccionaron 34 mujeres (grupo A) con SOPQ obesas (índice de masa corporal >27kg/m2) y 31 mujeres (grupo B) con SOPQ y no obesas (índice de masa corporal <27kg/m2). Las mujeres recibieron metformina a una dosis de 500mg 2 veces al día los primeros 3 meses y luego se incrementó a 1.000mg 2 veces al día los 3 meses siguientes. Se solicitó a las pacientes que no realizaran modificaciones en su dieta y actividad física y que las realizaran en forma similar a antes del inicio del estudio.
La evaluación Doppler se realizó con un ecógrafo Doppler color Logiq Pro 3 Marca General Electric® usando un transductor abdominal convexo de de 3,5MHz. Y un transductor vaginal de 5MHz.
Se midió la circunferencia de la cintura y la cadera en la región más estrecha del abdomen y en la parte más ancha de la región glútea, respectivamente. Las muestras de sangre venosa se tomaron después de un ayuno de 12h; se extrajo una muestra de la vena antecubital en la primera semana posterior a la menstruación espontánea o inducida, antes del inicio del tratamiento y a los 6 meses después. Todas las muestras se manejaron de forma similar y se almacenaron a 2–8°C en las siguientes 72h.
Las concentraciones de FSH, LH y testosterona se midieron por radioinmunoensayo y quimioluminiscencia usando kits comerciales (Immulite 2000, Diagnostic Product Corp, USA). Los coeficientes de variación intra e inter ensayo fueron de 4 y 7% para FSH, 6 y 7% para LH y 4 y 7% para testosterona, respectivamente.
El colesterol total y los triglicéridos se midieron usando métodos enzimáticos automáticos (COBAS® Integra Colesterol y COBAS® Integra tryglicerides) en un analizador Roche/Hitachi 74. Las HDL se determinaron después de precipitación selectiva usando manganeso heparina y posterior determinación enzimática de colesterol. Las lipoproteínas de baja densidad se calcularon usando la fórmula de Friedwald (LDL=colesterol-HDL–(triglicéridos/5)).
Se utilizó la prueba exacta de Fischer (datos cualitativos) y la prueba t de Student para muestras relacionadas (datos cuantitativos) para comparar las diferentes variables entre los grupos y para estudiar los cambios clínicos y metabólicos producidos por la metformina en los diferentes grupos de estudio. Se consideró una p<0,05 como estadísticamente significativa.
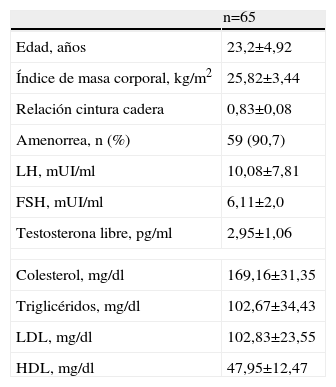
ResultadosSe seleccionaron un total de 65 mujeres cuyas características generales se muestran en la tabla 1. La edad promedio de las mujeres fue de 23,2±4,92 años, el índice de masa corporal promedio de 25,82±3,44kg/m2 y la relación cintura cadera de 0,83±0,08. La amenorrea estaba presente en 59 mujeres (90,7%).
Parámetros clínicos y de laboratorio de las pacientes con ovarios poliquísticos
| n=65 | |
| Edad, años | 23,2±4,92 |
| Índice de masa corporal, kg/m2 | 25,82±3,44 |
| Relación cintura cadera | 0,83±0,08 |
| Amenorrea, n (%) | 59 (90,7) |
| LH, mUI/ml | 10,08±7,81 |
| FSH, mUI/ml | 6,11±2,0 |
| Testosterona libre, pg/ml | 2,95±1,06 |
| Colesterol, mg/dl | 169,16±31,35 |
| Triglicéridos, mg/dl | 102,67±34,43 |
| LDL, mg/dl | 102,83±23,55 |
| HDL, mg/dl | 47,95±12,47 |
FSH: folitropina; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; LH: lutotropina.
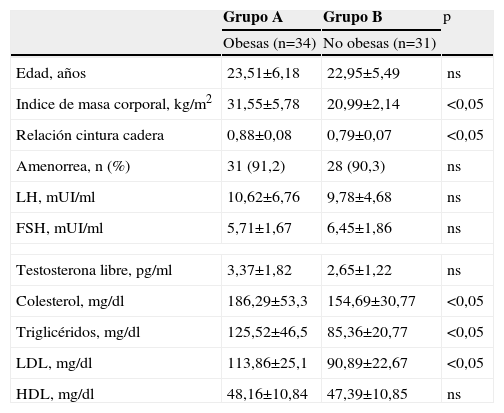
Posteriormente las mujeres fueron divididas según el índice de masa corporal (>o<27kg/m2) en dos grupos (tabla 2): grupo A, obesas (n=34) y grupo B no obesas (n=31). Las mujeres obesas mostraron diferencias significativas respecto a las no obesas en el índice de masa corporal (31,55±5,78kg/m2 comparado con 20,99±2,14kg/m2; p<0,05), relación cintura cadera (0,88±0,08 comparado con 0,79±0,07; p<0,05), colesterol (186,29±53,3mg/dl comparado con 154,69±30,77mg/dl; p<0,05), triglicéridos (125,52±46,5mg/dl comparado con 85,36±20,77mg/dl; p<0,05), LDL (113,86±25,1mg/dl comparado con 90,89±22,67; p<0,05) y HDL (48,16±10,84mg/dl comparado con 47,39±10,85mg/dl; p<0,05).
Parámetros clínicos y de laboratorio en pacientes obesas y no obesas con síndrome de ovarios poliquísticos
| Grupo A | Grupo B | p | |
| Obesas (n=34) | No obesas (n=31) | ||
| Edad, años | 23,51±6,18 | 22,95±5,49 | ns |
| Indice de masa corporal, kg/m2 | 31,55±5,78 | 20,99±2,14 | <0,05 |
| Relación cintura cadera | 0,88±0,08 | 0,79±0,07 | <0,05 |
| Amenorrea, n (%) | 31 (91,2) | 28 (90,3) | ns |
| LH, mUI/ml | 10,62±6,76 | 9,78±4,68 | ns |
| FSH, mUI/ml | 5,71±1,67 | 6,45±1,86 | ns |
| Testosterona libre, pg/ml | 3,37±1,82 | 2,65±1,22 | ns |
| Colesterol, mg/dl | 186,29±53,3 | 154,69±30,77 | <0,05 |
| Triglicéridos, mg/dl | 125,52±46,5 | 85,36±20,77 | <0,05 |
| LDL, mg/dl | 113,86±25,1 | 90,89±22,67 | <0,05 |
| HDL, mg/dl | 48,16±10,84 | 47,39±10,85 | ns |
FSH: folitropina; HDL: lipoproteínas de alta densidad.; LDL: lipoproteínas de baja densidad; LH: lutotropina.
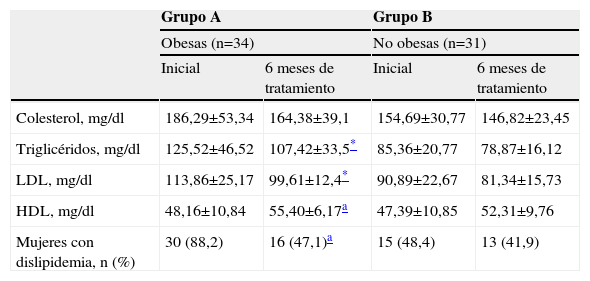
En la tabla 3 se muestran las modificaciones en el perfil lipídico de las mujeres obesas y no obesas con SOPQ después de 6 meses de tratamiento con metformina. En las mujeres obesas se observaron reducciones significativas en las concentraciones séricas de triglicéridos (–14,4%; p<0,05) y LDL (–12,5%; p<0,05), mientras que las concentraciones séricas de HDL aumentaron igualmente en forma significativa (+13,1%; p<0,05). Aunque se observó una disminución de las concentraciones de colesterol (alrededor de –11,8%), esta disminución no fue considerada estadísticamente significativa (p=ns).
Perfil lipídico en pacientes obesas y no obesas con síndrome de ovarios poliquísticos antes y después de 6 meses de tratamiento con metformin
| Grupo A | Grupo B | |||
| Obesas (n=34) | No obesas (n=31) | |||
| Inicial | 6 meses de tratamiento | Inicial | 6 meses de tratamiento | |
| Colesterol, mg/dl | 186,29±53,34 | 164,38±39,1 | 154,69±30,77 | 146,82±23,45 |
| Triglicéridos, mg/dl | 125,52±46,52 | 107,42±33,5* | 85,36±20,77 | 78,87±16,12 |
| LDL, mg/dl | 113,86±25,17 | 99,61±12,4* | 90,89±22,67 | 81,34±15,73 |
| HDL, mg/dl | 48,16±10,84 | 55,40±6,17a | 47,39±10,85 | 52,31±9,76 |
| Mujeres con dislipidemia, n (%) | 30 (88,2) | 16 (47,1)a | 15 (48,4) | 13 (41,9) |
HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad.
Con respecto a las mujeres no obesas con SOPQ, se encontraron disminuciones en las concentraciones de colesterol (–5,1%), triglicéridos (–7,6%) y LDL (–10,5%). También se observó un aumento en las concentraciones de HDL (+10,4%). Ninguna de estas modificaciones en el perfil lipídico fue considerada estadísticamente significativa (p=ns).
En la tabla 3 también se muestran el número de mujeres con dislipidemia. Se observó que antes del tratamiento 30 de las mujeres obesas (88,2%) presentaron dislipidemia al inicio del estudio y 16 de ellas (47,1%) continuaban con alteraciones del perfil lipídico después de 6 meses de tratamiento. Esta diferencia fue estadísticamente significativa (p<0,05). Entre tanto en el grupo de mujeres no obesas, 15 de ellas (48,4%) presentaron dislipidemia y 13 mujeres (41,9%) aún presentaban dislipidemia después del tratamiento con metformina.
DiscusiónLos resultados de la investigación demuestran que el uso de metformina produce modificaciones significativas en las concentraciones de colesterol, triglicéridos, LDL y HDL en mujeres obesas con SOPQ, sin producir cambios significativos en las mujeres no obesas.
Investigaciones recientes han demostrado que el SOPQ no es solo una condición ginecológica que afecta a las mujeres en edad reproductiva, sino también un amplio síndrome con una variedad de desordenes metabólicos asociados como la resistencia a la insulina y la hiperlipidemia5,7,15. Mientras que el mecanismo que lleva al desarrollo del síndrome es aún desconocido, se ha vuelto aparente que la resistencia a la insulina y la hiperlipidemia pueden jugar un papel importante en la fisiopatología15. Aunque la resistencia a la insulina esta asociada con la obesidad, la hiperinsulinemia y la resistencia a la insulina no están claramente relacionadas con la obesidad en el SOPQ, pero una gran mayoría de mujeres presentan resistencia a la insulina como una característica etiopatogénica inherente al síndrome la cual se ve potenciada claramente por la presencia de obesidad16.
La dislipidemia puede contribuir al incremento del riesgo cardiovascular en mujeres con el síndrome. Los resultados de esta investigación demuestran altas concentraciones de colesterol, triglicéridos y LDL y bajas concentraciones de HDL. Las bajas concentraciones de HDL son un factor de riesgo para enfermedad cardiovascular4. Específicamente, las modificaciones observadas en el perfil lipídico son las más frecuentemente reportadas en los sujetos obesos comparados con los no obesos1,4. En esta investigación se encontraron valores aumentados de colesterol, triglicéridos y LDL en las mujeres obesas con SOPQ comparado con las mujeres no obesas con el síndrome. Se ha sugerido que la obesidad esta generalmente asociada con perfiles lípidicos mas aterogénicos en mujeres con ovarios poliquísticos4,7.
Además, los hallazgos de concentraciones séricas elevadas de colesterol, triglicéridos y LDL se correlacionan significativamente con indicadores bien conocidos de resistencia a la insulina (por ejemplo, con el índice de masa corporal y la relación cintura/cadera), fortaleciendo el concepto que la obesidad (generalmente obesidad abdominal) y la resistencia a la insulina son los principales contribuyentes en el desarrollo de las alteraciones metabólicas y lipídicas en el SOPQ4.
La relación entre resistencia a la insulina, hiperinsulinemia compensatoria, obesidad y dislipidemia es compleja. Mientras que todas las características están estrechamente interrelacionadas, la identificación de la relación causa efecto es excesivamente difícil. Existen pocas dudas de que la obesidad sola induce o empeora la resistencia a la insulina y la hiperinsulinemia compensatoria; sin embargo, también existe evidencia de que la resistencia a la insulina/hiperinsulinemia es explicada exclusivamente sobre la base del índice de masa corporal3,11. Mientras que la obesidad y la hiperinsulinemia están relacionadas, ambas condiciones puede contribuir de manera independiente al desarrollo del perfil lipídico alterado15. Además, las alteraciones en los perfiles lípidicos en las mujeres con SOPQ no son explicadas exclusivamente por la obesidad17. De forma similar, entre los sujetos con enfermedad cardiaca coronaria, la resistencia a la insulina es independiente a la obesidad18. Es conocido que la metformina disminuye las concentraciones de insulina lo que puede jugar un papel importante en la mejoría del perfil lipídico.
La metformina ha sido efectiva en la mejoría de varios parámetros del perfil lipídico en pacientes diabéticos tipo 2 y en no diabéticos con enfermedad cardiaca coronaria19. En esta investigación, el tratamiento con metformina disminuyó de forma significativa las concentraciones de colesterol, triglicéridos y LDL asociados a aumento significativos las concentraciones de HDL en la población de mujeres obesas. Los cambios metabólicos más leves en las mujeres no obesas con SOPQ pueden explicar la falta de efectos significativos de la metformina sobre el perfil lipídico en estas mujeres. Los hallazgos de esta investigación son apoyados por investigaciones previas, donde la metformina demostró mejoras en el perfil lipídico, principalmente por incremento en las concentraciones de HDL13,20,21. Por otra parte, otras investigaciones han demostrado la ausencia o un efecto negativo sobre los lípidos en pacientes con SOPQ12,13,21,22. Estas discrepancias pueden ser explicadas por las diferencias en las poblaciones de estudio o por una duración más corta del tratamiento al compararla con la presente investigación.
El mecanismo por el cual la metformina mejora el perfil lipídico no está claro. Se ha sugerido que reduce la captación o la síntesis de lípidos en el intestino y el hepatocito19. La mejoría en la obesidad y especialmente en la obesidad abdominal con una posterior liberación de ácidos grasos libres observados durante el tratamiento con metformina puede suministrar una explicación parcial a la mejoría del perfil lipídico durante el tratamiento, por lo menos en mujeres obesas1.
El hecho de que el tratamiento con metformina no produjera modificaciones significativas en el perfil lipídico en mujeres no obesas debe ser analizado con cuidado, debido al pequeño numero de mujeres no obesas que completaron la investigación. Es sorprendente, sin embargo, que la metformina no modificara los parámetros estudiados en esta investigación, y esto enfatiza la heterogeneidad del SOPQ y la importancia de probar los diferentes tipos de tratamientos en diferentes subgrupos de mujeres claramente definidos. Se debe tener en cuenta que las mujeres obesas y no obesas tenían diferencias significativas al inicio del tratamiento. Las mujeres obesas tenían valores más altos y distantes de los normales, lo cual hace que la posibilidad clínica y estadística de una mejoría en los parámetros sea mucho mayor.
Aún existe un debate si las mujeres no obesas con SOPQ son insulinoresistentes4,15,19,23. Mientras no se ha observado diferencias entre las pacientes obesas y no obesas en algunos estudios4,23, otros no han sido capaces de demostrar la insulinoresistencia en pacientes delgadas13. La obesidad agrava claramente los síntomas del síndrome y la pérdida de peso es la medida central en el tratamiento24. La pérdida de peso ha demostrado que mejora la frecuencia de la ovulación y normaliza los ciclos menstruales4. También se considera de importancia fundamental en la reducción de los factores de riesgo cardiovascular incluyendo el síndrome metabólico. El uso de metformina disminuye la sensación de hambre durante la hipoglucemia25. La moderada pérdida de peso también es común durante el tratamiento, pero las conclusiones de los estudios al azar difieren en relación a la pérdida de peso en las mujeres con SOPQ.
Se ha demostrado previamente que los efectos benéficos de la metformina ya se observan a los 3 meses de tratamiento y a dosis de 1g/d, pero la mayoría de la mejoría en los cambios hormonales y metabólicos se observan después de los 3 meses de tratamiento cuando se ha aumentado la dosis26–29. Se desconoce si la mejoría se debe a un periodo de tratamiento más largo o al incremento en la dosis de metformina. Debido a la pequeña cantidad de mujeres tratadas durante 6 meses, es difícil establecer una conclusión. Sin embargo, la mayoría de los cambios significativos en los perfiles lípidicos se obtienen ya a los 3 meses de tratamiento con dosis bajas (1g/d) que es la dosis utilizada en las mujeres obesas29. Además, esta dosis puede ser recomendada a los sujetos que sufren efectos adversos a dosis más altas.
Se concluye que el uso de metformina durante 6 meses produce modificaciones en las concentraciones de triglicéridos, LDL y HDL comparado con los valores iniciales en mujeres obesas con SOPQ. Las mujeres no obesas no presentaron modificaciones significativas en las concentraciones de lípidos y lipoproteínas después del tratamiento.