Estudios recientes muestran una elevada prevalencia de déficit de vitamina D en la población general, sobre todo en pacientes ancianos. También existen estudios que describen esta misma situación en los sujetos con obesidad mórbida (OM), aunque en pocos se compara a sujetos con OM y sin obesidad. Los objetivos de este estudio fueron estimar la prevalencia de déficit de vitamina D e hiperparatiroidismo secundario en ambos grupos y valorar si existe relación entre OM y deficiencia de vitamina D.
MétodosEl estudio se realizó en el Hospital Universitario de Guadalajara (España), desde diciembre de 2008 hasta diciembre de 2009, obteniéndose los datos de 138 sujetos. El 50,7% presentaba OM y el 49,3% no presentaba obesidad. En ambos grupos se obtuvo una muestra de sangre en ayunas para la determinación de 25-hidroxivitamina D, paratirina intacta, calcio, albúmina y fósforo, entre otros constituyentes bioquímicos.
ResultadosEn el grupo de sujetos con OM, la concentración media de 25-hidroxivitamina D fue de 16,6±8,12ng/ml, mientras que en el grupo de sujetos sin obesidad fue de 21,9±7,34ng/ml (p<0,0001). El déficit de vitamina D fue del 80% en el grupo de pacientes con OM y del 41% en los sujetos sin obesidad (p<0,0001). No se obtuvieron diferencias estadísticamente significativas en las concentraciones de paratirina intacta, calcio y fósforo entre ambos grupos.
ConclusionesSe confirma la elevada prevalencia de deficiencia de vitamina D en los grupos estudiados, aunque la concentración de 25-hidroxivitamina D fue significativamente menor en los sujetos con OM. La OM es un factor asociado a que exista déficit de vitamina D, por lo que podría valorarse incluir la determinación de 25-hidroxivitamina D en las guías para el manejo de los pacientes con OM con el fin de evitar estados carenciales.
Recent studies show a high prevalence of vitamin D deficiency in the general population, especially in the elderly. There are also studies reporting the same observations in the morbidly obese, although few of these studies have compared morbidly obese individuals with non-obese persons. The objectives of this study were to estimate the prevalence of vitamin D deficiency and secondary hyperparathyroidism in both groups and to assess whether there is a relationship between obesity and vitamin D deficiency.
MethodsThis study was carried out in 138 patients in the Guadalajara University Hospital (Spain) between December 2008 and December 2009. Of these, 50.7% were morbidly obese and 49.3% were not obese. Fasting blood samples were taken from both groups for determination of 25-hydroxyvitamin D, intact parathyroid hormone, calcium, albumin and phosphorus, among other biochemical parameters.
ResultsThe mean concentration of 25-hydroxyvitamin D was 16.6±8.12ng/ml in the morbidly obese group and 21.9±7.34ng/ml in the non-obese group (p<0.0001). The prevalence of vitamin D deficiency was 80% in morbidly obese patients and 41% in non-obese patients (p<0.0001). There were no statistically significant differences in concentrations of parathyroid hormone, calcium or phosphorus between the two groups.
ConclusionsA high prevalence of vitamin D deficiency was found in both groups studied, although the concentration of 25-hydroxyvitamin D was significantly lower in the morbidly obese. Morbid obesity is closely linked to vitamin D deficiency. To prevent this deficiency, determination of 25-hydroxyvitamin D should be included in clinical practice guidelines for the treatment of obesity.
La obesidad es una enfermedad multifactorial y crónica, de gran trascendencia sociosanitaria y económica, y constituye un problema de salud pública. Unos 6 millones de españoles mayores de 18 años (17,1%) tienen problemas de obesidad y un 36,7% tiene sobrepeso, según la última Encuesta Europea de Salud en España 20091. El sobrepeso y la obesidad se asocian con un aumento de la morbimortalidad. Este incremento está claramente relacionado con el grado de obesidad. En estos sujetos se detecta un aumento del riesgo de sufrir distintas enfermedades, tales como alteraciones en el metabolismo de los hidratos de carbono, hipertensión arterial, enfermedad coronaria, insuficiencia venosa, síndrome de ovario poliquístico, artrosis, síndrome de apnea del sueño, litiasis biliar, esteatosis hepática, hipertensión endocraneal benigna, aumento de la prevalencia de diferentes tipos de cánceres, etc2.
Por otro lado, en los últimos años se ha incrementado el interés por la vitamina D debido a que múltiples estudios muestran déficit de vitamina D en la población general y también en los personas con obesidad mórbida (OM)3–5.
La vitamina D es una pieza clave en la regulación de la homeostasis mineral, protege la integridad del esqueleto y modula el crecimiento y la diferenciación celular en una amplia variedad de tejidos. En el hombre, el 90–95% de los depósitos de vitamina D depende de la transformación del 7-deshidrocolesterol de la piel en colecalciferol durante la exposición a la radiación ultravioleta B. El resto se obtiene a través de la dieta en forma de alimentos naturales (la principal fuente natural es el aceite de pescado y también se encuentra, aunque en menor cantidad, en huevos y productos lácteos), alimentos enriquecidos o suplementos farmacológicos. Independientemente del origen, esta llega al hígado, donde sufre la primera hidroxilación y se transforma en 25-hidroxivitamina D (calcidiol), que es la principal forma circulante y sus valores plasmáticos son los que mejor reflejan los depósitos corporales. A nivel renal, se produce la segunda hidroxilación y se obtiene la forma biológicamente activa, la 1,25-dihidroxivitamina D o calcitriol. Esta segunda hidroxilación está estrechamente regulada, entre otros factores, por las concentraciones plasmáticas de fósforo, calcio y por la paratirina (PTH). La actividad de la 1-alfahidroxilasa suele disminuir con la edad de forma paralela a la disminución de la función renal6.
No existe un consenso sobre cuáles son las concentraciones óptimas de vitamina D, pero la mayoría de los autores establecen que existe deficiencia cuando los niveles plasmáticos de calcidiol son inferiores a 20ng/ml. Se ha demostrado que este es el límite por debajo del cual la PTH comienza a elevarse, afectando de esta manera a la salud ósea3,7. Independientemente de la relación entre la vitamina D y el tejido óseo, también existe asociación de esta hormona con determinadas enfermedades crónicas, tales como hipertensión esencial, enfermedad cardiovascular, diabetes mellitus, miopatía, determinados tipos de cáncer (mama, próstata y colon) y enfermedades autoinmunes8.
El déficit de vitamina D es muy frecuente tras la cirugía bariátrica, con una prevalencia de hasta un 50–80% de los casos tras técnicas mixtas o puramente malabsortivas9,10. Sin embargo, la obesidad por sí misma también se ha asociado con bajas concentraciones. Se han descrito prevalencias muy variadas que oscilan entre un 21–62% en la población con obesidad11,12. Existen diferentes hipótesis que explican el déficit en estos sujetos: baja exposición solar, ingesta deficiente, acumulación a nivel del tejido adiposo o necesidad de mayor masa ósea que soporte el peso elevado que presentan13,14. Sin embargo, el déficit de vitamina D afecta a individuos sin aparente riesgo para esta deficiencia, con adecuada ingesta de vitamina D y suficiente exposición solar15–17.
El objetivo del presente trabajo fue estimar el porcentaje de déficit de vitamina D e hiperparatiroidismo secundario en pacientes con OM y en pacientes sin obesidad, con el fin de comparar ambos grupos e intentar caracterizar los sujetos con riesgo de sufrir déficit de vitamina D.
Material y métodosEl estudio se realizó en el Hospital Universitario de Guadalajara (España) desde diciembre de 2008 hasta diciembre de 2009, obteniéndose los datos de 138 sujetos (todos de raza caucásica). El 50,7% presentaba una OM definida por un índice de masa corporal (IMC) mayor o igual a 40kg/m2 y se trataba de pacientes revisados de forma consecutiva en una consulta de endocrinología general, con edades comprendidas entre los 20–65 años. El resto no presentaba obesidad, definida por un IMC inferior a 30kg/m2, y eran todos trabajadores del hospital, con el mismo rango de edad (de 20–65 años). El IMC se calculó con la fórmula de Quetelet (peso en kilogramos dividido por el cuadrado de la estatura en metros) y se utilizaron las tablas recomendadas por la Sociedad Española para el estudio de la obesidad publicadas en el año 2000. Los criterios de exclusión para ambos grupos fueron insuficiencia renal (creatinina >1,5mg/dl), enfermedad inflamatoria grave, enfermedad maligna activa, enfermedades óseas conocidas, problemas hepáticos, ingesta de suplementos farmacológicos o alimentos enriquecidos y tratamientos que interfirieran en la absorción o concentración de vitamina D.
Diseño del estudioEn los pacientes con OM, se aprovechó la analítica realizada para control de su patología de base para determinar los valores de calcidiol, PTH intacta (PTHi), calcio, albúmina y fósforo, entre otros constituyentes bioquímicos. Dicha analítica se realizó en todos los casos entre los meses de diciembre y enero de 2008. En los sujetos control sin obesidad se realizó analítica para determinar los mismos constituyentes bioquímicos en los meses de noviembre y diciembre de 2009. Asimismo, se pesó a todos los sujetos incluidos en el estudio en una báscula de precisión. La medición de la estatura se realizó con el sujeto de espaldas al tallímetro de la misma báscula. Se midió el perímetro de cintura (PC) con una cinta métrica inextensible, pasando la cinta un centímetro por encima de las crestas iliacas y realizando la lectura a nivel del ombligo.
Los datos se analizaron en función de la presencia de deficiencia o no de calcidiol y se buscaron correlaciones significativas con el resto de los constituyentes bioquímicos (hiperparatiroidismo secundario, calcio, fósforo, etc.). Se consideraron valores deficientes de calcidiol concentraciones inferiores a 20ng/ml, y se consideraron valores suficientes concentraciones superiores o iguales a 20ng/ml. Se consideró hiperparatiroidismo secundario a cifras de PTHi por encima de 73pg/ml, que es el límite superior de los valores de referencia en nuestro laboratorio. El análisis de los datos también se realizó dividiendo a los sujetos en dos grupos según el IMC, con el objetivo de comparar los resultados.
Análisis de constituyentes bioquímicosLos valores de calcidiol se determinaron en suero mediante inmunoanálisis quimioluminiscente por un autoanalizador LIAISON® (DiaSorin, Saluggia, Italia), con una sensibilidad analítica menor a 4ng/ml y un coeficiente de variabilidad intraensayo e interensayo del 2,9 y el 5,5%, respectivamente. Los valores de referencia estaban establecidos entre 12–54ng/ml.
La PTHi se cuantificó en plasma por inmunoanálisis quimioluminiscente directo con un autoanalizador LIAISON® (DiaSorin, Saluggia, Italia), con una sensibilidad analítica de 1,0pg/ml y un coeficiente de variabilidad intraensayo e interensayo del 2,2 y el 11,1%, respectivamente. Se consideraron valores apropiados de PTHi entre 17–73pg/ml.
El calcio se determinó en suero y se analizó por colorimetría por un analizador Dimension® (Siemens, Deerfield, EE. UU.). El límite de detección era de 5mg/dl. Las concentraciones séricas de calcio fueron corregidas con la albúmina plasmática mediante la siguiente fórmula: calcio corregido (mg/dl)=calcio medido (mg/dl)+0,8 (4-albúmina en sangre)18. Los valores de referencia están establecidos entre 8,5–10,5mg/dl.
El fósforo se determinó en suero y se analizó por colorimetría con un autoanalizador Dimensio® (Siemens, Deerfield, EE. UU.) con un límite de detección de 0,2mg/dl. Se consideraron concentraciones adecuadas de fósforo en sangre de 2,7–4,5mg/dl.
Análisis estadísticoSe realizó un análisis de los datos utilizando el programa SPSS 15.0 para Windows. Las variables cuantitativas se expresaron como media±desviación estándar y las variables cualititativas se expresaron como porcentajes. Para la comparación entre los dos grupos de pacientes se utilizó la prueba de la χ2 en el caso de variables cualitativas y la prueba de la t de Student para muestras independientes en el caso de variables cuantitativas. Un valor de p<0,05 se consideró como estadísticamente significativo.
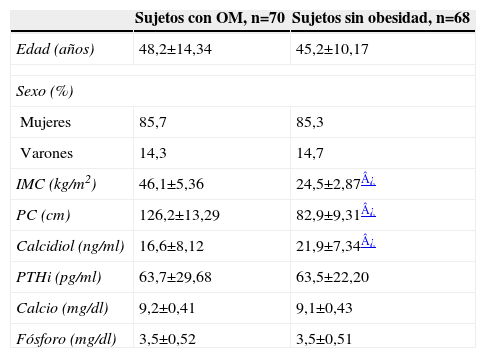
ResultadosEn el grupo de pacientes con OM, la edad media fue de 48±14,34 años, siendo el 85,7% mujeres. En el grupo de sujetos sin obesidad, la edad fue de 45±10,17 años, siendo el 85,3% mujeres (tabla 1).
Parámetros clínicos y analíticos en pacientes con obesidad mórbida y sin obesidad
| Sujetos con OM, n=70 | Sujetos sin obesidad, n=68 | |
| Edad (años) | 48,2±14,34 | 45,2±10,17 |
| Sexo (%) | ||
| Mujeres | 85,7 | 85,3 |
| Varones | 14,3 | 14,7 |
| IMC (kg/m2) | 46,1±5,36 | 24,5±2,87¿ |
| PC (cm) | 126,2±13,29 | 82,9±9,31¿ |
| Calcidiol (ng/ml) | 16,6±8,12 | 21,9±7,34¿ |
| PTHi (pg/ml) | 63,7±29,68 | 63,5±22,20 |
| Calcio (mg/dl) | 9,2±0,41 | 9,1±0,43 |
| Fósforo (mg/dl) | 3,5±0,52 | 3,5±0,51 |
Los datos son la media±desviación estándar de la media, excepto en el caso de los porcentajes.
IMC: índice de masa corporal; OM: obesidad mórbida; PC: perímetro de cintura; PTHi: paratirina intacta.
La concentración de calcidiol fue significativamente menor en el grupo con OM. Un 80% de los pacientes tenía déficit de calcidiol, siendo la concentración media de 16,6±8,12ng/ml. En el grupo sin obesidad la concentración media de calcidiol fue de 21,9±7,34ng/ml (p<0,0001). Aunque el valor medio de calcidiol en los pacientes sin OM fue adecuado, el porcentaje de sujetos que presentaban concentraciones deficientes fue muy elevado (41%). El valor medio de PTHi en el grupo de pacientes con obesidad no fue significativamente diferente a la concentración media de esta hormona en el grupo control, 63,7±29,68pg/ml vs. 63,5±22,20pg/ml (tabla 1). El calcio y el fósforo se encontraban dentro de los valores normales en ambos grupos y no se obtuvieron diferencias estadísticamente significativas (tabla 1).
La proporción de déficit de calcidiol en los casos con OM fue el doble que en los sujetos sin obesidad (el 80 y el 41,2%, respectivamente; p<0,0001). Sin embargo, el porcentaje de hiperparatiroidismo secundario no fue significativamente diferente entre ambos grupos (el 25,7 y el 30,9%, respectivamente).
Dentro del grupo de pacientes con OM se analizaron datos de los pacientes con IMC mayor o igual a 50kg/m2 (obesidad grado 4 u obesidad extrema). De los 17 sujetos que cumplían este criterio (el 24,3% del grupo con OM), 11 pacientes (64,7%) presentaron un déficit de calcidiol. La concentración media de calcidiol fue de 17,6±9,74ng/ml, y la concentración de PTHi fue de 60,8±17,13pg/ml. No se obtuvieron diferencias estadísticamente significativas en cuanto a la concentración de calcidiol y PTHi entre los pacientes con IMC entre 40–49,9kg/m2 y aquellos con IMC mayor o igual a 50kg/m2. Tampoco se obtuvieron diferencias estadísticamente significativas en cuanto al porcentaje de déficit de calcidiol entre ambos grupos, probablemente porque el grupo de sujetos con obesidad grado 4 fue muy reducido.
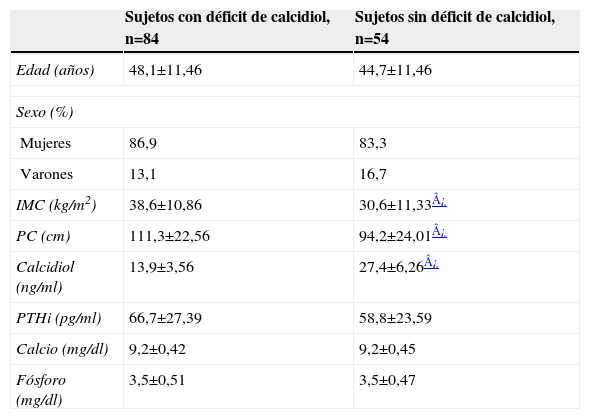
También se analizaron los datos de todos los pacientes según presentaran o no déficit de calcidiol. Tal y como se expone en la tabla 2, 84 sujetos (60,9%) presentaron un déficit, siendo la concentración media de calcidiol de 13,9±3,56ng/ml, mientras que en 54 sujetos (39,3%) no se observó déficit, siendo la concentración media de calcidiol de 27,4±6,26ng/ml. En el grupo de pacientes con déficit de calcidiol, la edad media fue de 48,1±11,46 años, siendo el 86,9% mujeres, valores que no fueron significativamente diferentes a los del grupo de individuos sin déficit, en el cual la edad media fue de 44,7±11,46 años, siendo el 83,3% mujeres. Puesto que la menopausia es un factor que afecta al metabolismo óseo de las mujeres, se analizó la posible relación con el déficit de vitamina D, sin encontrarse relación estadísticamente significativa. Respecto a los varones, el 45% tuvo concentraciones suficientes, mientras que el 55% presentó déficit. En este estudio, el déficit de calcidiol no se relacionó con el sexo de los individuos, aunque el alto porcentaje de mujeres en la muestra total respecto al de varones hace que los datos relativos al sexo no sean representativos o extrapolables a la población masculina.
Parámetros clínicos y analíticos en pacientes con déficit y sin déficit de calcidiol
| Sujetos con déficit de calcidiol, n=84 | Sujetos sin déficit de calcidiol, n=54 | |
| Edad (años) | 48,1±11,46 | 44,7±11,46 |
| Sexo (%) | ||
| Mujeres | 86,9 | 83,3 |
| Varones | 13,1 | 16,7 |
| IMC (kg/m2) | 38,6±10,86 | 30,6±11,33¿ |
| PC (cm) | 111,3±22,56 | 94,2±24,01¿ |
| Calcidiol (ng/ml) | 13,9±3,56 | 27,4±6,26¿ |
| PTHi (pg/ml) | 66,7±27,39 | 58,8±23,59 |
| Calcio (mg/dl) | 9,2±0,42 | 9,2±0,45 |
| Fósforo (mg/dl) | 3,5±0,51 | 3,5±0,47 |
Los datos son la media±desviación estándar de la media, excepto en el caso de los porcentajes.
IMC: índice de masa corporal; PC: perímetro de cintura; PTHi: paratirina intacta.
En cuanto al IMC, el valor medio en el grupo de pacientes con déficit de calcidiol fue de 38,6±10,86kg/m2 mientras que en los individuos sin déficit, el IMC medio fue de 30,6±11,33kg/m2 (p<0,0001). Al analizar el PC, en aquellos sujetos con déficit de calcidiol se obtuvo una media de 111,3±22,56cm, mientras que en el grupo de pacientes con concentraciones suficientes de calcidiol se obtuvo una media de 94,2±24,01cm (p<0,0001). La concentración de PTHi fue de 66,7±27,39pg/ml en los sujetos con déficit y de 58,8±23,59pg/ml en los sujetos sin déficit, sin obtenerse diferencias estadísticamente significativas. Las concentraciones de calcio y fósforo se encontraban dentro de los límites normales en ambos grupos, y no se encontraron diferencias estadísticamente significativas.
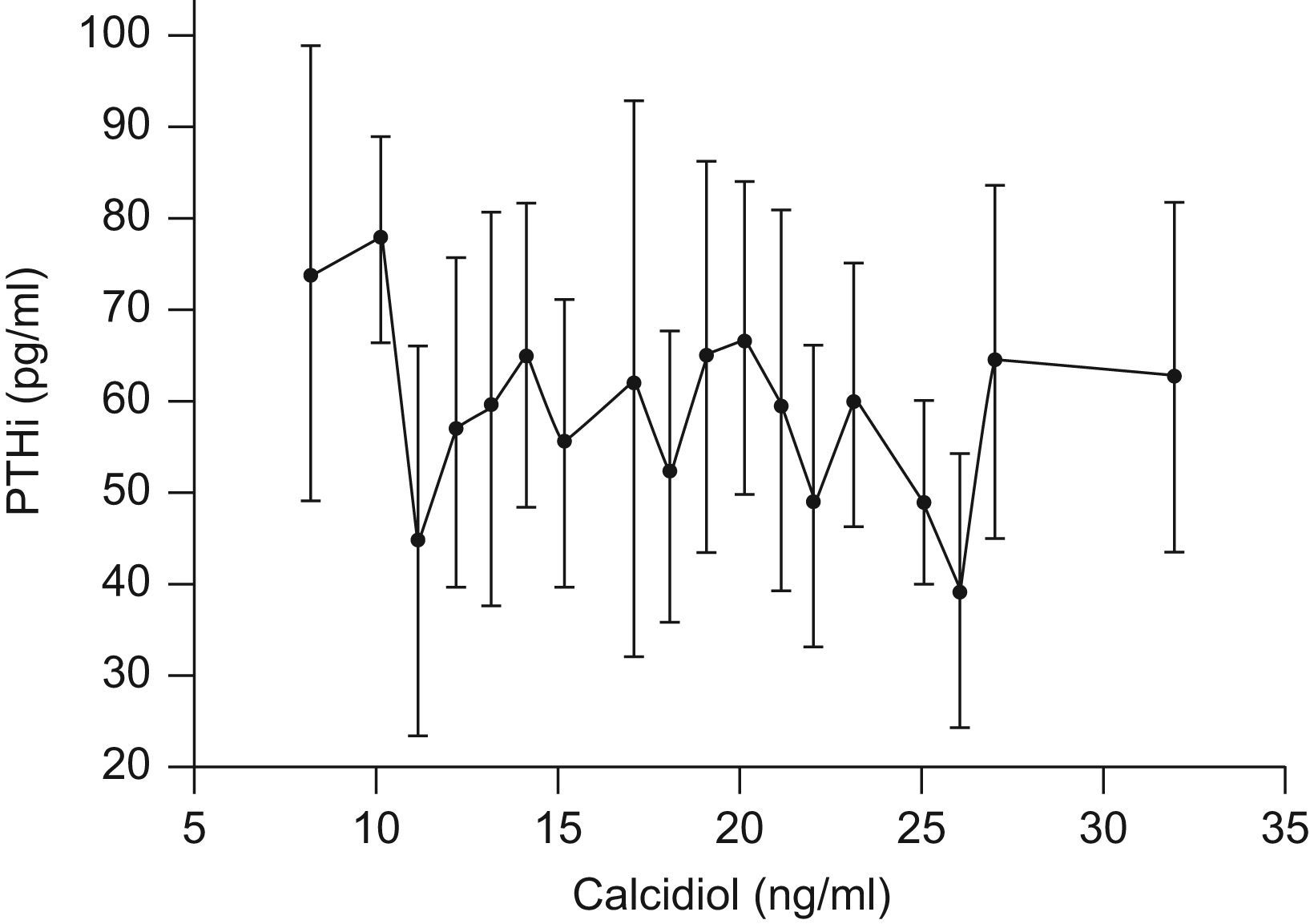
La figura 1 muestra la relación entre calcidiol y la concentración media de PTHi de todos los sujetos que participaron en el estudio. Los individuos fueron categorizados de acuerdo con sus concentraciones de calcidiol. Se puede observar que en la población estudiada existe una elevada variabilidad de la concentración de PTHi para un mismo valor de calcidiol. La relación entre calcidol y PTHi no fue estadísticamente significativa. Aun así, los sujetos con concentraciones de calcidiol inferiores a 11ng/ml presentaron una PTHi media superior a 73pg/ml. De todos los sujetos que presentaron hiperparatiroidismo secundario, el 77,7% tenía concentraciones deficientes de calcidiol.
DiscusiónLa elevada prevalencia de déficit de vitamina D tiene gran relevancia para la salud pública, puesto que no se consigue alcanzar el pico máximo de masa ósea, que puede continuar hasta la tercera década en las mujeres y, por lo tanto, aumenta el riesgo de desarrollar osteoporosis. La investigación en este campo ha demostrado la elevada prevalencia de déficit de vitamina D en la población general, con una elevada incidencia en pacientes con OM, entre otras patologías3,12,15,19.
El concepto de valor adecuado o suficiente de vitamina D se encuentra en plena revisión. Muchos autores consideran que existe déficit de vitamina D cuando la concentración de calcidiol es inferior a 20ng/ml y establecen como deseable una concentración superior a 40ng/ml, aunque valores superiores a 30–32ng/ml se consideran suficientes para evitar descalcificación ósea y/o hiperparatiroidismo secundario3,7,17,20 . Si se hubiera considerado este criterio en nuestro estudio, en el grupo de pacientes con OM únicamente el 7,1% hubiera presentado concentraciones suficientes de calcidiol, mientras que en el grupo de individuos sin obesidad, el porcentaje de sujetos con concentración suficiente hubiera sido del 14,7%.
La síntesis cutánea por exposición solar y la dieta son las principales fuentes de vitamina D. Estudios realizados en la población española encuentran una elevada prevalencia de déficit de vitamina D y revelan que la exposición solar no es suficiente para mantener valores óptimos de vitamina D21,22. En cuanto a la dieta, resulta difícil alcanzar la ingesta dietética recomendada de vitamina D: 5μg/día para adultos de 19–50 años (200UI/día), 10μg/día para adultos de 51–70 años (400UI/día) y 15μg/día a partir de 70 años (600UI/día)23, ya que para ello se debería consumir muy frecuentemente pescado graso (atún y bacalao) y lácteos sin desnatar3. La mayoría de los autores consideran que la ingesta dietética recomendada de vitamina D es insuficiente, puesto que recientemente se ha establecido que la mayor densidad ósea, el menor riesgo de fracturas de cadera e incluso el menor riesgo de caídas se consiguen mediante suplementación con 700 a 800UI/día de vitamina D (colecalciferol) hasta conseguir niveles séricos de calcidiol superiores a 30 ng/ml, junto con el aporte de cantidades de calcio superiores 500mg/día, aunque los mayores beneficios se alcanzan con dosis de 1.000–1.200mg/día de calcio elemental19,24,25.
La probabilidad de que exista deficiencia de vitamina D en los pacientes con OM es muy elevada (el 80% en nuestra serie). A pesar del alto porcentaje de déficit de vitamina D en los pacientes con OM, solo un 25,7% presentó hiperparatiroidismo secundario. Este resultado podría parecer contradictorio, puesto que ambas hormonas están inversamente relacionadas, aunque estudios previos muestran resultados similares. Generalmente, la concentración media de PTHi se encuentra dentro de los límites normales, aunque la concentración media de calcidiol está por debajo de 20ng/ml4,5,12,17. Thomas et al solo encontraron casos de hiperparatiroidismo secundario en pacientes con concentraciones de calcidiol inferiores a 6ng/ml. En nuestro estudio existe una gran variabilidad entre la concentración de calcidiol y PTHi. Hay que destacar que de los individuos con hiperparatiroidismo secundario, la mayoría (77,7%) tenía déficit de calcidiol. Sin embargo, la determinación de calcidiol no está estandarizada, lo que implica que los resultados varíen mucho de unos laboratorios a otros y que, mientras no se solucione este problema, los resultados obtenidos con una técnica determinada no permiten conocer con exactitud el verdadero estado de las reservas de vitamina D de un individuo26,27. Además, la determinación de calcidiol resulta costosa, pero consideramos que se podría incluir en el manejo de los pacientes con OM para detectar en la medida de lo posible déficit de vitamina D.
En conclusión, sobre la base de los datos de nuestro estudio se puede considerar que tener OM podría ser un factor asociado a que existiera déficit de vitamina D, aunque en los pacientes que no presentaban OM el déficit de vitamina D también fue muy elevado (41%). Esta situación podría estar relacionada con la escasa ingesta de alimentos ricos en vitamina D así como de alimentos enriquecidos. Sería interesante poder demostrar esta asociación para recomendar alimentos enriquecidos o suplementos farmacológicos con el fin de alcanzar concentraciones suficientes de vitamina D.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.