El pituitary transforming tumour gene (PTTG) está involucrado en una gran variedad de mecanismos fisiológicos. Se ha descrito sobreexpresión proteínica de PTTG en múltiples neoplasias, como los tumores hipofisarios, la cual favorece la aneuploidía, la inestabilidad genética, la proliferación celular y la angiogénesis, todos ellos procesos clave en la transformación neoplásica. Los estudios llevados a cabo en adenomas hipofisarios indican su asociación con un mayor grado de infiltración y de recidivas. Actualmente se plantea su función potencial como diana terapéutica.
The pathogenesis of pituitary tumours is far to be understood. Pituitary transforming tumour gene (PTTG), a gen that induces aneuploidy, genetic instability, cellular proliferation and to stimulate angiogenesis, has been involved in neoplasic transformation and shown overexpressed in many neoplasm as lung, breast, endometrium, thyroid and colon malignant tumours. On the other hand, PTTG has been inconsistently studied in pituitary tumours. The majority of studies have been performed in animals and there is a great variability in the methods used in its determination. The goal of this review is to resume the role of PTTG in tumourogenesis and critically to revise the studies published in humans in order to advance in the knowledge of the pathogenesis of pituitary adenomas and to find clinical useful predictors of the behavior of these tumours.
Los adenomas hipofisarios son la causa más frecuente de tumores en la región selar, aproximadamente el 10-15% de las neoplasias intracraneales. Se originan por la expansión monoclonal de células adenohipofisarias y clínicamente se expresan por exceso de secreción hormonal, efectos compresivos debidos a expansión local o hipofunción adenohipofisaria por afección de la glándula sana1.
La patogenia de estos tumores continúa siendo objeto de estudio. Desde la descripción del pituitary transforming tumour gene (PTTG) en células tumorales hipofisarias en ratas GH4 en 19972, se lo ha involucrado en los mecanismos moleculares subyacentes al desarrollo de los adenomas hipofisarios, así como de muchas otras neoplasias.
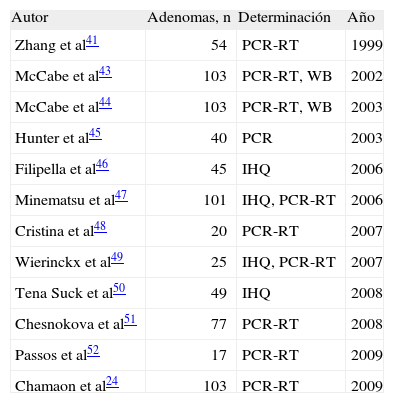
Los objetivos de esta revisión son determinar el papel del PTTG en la génesis de los adenomas hipofisarios, conocer si la sobreexpresión de PTTG se asocia a fenotipos característicos y esclarecer las implicaciones clínicas de la detección de PTTG en este tipo de tumores. Se diseñó una búsqueda en PubMed mediante las palabras clave "[PTTG] and [pituitary]". Se revisaron estudios de la Fundación Cochrane. La búsqueda se limitó a estudios en humanos (última búsqueda, 23 de octubre de 2009) y se obtuvieron 12 artículos entre 1999 y 2009, que se correspondían con los criterios de selección enumerados (tabla 1).
Descripción de los estudios realizados con adenomas hipofisarios humanos
| Autor | Adenomas, n | Determinación | Año |
| Zhang et al41 | 54 | PCR-RT | 1999 |
| McCabe et al43 | 103 | PCR-RT, WB | 2002 |
| McCabe et al44 | 103 | PCR-RT, WB | 2003 |
| Hunter et al45 | 40 | PCR | 2003 |
| Filipella et al46 | 45 | IHQ | 2006 |
| Minematsu et al47 | 101 | IHQ, PCR-RT | 2006 |
| Cristina et al48 | 20 | PCR-RT | 2007 |
| Wierinckx et al49 | 25 | IHQ, PCR-RT | 2007 |
| Tena Suck et al50 | 49 | IHQ | 2008 |
| Chesnokova et al51 | 77 | PCR-RT | 2008 |
| Passos et al52 | 17 | PCR-RT | 2009 |
| Chamaon et al24 | 103 | PCR-RT | 2009 |
IHQ: inmunohistoquímica; PCR-RT: reacción en cadena de la polimerasa en tiempo real; WB: Western blot.
La familia PTTG está formada por tres genes diferentes, cada unos de ellos localizado en distintos cromosomas: PTTG1, localizado en el cromosoma 5q35.13 (aunque hay controversia, puesto que también se ha situado en 5q334); PTTG2, en 4p15.15 y PTTG3, en 8q13.16. En humanos existe una fuerte homología estructural (mayor del 89%) entre ellos. PTTG1 es el más abundante y está ampliamente distribuido en tejidos sanos como el hígado fetal, los testículos y el timo, y se expresa en menor proporción en el colon, el intestino delgado, el cerebro (incluida la hipófisis), la placenta y el páncreas. PTTG2 se ha detectado en pequeñas cantidades en el cerebro, la placenta, el intestino delgado, el colon, el hígado, el bazo, el timo, la próstata, los testículos y los ovarios, pero se ha comprobado su expresión en tumores hipofisarios, hepáticos, testiculares y ováricos7. PTTG3 se ha relacionado con la maduración de los ovocitos y se ha detectado en neoplasias ováricas8.
Esta revisión se centrará en el comportamiento de PTTG1, el más abundante y estudiado, que denominaremos PTTG.
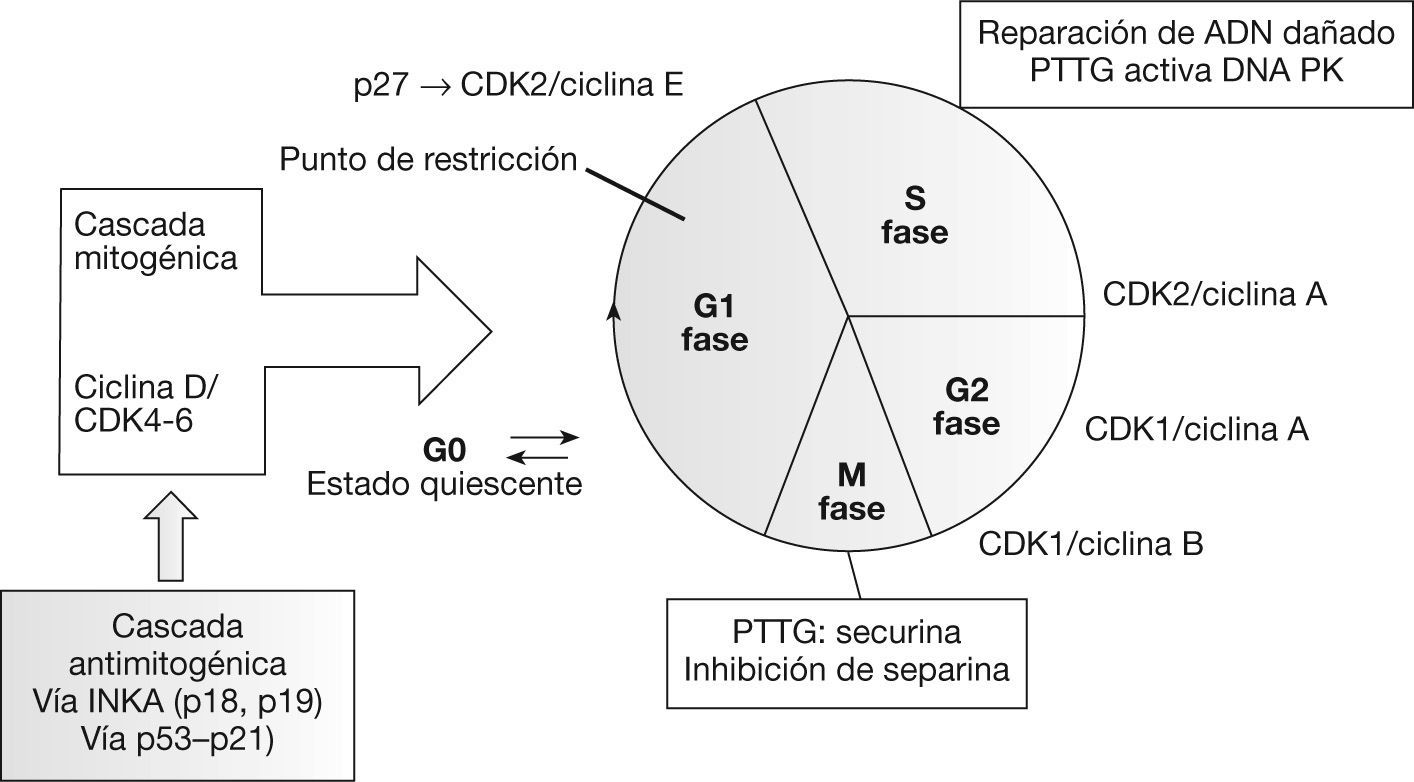
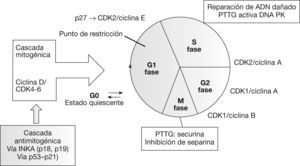
Función de PTTGLa proteína PTTG puede detectarse tanto en el núcleo como en el citoplasma celular. Su translocación al núcleo está mediada por el PTTG-binding factor (PBF) y por la vía de la proteincinasa activada por mitógeno (MAPK)9. Las funciones enumeradas a continuación las lleva a cabo en su localización nuclear, mientras que su papel en el citoplasma permanece sin identificar3 (fig. 1).
Recientemente se ha correlacionado el PTTG con la regulación de la transición entre las fases G1 y S del ciclo celular. Para ello, forma un complejo con el factor de transcripción Sp1, que regula la expresión de la ciclina D310. Las ciclinas, elementos reguladores de las cinasas dependientes de ciclina (cdk), regulan en último lugar el ciclo celular mediante la fosforilación de diferentes sustratos. La presencia de las ciclinas D es necesaria para la progresión de la fase G111.
SecurinaPTTG tiene un importante papel durante la mitosis. En la metafase, los pares de cromátidas hermanas permanecen unidas mediante el complejo cohesina, lo que facilita su orientación correcta en el huso mitótico12. Este complejo se degrada mediante una separina en la transición hacia la anafase, lo que permite la disyunción de las cromátidas hermanas para dar lugar a células hijas diploides. PTTG se une a la separina durante la metafase e impide la degradación del complejo cohesina y la separación precoz de las cromátidas hermanas13.
Transactivación. Factor de transcripciónEstudios en levaduras, roedores e in vitro han demostrado la capacidad de PTTG como factor transactivador de determinados genes. Se ha comprobado su función como factor de transcripción en 400 de 700 genes estudiados, implicados la mayoría de ellos en la regulación del ciclo celular y el control metabólico y de señales de transducción14. Uno de los más estudiados es el factor de crecimiento fibroblástico (FGF-2), que incrementa su acción angiogénica y promitótica15. También se lo ha relacionado con el aumento de expresión de la metaloproteinasa matricial 2 (MMP2), que favorece la capacidad de invasión tumoral14.
Reparación ADNPTTG se une a la subunidad Ku-70 que regula la actividad de la proteincinasa dependiente del ADN (DNA-PK), implicada en la reparación de las roturas de ADN. Esta unión se inhibe por roturas de doble cadena del ADN, con lo que esta subunidad se activa iniciando los mecanismos de reparación. Al mismo tiempo, debido a su acción securina, inhibe la separación de las cromátidas hermanas retrasando la mitosis mientras se produce la reparación del ADN16.
ApoptosisLa sobreexpresión de PTTG puede inducir apoptosis dependiente o independiente de p53. Además, PTTG regula la expresión del oncogén c-myc, que a su vez interactúa con el promotor de p53 y potencia su transcripción14. PTTG estimula directamente a Bax, que promueve también la apoptosis por la vía mitocondrial. Los mecanismos mediante los cuales causa apoptosis independientemente de p53 no están claros17,18. Sin embargo, estudios en cultivos celulares utilizando short interfering RNA (siRNA), cuya función es disminuir la expresión de PTTG, o mediante la transfección de PTTG, con lo que se induce su sobreexpresión, muestran una relación inversa entre la expresión de PTTG y p537.
SenescenciaLas células pueden responder a situaciones de estrés en el ADN entrando en apoptosis o mediante la proliferación detenida (también llamada senescencia celular). Como se ha descrito anteriormente, PTTG puede promover la transcripción de p53, lo que a su vez estimula la expresión de p21 en situaciones de estrés celular; p21 es un inhibidor de cinasas dependiente de ciclina que inhibe la formación de los complejos ciclina-CDK2 o CDK4. Además, regula la progresión de la fase G1 activando la senescencia en células inestables o aneuploides, la replicación del ADN, así como la entrada de las células en apoptosis. Por estos mecanismos, controla el crecimiento tumoral e impide la transformación maligna en determinados tejidos como la hipófisis19.
Regulación de la expresión de PTTGEstudios in vitro y en roedores han demostrado la importancia de determinadas sustancias en la regulación de la expresión de PTTG. Los estrógenos aumentan la expresión de ARNm de PTTG, aunque esta regulación parece ser específica de determinados tipos celulares (principalmente hipofisarios). En tumores hipofisarios, se han demostrado concentraciones elevadas de receptores de estrógenos, lo que indica actividad tumorogénica mediada por el aumento de PTTG, por lo que se lo considera una posible diana terapéutica con el empleo de fármacos antiestrogénicos20–22.
La expresión de PTTG también se ha correlacionado con la insulina y el factor de crecimiento insulinoide 1 (IGF1) en líneas celulares de cáncer de mama y astrocitomas. Se han identificado dos secuencias en el promotor de PTTG que responden a la insulina y al IGF1, lo que explicaría una de las posibles vías de regulación3,23-25.
Estudios en diferentes cultivos celulares (astrocitomas y células adenohipofisarias) han demostrado expresión de PTTG mediada por los ligandos del receptor del factor de crecimiento epidérmico (EGFR), por el propio factor de crecimiento epidérmico y por el factor alfa de crecimiento transformador (TGFa)26.
La vía de la betacatenina/T cell factor (TCF) se ha implicado en la regulación de la expresión de PTTG en carcinomas escamosos del esófago27, así como en la tumorogénesis hipofisaria28. Otros factores relacionados son el calcio, el factor de crecimiento hepatocitario, la ciclosporina A y los glucocorticoides29–31.
Fosforilación de PTTGLa fosforilación de PTTG facilita su translocación al núcleo32, lo que depende de la fase del ciclo celular en que se encuentre16,33. En ella interviene la cinasa dependiente de ciclina 2 (cdk2), que puede activarse por tres vías diferentes: fosfoinositol-3 cinasa (PI3K), MAPK o la subunidad Ku70 de la DNAPK23,34. En la actualidad se está estudiando el papel de la fosforilación en la modulación de la función de PTTG.
Papel en la tumorogénesisLa sobreexpresión de PTTG se ha comprobado en múltiples neoplasias, como tumores hipofisarios, carcinoma de pulmón, mama, endometrio, esófago, colon, recto, tiroides, ovario y testículo, gliomas, etc.7,35.
Proliferación celularEl efecto de PTTG en la proliferación celular no está aclarado. Como proteína oncogénica, sería esperable un aumento de la actividad proliferativa, pero como securina debería inhibir dicha proliferación35. Ambos posibles efectos han sido demostrados tanto en estudios clínicos como in vitro21,36,37. Incluso se ha comprobado que la sobreexpresión relativamente baja (1,7 veces) estimula la proliferación celular, mientras que una sobreexpresión alta (6 veces) inhibe el recambio celular38. Parte del efecto en la proliferación celular está mediado por la activación del protooncogén cmyc39. Se ha propuesto además que el estado de fosforilación de PTTG puede estar relacionado con la modificación del efecto en la proliferación celular15. Esta doble función podría justificar que la gran mayoría de los tumores hipofisarios sean benignos.
Aneuploidía (e inestabilidad genética)Se ha demostrado tanto in vivo como in vitro la asociación entre la sobreexpresión de PTTG y el aumento de aneuploidía e inestabilidad genética en diversos tumores y líneas celulares36,40. Su acumulación (debido a sobreexpresión o fallo en su degradación) inhibe la progresión de las mitosis y la segregación cromosómica, lo que da lugar a aneuploidía con implicación significativa en el potencial oncogénico.
Invasión y angiogénesisLa sobreexpresión de PTTG parece actuar de forma autocrina/paracrina incrementando la expresión de ciertos factores de crecimiento que favorecen la angiogénesis, como el FGF-2 o el factor de crecimiento del endotelio vascular (VEGF)35. Estudios in vivo e in vitro han correlacionado la sobreexpresión de PTTG con la neovascularización y la expresión de FGF-2 y VEGF-A36,41,42.
PTTG en los tumores hipofisariosLa tabla 1 expone el número de muestras hipofisarias estudiadas y los métodos empleados para la determinación de PTTG en los 12 artículos revisados. Los estudios eran muy heterogéneos en cuanto a número de pacientes, el tipo de adenomas intervenidos y las técnicas de determinación de PTTG. Varios de ellos incluían estudios en animales48,49,51 o tejidos celulares43,45. Cristina et al48 y Wierinckx et al49 incluyeron sólo prolactinomas intervenidos, mientras que en el resto de los estudios no se realizó una selección por subtipo de adenoma. Se ha estudiado un total de 659 adenomas, con la siguiente distribución según el subtipo histológico: el 22% somatotropinomas, el 15% gonadotropinomas, el 15% prolactinomas, el 5% corticotropinomas, el 3% nulos y el 1% tirotropinomas. No se dispone de datos sobre el subtipo histológico en el 39% de los tumores estudiados. La mayoría de los estudios emplean técnicas de reacción en cadena de la polimerasa en tiempo real (PCR-RT) para la determinación de la expresión del ácido ribonucleico mensajero (ARNm) de PTTG. Sólo dos46,50 utilizan de forma aislada técnicas de inmunohistoquímica para valorar la presencia de la proteína y unicamente McCabe et al43,44 emplean el Western blot en su estudio.
Características clínicasNingún autor encontró relación entre la sobreexpresión de PTTG y características tales como edad, sexo o síntomas clínicos al diagnóstico44,46,51.
Subtipo de adenomaTodos los trabajos referían mayor expresión de PTTG en los adenomas hipofisarios que en la hipófisis normal. En tres encontraron mayor grado de expresión en los funcionantes que en los no funcionantes41,45,51. Se ha objetivado un mayor grado de sobreexpresión en los adenomas somatotropos41,47,51. Filipella et al46, por el contrario, describieron mayor expresión de PTTG en adenomas nulos, seguidos de los gonadotropos. Sin embargo, Minematsu et al47 y McCabe et al44 no encontraron diferencias de expresión en los adenomas tirotropos comparados con las hipófisis normales, y proponen que estos tumores presentan una fisiopatología diferente.
Secreción hormonalHunter et al45 analizaron la secreción hormonal in vitro y el grado de sobreexpresión de PTTG, y encontraron una correlación positiva estadísticamente significativa con la secreción de GH. Esto va a favor de los datos obtenidos previamente en cultivos celulares de células lactosomatotropas, en los que la sobreexpresión de PTTG aumentaba la secreción y expresión de ARNm de somatotropina y disminuía la de prolactina53.
Tamaño tumoral y la capacidad de invasiónPara Zhang et al41 hubo una correlación positiva entre la invasión del seno esfenoidal en los adenomas funcionantes y la sobreexpresión de PTTG, lo que supondría un comportamiento más agresivo. Hunter et al45 describieron diferencias significativas en cuanto al volumen tumoral en relación con el grado de sobreexpresión de PTTG. Sin embargo, otros autores no encontraron diferencias43,45,49.
Proliferación celularFilipella et al46 demostraron correlación entre la concentración de PTTG y la proliferación celular (medida con Ki67), lo que se asoció a un peor pronóstico. Por el contrario, Minematsu et al47 encontraron correlación sólo en las hipófisis normales. Wierinckx et al49 describieron un subtipo de adenoma, al que denominaron "atípico", en el que había sobreexpresión de PTTG nuclear junto con aumento de Ki67 y p53.
AngiogénesisLos resultados de McCabe et al43 mostraron una asociación entre PTTG y VEGF (y su receptor KDR), también descrita por Minematsu et al47, en adenomas somatotropos en relación con el número de vasos (estudiados mediante inmunohistoquímica con CD34). Sin embargo, Hunter et al45 no encontraron correlación.
PronósticoFilipella et al46 estudiaron a 27 pacientes con seguimiento mayor de 1 año (máximo, 72 meses), y encontraron que los adenomas con mayor sobreexpresión de PTTG y altas concentraciones de Ki67 presentaban un menor tiempo de recidiva. Establecieron como punto de corte para distinguir grupos de riesgo PTTG y Ki67 del 3,3% (sensibilidad, 60%; especificidad, 76%), aunque el mejor marcador pronóstico fue la Ki67 > 2,9%. Por otra parte, Wierinckx et al49 estudiaron a 25 pacientes con prolactinomas con seguimiento superior a 1 año (media, 93 meses), dividiendo los adenomas en tres subtipos en función de su agresividad. Describieron el "adenoma atípico" caracterizado por mayor porcentaje de recidivas (y más precoces), correlacionadas con la sobreexpresión de PTTG nuclear, mayor índice de Ki67 y sobreexpresión de p53.
Respuesta a tratamiento médicoLos estudios en adenomas lactotropos no demostraron asociación entre PTTG y la resistencia al tratamiento con agonistas dopaminérgicos48,52. No existen estudios en otros tipos histológicos que analicen la respuesta al tratamiento médico.
ConclusionesSegún los datos expuestos (tabla 2), se puede concluir que hay sobreexpresión de PTTG en los adenomas hipofisarios. La mayoría de los estudios encuentran mayor expresión de PTTG en los adenomas funcionantes y, de éstos, en los adenomas somatotropos. Con los datos disponibles hasta el momento, no hay asociación clara con el tamaño al diagnóstico o la capacidad de invasión, pero parece que hay correlación positiva entre PTTG y la proliferación tumoral (medida con Ki67). Sin embargo, hay controversia sobre la relación entre PTTG y la sobreexpresión de VEGF como marcador de angiogénesis. En cuanto a la relevancia clínica de PTTG, los datos indican una asociación con el desarrollo de recidivas y un peor pronóstico. Por todo lo referido, se necesitan más estudios para conocer la posible utilidad de la determinación del PTTG como factor pronóstico y/o diana terapéutica en los adenomas hipofisarios.
Resumen de los estudios realizados con adenomas hipofisarios humanos
| Tamaño tumoral e invasión | |
| Zhang et al41 | Marcador de invasión en adenomas funcionantes |
| McCabe et al44 | Sin diferencias en grado tumoral |
| Hunter et al45 | Relación positiva con tamaño tumoral |
| Filipella et al46 | Sin diferencias en grado tumoral y diámetro máximo |
| Tena Suck et al50 | Sin diferencias en volumen tumoral |
| Proliferación | |
| Filipella et al46 | Relación positiva |
| Minematsu et al47 | Relación positiva en hipófisis normales |
| Wierinckx et al49 | Relación positiva |
| Angiogénesis | |
| McCabe et al43 | Relación positiva |
| Hunter et al45 | Sin relación |
| Minematsu et al47 | Relación positiva en adenomas somatotropos |
| Pronóstico | |
| Filipella et al46 | Peor pronóstico, mayor riesgo de recurrencia |
| Wierinckx et al49 | Peor pronóstico, recidiva precoz |
| Tratamiento médico | |
| Cristina et al48 | Sin relación |
| Passos et al52 | Sin relación |
Los autores declaran no tener ningún conflicto de intereses.