Determinar las modificaciones del perfil lipídico en menopáusicas tratadas con gel de testosterona.
MétodosSe incluyeron 36 mujeres ooforectomizadas, tratadas con estradiol, que recibieron tratamiento con gel de testosterona (5mg transdérmicos diarios). Se analizaron la presencia de obesidad, concentraciones séricas de colesterol, triglicéridos, colesterol unido a proteínas de alta densidad (HDL-C) y colesterol unido a proteínas de baja densidad (LDL-C), colesterol unido a proteínas de muy baja densidad (VLDL-C) y lipoproteína (a) antes y después de 6 meses de tratamiento.
ResultadosLa edad promedio de las participantes seleccionadas fue de 50,9±4,6 años, con un índice de masa corporal de 30,1±3,8Kg/m2. Se observó una disminución significativa de las concentraciones de colesterol (204,5±35,1mg/dL antes del tratamiento comparado con 183,1±21,9mg/dL después del tratamiento; p<0,05). También se observó una disminución significativa en las concentraciones de LDL-C entre las concentraciones iniciales y luego de 6 meses de tratamiento con gel de testosterona (130,9±29,7mg/dL comparado con 118,5±21,3mg/dL; p<0,05). No se encontraron diferencias en las concentraciones de triglicéridos, HDL-C, VLDL-C y lipoproteína (a) (p=ns).
ConclusiónEl gel de testosterona, asociado a tratamiento estrogénico en mujeres ooforectomizadas, produce disminución de las concentraciones de colesterol y LDL-C posterior a 6 meses de tratamiento, sin afectar las concentraciones de triglicéridos, HDL-C, VLDL-C y lipoproteína (a).
To assess lipid profile changes in post-menopausal women treated with testosterone gel.
MethodsThirty-six oophorectomized women on estradiol treatment who received transdermal testosterone gel (5mg daily) were enrolled into our study. Cholesterol, triglycerides, high density lipoprotein cholesterol (HDL-C), low density lipoprotein cholesterol (LDL-C), very low density-lipoprotein cholesterol (VLDL-C), and lipoprotein (a) were tested before and after 6 months of treatment.
ResultsSelected participants had a mean age of 50.9±4.6 years and a body mass index of 30.1±3.8kg/m2. Significantly decreased cholesterol levels were found after 6 months of treatment (204.5±35.1mg/dL before treatment as compared to 183.1±21.9mg/dL after treatment; p<0.05). A significant reduction was also seen in LDL-C levels after 6 months of treatment with testosterone gel as compared to baseline (130.9±29.7mg/dL versus 118.5±21.3mg/dL; p<0.05). No differences were found in triglyceride, HDL-C, VLDL-C, and lipoprotein (a) levels (p=ns).
ConclusionEl gel de testosterona, asociado a tratamiento estrogénico en mujeres ooforectomizadas, produce disminución de las concentraciones de colesterol y LDL-C posterior a 6 meses de tratamiento, sin afectar las concentraciones de triglicéridos, HDL-C, VLDL-C y lipoproteína (a)Testosterone gel, associated to estrogen treatment in oophorectomized women, decreased cholesterol and LDL-C levels after 6 months of treatment, without affecting serum triglyceride, HDL-C, VLDL-C, and lipoprotein (a) levels.
Las enfermedades cardiovasculares son la principal causa de muerte en el mundo1. Su incremento de prevalencia en los hombres puede ser atribuido a bajas concentraciones de lipoproteínas de alta densidad comparada con las mujeres premenopáusicas2. La reducción del colesterol y del colesterol unido a proteínas de baja densidad (LDL-C) disminuye la incidencia de la enfermedad coronaria. La relación entre colesterol unido a proteínas de alta densidad (HDL-C) y la enfermedad coronaria es inversa en el mundo desarrollado. Cuando los niveles de HDL-C son menores de 50mg/dL, las mujeres en menopausia tienen tres veces mayor posibilidad de morir que las mujeres con concentraciones normales3. Una reducción del 11% en LDL-C y el incremento del 12% en HDL-C ha sido relacionada con una disminución del 34% en enfermedad coronaria4. Se piensa que las diferentes concentraciones de hormonas sexuales en el hombre y la mujer son factores importantes que contribuyen a las diferencias por sexos en las concentraciones de lipoproteínas. Esta observación demuestra que el uso de terapia de sustitución hormonal disminuye el riesgo cardiovascular5.
En mujeres sanas con menstruaciones normales, los ovarios y las glándulas adrenales contribuyen a la producción de aproximadamente 300μg de testosterona al día6. Sin embargo, el papel fisiológico de la testosterona en la mujer es poco claro7. A partir de los 30 años de edad, las mujeres experimentan una reducción significativa de las concentraciones séricas de andrógenos como consecuencia de la disminución relacionada con la edad8. Esto puede llevar a un síndrome clínico de insuficiencia androgénica femenina caracterizado por agotamiento, disminución de la sensación de bienestar y de la libido, alteraciones en la composición corporal y pérdida ósea. Si se asocia con bajas concentraciones de testosterona libre, estos signos y síntomas pueden ser aliviados con la administración de andrógenos, se ha planteado como una opción de tratamiento en la actualidad7.
Se ha sugerido que la restauración de las concentraciones fisiológicas de testosterona podría proteger el sistema cardiovascular en las mujeres en menopausia9, pero la hiperandrogenemia se asocia con disminución de las lipoproteínas de baja densidad, hiperinsulinemia, resistencia a la insulina e incremento de la acumulación de grasa abdominal, todo lo cual contribuye a aumentar el riesgo de enfermedades cardiovasculares10. También se ha propuesto que el incremento de la actividad lipolítica de la grasa visceral, inducida por los andrógenos, produce una liberación excesiva de ácidos grasos en la vena portal, produciendo disminución de la depuración hepática de insulina, aumento de la producción de glucosa y de lipoproteínas de muy baja densidad11.
En hombres con hipogonadismo, la administración de gel de testosterona tiene efectos diversos sobre los lípidos. La 5alfa-dihidrotestosterona transdérmica disminuye el colesterol y las lipoproteínas de baja densidad sin producir cambios en los triglicéridos o las lipoproteínas de alta densidad12. La testosterona transdérmica disminuye las concentraciones de lipoproteínas de alta densidad e incrementa la relación colesterol / HDL-C13. Estudios posteriores no han mostrado efectos indeseables en el perfil lipídico14. En la actualidad, aún existen controversias sobre los posibles efectos del uso de gel de andrógenos en mujeres con hipogonadismo por ooforectomía tratadas con estrógenos.
El objetivo de la investigación fue determinar las modificaciones del perfil lipídico en menopáusicas tratadas con gel de testosterona.
Materiales y métodoLa investigación fue realizada entre marzo de 2009 a diciembre del 2010 y se incluyeron en el estudio 36 mujeres con hipogonadismo por ooforectomía que asistieron a la consulta de Medicina Interna, Endocrinología y Ginecología del Hospital Central Dr. Urquinaona y fueron tratadas con gel de testosterona. El Comité de Ética del hospital aprobó el estudio y se obtuvo consentimiento por escrito de todas las participantes.
Las mujeres tenían entre 41 y 59 años de edad, fueron sometidas a histerectomía y salpingo-ooforectomía bilateral con síntomas climatéricos, fumaban menos de 5 cigarrillos por día y eran normotensas (menos de 140/90mm de Hg). Todas las mujeres debían haber utilizado previamente terapia de sustitución hormonal con 1mg de estradiol por lo menos durante 12 meses y no habían utilizado medicamentos que alteraran el metabolismo de los lípidos, antihipertensivos, vitaminas u antioxidantes en los 12 meses previos al inicio o durante el estudio. Se excluyeron las mujeres en menopausia con consumo de alcohol, antecedentes del uso de testosterona en los seis meses previos, uso de antidepresivos, enfermedad cardíaca, neoplásica, cerebrovascular, tromboembólica, hepática o renal previa. La cirugía se practicó por lo menos 12 meses antes que las mujeres se incluyeran en el estudio. Ninguna de las mujeres tenía elevaciones de las transaminasas o fosfatasa alcalina por encima de dos veces los valores normales de laboratorio. También se excluyeron a las participantes con antecedentes de hiperandrogenismo como hirsutismo y síndrome de ovarios poliquísticos. Se les realizó electrocardiograma a todas las participantes, y aquellas que presentaron electrocardiogramas anormales fueron excluidas del estudio.
Las participantes fueron tratadas con 1mg de estradiol oral y una dosis diaria de 5mg de testosterona (una aplicación) suministrada por un gel que contiene testosterona al 1%, alcohol etílico y agua destilada por 6 meses. El gel venia envasado en una botella de 40ml con un dispensador que suministraba cada vez 0,5g de gel que contiene 5mg de testosterona. El gel se aplicó en la superficie lateral interna del muslo en la noche (10 pm). Se les informó a las participantes que debía lavarse las manos inmediatamente después de la aplicación y no podían bañarse en las siguientes seis horas. Las muestras de sangre venosa se tomaron en la mañana, después de por lo menos 12 horas de ayuno, al momento del inicio del estudio y a los seis meses de tratamiento.
Las concentraciones de FSH y estradiol se midieron por radioinmunoensayo usando kits comerciales (Immulite 2000, Diagnostic Product Corp, EE.UU.). Los coeficientes de variación intra e interensayo fueron de 4 y 7% para FSH, y 5 y 9% para testosterona. El colesterol total y los triglicéridos se midieron usando métodos enzimáticos automáticos (COBASs Integra Colesterol y COBASs Integra tryglicerides) en un analizador Roche/Hitachi 74. La HDL-C se determinó después de precipitación selectiva usando manganeso heparina y posterior determinación enzimática de colesterol. Las lipoproteínas de baja densidad se calcularon usando la fórmula de Friedwald [LDL-C=(colesterol total-HDL-C) - (triglicéridos/5)]. Las concentraciones séricas de lipoproteína (a) se midieron utilizando una prueba inmunoturbidimétrica (Polymedco, EE.UU.). El límite de detección fue de 10mg/dL. Los coeficientes de variación intra ensayo fueron de<3%.
Se utilizó la prueba t de Student para muestras relacionadas para evaluar los cambios en las concentraciones séricas de los lípidos y lipoproteínas producidos por el gel de testosterona en las participantes. Se consideró p<0,05 como estadísticamente significativo.
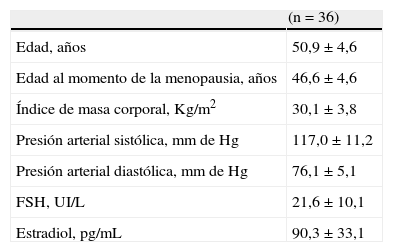
ResultadosLas características generales de las mujeres en menopausia se muestran en la tabla 1. La edad promedio de las participantes seleccionadas fue de 50,9±4,6 años, con un índice de masa corporal de 30,1±3,8Kg/m2, y concentraciones de FSH y estradiol de 21,6±10,1UI/L y 90,3±33,1pg/mL, respectivamente.
Características clínicas de las pacientes
| (n=36) | |
| Edad, años | 50,9±4,6 |
| Edad al momento de la menopausia, años | 46,6±4,6 |
| Índice de masa corporal, Kg/m2 | 30,1±3,8 |
| Presión arterial sistólica, mm de Hg | 117,0±11,2 |
| Presión arterial diastólica, mm de Hg | 76,1±5,1 |
| FSH, UI/L | 21,6±10,1 |
| Estradiol, pg/mL | 90,3±33,1 |
FSH: folitropina.
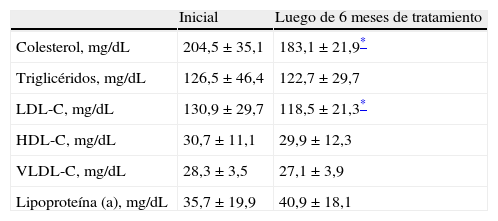
En la tabla 2 se muestran los valores promedio de las concentraciones de lípidos y lipoproteínas antes de y después del tratamiento con gel de testosterona. Se observó una disminución de las concentraciones de colesterol mayor de 10% al comparar los valores iniciales con los valores promedio tras seis meses de tratamiento (204,5±35,1mg/dL antes del tratamiento comparado con 183,1±21,9mg/dL después del tratamiento; p<0,05). Con respecto a los valores de triglicéridos plasmáticos, la concentración promedio inicial fue de 126,5±46,4mg/dL, encontrándose una disminución no significativa superior de 3% hasta llegar a 122,7±29,7 tras seis meses de tratamiento (p=ns).
Concentraciones de lípidos - lipoproteínas antes y después del tratamiento (n=36)
| Inicial | Luego de 6 meses de tratamiento | |
| Colesterol, mg/dL | 204,5±35,1 | 183,1±21,9* |
| Triglicéridos, mg/dL | 126,5±46,4 | 122,7±29,7 |
| LDL-C, mg/dL | 130,9±29,7 | 118,5±21,3* |
| HDL-C, mg/dL | 30,7±11,1 | 29,9±12,3 |
| VLDL-C, mg/dL | 28,3±3,5 | 27,1±3,9 |
| Lipoproteína (a), mg/dL | 35,7±19,9 | 40,9±18,1 |
HDL-C: colesterol unido a proteínas de alta densidad; LDL-C: colesterol unido a proteínas de baja densidad; VLDL-C: colesterol unido a proteínas de muy baja densidad.
Con respecto a las lipoproteínas (tabla 2), se observó una disminución significativa (mayor del 9%) en las concentraciones de LDL-C entre las concentraciones iniciales y tras seis meses de tratamiento con gel de testosterona (130,9±29,7mg/dL comparado con 118,5±21,3mg/dL; p<0,05). En cuanto a las concentraciones de HDL-C, las iniciales fueron de 30,7±11,1mg/dL, las cuales disminuyeron hasta 29,9±12,3mg/dL (−2,6%) tras seis meses de tratamiento (p=ns). Las concentraciones iniciales de VLDL-C fueron de 28,3±3,5mg/dL, presentando una disminución mayor de 4% hasta alcanzar 27,1±3,9mg/dL (p=ns). Las concentraciones de lipoproteína (a) fueron de 35,7±19,9md/dL antes del tratamiento y de 40,9±18,1mg/dL. Las concentraciones presentaron un aumento superior al 12%, pero este aumento fue considerado no significativo (p=ns).
DiscusiónLos resultados de la presente investigación demuestran que el gel de testosterona produce modificaciones significativas en las concentraciones de colesterol y LDL-C. También se demostró que no produce modificaciones significativas en las concentraciones de triglicéridos, HDL-C, VLDL-C y lipoproteína (a).
Entre los varios factores de riesgo conocidos para la enfermedad cardíaca coronaria, existen cinco que son citados con más frecuencia: hipertensión arterial, diabetes mellitus, hábito tabáquico, hiperlipidemia y obesidad. La disparidad entre sexos en la incidencia de enfermedades cardiovasculares ha sido interpretada como reflejo de la protección mediada por los estrógenos contra la aterogénesis, en contraste con la promoción de la arterosclerosis por parte de los andrógenos. Estudios clínicos al azar han demostrado que no existen beneficios cardiovasculares del uso de la combinación estrógenos/progestágenos en la mujer en menopausia15. La mayor susceptibilidad de los hombres a las enfermedades cardiovasculares puede ser debida a factores genéticos, hormonales, estilo de vida o a una combinación de mecanismo.
El efecto neto de la testosterona sobre los factores de riesgo de la enfermedad cardiovascular es difícil de determinar por varias razones16. Primero, las asociaciones entre las concentraciones de testosterona endógena y factores de riesgo cardiovascular se confunden por las múltiples interacciones de los andrógenos endógenos, distribución de la grasa corporal y sensibilidad a la insulina. Segundo, la testosterona exógena tiene marcados efectos, algunos de los cuales son benéficos sobre varios factores de riesgo como la disminución del fibrinógeno, plasminógeno e insulina, mientras que otros efectos pueden ser considerados como negativos (disminución de las concentraciones de HDL-C). Tercero, la relación causal entre los factores de riesgo y la aterosclerosis no ha sido plenamente comprobada. Cuarto, la testosterona ejerce sus efectos metabólicos tanto directamente como por medio de sus metabolitos estradiol y 5alfa-dihidrotestosterona. Los efectos de la testosterona y el estradiol pueden ser aditivos o contrarreguladores. Quinto, los polimorfismos en los genes de los receptores de andrógenos, globulina fijadora de hormonas sexuales y 5alfa-reductasa regulan los efectos biológicos y la biodisponibilidad de la testosterona y la 5alfa-dihidrotestosterona, respectivamente.
Los efectos de los estrógenos orales y transdérmicos sin oposición sobre el metabolismo de los lípidos - lipoproteínas están claramente definidos. Se conoce que el uso de estrógenos modifica el perfil lipídico y las concentraciones de lipoproteínas17. La terapia con estrógenos ha demostrado que reduce las concentraciones séricas de LDL-C e incrementa las de HDL-C en una forma dependiente de la dosis18. En años recientes, existe un creciente interés sobre el tratamiento con andrógenos de las mujeres con hipogonadismo por ooforectomía. Aunque la adición de dosis bajas de testosterona al tratamiento estrogénico ha demostrado mejorías en la composición corporal19 y densidad mineral ósea20, aún se conoce poco sobre los efectos de estas sustancias sobre los factores de riesgo cardiovascular. Estudios previos han comprobado que la principal indicación para administración de testosterona por medio de gel transdérmico en mujeres en menopausia es la disfunción sexual, ya que produce mejoría de los síntomas6,21.
Diferentes investigaciones han indicado que la co-administración de andrógenos atenúa el efecto cardioprotector de los estrógenos sobre la HDL-C sérica; reduce el colesterol total y los triglicéridos22,23; tienen un efecto neutro sobre el flujo sanguíneo24, mientras que el tratamiento con testosterona parenteral no produce modificaciones en las concentraciones de lipoproteínas, pero mejora la vasodilatación tanto dependiente como independiente del endotelio asociada a la terapia hormonal de reemplazo en la menopausia25.
En la presente investigación se demostró que el gel de testosterona (sumado al tratamiento estrogénico) produce disminución de las concentraciones de colesterol y LDL-C. También se observó un efecto neutro sobre las concentraciones de HDL-C, lo cual es contrario a lo reportado por investigaciones previas23. Estudios en hombres han demostrado un incremento superior al 30% de las concentraciones de HDL-C posterior al uso de altas dosis de andrógenos26. Resultados similares se han observado con el uso de andrógenos no aromatizados y se han asociado con un incremento de la actividad de la lipasa de triglicéridos hepática, la cual incrementa el catabolismo de la HDL-C12.
El significado clínico de los cambios reportados en esta investigación, y en estudios previos, con respecto a los factores de riesgo para enfermedad cardiovascular es desconocido, aunque se ha sugerido que los cambios en las concentraciones de HDL-C inducidos por los andrógenos no deberían ser considerados como pro-aterogénicos, debido a que podrían reflejar una aceleración del transporte reverso del colesterol27. Estudios clínicos y epidemiológicos suministran evidencias de los efectos cardioprotectores de las concentraciones de HDL-C atribuidos a su papel en el transporte reverso de colesterol, pero también a su efecto sobre las células endoteliales y actividad antioxidante.
A diferencia de lo observado en los resultados de la presente investigación (efectos no significativos sobre las concentraciones de triglicéridos), se ha reportado previamente que las mujeres ooforectomizadas tratadas con estrógenos conjugados y andrógenos experimentan una reducción significativa en la concentración de triglicéridos plasmáticos comparado con aquellas en tratamiento con estrógenos conjugados solos28. Este hallazgo debería ser tomado en consideración debido a que las lipoproteínas que contienen triglicéridos están relacionadas en forma cercana con la viscosidad del plasma, un factor de riesgo establecido para enfermedad cardiovascular29. Existe alguna evidencia que propone a los triglicéridos como un factor de riesgo en ciertos subgrupos de pacientes, incluyendo las menopáusicas. Además, es bien conocido que los efectos sobre las concentraciones de triglicéridos son dependientes de la ruta de administración de las hormonas4.
El efecto de disminución de las concentraciones de LDL-C observado en la presente investigación podría proteger contra la aterosclerosis como ha sido propuesto previamente16. La endocitosis de las moléculas de LDL-C permite que los ésteres de colesterol sean liberados en los diferentes tejidos. Esta captura es regulada por las concentraciones de colesterol libre que modula la expresión de receptores de LDL-C en la membrana celular. La LDL-C acetilada y la LDL-C oxidada interactúan con el receptor de recuperación ubicado en la superficie celular del macrófago, para permitir la acumulación intercelular de LDL-C. Este tipo de proceso, el cual forma células espumosas, parece favorecer el desarrollo de aterosclerosis.
Se concluye que el gel de testosterona, asociado a tratamiento estrogénico en mujeres ooforectomizadas, produce disminución de las concentraciones de colesterol y LDL-C tras 6 meses de uso.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.