Las dislipemias (alteraciones del metabolismo lipoproteínico) son un factor de riesgo de enfermedad cardiovascular de creciente prevalencia. La determinación de las concentraciones de lípidos, lipoproteínas y proteínas relacionadas circulantes permite el diagnóstico, el tratamiento y el seguimiento de las diferentes dislipemias. Sin embargo, existen numerosos factores que influyen en la concentración de estos constituyentes en la circulación y dependen tanto del individuo (hábitos, características físicas, otros factores de riesgo) como de la muestra analizada y la metodología analítica empleada, y hay que tenerlos en cuenta a la hora de valorar e interpretar los resultados analíticos. Asimismo, las diferentes dislipemias pueden tener su origen no sólo en factores ambientales, sino en factores genéticos; por este motivo, la inclusión de pruebas genéticas para el diagnóstico de las dislipemias es cada vez más frecuente.
The prevalence of dyslipidemia (alterations in lipoprotein metabolism) as a risk factor for cardiovascular disease continues to rise. Determination of circulating levels of lipids, lipoproteins and related proteins allows the diagnosis, treatment and followup of the various types of dyslipidemia. However, numerous factors influence the concentration of these constituents in the circulation. These factors depend both on the individual (habits, physical characteristics, presence of other risk factors) and on the sample and analytical methods employed and must be taken into account when assessing and interpreting laboratory results. Similarly, the cause of the different forms of dyslipidemia may lie not only in environmental but also in genetic factors. Consequently, the inclusion of genetic tests in the diagnosis of dyslipidemia is increasingly frequent.
Las alteraciones del metabolismo lipídico (dislipemias) son un problema frecuente y creciente. Las dislipemias se detectan mediante el análisis de la concentración de los lípidos circulantes, pero esta concentración está influida por numerosos factores, como la absorción digestiva, la síntesis de las lipoproteínas (las partículas mixtas de lípidos y apolipoproteínas que permiten disolver los lípidos en medio acuoso) y su circulación, el metabolismo de las lipoproteínas y su interacción con las células mediante receptores específicos, los procesos que afectan a esta interacción como la correcta síntesis de las proteínas receptoras o de las apolipoproteínas que se unen a ellas y el balance entre los mecanismos de transporte de lípidos desde el hígado a los tejidos extrahepáticos y el transporte inverso desde los tejidos extrahepáticos al hígado. El análisis de los lípidos circulantes proporciona los elementos fundamentales para el diagnóstico fenotípico de las dislipemias y para la indicación y el seguimiento de su tratamiento. Sin embargo, la clasificación fenotípica de las dislipemias no distingue si una dislipemia es secundaria (p. ej., a la dieta) o primaria (defectos genéticos que afectan a cualquiera de las etapas anteriormente señaladas). Por esta razón, los laboratorios de lípidos ya no sólo realizan análisis de lípidos circulantes, sino que han incluido pruebas genéticas de mayor o menor complejidad en su cartera de servicios. En esta revisión se repasa algunos temas de importancia para realizar e interpretar correctamente los análisis de lípidos, incluidos aspectos del individuo que se analiza y de los métodos empleados en el análisis.
PERFIL LIPÍDICOLos resultados de los análisis de lípidos circulantes están influidos por diversos factores: los propios del individuo en estudio (fisiológicos o patológicos), de la muestra que se analiza o del método analítico empleado (analíticos). Los factores fisiológicos y de la muestra, denominados preanalíticos, son múltiples y dependen tanto del individuo analizado, sus hábitos conductuales y tóxicos y de su estado fisiológico como de la muestra obtenida y de la forma de obtenerla y conservarla. Esta variación preanalítica afecta de forma diferencial a los diversos constituyentes del perfil lipídico y existen unas recomendaciones internacionales1 para minimizarla. A continuación se detallan estas recomendaciones para las causas más frecuentes de variabilidad preanalítica.
FACTORES PREANALÍTICOS QUE INFLUYEN EN EL PERFIL LIPÍDICODel individuoAlcohol, tabacoEn el caso del alcohol, los efectos dependen del consumo. Un consumo máximo de hasta 20g/día en mujeres o hasta 30g/día en varones induce un perfil lipídico con aumento del colesterol ligado a lipoproteínas de alta densidad (cHDL) respecto a los abstemios; consumos superiores aumentan más el cHDL, pero también los triglicéridos (Tg)2. Los fumadores tienen mayor concentración de Tg y colesterol ligado a lipoproteínas de baja densidad (cLDL) y menor de cHDL y apolipoproteína A-I (apoA-I)3. Los efectos dependen cuantitativamente del consumo. Se recomienda no variar el consumo alcohólico y tabáquico habitual antes de la obtención de las muestras.
AyunoLa determinación de colesterol total, apoA-I y apoB y lipoproteína (a) [Lp(a)] no requiere ayuno previo, ya que no muestran modificaciones posprandiales evidentes. Sin embargo, la ingestión de cualquier grasa aumenta de forma variable la concentración de los Tg y del colesterol de las lipoproteínas de muy baja densidad (cVLDL) y disminuye (5-10%) el cHDL. En consecuencia, las muestras deben obtenerse tras ayuno de 10–12h, excepto para la determinación de colesterol total y apolipoproteínas.
CaféEl efecto del café en los lípidos parece depender de su forma de elaboración. El café hervido aumenta las concentraciones de colesterol total, cLDL y Tg4; el café filtrado no parece afectarlas significativamente. Debería evitarse la ingestión de café en las 10–12h previas a la extracción, de acuerdo con la recomendación de ayuno previo a la extracción.
DietaLas concentraciones de colesterol total, cLDL, Tg y apoB se incrementan con el consumo de grasa saturada; el incremento es menor en el caso del consumo de grasa poliinsaturada. El consumo de grasa monoinsaturada tiende a disminuir las concentraciones de estos constituyentes5. Los vegetarianos presentan mayor concentración de cHDL y menor de cLDL; los efectos de la dieta vegetariana se observan aproximadamente a las 5 semanas de iniciada. En consecuencia, para que el perfil lipídico sea representativo del efecto de la dieta habitual, ésta debe mantenerse durante las 2 semanas previas a la extracción, independientemente de que se trate de una dieta hipolipemiante o no.
EdadLas concentraciones de los constituyentes lipídicos aumentan con la edad, excepto las de cHDL. Este hecho se ha observado en diferentes poblaciones, entre ellas la española6. En los recién nacidos las concentraciones de los constituyentes lipídicos aumentan hasta alcanzar el 75-80% de los valores del adulto durante la primera semana de vida7; la Lp(a) es una excepción, ya que aumenta más lentamente.
EjercicioEl nivel de ejercicio habitual debe mantenerse sin cambios antes de las extracciones, aunque se debe evitar cualquier ejercicio extenuante o no habitual 24h antes8. El ejercicio intenso, especialmente de tipo aeróbico, modifica los constituyentes lipídicos y disminuye especialmente las concentraciones de Tg y aumenta las de cHDL y apoA-I9. El ejercicio regular produce similares cambios, pero de menor magnitud10.
Embarazo, parto, lactanciaNo se debería realizar perfiles lipídicos durante el embarazo, excepto en el caso del seguimiento de algunas hipertrigliceridemias severas que pueden exacerbarse durante la gestación. En el embarazo aumentan las concentraciones de todos los constituyentes lipidíeos, inclusive las apolipoproteinas y la Lp(a)11. Las concentraciones lipidicas vuelven a los valores previos aproximadamente a los 3 meses del parto o del final de la lactación12.
EnfermedadesCualquier enfermedad aguda o crónica agudizada causa alteración en el perfil lipidico. Esta alteración se produce especialmente a expensas de una disminución del cHDL y, posteriormente, del cLDL13. Sin embargo, durante las primeras 12–24h de evolución de episodios agudos (p. ej., infarto de miocardio, accidente cerebrovascular), el perfil lipidico -especialmente el colesterol total, el cHDL y el cLDL- permanece lo suficientemente estable para ser representativo del estado previo a la fase aguda8. Se recomienda que el perfil lipidico se valore durante las primeras 24h de evolución de los episodios agudos y, si no es posible, no se valore hasta después de 2–3 meses de la resolución de cualquier enfermedad aguda o agudización de una crónica.
EtniaExisten pocas variaciones dependientes de la etnia, excepto las relacionadas con dietas especificas. Se ha descrito una mayor concentración de Lp(a) en la raza negra14.
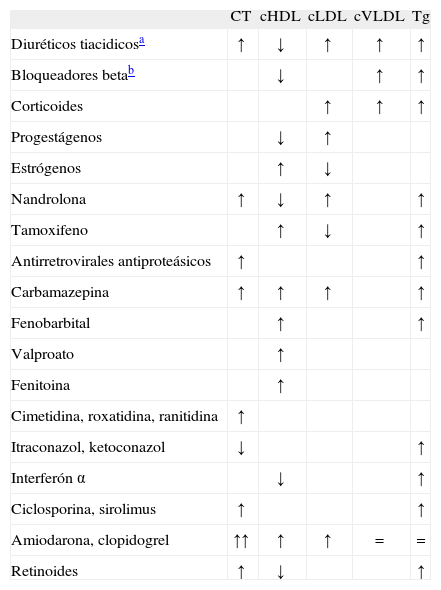
FármacosNumerosos fármacos, aparte de los hipolipemiantes, pueden alterar el perfil lipidico habitual (tabla 1)15. Se recomienda suspender, desde varios dias a semanas antes del análisis y siempre que sea posible, las medicaciones que alteren el perfil lipídico; si esto no resulta posible, debe registrarse la medicación, con especial atención a su dosis y el momento de la última toma, para relacionarla con eventuales alteraciones del perfil lipidico.
Efecto de diferentes fármacos sobre el perfil lipídico
| CT | cHDL | cLDL | cVLDL | Tg | |
| Diuréticos tiacidicosa | ↑ | ↓ | ↑ | ↑ | ↑ |
| Bloqueadores betab | ↓ | ↑ | ↑ | ||
| Corticoides | ↑ | ↑ | ↑ | ||
| Progestágenos | ↓ | ↑ | |||
| Estrógenos | ↑ | ↓ | |||
| Nandrolona | ↑ | ↓ | ↑ | ↑ | |
| Tamoxifeno | ↑ | ↓ | ↑ | ||
| Antirretrovirales antiproteásicos | ↑ | ↑ | |||
| Carbamazepina | ↑ | ↑ | ↑ | ↑ | |
| Fenobarbital | ↑ | ↑ | |||
| Valproato | ↑ | ||||
| Fenitoina | ↑ | ||||
| Cimetidina, roxatidina, ranitidina | ↑ | ||||
| Itraconazol, ketoconazol | ↓ | ↑ | |||
| Interferón α | ↓ | ↑ | |||
| Ciclosporina, sirolimus | ↑ | ↑ | |||
| Amiodarona, clopidogrel | ↑↑ | ↑ | ↑ | = | = |
| Retinoides | ↑ | ↓ | ↑ |
cHDL: colesterol ligado a lipoproteinas de alta densidad; cLDL: colesterol ligado a lipoproteinas de baja densidad; CT: colesterol total; cVLDL: colesterol de las lipoproteinas de muy baja densidad; Tg: triglicéridos.
A partir de la pubertad, los varones experimentan una disminución de la concentración de cHDL, mientras que en las mujeres aumenta hasta la menopausia16. En la perimenopausia el colesterol total y el cLDL pueden aumentar aproximadamente un 15 y un 20%, respectivamente; una vez ocurrido este aumento, se mantiene durante la menopausia17.
Peso corporalLa obesidad aumenta las concentraciones de Tg, colesterol total y cLDL, a la vez que disminuye las de cHDL18. La disminución de peso corrige estas modificaciones, que se observan más precozmente (a partir de 2–4 semanas) en la concentración de Tg.
Variación biológica individualLa variación biológica individual es uno de los factores más importantes y menos conocidos para interpretar el perfil lipidico. Independientemente de los factores ya mencionados, hay variaciones individuales e interindividuales de las concentraciones lipidicas que originan variación biológica. Las variaciones individuales generalmente son mayores que las analiticas; ante una variación inesperada de una magnitud lipidica, siempre se deberia excluir las causas extraanaliticas antes que las analiticas. La variación individual es diferente según las poblaciones en que se estudie; en nuestro pais se ha calculado la variación individual de los constituyentes lipidicos (tabla 2)19. De todos los constituyentes lipídicos, los Tg son los que muestran una mayor variación individual, y algunos estudios han demostrado que puede llegar hasta el 30% en muestras obtenidas en ayunas19. Esta variabilidad también debe tenerse en cuenta para considerar significativos los resultados de la terapéutica. Se ha recomendado obtener muestras seriadas para minimizar la variabilidad individual; en la práctica, la seriación sólo es recomendable para casos dudosos de decisión clínica o terapéutica.
Variaciones individuales de los principales constituyentes lipídicos
| Magnitud | Variabilidad intraindividual (%) | Variabilidad analítica (%) |
| Colesterol total, Tg, cHDL, cLDL, apoA-I, apoB, Lp(a) | 7; 18; 7; 14; 6,5; 13,5; 9* | < 1; < 3; < 4, según métodos (2-10%); < 5; < 5; < 5 |
Apo: apolipoproteína; cHDL: colesterol ligado a lipoproteínas de alta densidad; cLDL: colesterol ligado a lipoproteínas de baja densidad; Tg: triglicéridos.
Idealmente, las extracciones deberían realizarse en sedestación, tras 5min de reposo. El torniquete (produce hemoconcentración) no debería mantenerse más de 1min y, de ser posible, debería realizarse la extracción sin utilizarlo.
Condiciones de la muestraSe debe obtener preferentemente muestras de suero o plasma (con heparina con litio o sódica o ácido etilendiaminotetraacético [EDTA] como anticoagulante). Los valores obtenidos en plasma se habrían de multiplicar por 1,03 para igualarlos a los obtenidos en suero, ya que las concentraciones recomendadas para el diagnóstico y fijar objetivos terapéuticos de las dislipemias se refieren a valores obtenidos en muestras de suero. Ciertos anticoagulantes tienen un efecto osmótico y extraen agua de los elementos formes (hematíes, principalmente) hacia el plasma y lo diluyen. Este efecto es máximo con anticoagulantes como el citrato y el oxalato8. En el caso de la heparina y el EDTA, el efecto osmótico es menor; no obstante, el efecto lipolítico de la heparina puede causar disminución in vitro de las concentraciones de los Tg si la muestra no se conserva a baja temperatura20. La separación del suero/plasma debe hacerse antes de las 3h de la extracción. Si no se analiza inmediatamente los constituyentes lipídicos del suero/plasma, deben mantenerse a 4°C durante un máximo de 24h; los lípidos asociados a las lipoproteínas de baja y alta densidad son los más inestables en refrigeración; por el contrario, el colesterol total se mantiene inalterado tras 4 días a temperatura ambiente. La estabilidad en congelación depende de los constituyentes y la temperatura. A −20°C, la concentración de colesterol total es estable, pero se recomienda no conservar los demás constituyentes lipídicos más de 3 meses a esa temperatura. Se asume que a −70 o −80°C los constituyentes lipídicos son estables indefinidamente (al menos 2 años).
ASPECTOS METODOLÓGICOS QUE INFLUYEN EN EL PERFIL LIPÍDICOTeniendo en cuenta su uso en la clínica, las magnitudes lipídicas se podrían dividir en dos grupos: las determinaciones no especializadas, como colesterol total, Tg totales, fracciones de colesterol (cHDL, cLDL), apolipoproteínas y Lp(a), y las determinaciones propias de laboratorios especializados (el resto).
Colesterol totalLos métodos actualmente disponibles miden el colesterol total con la exactitud (inexactitud<4%) y precisión (imprecisión<4%) requeridas para que sus resultados sean comparables a los obtenidos con métodos de referencia o internacionalmente recomendados.
TriglicéridosLa determinación de los Tg totales en el plasma es metodológicamente sencilla; los métodos disponibles satisfacen las actuales recomendaciones internacionales de inexactitud (< 5%) e imprecisión (< 5%); las variaciones plasmáticas de Tg observadas en los pacientes dependen más de la elevada variabilidad individual de este constituyente (aproximadamente un 2030%) que de variaciones metodológicas. Sin embargo, hay un factor metodológico que puede ser causa de falsas hipertrigliceridemias. La determinación de Tg se realiza midiendo el glicerol (los triglicéridos son combinaciones de glicerol con 3 ácidos grasos) que contienen las muestras; en caso de que en el plasma haya glicerol libre, no unido a los Tg, éste se mide como si proviniera de ellos. Por lo tanto, el glicerol libre circulante causa falsos aumentos de Tg. En la diabetes descompensada y en los sujetos sometidos a nutrición parenteral, la concentración de glicerol puede falsear hasta en un 100% la verdadera concentración de Tg. Se ha demostrado que hasta un 4% de los pacientes ambulatorios y un 12% de los ingresados presentan concentraciones de glicerol libre que falsean en más de un 10% la concentración de Tg21. En consecuencia, se recomienda que el glicerol libre solamente se deduzca de la cifra de Tg en los pacientes hospitalizados con diabetes mellitus descompensada o en nutrición parenteral y en los pacientes ambulatorios en los que los datos clinicos lo justifiquen22. Sin embargo, independientemente del tipo de pacientes de que se trate, la concentración de Tg es necesaria para calcular el cLDL mediante la fórmula de Friedewald (véase más adelante). Por ello, la inexactitud de la medición es critica en todos los casos en que se utilice para el citado cálculo.
Colesterol de las lipoproteinasEl método de referencia para determinar las dos fracciones clinicamente significativas del colesterol (cHDL y cLDL) se basa en separarlas por ultracentrifugación. Sin embargo, éste es un método sólo reservado a laboratorios especializados, caro en personal e instrumental y no aplicable a grandes series de muestras. Por este motivo, los laboratorios clinicos utilizan métodos alternativos para ambas determinaciones. Los métodos alternativos son más practicables, pero presentan algunas fuentes de error que hay que conocer para su correcto uso en la práctica clinica.
Para medir el cHDL hay dos grandes tipos de métodos alternativos. El primer grupo requiere la separación de cHDL del resto de las lipoproteinas por precipitación de estas últimas mediante agentes quimicos (métodos de precipitación); el segundo grupo permite medir el cHDL sin tal separación y agrupa los denominados métodos homogéneos, directos. Los métodos homogéneos son los más empleados para medir el cHDL. Muchos de los resultados de cHDL obtenidos en los grandes estudios epidemiológicos que sirven de base para las actuales tablas de cálculo de riesgo se han obtenido mediante los métodos de precipitación. Los resultados obtenidos con los métodos directos, homogéneos, muestran muy buena correlación con los obtenidos con métodos por precipitación; en consecuencia, y de acuerdo con las recomendaciones internacionales, los actuales métodos homogéneos "mantienen" la base de conocimiento obtenida con los métodos de precipitación en estudios ya antiguos, como el de Framingham, los estudios MONICA y PROCAM, etc. Algunos métodos directos pueden producir resultados falsamente elevados en la hipertrigliceridemia severa (> 600–800mg/dl); este hecho debe tenerse en cuenta para la interpretación de los resultados de cHDL en esta situación.
La determinación exacta del cLDL es uno de los grandes retos del laboratorio clinico. Las recomendaciones internacionales fijan como objetivos de calidad analitica para cualquier método que mida la concentración de cLDL con un error total<12%, una imprecisión máxima del 4% y una inexactitud máxima del±4%23. El objetivo de error total, desafortunadamente, no se alcanza en todas las muestras por los métodos actualmente disponibles para medir o calcular el cLDL. Las numerosas manipulaciones que requiere la ultracentrifugación dificultan la obtención de estos objetivos; como alternativa a la ultracentrifugación, los laboratorios clinicos disponen de los métodos homogéneos, directos (semejantes a los empleados para cHDL) y del cálculo mediante la fórmula de Friedewald. Los métodos homogéneos son de reciente introducción en la práctica habitual, y empiezan a estar suficientemente contrastados como para que en un futuro próximo sean los más utilizados para medir el cLDL; sin embargo, el método más utilizado en la actualidad es el cálculo de Friedewald. La fórmula de Friedewald para calcular el cLDL se basa en dos premisas: primero, que la relación entre los Tg y el cVLDL es constante y próxima a 5 (cuando las magnitudes se expresan en mg/dl), y segundo, que prácticamente todos los Tg del plasma están unidos a las particulas VLDL. En estas condiciones, el cVLDL se puede calcular como: Tg del plasma/5. A partir de este cálculo, el cLDL puede calcularse fácilmente como24: cLDL=colesterol total - cHDL - (Tg/5). El cálculo de Friedewald no puede aplicarse a muestras con Tg>400mg/dl o en pacientes con disbetalipoproteinemias, hepatopatias, nefropatias o incluso diabetes, situaciones en que la razón colesterol/Tg en VLDL dista mucho del factor 5. Sin embargo, incluso en las condiciones teóricas de aplicación, la fórmula de Friedewald subestima el verdadero cLDL en más de un 10% en un 10-15% de las muestras con Tg entre 50 y 200mg/dl, en el 25% de las muestras con 200–300mg/dl y en casi el 50% de las que contienen 300–400mg/dl25. Si los Tg son superiores a esta cifra, el cálculo del cLDL puede llegar a producir resultados negativos. Estos datos son fundamentales para la correcta valoración de la concentración de cLDL, el constituyente lipidico clave para el diagnóstico, la indicación y el control de la terapéutica de las dislipemias.
Apolipoproteinas A-I y B en plasmaLa determinación de apoA-I y apoB se halla perfectamente estandarizada al existir unas preparaciones estándar de la Organización Mundial de la Salud (OMS) que facilitan la equivalencia ("transferibilidad") de los resultados entre los diferentes métodos; las variaciones de los valores de apoA-I y apoB entre diferentes poblaciones sólo dependen de los sujetos en que se mide y no de las metodologias.
Lipoproteina (a)La Lp(a) es una forma modificada de la LDL que contiene una apolipoproteina adicional, la apo(a). La Lp(a) es rica en colesterol, pero su contribución al colesterol aterogénico [cVLDL, cIDL, cLDL, cLp(a)] es escasa, ya que no representa más del 5%.
La molécula de Lp(a) es compleja; la apo(a) es muy polimórfica y es la determinante de las concentraciones plasmáticas de Lp(a). Cuando en la apo(a) hay pocas copias de una molécula polipeptidica denominada kringle 4 tipo 2, las concentraciones plasmáticas aumentan y, con ellas, el riesgo cardiovascular, y viceversa. La mayor parte de métodos de medida de Lp(a) son inmunoanálisis que utilizan anticuerpos contra la molécula completa o contra la apo(a)26. La naturaleza de los anticuerpos y su capacidad para reconocer las repeticiones del kringle 4 tipo 2, así como su número, determinan la concentración de Lp(a) medida por los diferentes inmunoanálisis. A pesar de las numerosas fuentes de variación existentes para la determinación de Lp(a), en la bibliografía médica se ha consensuado una concentración>300mg/l como indicio de riesgo cardiovascular aumentado26, aunque este valor es sólo indicativo. Cuando se disponga de un estándar internacional que permita homologar los resultados de los diferentes métodos, se podrá recomendar valores de referencia y validar estudios de relación entre Lp(a) y riesgo cardiovascular.
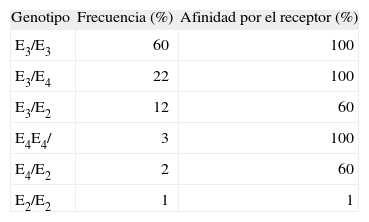
DETERMINACIONES ESPECIALIZADASGenotipos de la apoELa apoE forma parte de las lipoproteínas ricas en Tg (quilomicrones y VLDL) y de sus respectivas partículas remanentes, así como de una subfracción minoritaria de las HDL. Su interacción con los receptores de LDL (receptor apoB, E, rLDL) o el LRP (LDL-receptor related protein) permite el aclaramiento de los remanentes de las lipoproteínas ricas en Tg. La apoE es genéticamente heterogénea. Las tres isoformas más comunes (apoE2, apoE3 y apoE4) dan lugar a seis genotipos (tabla 3).
La homocigosis para la apoE2 (genotipo E2/E2) es causa de la disbetalipoproteinemia, que se caracteriza por un incremento plasmático de las lipoproteínas de densidad intermedia (IDL). Sin embargo, la expresión fenotípica de la dislipemia sólo ocurre cuando concurren además determinados factores como obesidad, diabetes, hipotiroidismo o menopausia, entre otros. Los portadores del alelo E4, por su parte, tienen concentraciones ligeramente aumentadas de colesterol27. Este alelo también se ha asociado a las formas tardías de la enfermedad de Alzheimer28. El gen de la apoE está situado en el cromosoma 19q13.2 y consta de 4 exones y 3 intrones29. Las mutaciones afectan a la secuencia de reconocimiento de una enzima de restricción (Cfo I), lo que permite detectar dichas mutaciones analizando el patrón de bandas generadas por la digestión con dicha enzima.
Subfracciones de lipoproteínas de baja densidadLa abundancia anormal de partículas LDL de menor tamaño y mayor densidad (tipo B) se denomina fenotipo B30; estas partículas se hallan aumentadas en el síndrome metabólico, la hiperlipemia combinada o la dislipemia diabética. El fenotipo de LDL se puede identificar mediante diferentes técnicas31; la principal de ellas es la electroforesis. Existe un equipo comercial que permite medir de forma relativamente sencilla hasta 7 subfracciones de LDL de diferente tamaño. El aislamiento de las diferentes subfracciones de LDL mediante ultracentrifugación en gradiente es una técnica más compleja y, por ello, menos utilizada; sin embargo, permite estudiar la composición de cada subfracción. La espectroscopia de resonancia magnética permite identificar en una misma muestra varias subfracciones de diferentes lipoproteínas: 6 de VLDL, 2 de LDL y 2 de HDL; en todo el mundo, esta técnica se realiza en un único laboratorio comercial32.
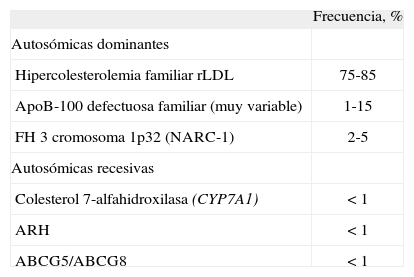
Defectos genéticos que se expresan como hipercolesterolemia familiar (HF)En la denominación de HF se agrupan varias alteraciones genéticas que se manifiestan con un fenotipo de hipercolesterolemia aislada. La causa más frecuente de la HF son mutaciones en el gen que codifica para el receptor de las LDL33. El gen LDLR (19 p13.3) presenta numerosas mutaciones (más de mil) que producen alteraciones en todas las fases del proceso celular del receptor LDL (rLDL). Al interaccionar con la molécula de apoB que se integra en las partículas LDL, el rLDL permite la entrada del colesterol circulante a las células; las mutaciones del gen que codifica para la apolipoproteína B (APOB) también producen hipercolesterolemia, y ambos defectos se heredan de forma autosómica dominante33. También existen mutaciones que afectan a otras proteínas implicadas en el metabolismo del colesterol, como CYP7A1 o ARH, y cuyo patrón de herencia es autosómico recesivo; sin embargo, entre el 80 y el 95% de las HF están causadas por mutaciones que se heredan de forma dominante como las de LDLR o el APOB (tabla 4). En nuestro país se ha desarrollado un sistema de biochip de ADN (o DNA microarray) de alta densidad, denominado Lipochip®, con el que se puede detectar las mutaciones más frecuentes del rLDL, la apoB e incluso apoE que se relacionan con hipercolesterolemia34; con este sistema se puede diagnosticar HF sin recurrir a largos y tediosos procesos de secuenciación de los genes que la causan, algunos de los cuales se caracterizan por tener una región codificadora larga y muy fragmentada. Dado que el sistema no está comercialmente disponible para los laboratorios clinicos y requiere una inversión importante en infraestructura, su uso por ahora se halla muy restringido, aspecto que no favorece el uso habitual de esta tecnologia. Un aspecto favorable es que cuando el biochip de ADN permite reconocer la mutación presente en el caso indice de una familia con HF, se puede utilizar análisis más simples y baratos, como la digestión con enzimas de restricción, dirigidos a la búsqueda de la mutación identificada en el resto de los miembros de la familia; este hecho abarata notablemente la identificación de portadores de HF.
Frecuencia de las distintas formas de hipercolesterolemias familiares
| Frecuencia, % | |
| Autosómicas dominantes | |
| Hipercolesterolemia familiar rLDL | 75-85 |
| ApoB-100 defectuosa familiar (muy variable) | 1-15 |
| FH 3 cromosoma 1p32 (NARC-1) | 2-5 |
| Autosómicas recesivas | |
| Colesterol 7-alfahidroxilasa (CYP7A1) | < 1 |
| ARH | < 1 |
| ABCG5/ABCG8 | < 1 |
Tomado de Rader et al33.
Se ha demostrado una relación entre los remanentes (procedentes de la metabolización de las particulas originales) de las lipoproteinas ricas en Tg (LRT) (quilomicrones, VLDL) y la arteriosclerosis35. La valoración de los remanentes de las LRT es dificil, ya que se trata de particulas dificiles de diferenciar de sus precursores (quilomicrones y VLDL); tienen un catabolismo rápido y, en consecuencia, una baja concentración circulante. Son, además, muy heterogéneas, al producirse por diferentes procesos y en diferentes momentos metabólicos. Las LRT de menor tamaño se han relacionado con la arteriosclerosis. Los métodos para su identificación y/o cuantificación se desarrollan en dos etapas. La primera es su aislamiento por diferentes técnicas; la segunda, la medición de su contenido en colesterol y Tg. La etapa de separación se ha realizado mediante diversos métodos. El primero de ellos es la ultracentrifugación en gradiente de densidad, la técnica de referencia para la separación de las lipoproteinas; los remanentes de las LRT se localizan en el rango de densidad (1,006<d<1,019kg/l) de las IDL. También se las ha separado e identificado mediante otras técnicas, como electroforesis y análisis de apolipoproteinas especificas (apoB-48 y apoC-III). Todas estas técnicas son altamente complejas; la única aplicable por laboratorios no especializados es un método basado en la utilización de anticuerpos contra la apoAI y la apoB, que forman inmunocomplejos con los quilomicrones, VLDL de mayor tamaño, HDL y LDL y, de esta manera, permiten medir el colesterol y los Tg de los remanentes de las LRT de menor tamaño36.
Apolipoproteínas C-II y C-IIILas apoC-II y apoC-III desempeñan un papel importante en el catabolismo de las LRT. La apoC-II es el cofactor de la lipoproteinlipasa, que metaboliza las LRT, y la apoC-III inhibe esta actividad enzimática. Ambas apolipoproteinas se encuentran mayoritariamente en los quilomicrones y las VLDL y en menor proporción en HDL e IDL. Existen métodos inmunológicos para medir la concentración circulante de la apoC-II y la apoC-III, alguno de ellos comercializado. Sin embargo, no existe ningún estándar internacionalmente aceptado que homologue los resultados de los diferentes métodos y no se conoce exactamente la especificidad de los anticuerpos utilizados en los análisis; en consecuencia, no existe un valor de referencia para definir los incrementos de ambas. Con los métodos actualmente disponibles sólo puede confirmarse la deficiencia genética de apoC-II.