La acromegalia es una enfermedad que se caracteriza por un exceso de la hormona del crecimiento (GH), la cual se inicia tras el cierre de las placas epifisarias de los huesos largos. La somatostatina es una hormona peptídica con una vida media corta (2-3min) y es sintetizada en muchos tejidos, incluyendo el hipotálamo, con la finalidad de inhibir la secreción de la GH. Esta hormona media sus acciones a través de 5 subtipos de receptores (SSR), de los cuales el SSR2 y el SSR5 son los más expresados en los adenomas de la hipófisis1. El octreotide es un análogo sintético de la somatostatina con acción inhibitoria de la secreción de GH y de diversas hormonas tanto gastrointestinales como pancreáticas1.
Presentamos el caso de un paciente varón de 37 años de edad, natural y procedente de Mérida (Venezuela), sin antecedentes personales ni familiares patológicos, que fue referido a la Unidad de Endocrinología por presentar cambios fisonómicos de 7 años de evolución, así como cefalea holocraneana de fuerte intensidad y hemianopsia heterónima bitemporal desde hacía 5 meses.
El examen físico reveló un peso corporal de 102kg, talla 185,0cm, un índice de masa corporal (IMC) de 29,8kg/m2, una frecuencia cardíaca de 72lpm, presión arterial de 130/80mmHg, rasgos faciales toscos caracterizados por el engrosamiento de la nariz, prognatismo, abultamiento frontal y pómulos prominentes. Además, se evidenció piel gruesa y de textura oleosa, cifosis dorsal superior con hiperlordosis lumbar compensatoria, prominencia de la porción inferior del esternón, manos y pies grandes y en la campimetría por confrontación se demostró la presencia de una hemianopsia heterónima bitemporal. No se encontraron alteraciones cardiovasculares ni respiratorias.
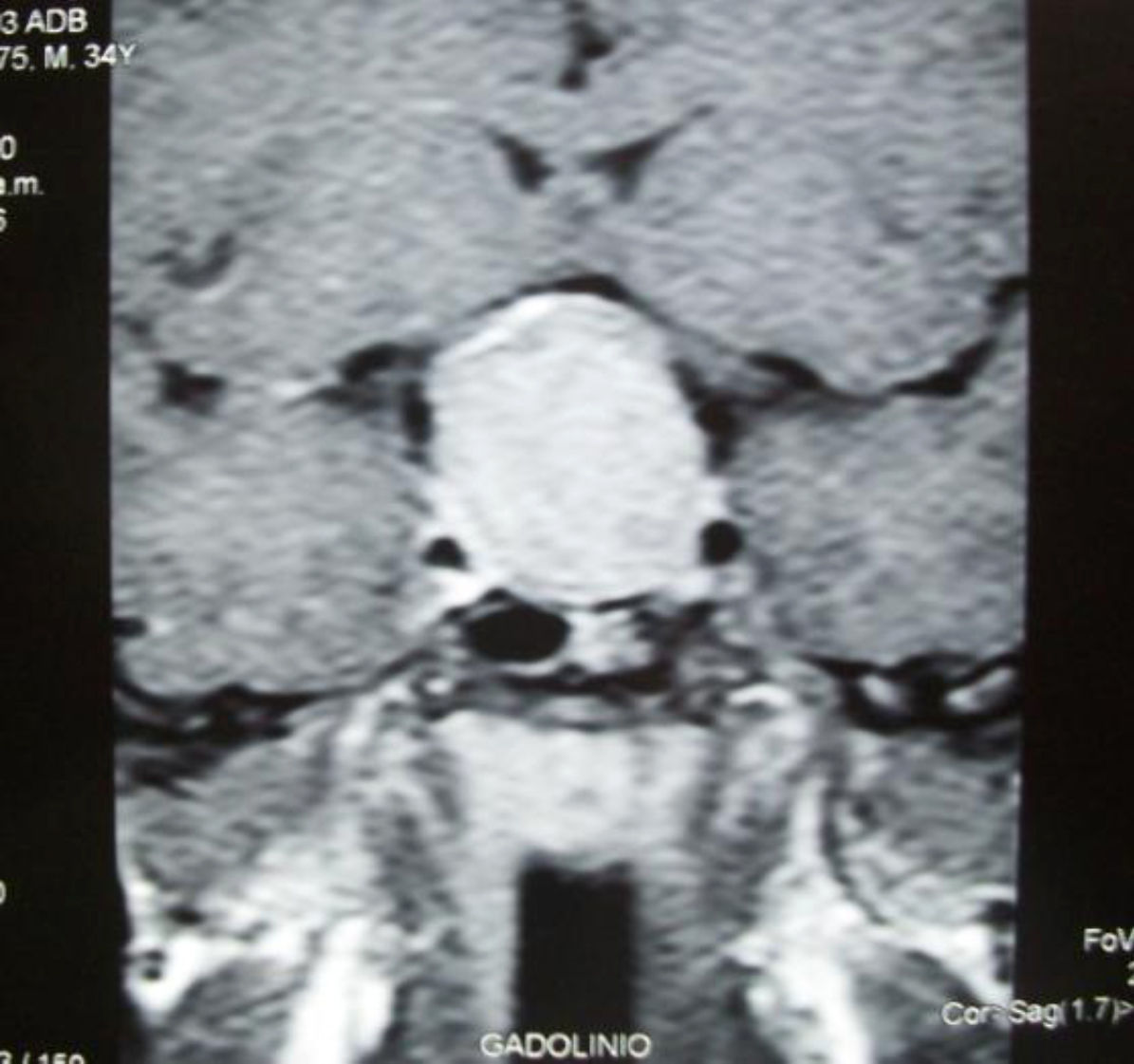
En los análisis de laboratorio no se identificaron alteraciones hematológicas. La bioquímica sanguínea demostró valores normales de glucosa, función renal y hepática, calcio y fósforo. Se objetivó una concentración plasmática de GH basal de 9,7μg/L (VN: 0-2,5), una GH a las 2h de la sobrecarga oral con 75g de glucosa de 8,2μg/L (VN: menor de 1), IGF-1 (del inglés insulin-like growth factor) de 355ng/mL (VN para la edad: 109-284), hormona estimulante de tiroides (TSH) de 2,45μUI/mL (VN: 0,3-4,2), tiroxina libre (T4L) de 1,20ng/dL (VN: 0,8-2) y prolactina de 12,8ng/mL (VN hombres: 0-15). Se solicitó una resonancia magnética nuclear contrastada con gadolinio en la que se evidenció un macroadenoma de hipófisis con extensión supraselar y compresión del quiasma óptico (fig. 1).
En vista de los hallazgos clínicos, analíticos y de imagen se realizó el diagnóstico de acromegalia y se indicó conducta quirúrgica, pudiéndose realizar solo una exéresis parcial del macroadenoma de hipófisis. El paciente se reevaluó al cabo de 3 meses, refiriendo mejoría significativa de la cefalea y de las alteraciones del campo visual, evidenciando una GH basal de 3,2μg/L y una concentración plasmática de IGF-1 de 298ng/mL. Por tanto, debido a que no se alcanzaron los criterios bioquímicos de control de la enfermedad, se indicó tratamiento con octreotide 100μg por vía subcutánea cada 8h para iniciar tolerancia, pero al cabo de 10días el paciente comenzó a presentar clínica de mareos y debilidad generalizada, objetivándose en el examen físico una frecuencia cardíaca de 41lpm.
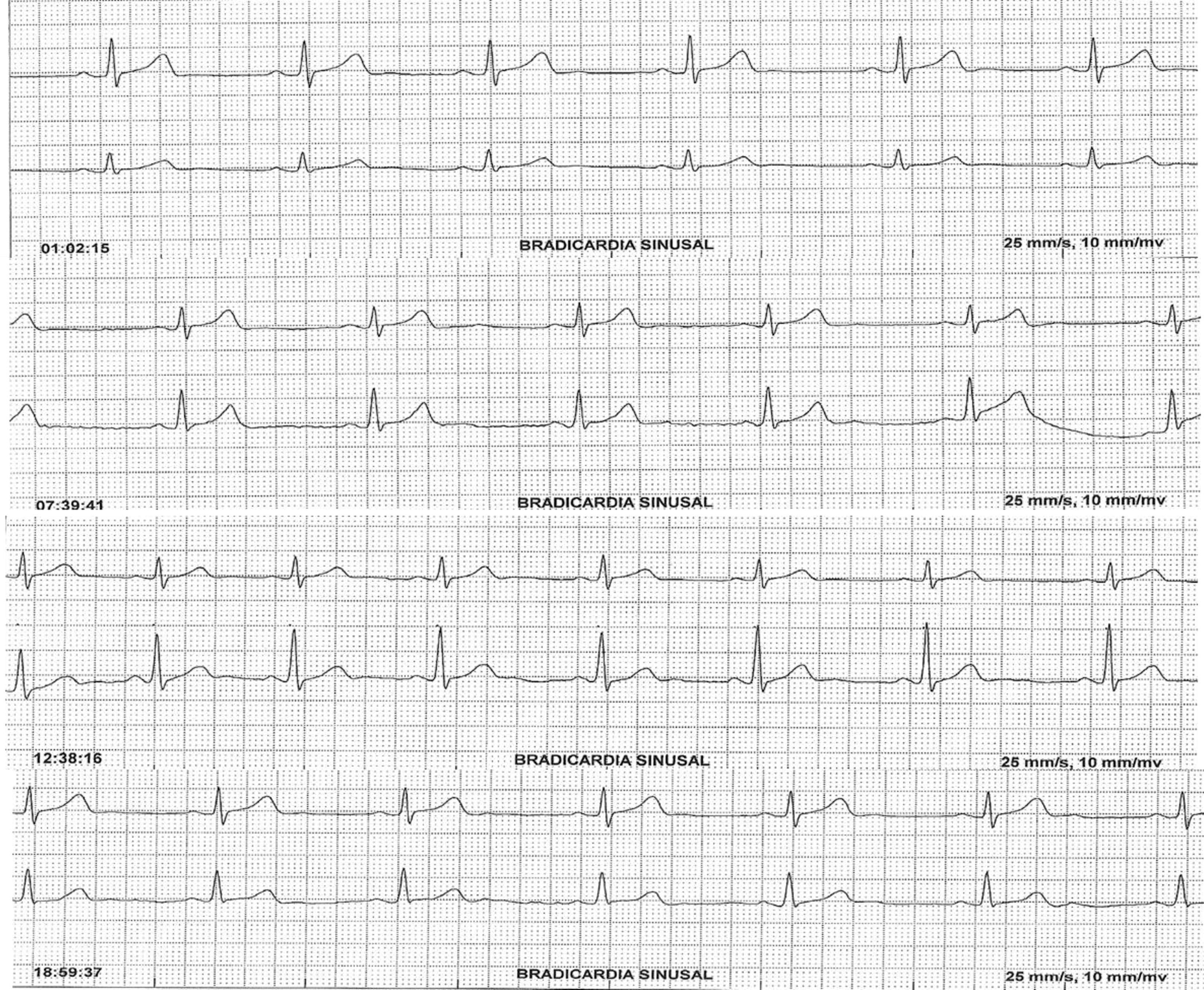
El paciente fue referido al Servicio de Cardiología, quienes colocaron un Holter de 24h en el que se evidenció bradicardia sinusal (fig. 2) con una frecuencia cardíaca promedio de 44lpm. Se decidió omitir el octreotide, tras el cual se logró la normalización de la frecuencia cardíaca.
Los análogos de la somatostatina constituyen los principales agentes terapéuticos para el manejo de la acromegalia1. Tradicionalmente, han sido usados como terapia coadyuvante en caso de fracaso de la cirugía con el fin de alcanzar control bioquímico y disminución del volumen tumoral, así como para proveer control parcial o total de la enfermedad entre el tiempo de administración de la radioterapia y el inicio del máximo beneficio derivado de la misma2. Además, se ha postulado el uso de estos fármacos como medicamentos de primera línea en caso de macroadenomas de hipófisis con extensión supraselar a fin de disminuir el volumen tumoral antes de la cirugía2; sin embargo, no se pautó en este paciente debido a la presencia de signos compresivos que indicaron la intervención quirúrgica inmediata.
Se han propuesto diversos factores que pueden explicar la respuesta individual a los análogos de la somatostatina y entre los que destacan: edad y sexo, nivel de GH pretratamiento, test de supresión de GH, histopatología (tumores con granulación densa), detección inmunohistoquímica del SSR2, presencia del oncogén gsp, dosis y duración del tratamiento3.
Los efectos adversos más frecuentemente asociados a los análogos de la somatostatina son de naturaleza gastrointestinal e incluyen náuseas, vómitos, flatulencia y diarrea, los cuales son de gravedad variable y a menudo cesan al suspender la medicación4. La aparición de bradicardia inducida por octreotide ha sido reportada previamente como un hallazgo inusual en diferentes situaciones clínicas5,6. Al igual que en nuestro caso, Herrington et al.5 describieron un paciente que presentó bradicardia sinusal (38lpm) tras el uso de octreotide por vía subcutánea. Además, en una pequeña serie de pacientes con acromegalia se demostró una reducción significativa de la frecuencia cardíaca con incremento concomitante de la resistencia vascular periférica7.
El mecanismo más plausible para explicar el efecto cronotrópico negativo del octreotide radica en la acción directa de la somatostatina en el corazón. Dicha hormona coexiste con la acetilcolina en las terminales vagales presinápticas y, por tanto, puede ser liberada por la estimulación del nervio vago8. Los principales efectos cardiovasculares de la somatostatina son la disminución de la frecuencia cardíaca y de la contractilidad miocárdica, así como el enlentecimiento de la velocidad de conducción cardíaca. Muchas de las acciones de la somatostatina o sus análogos resultan de la interacción con los SSR, los cuales pertenecen a la familia de receptores acoplados a proteínas G y cuya activación provoca la inhibición de la adenilato ciclasa con la subsiguiente disminución en la concentración intracelular de la adenosina monofosfato cíclico (AMPc), lo cual produce una disminución en la conducción a través de los canales de calcio voltaje dependientes y un aumento en la permeabilidad de la membrana al potasio9. De hecho, debido a su efecto cronotrópico negativo y a su habilidad para prolongar la conducción aurículoventricular, la somatostatina ha sido usada con éxito en el tratamiento de taquicardias supraventriculares10.
Concluimos que se trata de una bradicardia sinusal secundaria al uso de octreotide con base en una relación secuencial clara y compatible tanto en la aparición de los síntomas como en la mejoría clínica al suspender el fármaco. Por tanto, debe considerarse este posible efecto secundario al momento de tratar a pacientes con acromegalia que requieran el uso de análogos de la somatostatina.