La hipoglucemia limita la eficacia de la terapia insulínica intensiva, principalmente en pacientes con gran variabilidad glucémica. Nuestro objetivo fue determinar si la terapia con infusión subcutánea contínua de insulina (ISCI) es útil y si logra disminuir la variabilidad glucémica e hipoglucemias, principalmente en los pacientes con mayor variabilidad.
MétodoSe realizó una monitorización continua de glucosa de 3 días de duración a 24 pacientes con diabetes mellitus tipo 1 (DM1) en 2 ocasiones diferentes: antes de iniciar la terapia con ISCI y 6 meses después de su implantación. Se comparó la variabilidad glucémica con distintas medidas de variabilidad (desviación estándar [SD], amplitud media de las excursiones glucémicas [MAGE], valor M) y el área bajo la curva (AUC) <70mg/dl de forma global en todos los pacientes y en aquellos con mayor variabilidad inicial (MAGE en mayor cuartil)
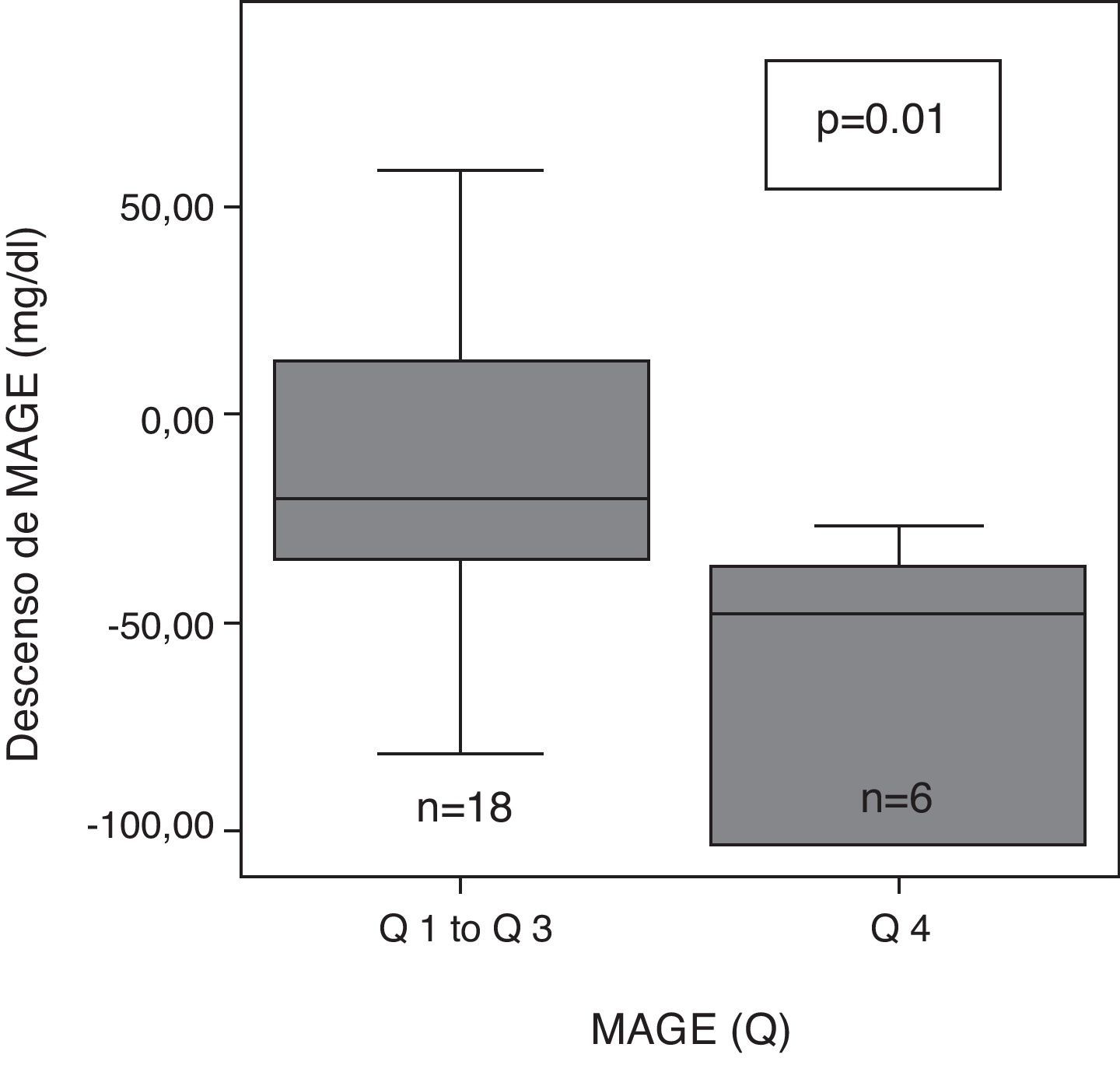
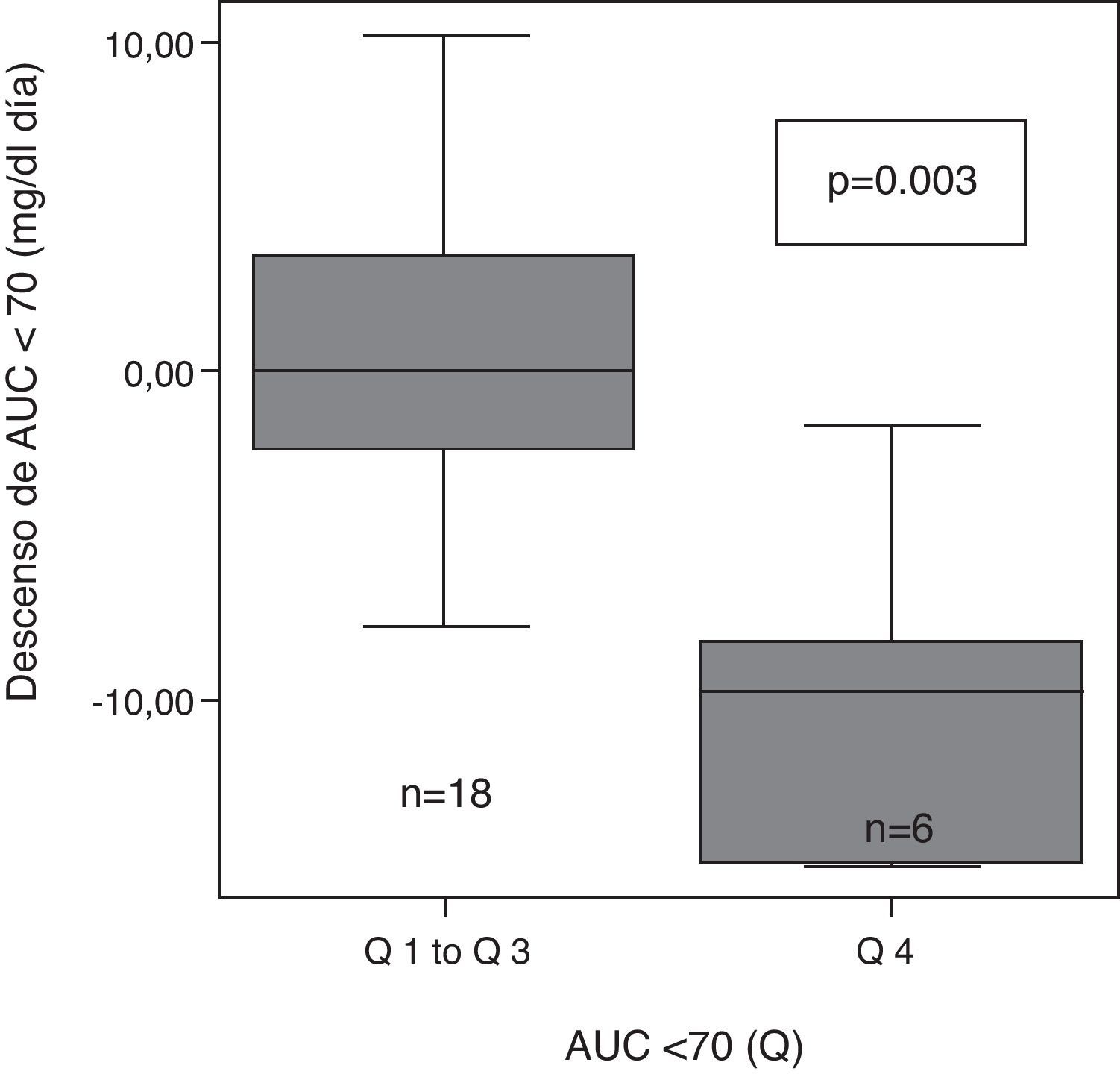
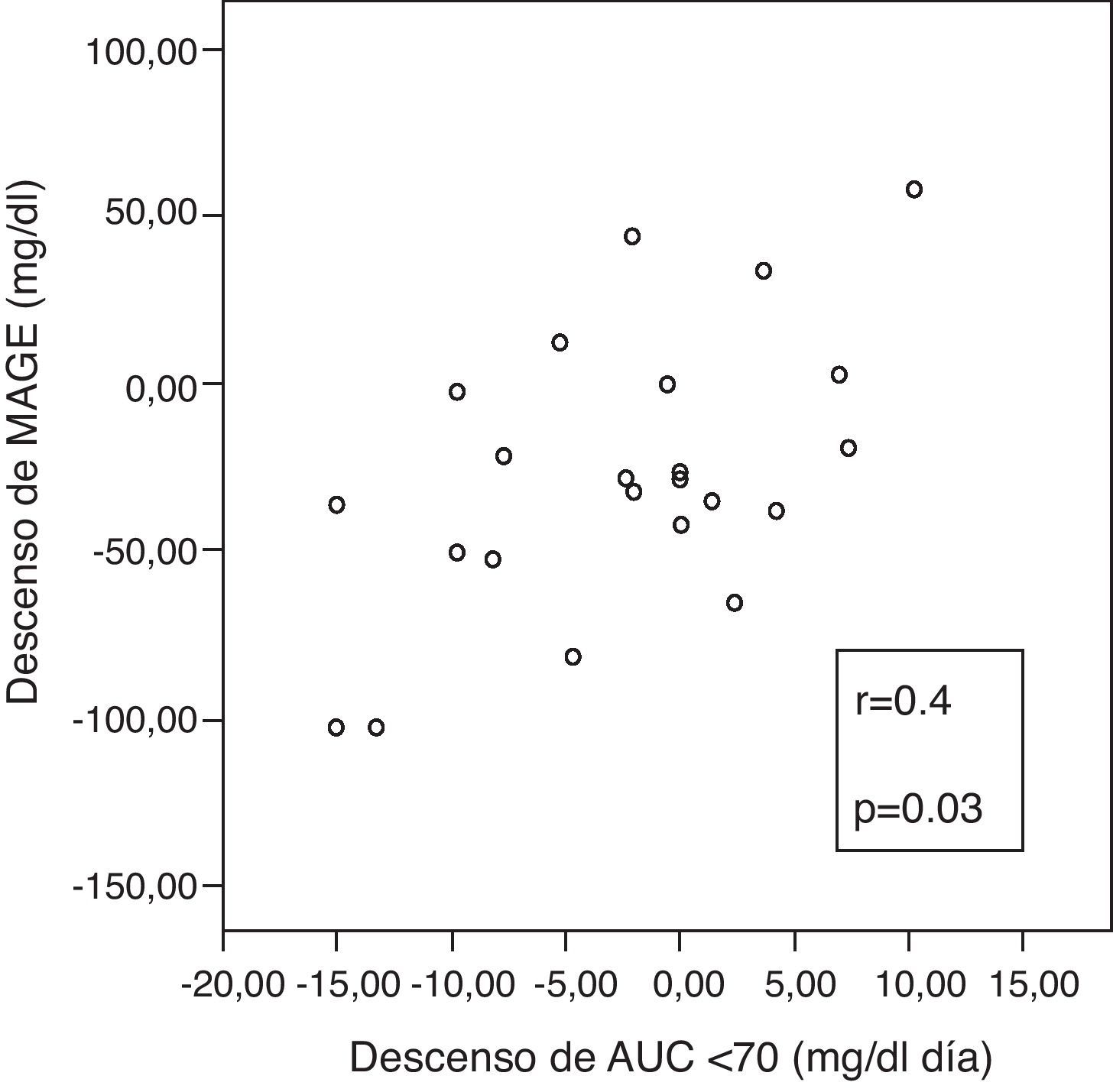
ResultadosA los 6 meses, se observó un descenso de la variabilidad glucémica medida como MAGE (mediana:-28mg/dl [rango interquartílico {RI}, -48 a 1], p=0,03); valor M (-22 [-40 a 0], p=0,04) y SD (-11[-23 a 0], p=0,009) en todos los pacientes. Los pacientes con mayor variabilidad glucémica inicial (MAGE cuartil 4) mostraron un mayor descenso de MAGE (-47mg/dl [-103 a -34] vs -20 [-36 a 17], p=0,01) y de AUC<70 (-10,7mg/dlxdía [-15 a 0] vs -1,1[-4,7 a 3,8], p=0,03), que el resto. Los pacientes con más tiempo en hipoglucemia inicial (AUC cuartil 4) lograron una mayor reducción del AUC<70 (-9,7mg/dlxdía [-15 a -6,5] vs -0,08 [-2,9 a 3,8], p=0,003]. Se halló una correlación entre ΔMAGE-ΔAUC [r 0,4, p=0,03].
ConclusionesDurante el tratamiento con ISCI, la variabilidad glucémica descendió significativamente, principalmente en aquellos pacientes con mayor variabilidad inicial. El tiempo en hipoglucemia también fue menor en aquellos con una mayor variabilidad. Los pacientes con más hipoglucemias iniciales experimentaron un mayor descenso de estas con ISCI.
Hypoglycemia limits the efficacy of intensive insulin therapy, especially in patients with great glucose variability. The extent to which continuous subcutaneous insulin infusion (CSII) overcomes this limitation is unclear. Our aim was to determine whether CSII is helpful for decreasing glucose variability and hypoglycemia, mainly in patients with the greatest variability.
MethodTwenty-four patients with type 1 diabetes wore a continuous glucose monitoring system sensor for three days before starting therapy with CSII and 6 months later. Glucose variability (SD, MAGE, M) and hypoglycemia duration (area under the curve (AUC) <70mg/dL) were compared in all patients and in those with the greatest MAGE (highest quartile).
ResultsAt 6 months, a decreased glucose variability was seen, as measured by MAGE, M, and SD (median: -28mg/dL (interquartile range, -48 to 1), p=0.03; -22(-40 to 0), p=0.04; -11(-23 to 0), p=0.009; respectively). Patients with the greatest initial glucose variability (MAGE quartile 4) showed a greater decrease in both MAGE (-47mg/dL (-103 to -34) vs -20 (-36 to 17), p=0.01) and AUC <70 (-10.7mg/dL x day (-15 to 0) vs -1.1 (-4.7 to 3.8), p=0.03) as compared to all others. Patients with longer initial hypoglycemia (AUC quartile 4) achieved a greater reduction in AUC <70 (-9.7mg/dL x day(-15 to -6.5) vs -0.08 (-2.9 to 3.8), p=0.003). A correlation was found between ΔMAGE-ΔAUC (r 0.4, p=0.03).
ConclusionsDuring CSII, glucose variability significantly decreased, especially in patients with the greatest initial variability. Hypoglycemia was also markedly less in patients with greater variability, with the greatest reduction occurring in those who experienced more marked hypoglycemia with CSII.
El estudio Diabetes Control and Complications Trial (DCCT) mostró que mantener un control glucémico estricto en los pacientes con diabetes mellitus tipo 1 (DM1) es fundamental para evitar o retrasar la aparición de complicaciones a largo plazo1. Se ha demostrado que existe una relación exponencial entre unas cifras de glucemia elevadas y un mayor riesgo de retinopatía, neuropatía y nefropatía1–3. Desde entonces, uno de los objetivos fundamentales en el manejo de estos pacientes diabéticos ha sido intentar mantener la glucemia lo más cercana posible a la normalidad4. Sin embargo, a día de hoy el mantenimiento de la euglucemia todavía es limitado y, a pesar de la terapia insulínica intensiva con múltiples dosis de insulina (MDI), no siempre se alcanza la hemoglobina glucosilada (HbA1c) recomendada. Esta situación es especialmente frecuente en pacientes con grandes excursiones glucémicas (elevada variabilidad glucémica) en los que alcanzar una HbA1c adecuada sin incrementar las hipoglucemias supone un gran reto, en ocasiones imposible. Esto se debe a que cuanto más desciende la HbA1c, más se incrementa el riesgo de sufrir un episodio de hipoglucemia grave, de una manera exponencial1. Además, la aparición de hipoglucemias no es solo la principal barrera en el manejo de la diabetes mellitus5, sino que también supone una elevada causa de morbilidad6, mortalidad7 y deterioro de la calidad de vida en los pacientes con DM1. De hecho, episodios repetidos de hipoglucemia pueden afectar a la coordinación a nivel psicológico o interferir con el desempeño de determinados trabajos5,8.
La infusión subcutánea continua de insulina (ISCI) mediante una microinfusora externa es una forma alternativa de tratamiento insulínico intensivo, cada vez más empleada. Esta ha demostrado mejorar el control metabólico, alcanzando concentraciones de HbA1c discretamente menores9–11 y disminuyendo la inestabilidad glucémica12–15. Además, la mayoría de las guías de práctica clínica la incluyen como una alternativa eficaz en pacientes con episodios recurrentes de hipoglucemias moderadas o graves y en aquellos en los que no es posible lograr una HbA1c adecuada con MDI16,17.
Sin embargo, en lo que se refiere a la prevención de hipoglucemias, los resultados de los distintos artículos resultan controvertidos. Algunos estudios sugieren que la terapia con ISCI permite disminuir los episodios hipoglucémicos y, por tanto, mejorar la estabilidad glucémica18,19, probablemente debido a la posibilidad de realizar un ajuste más preciso en la infusión de insulina. Por el contrario, otras publicaciones no han mostrado diferencias en el número de episodios hipoglucémicos20,21. En otros estudios lo que se consigue es una menor variabilidad glucémica y un mayor descenso de la HbA1c sin incrementar el riesgo de hipoglucemias14,15,22. Por otro lado, una revisión publicada en el 2002 concluyó que la terapia con ISCI se asociaba incluso con un mayor riesgo de hipoglucemia23. Varios metaanálisis24,25 publicados y una revisión sistemática26 concluyeron que no existen diferencias significativas en el número de episodios hipoglucémicos en pacientes con DM1 tratados bien sea con MDI (con análogos) o con ISCI. Además, incluso se llegó a señalar un mayor riesgo de hipoglucemia leve en niños con ISCI25. Finalmente, un estudio piloto27 realizado en pacientes con episodios recurrentes de hipoglucemias moderadas o graves, mostró que la terapia con ISCI permite disminuir las hipoglucemias y mejorar su percepción en esta población.
El objetivo de nuestro estudio fue determinar si la terapia con ISCI es útil para disminuir la variabilidad glucémica y el tiempo en hipoglucemia en pacientes con DM1, principalmente en aquellos con mayor variabilidad glucémica y, por tanto, con un mayor riesgo y más difícil manejo. Intentamos conocer qué perfil de paciente se beneficiaba más del tratamiento con ISCI y se esperaba que esta información pueda ser de utilidad en la práctica clínica.
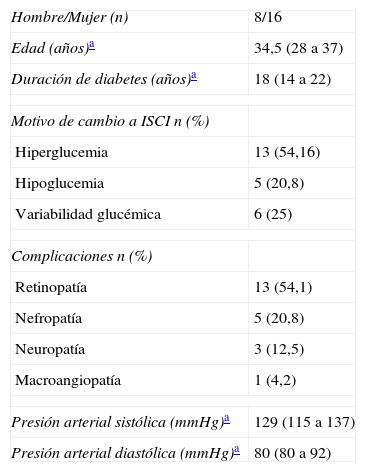
Material y métodosSe llevó a cabo un estudio observacional prospectivo en el Hospital Clínico Universitario de Santiago de Compostela. Se incluyeron 24 pacientes con DM1 en tratamiento insulínico intensivo. Al inicio del estudio todos los pacientes recibían tratamiento con MDI, pero estaban a punto de iniciar tratamiento con ISCI por presentar hipoglucemias, hiperglucemias o diferente grado de variabilidad glucémica. Sus principales características clínicas se muestran en la tabla 1.
Características clínicas basales
| Hombre/Mujer (n) | 8/16 |
| Edad (años)a | 34,5 (28 a 37) |
| Duración de diabetes (años)a | 18 (14 a 22) |
| Motivo de cambio a ISCI n (%) | |
| Hiperglucemia | 13 (54,16) |
| Hipoglucemia | 5 (20,8) |
| Variabilidad glucémica | 6 (25) |
| Complicaciones n (%) | |
| Retinopatía | 13 (54,1) |
| Nefropatía | 5 (20,8) |
| Neuropatía | 3 (12,5) |
| Macroangiopatía | 1 (4,2) |
| Presión arterial sistólica (mmHg)a | 129 (115 a 137) |
| Presión arterial diastólica (mmHg)a | 80 (80 a 92) |
ISCI:infusión subcutánea continua de insulina.
La existencia de retinopatía, nefropatía o neuropatía diabética se definió como la existencia de retinopatía proliferativa o no proliferativa, micro/macroalbuminuria confirmada y alteración de la sensibilidad de manos y/o pies, respectivamente. La existencia de complicaciones macrovasculares se definió como la presencia de antecedentes de enfermedad coronaria y/o cerebrovascular. Se excluyeron del estudio: pacientes embarazadas, pacientes en tratamiento con glucocorticoides, presencia de enfermedades dermatológicas que contraindicaran la colocación del sensor, episodios febriles durante el estudio o en los 3 meses anteriores, enfermedades psiquiátricas o neurológicas que imposibilitaran una adecuada colaboración, o una duración de la DM1 menor de 12 meses.
Los dispositivos de infusión subcutánea continua de insulina implantados fueron las microinfusoras Minimed Paradigm® 712 y 722 (Medtronic), Accu-Check® Spirit (Roche) o la bomba Animas® (Johnson&Johnson). Se emplearon análogos de insulina de acción rápida (lispro y aspart).
ProtocoloDurante el estudio se programaron 3 visitas obligatorias: la primera se realizó antes de la colocación de la ISCI, la segunda visita se realizó en el momento de la colocación de la ISCI, y la tercera 6 meses después de haber iniciado el tratamiento con ISCI. En la primera y la tercera visita, se implantó un sistema de monitorización continua de glucosa (MCG) a nivel periumbilical con el sistema CGMS® System Gold TM o con el sistema Guardian® REAL-TIME del laboratorio Medtronic. De este modo se monitorizaron las concentraciones de glucosa del líquido intersticial durante 2 periodos de 72 horas consecutivas. El día 0 se insertaba el sensor y 3 días después el paciente volvía al hospital para retirarlo y descargar la información para su posterior evaluación. Para una adecuada calibración del sensor, los pacientes realizaban 4 glucemias capilares diarias. Además de estas 3 visitas, y siguiendo el «Protocolo de formación del paciente que inicia tratamiento con ISCI» implantado en nuestro hospital, se mantuvo un contacto frecuente con el diabetólogo, dietista y enfermero educador responsable. De este modo se repasaron distintos temas de educación diabetológica como cálculo de raciones de hidratos de carbono, técnicas de inserción del catéter o ajuste de la dosis de insulina.
En la visita basal, se recogió información (tabla 1) referente a la edad, años de evolución de la diabetes, complicaciones, tratamientos, peso, índice de masa corporal (IMC), presión arterial y valor de HbA1c. En las 2 visitas posteriores, el peso, las cifras de presión arterial, los tratamientos y posibles incidencias fueron actualizados. Se midió la presión arterial del brazo derecho tras 5 minutos de reposo, empleándose para el análisis la media de 3 mediciones consecutivas. La determinación de la HbA1c en la visita basal y 6 meses después del inicio de la ISCI, se realizó en una muestra de sangre venosa mediante cromatografía líquida de alta resolución (HPLC).
El estudio fue aprobado por el Comité de Ética de nuestro hospital y se realizó siguiendo las Normas de Buena Práctica Clínica y la declaración de Helsinki. Todos los participantes firmaron el consentimiento informado correspondiente.
Determinación de la variabilidad glucémica:A partir de los datos obtenidos con la MCG evaluamos la variabilidad glucémica mediante 3 parámetros diferentes: la desviación estándar (SD), el valor M y la amplitud media de las excursiones glucémicas (MAGE).
El valor M es un índice cuantitativo de las desviaciones de varias determinaciones de glucosa en sangre (en un periodo de 24 horas)28,29, con respecto a un valor estándar seleccionado arbitrariamente (80mg/dl). Se calcula como la media de 1.000 x (log glucemia plasmática/80)28.
El valor de MAGE se define como la media aritmética del nadir, el punto más bajo de los niveles de glucosa en sangre, hasta los picos, o viceversa, cuando los segmentos ascendentes y descendentes exceden una desviación estándar de la glucosa promedio en sangre para el mismo periodo de 24 horas30. Para clasificar a los pacientes en función de su variabilidad glucémica, el MAGE inicial se dividió en diferentes cuartiles (Q): muy alta (Q4), alta (Q3), moderada (Q2) y baja (Q1).
Evaluación de las hipoglucemiasSe definieron las hipoglucemias leves como aquellas glucemias <70mg/dl. Las hipoglucemias graves se definieron como aquellas que precisaron asistencia por terceras personas. La duración del tiempo en hipoglucemia se determinó mediante el cálculo del área bajo la curva (AUC) <70mg/dl, empleando para esto el método trapezoidal31. Para este cálculo solo se tuvo en cuenta el segundo día de la monitorización, con la finalidad de analizar un registro fiable de 24 horas seguidas. Para clasificar a los pacientes en función de su tiempo en hipoglucemia, y al igual que hicimos con el MAGE, la AUC <70mg/dl inicial se dividió en cuartiles: muy elevado (Q 4), elevado (Q 3), moderado (Q 2) y bajo (Q 1).
Calidad de vidaUn cuestionario validado, que evalúa la satisfacción con el nuevo tratamiento hipoglucemiante (DTSQc), fue realizado por los pacientes a los 6 meses de haberse iniciado la ISCI. El cuestionario evalúa 8 ítems: 6 ítems relacionados con la satisfacción en general con el tratamiento y 2 ítems que evalúan la frecuencia de episodios de hipo o hiperglucemia, en relación a la terapia previa32.
Análisis estadísticoLas variables se presentan como mediana (rango intercuartílico). Las variaciones intra-individuales (pre-ISCI vs 6 meses post-ISCI) de las variables cuantitativas se calcularon mediante el test de Wilcoxon. Para el estudio comparativo de las variables cuantitativas de 2 muestras independientes se empléo el test de Mann-Whitney. El estudio comparativo de más de 2 categorías ordinales se realizó con el test de Jonkheere-Terpstra test. El estudio de posibles correlaciones se realizó mediante el método de Spearman. Todos estos son test no paramétricos, independientes de la distribución de la muestra y adecuados para el estudio de una muestra pequeña como la nuestra. Se empleó el paquete estadístico SPSS (version 14; SPSS, Chicago, USA) para el análisis de los datos, asumiendo como estadísticamente significativo un valor p<0,05.
ResultadosSe recogieron datos de la MCG realizada durante 72 horas en los 24 pacientes. En ningún paciente se precisó repetir la MCG.
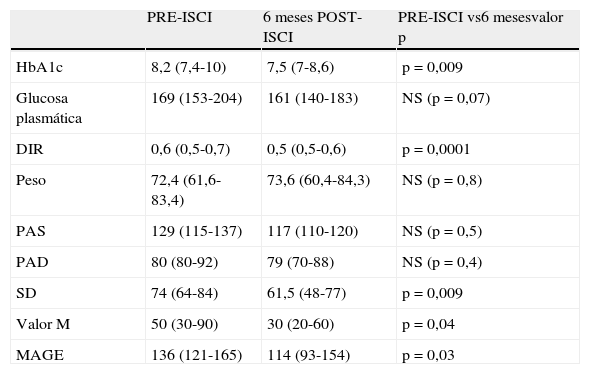
Efectos globales sobre el control metabólico, requerimientos diarios de insulina (DIR), peso y presión arterialLa HbA1c obtenida tras 6 meses con ISCI, fue significativamente menor (tabla 2) que la inicial, con una mediana de descenso de -0,8% (rango intercuartílico, -1,4 a 0,2%). A los 6 meses, se apreció una tendencia a descender la mediana de glucemia plasmática (tabla 2), aunque esta no alcanzó significación estadística. Además, los DIR también disminuyeron significativamente a los 6 meses mientras que el peso y la presión arterial permanecieron estables (tabla 2).
Comparación de concentraciones de hemoglobina glucosilada (HbA1c) (%), glucosa plasmática (mg/dl), requerimientos diarios de insulina (DIR) (U/kg/d), peso (kg), presión arterial sistólica (PAS), presión arterial diastólica (PAD), desviación estándar (SD), valor M (mg/dl) y amplitud media de las excursiones glucémicas (MAGE) (mg/dl), pre-ISCI (infusión subcutánea continua de insulina) y 6 meses después (post-ISCI)
| PRE-ISCI | 6 meses POST-ISCI | PRE-ISCI vs6 mesesvalor p | |
| HbA1c | 8,2 (7,4-10) | 7,5 (7-8,6) | p=0,009 |
| Glucosa plasmática | 169 (153-204) | 161 (140-183) | NS (p=0,07) |
| DIR | 0,6 (0,5-0,7) | 0,5 (0,5-0,6) | p=0,0001 |
| Peso | 72,4 (61,6-83,4) | 73,6 (60,4-84,3) | NS (p=0,8) |
| PAS | 129 (115-137) | 117 (110-120) | NS (p=0,5) |
| PAD | 80 (80-92) | 79 (70-88) | NS (p=0,4) |
| SD | 74 (64-84) | 61,5 (48-77) | p=0,009 |
| Valor M | 50 (30-90) | 30 (20-60) | p=0,04 |
| MAGE | 136 (121-165) | 114 (93-154) | p=0,03 |
Los datos están expresados en mediana (rango intercuartílico); ns:no significativo.
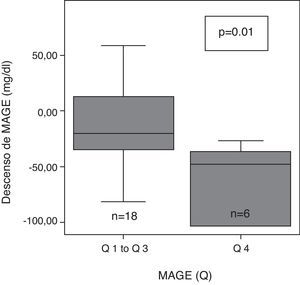
Tras 6 meses de terapia con ISCI, la variabilidad glucémica evaluada con SD, valor M y MAGE descendió significativamente de forma global (tabla 2). Tras subdividir la variabilidad glucémica inicial (MAGE) en 4 cuartiles: muy alta (Q4:>165,9), alta (Q3: de 136 a 165,9), moderada (Q2: de 121,3 a 136) y baja (Q1: <121,.3), se observaron diferencias significativas en el grado de descenso de MAGE en función del cuartil (p=0,02). A los 6 meses, el descenso de MAGE fue mayor en el grupo de pacientes con mayor MAGE inicial (MAGE Q 4), que en el resto (fig. 1).
HipoglucemiasAl cabo de 6 meses, se apreció una tendencia global a disminuir el tiempo en hipoglucemia, calculado como AUC <70mg/dl (preISCI: mediana 4,1mg/dlxdía (rango intercuartílico; 0,4 a 8,1mg/dlxdía) vs postISCI: 1,2mg/dl/día (0 a 5mg/dlxdía), p=0,32). En aquellos pacientes con mayor variabilidad inicial (MAGE Q4), se observó un descenso significativamente mayor de AUC<70 (mediana -10mg/dl/día (rango intercuartílico; -1,5 a 0mg/dlxdia) que en el resto (MAGE Q1 a Q3: -1,1mg/dl/xdía [-4,7 a 3,8mg/dlxdía], p 0,04). Ningún paciente sufrió hipoglucemias graves.
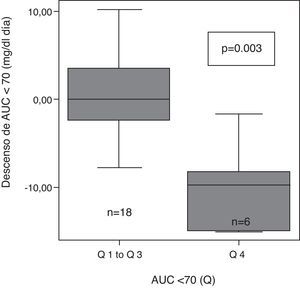
Tras clasificar a los pacientes en cuartiles en función de su AUC <70mg/dl inicial como muy alta (>8,1), alta (de 8,1 a 4,1), moderada (4,1 a 0,4) y baja (<0,4), se observaron diferencias significativas en el grado de descenso de la AUC entre los diferentes grupos (p=0,004). El descenso de AUC tras 6 meses con ISCI, fue mayor en el grupo de pacientes con mayor AUC<70 inicial (Q 4) que en el resto (Q1 a Q3) (fig. 2).
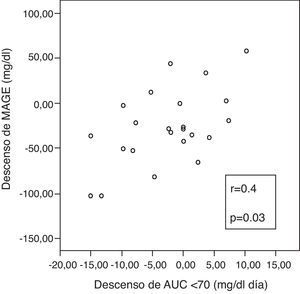
Se apreció una correlación positiva entre las variaciones incrementales de ΔMAGE-ΔAUC, (fig. 3), lo que implica que cuanto más desciende MAGE a los 6 meses, más desciende el tiempo en hipoglucemia.
Calidad de vida (QOL)La calidad de vida global y el grado de satisfacción con el tratamiento mejoró en todos los pacientes. Un 45,8% (11/24) de los pacientes percibió un descenso de las excursiones hipoglucémicas.
DiscusiónLa terapia con ISCI ha sido clásicamente empleada en pacientes con DM1 con intenso fenómeno del alba, insuficiente control metabólico, elevada variabilidad glucémica o hipoglucemias severas33. Sin embargo, desde la aparición de los análogos de insulina de acción prolongada, ha existido cierta controversia en lo que se refiere a su mayor utilidad en estas situaciones. Esto es debido a que según algunos autores, los análogos de insulina podrían obtener resultados similares con un menor coste. Esta idea ha sido especialmente discutida en el caso de las hipoglucemias (una de sus principales indicaciones)17 y se atribuye a diversas razones. Uno de los motivos es que con los análogos de insulina de acción prolongada se disminuye la incidencia de hipoglucemias nocturnas34,35. La otra razón es que varias publicaciones no han encontrado diferencias significativas (entre MDI con análogos de insulina e ISCI) en incidencia de hipoglucemias, como hemos indicado previamente20,21,24–26. La mayoría de estos estudios, sin embargo, son de pequeño tamaño muestral y corta duración, lo que puede haber influido los resultados.
Los resultados de este estudio, al igual que los de otros estudios, no muestran diferencias significativas (pre-ISCI vs post-ISCI) en el tiempo en hipoglucemia tras analizar una muestra general de pacientes con DM1. Sin embargo, sí observamos que la terapia con ISCI puede ser extremadamente útil en casos bien seleccionados (pacientes con más AUC o más MAGE inicial). Así, Pickup et al.19, mostraron que el mayor descenso en el número de episodios hipoglucémicos se observa en pacientes con mayores y más graves hipoglucemias preISCI. Giménez et al.27 también mostraron que la terapia con ISCI disminuye las hipoglucemias en pacientes con episodios recurrentes de hipoglucemias graves o moderadas. En consonancia con estos estudios, nosotros también hallamos que los pacientes con más hipoglucemias iniciales son los que más se beneficiarían de la terapia con ISCI, dado que presentan una reducción mayor de estos episodios.
Por otro lado, confirmamos que la terapia con ISCI es una herramienta útil para disminuir la variabilidad glucémica, tal y como ya había sido descrito en otros estudios21,36. Además, los resultados del presente estudio fueron mejores en aquellos pacientes con mayor variabilidad inicial. Este concepto de variabilidad glucémica ha adquirido mucha importancia en los últimos años, no solo por su potencial y controvertida relación con el desarrollo de complicaciones microvasculares, sino también por su relación con la aparición de hipoglucemias37,38. De hecho, se ha publicado que al contrario de lo que sucede con la HbA1c, la variabilidad glucémica puede llegar a explicar hasta un 40-50% de la varianza de hipoglucemias futuras39. Lo que el presente estudio añade en este sentido es que los pacientes con mayor variabilidad son también los que obtienen un mayor descenso de sus excursiones glucémicas. Esto es similar a lo que sucede con la reducción de la HbA1c o de las hipoglucemias, que es mayor en pacientes con una mayor HbA1c36 o más hipoglucemias18 iniciales, respectivamente. Este concepto, no objetivado hasta ahora, nos puede permitir añadir una nueva y clara indicación de ISCI, ya que hasta ahora la variabilidad glucémica es considerada como indicación en algunas guías, pero no en todas17.
Además, observamos que el descenso de las hipoglucemias fue también mayor en pacientes con mayor variabilidad inicial. Esto, confirmó la existencia de una correlación positiva entre el descenso de la variabilidad glucémica y el descenso de las hipoglucemias. Este hallazgo, tienen una gran relevancia clínica ya que se ha argumentado que los pacientes con gran variabilidad glucémica a menudo mantienen elevadas concentraciones de HbA1c pero se resisten a la intensificación del tratamiento insulínico porque esto les precipitaría la aparición de hipoglucemias. Así, si estos pacientes «de riesgo» tienen menos hipoglucemias con ISCI, será más fácil alcanzar una adecuada HbA1c.
La mejoría de la variabilidad y de las hipoglucemias observada objetivamente, también fue percibida subjetivamente por los propios pacientes, tal y como mostró el test QoL.
Así, este estudio añade nueva y valiosa información. Primero, porque al contrario que en la mayoría de los estudios, nosotros no nos centramos en las hipoglucemias graves, sino en aquellas que no requieren tercera asistencia. Estas suponen un factor de riesgo de hipoglucemia grave y son más frecuentes y difíciles de evitar. Segundo, y dado que hasta el momento no está esclarecido cuál debería ser el método de referencia para el estudio de la variabilidad40,41, analizamos los datos con 3 medidas de variabilidad glucémica distintas (SD, valor M y MAGE). Esto supone una diferencia con los estudios publicados hasta el momento, en los que se emplean una o 2 variables. Por otro lado, utilizamos un método de MCG, considerada la prueba de referencia (gold standard) para identificar excursiones glucémicas. De hecho, el actual estudio es el primero en evaluar la variabilidad glucémica y tiempo en hipoglucemia mediante varios parámetros específicos y realizando MCG en todos los pacientes en tratamiento con ISCI. En 2006, Pickup36 mostró que la ISCI disminuía la variabilidad glucémica calculada mediante SD a partir de autoanálisis de glucemia capilar, recomendando el empleo de la MCG. Dos años después, en 2008, Simon et al.42 estudiaron la variabilidad glucémica y las hipoglucemias mediante MCG, pero sin emplear variables específicas (solo el % de valores >180mg/dl o <60mg/dl). Finalmente, Bruttomesso21 evaluó la variabilidad glucémica e hipoglucemias mediante 3 parámetros distintos (MAGE, SD, ADRR), pero solo empleó la MCG en menos de un tercio de los pacientes (11/39) y durante solo 34 horas.
A pesar de estas ventajas, el presente estudio tiene diversas limitaciones. Al igual que la mayoría de estudios publicados al respecto, la muestra es de pequeño tamaño, aunque suficiente para alcanzar significación estadística con métodos no paramétricos. Los parámetros de variabilidad glucémica, aunque son varios, se corresponden con medidas de variabilidad glucémica global, a los que se le podrían haber añadido otras medidas conocidas de variabilidad glucémica específicas intra-día como la acción glucémica general continua neta (CONGA) o inter-días como el promedio de las diferencias diarias (MODD) o el CONGA24h. En lo referente al estudio de las hipoglucemias, existen varias desventajas. Por un lado, no se han analizado los resultados de glucemias capilares realizadas por los propios pacientes. Por otro lado, nos basamos en el estudio del AUC <70mg/dl de un único día de monitorización. Además, los sistemas de MCG iniciales, principalmente el CGMS® System Gold™, presentan una menor precisión en la detección de valores de glucosa inferiores a 70mg/l (aunque son válidos y ampliamente utilizados con este propósito27,38). Finalmente, no existe un grupo control con el que comparar los resultados. Esto se debe principalmente a que nuestro objetivo no era comparar ISCI vs MDI, sino evaluar si la ISCI podría ser una terapia útil en pacientes con gran variabilidad. Aún así, somos conscientes de que habría sido deseable la existencia de control de otras variables pertenecientes a la intervención (un grupo que recibiera la misma educación diabetológica, las mismas visitas, etc.)
Como conclusión, la ISCI es una terapia extraordinariamente útil en pacientes con DM1, principalmente en aquellos que presentan una gran variabilidad glucémica y/o frecuentes hipoglucemias. En estos pacientes es en los que se obtienen mayores descensos de la variabilidad glucémica y de las hipoglucemias. Por este motivo, los candidatos a ISCI deben ser cuidadosamente seleccionados para que puedan beneficiarse al máximo de la terapia con bomba de insulina.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Deseamos expresar nuestro agradecimiento a la Sociedad Gallega de Endocrinología y Nutrición por haber financiado este estudio.