Los síndromes de neoplasia endocrina múltiple (MEN) se caracterizan por la presencia de tumores que afectan a 2 o más glándulas endocrinas. Los adenomas hipofisarios (AH) y los feocromocitomas/paragangliomas (Feo/PGL) son tumores frecuentes del MEN tipo 1 y 2, respectivamente. La presencia de ambos tumores en un paciente es excepcional y fue descrita por primera vez por Iversen en 19521. El avance de la genética ha puesto de manifiesto un posible mecanismo patogénico común donde podrían estar implicadas mutaciones de genes que codifican la enzima succinato deshidrogenasa (SDH)2,3. En 2015 Xekouki et al., confirmaron la existencia de esta asociación denominada «3PAs» (del inglés, «the three P Association», pituitary adenoma with pheochromocytoma/paraganglioma)4. Presentamos 3 casos clínicos con esta asociación, uno de ellos descrito parcialmente con anterioridad5.
Caso 1Varón de 54 años, sin antecedentes familiares de interés e hipertensión arterial. Se diagnosticó de incidentalomas suprarrenales bilaterales tras estudio ecográfico por disfunción eréctil. La tomografía computarizada (TC) de abdomen reveló una masa suprarrenal derecha de 6cm y un nódulo de 2cm en suprarrenal izquierda. En orina, las catecolaminas fueron 3.488nmol/d (normal: 116-699) y la gammagrafía con metayodobencilguanidina (MIBG) mostró captación bilateral. Además, destacaban rasgos acromegálicos, la IGF-1 sérica era de 46,4nmol/l (normal: 8,1-32,8) y la GH sérica no suprimía tras la sobrecarga oral de glucosa (SOG). En la resonancia magnética (RM) hipofisaria se visualizó una lesión selar de 7mm. Se realizó suprarrenalectomía bilateral y posterior cirugía transesfenoidal, siendo el diagnóstico anatomopatológico de feocromocitoma y adenoma hipofisario con inmunohistoquímica positiva para GH y prolactina, respectivamente. El estudio genético de RET, VHL, SDHB, SDHD fue negativo.
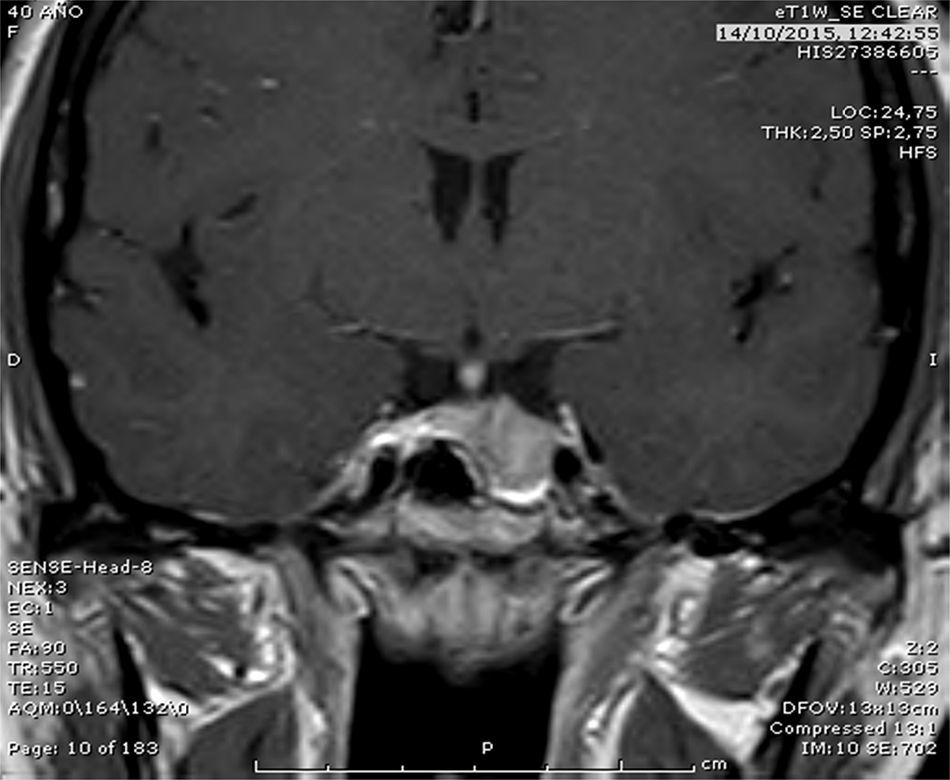
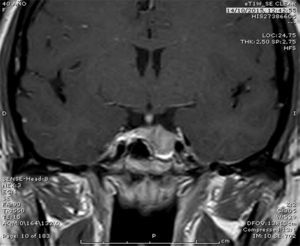
Caso 2Mujer de 38 años, portadora de deleción que afecta al exón 1 de SDHB. El caso índice fue su hermano intervenido de paraganglioma paraaórtico funcionante. Fue valorada inicialmente por alteración menstrual y galactorrea, diagnosticándose de macroprolactinoma (fig. 1). Se inició tratamiento con cabergolina 1mg/semana con desaparición de los síntomas y normalización de la prolactina sérica. No tenía hipertensión arterial ni síntomas adrenérgicos y las catecolaminas sérica y urinaria fueron normales. Dados los antecedentes familiares, y siendo portadora de la misma deleción que tenía el hermano, se realizó TC cérvico-toraco-abdominal que evidenció un nódulo laterocervical derecho de 11mm y una masa hipervascular de 35×20mm en mediastino. En OctreoScan®, dichas lesiones expresaban receptores para somatostatina, compatibles con paraganglioma. Por su cercanía a estructuras vasculares, la lesión mediastínica fue irresecable. Dada la positividad de la gammagrafía y teniendo en cuenta su eficacia en algunos casos6, se inició tratamiento con análogos de la somatostatina, y estamos pendientes de valorar la respuesta terapéutica. El test genético en la madre y hermana fue positivo.
Caso 3Mujer de 56 años, sin antecedentes familiares destacables, tenía hipertensión arterial y crisis hipertensivas frecuentes. La noradrenalina plasmática era de 31.656pg/ml (normal: <300) y la orina de 2.336μg/d (normal: <76). La TC y la RM abdominal revelaron una masa suprarrenal derecha de 4cm, y un nódulo de 1cm en la glándula contralateral. La gammagrafía con MIBG mostró captación suprarrenal derecha. En otro centro, se realizó suprarrenalectomía bilateral con resultado anatomopatológico de feocromocitoma derecho y suprarrenal izquierda normal. La paciente presentaba rasgos fenotípicos de acromegalia, tenía GH sérica de 17,9ng/ml (normal: <5), IGF-1 sérica 839ng/ml (normal: 94-483) y ausencia de supresión de GH sérica tras SOG. La RM hipofisaria evidenció un microadenoma, por lo que se realizó exéresis transesfenoidal. La bioquímica mostró hipercalcemia (calcio corregido de 11,3mg/dl), y una parathormona sérica de 87ng/ml (normal: <65) sugestivo de hiperparatiroidismo primario. La ecografía cervical describió un nódulo derecho de 16mm y otro izquierdo de 6mm compatibles con glándulas paratiroides, y la gammagrafía con 99Tc-sestamibi fue negativa. Dado que la paciente estaba asintomática, con calcemias inferiores a 11,5mg/dl, y sin otros criterios de cirugía, se mantuvo conducta expectante. El estudio de RET, MEN-1 y VHL no evidenciaron mutaciones.
La enzima SDH es un complejo proteico de la membrana mitocondrial que interviene en el ciclo de Krebs. Está compuesta por 4 subunidades, SDHA, SDHB, SDHC y SDHD. Las alteraciones en dichos genes inhiben la hidroxilación del factor de hipoxia inducible 1-alfa y producen acumulación de succinato, lo cual se relaciona con un estado de seudohipoxia tisular y la tumorogénesis7. Además de Feo/PGL, se han identificado mutaciones de genes SDH en pacientes con síndrome de Carney-Stratakis, carcinoma renal o síndrome de Cowden-like8,9.
En una revisión de todos los casos reportados de AH y Feo/PGL2, de 72 pacientes, en 21 se identificó una mutación relacionada con Feo/PGL o AH. En 23 casos no se pudo demostrar alteración genética, pero existían elementos sugestivos de síndrome hereditario como Feo/PGL múltiple, antecedentes familiares de AH o Feo/PGL o asociación a otra endocrinopatía. En los 28 pacientes restantes, no se encontró mutación, ni había elementos que sugirieran enfermedad hereditaria. En este último subgrupo se dispone de estudio genético solo en aproximadamente la mitad de los casos2.
Dénes et al.10 publicaron en 2015 el análisis genético de 39 pacientes con AH y Feo/PGL. El grupo detectó 11 mutaciones germinales en 5 genes diferentes: 5 SDHB, 1 SDHC, 1 SDHD, 2 VHL y 2 MEN1. Cabe destacar que en 20 pacientes no se encontró mutación.
En los pacientes con 3PAs y mutaciones de SDH, los AH suelen ser de mayor tamaño y localmente agresivos o resistentes al tratamiento. La mayoría son productores de GH, prolactina o no funcionantes. Los Feo/PGL son frecuentemente bilaterales o múltiples y con tendencia a la recurrencia4.
En el caso 1, la coexistencia de feocromocitoma bilateral y acromegalia, hace sospechar una relación patogénica entre ambos tumores. Actualmente está en curso la ampliación del estudio genético para la detección, entre otras, de mutación del MEN1 o una gran deleción del MAX, gen recientemente implicado en casos de Feo/PGL, cuando no hay evidencia de otras mutaciones conocidas, y que podría explicar la ausencia de antecedentes familiares aparentes11. La paciente 2 presentó un macroprolactinoma, situación poco habitual en mujeres de edad fértil, y que corresponde con el fenotipo de AH de pacientes con 3PAs. En el caso 3, la concurrencia de 3 enfermedades endocrinas hace suponer una relación entre ellas, y aunque entrarían dentro del espectro clínico de esta nueva asociación, también podría corresponder a un MEN tipo 4. Respecto a la heterogeneidad del estudio genético, debe tenerse en cuenta que los pacientes fueron atendidos en 3 centros hospitalarios diferentes, y la mayor parte del estudio, incluido el genético, se realizó con anterioridad a los conocimientos más recientes sobre la asociación 3PAs.
En conclusión, la evidencia actual indica que las mutaciones de SDH están relacionadas con la tumorogénesis hipofisaria y un fenotipo tumoral específico. Los pacientes con Feo/PGL múltiples, algún familiar afecto o alteración genética de la SDH, tienen predisposición al desarrollo de tumores hipofisarios. Sería conveniente en estos casos, una valoración clínica, hormonal y radiológica hipofisaria. A la luz de los conocimientos actuales, el estudio genético debería incluir en primer lugar, el gen de la SDHB, y posteriormente el resto de subunidades de succinato deshidrogenasa, VHL y MEN1. En caso de ser negativos, se debería hacer estudio del MEN4.