Los tumores neuroendocrinos (TNE) gastro-entero-pancreáticos (TNE-GEP) y torácicos son uno de los grupos de neoplasias más heredables del organismo, siendo el síndrome de neoplasia endocrina múltiple tipo 1 el síndrome genético que más frecuentemente se asocia a este tipo de tumores. Por otra parte, el síndrome de von Hippel Lindau, la esclerosis tuberosa, el síndrome de neoplasia múltiple tipo 4 y la neurofibromatosis tipo 1 también están asociados a un mayor riesgo de desarrollar TNE-GEP. Otro aspecto importante en los TNE-GEP y TNE torácicos es el conocimiento del perfil molecular, ya que el perfil molecular de estos tumores puede tener implicaciones en el pronóstico y en la respuesta a tratamientos específicos. En esta revisión se resumen las principales indicaciones de solicitar estudio genético en pacientes con TNE-GEP y TNE torácicos, y los métodos empleados para su realización. Además, se ofrece una descripción de los principales síndromes hereditarios asociados a estos TNE y de su perfil molecular, así como de las implicaciones clínicas del perfil molecular.
Gastro-entero-pancreatic (GEP-NET) and thoracic neuroendocrine tumours (NETs) are one of the most heritable groups of neoplasms in the body, being multiple endocrine neoplasia syndrome type 1 (MEN1), the genetic syndrome most frequently associated with this type of tumours. Moreover, Von Hippel Lindau syndrome, tuberous sclerosis, type 4 multiple neoplasia syndrome, and type 1 neurofibromatosis are associated with an increased risk of developing GEP-NETs. Another important aspect in GEP-NETs and thoracic NETs is the knowledge of the molecular background since the molecular profile of these tumours may have implications in the prognosis and in the response to specific treatments. This review summarizes the main indications for performing a genetic study in patients with GEP-NETs and thoracic NETs, and the methods used to carry it out. Moreover, it offers a description of the main hereditary syndromes associated with these NETs and their molecular background, as well as the clinical implications of the molecular profile.
Los tumores neuroendocrinos (TNE) son un conjunto diverso y heterogéneo de neoplasias que comparten un origen común, a partir de células del sistema neuroendocrino difuso, pero que pueden diferir notablemente en su localización, actividad secretora, grado de diferenciación, presencia o ausencia de metástasis, y otras tantas características1. Dentro de los TNE se incluyen, como grupo más destacado, los TNE gastro-entero-pancreáticos (TNE-GEP), que comprenden a su vez los TNE gastrointestinales y los TNE de páncreas (TNEP), los TNE pulmonares, los TNE de timo, los TNE de tiroides, así como otros TNE de origen desconocido, y los paragangliomas y feocromocitomas. Los TNE son uno de los grupos de neoplasias más heredables, que se presentan en al menos 10síndromes genéticos, siendo el síndrome de neoplasia endocrina múltiple tipo 1 (MEN1), el síndrome hereditario más frecuentemente asociado a TNE2,3.
La combinación de los avances ofrecidos por técnicas clásicas como la inmunohistoquímica, bioquímica clínica y las pruebas de imagen, y por el estudio de la biología molecular de los TNE, ha permitido llegar a un conocimiento más profundo y preciso de estos tumores. En este sentido, se han identificado mutaciones y alteraciones específicas en genes que subyacen en la génesis de los TNE mediante análisis genéticos avanzados. Conocer el trasfondo genético de los TNE tiene implicaciones no solo en cuanto a consejo genético, también en la predicción de la respuesta a tratamientos específicos y en la personalización del tratamiento y seguimiento de nuestros pacientes con TNE2,4-6. Debido a los avances en las técnicas de medicina molecular en los últimos años, se han descubierto una amplia gama de mutaciones genéticas en línea germinal previamente no conocidas que están involucradas en el desarrollo de algunos TNE, y con potenciales implicaciones clínicas7,8. Además, la disponibilidad de las técnicas de secuenciación de nueva generación (NGS) han permitido analizar múltiples genes de forma rápida y simultánea, lo que puede ser de gran utilidad en pacientes con TNE que se pueden presentar en el contexto de múltiples síndromes de predisposición hereditaria9.
En este trabajo se resumen las principales indicaciones de solicitar estudio genético en pacientes con TNE-GEP y TNE torácicos. También se ofrece una descripción de los principales síndromes genéticos hereditarios asociados a estos TNE y de su perfil molecular, incluyendo la descripción de las implicaciones clínicas del perfil molecular en TNE-GEP y TNE torácicos. Además, se describen las principales estrategias empleadas para realizar el estudio genético en pacientes con síndromes hereditarios (pruebas dirigidas o de paneles de genes y técnicas de NGS), señalándose brevemente las ventajas y los inconvenientes de cada una de ellas.
TNE-GEPPerfil molecularLos TNE-GEP son el grupo mayoritario de TNE, representando el 50% de todos los TNE. Se estima que el 5-10% de los casos ocurren en el contexto de síndromes hereditarios asociados a TNE10. La información molecular y genética es relativamente abundante para TNEP y TNE intestinales, mientras que es limitada para los TNE gástricos.
La distinción entre TNE y carcinoma neuroendocrino (NEC) está vinculada a su origen genético. El sello distintivo entre los NEC y los TNE es la inactivación de la proteína P53 y del RB111. En este sentido, la presencia de una mutación en P53 o pérdida de expresión de RB1 en el análisis histomorfológico es de utilidad para diferenciar los TNEP grado 3 de los NEC12.
En cuanto a los TNEP esporádicos, se han observado mutaciones somáticas recurrentes en el gen supresor tumoral MEN1 hasta en el 40% de los pacientes13, en genes de remodelado de la cromatina como ATRX/DAXX en el 38%6 y en el complejo PTEN/TSC1-2/DEPDC5 en el 15%. El perfil mutacional también parece ser diferente entre TNEP funcionantes y no funcionantes, ya que la prevalencia de mutaciones en MEN1 en glucagonoma es del 60%, en gastrinomas del 40% y en insulinomas de un 2-20%14. Sin embargo, en los TNE intestinales esporádicos se identifican principalmente alteraciones cromosómicas, identificándose mutaciones somáticas en CDKN1B y APC en una minoría de casos (en aproximadamente el 10% de los casos)15. Las mutaciones somáticas en CDKN1B son una de las mutaciones génicas más específicas de TNE intestinal. CDKN1B codifica un inhibidor de cinasa dependiente de ciclina que se une e inhibe Cdk2 y Cdk416,17. En cuanto a la vía APC/β-catenina, se ha implicado en la progresión inicial de las células madre multipotentes a células neoplásicas en estos tumores18.
Por otra parte, las alteraciones epigenéticas desempeñan un papel importante en la biología de los TNE-GEP. Varios genes están metilados diferencialmente en subgrupos relevantes de TNE-GEP y la hipometilación global del ADN es un mecanismo que se ha propuesto como impulsor de la inestabilidad cromosómica en asociación con la activación de ALT en TNEP19. En los TNE intestinales, los estudios de metilación del ADN han observado 3 subgrupos con distintos patrones de metilación con diferente pronóstico20.
Las 3vías moleculares principalmente implicadas en la tumorogénesis de los TNE-GEP son la vía de reparación de daños en el ADN, la vía de regulación del ciclo celular dependiente de ciclina y la vía PI3K-AKT-mTOR. En los TNEP se han identificado hasta 5 vías alteradas: la vía de reparación del daño al ADN, la vía de regulación del ciclo celular, la de remodelación de la cromatina, la vía de los telómeros y la vía de señalización de PI3K-AKT-mTOR. En cambio, en los TNE de intestino delgado únicamente estarían implicadas la vía PIK3-AKT-mTOR, la vía Wnt, la vía de regulación del ciclo celular y la de reparación de daño en el ADN15 (fig. 1).
Implicaciones clínicas del estudio molecular en TNE-GEPSe han identificado marcadores moleculares asociados a buen pronóstico, como la expresión del factor de crecimiento endotelial o del receptor de somatostatina tipo 2; de mejor respuesta a la quimioterapia en TNEP con pérdida de expresión de retinoblastoma, y otros asociados a peor pronóstico como son las mutaciones en ATRXX/PDX121, o la pérdida de inmunotinción de P16. Además, algunas de estas alteraciones moleculares podrían ser marcadores específicos de respuesta a tratamientos con terapia dirigida, como las alteraciones en la vía AKT-mTOR que se han asociado a una mejor respuesta a temsirólimus22. Por tanto, el conocimiento de estos marcadores moleculares podría ser de utilidad para individualizar el seguimiento y para orientar la selección de tratamientos sistémicos23.
En este sentido, se han creado 2herramientas basadas en el perfil molecular de los TNE con utilidad prometedora para el diagnóstico, pronóstico y predicción de respuesta en TNE: el NETest y el PPQ. El papel del NETest se encuentra ampliamente estudiado. Se trata de un estudio realizado en sangre periférica del que se extrae ARN mensajero que posteriormente se transforma en ADN para realizar una medición de la expresión de genes a través de PCR. En función de la expresión génica se otorga una puntuación del 0-100. Los resultados que se obtienen en el NETest son de utilidad para el diagnóstico preciso de los TNE, el seguimiento en tiempo real del estado de la enfermedad, la predicción del comportamiento agresivo del tumor, la identificación del grado de resección quirúrgica del tumor y para la predicción de respuesta al tratamiento médico y con radionúclidos en TNE-GEP, TNE pulmonares y en feocromocitomas y paragangliomas24. El PPQ se trata de una biopsia líquida molecular basada en 8factores de crecimiento y genes específicos de TNE, que permite predecir la eficacia de la terapia con radionúclidos con un 95% de precisión25.
Síndromes genéticos asociados a TNE-GEPAunque los TNE-GEP son de origen genético en menos del 10% de los pacientes, formando parte de síndromes hereditarios típicos como el síndrome de MEN1 o de neoplasia endocrina múltiple tipo 4 (MEN4), el síndrome de von Hippel Lindau (VHL), la esclerosis tuberosa (ET) o la neurofibromatosis tipo 1 (NF1) (tabla 1), se han descrito mutaciones germinales en MEN1, VHL y CDKN1B en el 17% de los TNEP aparentemente esporádicos. Además, las mutaciones de la línea germinal de genes de reparación de daños en el ADN, como MUTYH, CHEK2 y BRCA2, han sido detectadas con frecuencias de aproximadamente un 6% en TNE-GEP5. Otras mutaciones germinales que se han descrito en TNEP incluyen APC, RAD50, RECQL4, FANCC, MAPKBP1 y PIF1 en < 5%7,8. No obstante, muchas de estas últimas mutaciones tienen baja penetrancia o tienen una actividad clínica incierta, como, por ejemplo, RAD508.
Síndromes hereditarios asociados a TNE-GEP
| Síndrome genético | Gen | Cromosoma | Proteína | Herencia | Penetrancia |
|---|---|---|---|---|---|
| MEN1 | MEN1 | 11q13.1 | Menina | HAD10% mutaciones de novo | > 95% |
| MEN4 | CDKN1B | 12p13.1 | P27 | HAD | Desconocida |
| VHL | VHL | 3p25.3 | VHL | HAD20% mutaciones de novo | 50% a los 50 años |
| ET | CET | CET1:9q34.13CET2: 16p13.3 | HamartinaTuberina | HAD75% mutaciones de novo | 100% |
| NF1 | NF1 | 17q11.2 | Neurofibromina | HAD | 100% (infancia) |
ET: esclerosis tuberosa; HAD: herencia autosómica dominante; MEN1: síndrome de neoplasia endocrina múltiple tipo 1; MEN4: síndrome de neoplasia endocrina múltiple tipo 4; NF1: neurofibromatosis tipo 1; TNE-GEP: tumor neuroendocrino gastro-entero-pancreático; VHL: síndrome de von Hippel Lindau.
El MEN1 es un síndrome de herencia autosómica dominante (HAD) causado por mutaciones germinales en el cromosoma 11q13, cuya tríada típica es la asociación de hiperparatiroidismo primario (HPTP) causado por enfermedad multiglandular (95%), adenomas hipofisarios (20-40%) y TNE pancreáticos o duodenales (40-80%)26. Hasta en un 10% de los casos se producen mutaciones de novo, sin existir historia familiar de MEN127. Por otra parte, entre los pacientes que cumplen los criterios clínicos de MEN1, aproximadamente el 10% no tiene mutaciones identificables27.
Los TNEP son el segundo tumor más frecuente en el MEN1 y la principal causa de muerte en estos pacientes, con una supervivencia estimada a los 10 años del diagnóstico que oscila entre el 23 y el 62%28. Se estima que el riesgo de desarrollar un TNEP a lo largo de la vida en pacientes con MEN1 es de un 40-80%28. Los TNEP más frecuentes en MEN1 son los no funcionantes. Los TNEP no funcionantes suelen ser multifocales; el diagnóstico se realiza a una edad más temprana que los esporádicos, siendo los 40 años la edad media de diagnóstico, y tienen un curso de enfermedad más indolente que los casos esporádicos. Suelen ser asintomáticos cuando se diagnostican, pero pueden dar lugar a metástasis, siendo el hígado el lugar más frecuente de metástasis29. En pacientes portadores de mutación en el exón 2 se ha objetivado un riesgo 2veces mayor de desarrollar TNEP y una frecuencia significativamente mayor de enfermedad metastásica que en los pacientes sin mutación en el exón 2 (53% vs. 23%, p=0,049)30.
En cuanto a los TNE-GEP funcionantes en el MEN1, el más frecuente es con diferencia el gastrinoma. De hecho, se estima que el 25-30% de los gastrinomas se encuentran asociados al MEN1 y hasta un 60% de los pacientes con MEN1 desarrollarán un gastrinoma a lo largo de su vida31,32. En pacientes con MEN1 los gastrinomas ocurren de media una década antes que en los casos esporádicos1, se localizan casi exclusivamente en el duodeno y hay mayor incidencia de enfermedad esofágica severa que en los casos esporádicos33. Los insulinomas son los segundos TNE-GEP funcionantes en frecuencia en el MEN1, aproximadamente el 15% de los pacientes con MEN1 presentan insulinomas, pudiendo ser la primera manifestación de síndrome hasta en el 10%34. Por otra parte, en torno al 4-10% de los insulinomas se encuentran asociados al MEN1. Los insulinomas del MEN1 suelen ser tumores más pequeños que los esporádicos, pero con mayor frecuencia son metastásicos (hasta en el 25% de los casos en el MEN1 frente a un 10% en los insulinomas esporádicos)35. Otros tumores más infrecuentes como los glucagonomas, vipomas o somatostatinomas se detectan en menos de un 5% de los pacientes con MEN129 (fig. 2).
MEN4 y TNE-GEPUna variante del MEN1 también asociada a TNE-GEP y de HAD es el MEN4. Comparte un fenotipo similar al MEN1, pero se debe a mutaciones en el cromosoma 12p en CDKN1B que codifica la proteína p27 que es un gen supresor de tumores que regula la progresión del ciclo celular36. Los tumores más frecuentemente asociados a MEN4 son los hipofisarios y de paratiroides. En cuanto a los TNE-GEP en MEN4, son menos frecuentes que en el MEN1 (ocurren en el 25% de los MEN4 frente a un 60-80% en MEN1), y suelen ser gastrinomas o TNEP no funcionantes37.
VHL y TNE-GEPEl síndrome o enfermedad de VHL es otro de los síndromes hereditarios que se asocia a TNE-GEP. Es un síndrome de HAD causado por mutaciones inactivadoras en el gen supresor tumoral VHL, localizado en el cromosoma 3p2538. La enfermedad de VHL muestra una marcada variabilidad fenotípica y penetrancia dependiente de la edad39. Se caracteriza por una mayor predisposición a hemangioblastomas del sistema nervioso central (SNC), paragangliomas, carcinoma renal de células claras, quistes renales, TNE y quistes pancreáticos y tumores del saco endolinfático, principalmente. Este síndrome se subclasifica en tipo 1 (sin feocromocitoma) y tipo 2 (alto riesgo de feocromocitoma) en función del riesgo de feocromocitoma. A su vez, el VHL tipo 2 incluye 3 subtipos: el tipo 2A (sin carcinoma renal de células claras), 2B (alto riesgo de carcinoma renal de células claras) y 2C (únicamente feocromocitoma) según el riesgo de carcinoma de células renales claras38.
En cuanto al riesgo de TNEP, aunque en torno al 75% de los pacientes con VHL presentan algún tipo de lesión pancreática, la mayoría se corresponde con lesiones quísticas, generalmente cistoadenomas serosos. Los TNEP ocurren en el 10-17% de los pacientes con VHL38, aunque el riesgo es mayor en los pacientes con VHL con mutaciones en el exón 3 del gen de VHL40. No obstante, en términos globales, el riesgo de VHL en un paciente con TNEP es bajo, de aproximadamente un 0,5%. Los TNEP en VHL suelen ser no funcionantes, el 30-50% son múltiples y generalmente se diagnostican de forma más precoz que los esporádicos, lo que en parte podría explicar el riesgo de malignidad descrito en los pacientes con TNEP en VHL sea más bajo que en otros TNEP esporádicos41.
Esclerosis tuberosa y TNE-GEPLa ET es un trastorno autosómico dominante caracterizado por manifestaciones multisistémicas que incluyen hamartomas en el cerebro, el corazón, el pulmón, los riñones y la piel42. Infrecuentemente, concretamente en un 1% de los casos, se asocia a TNE, generalmente pancreáticos y no funcionantes e insulinomas43. La ET se produce a causa de mutaciones funcionales en los genes TSC1 y TSC2 que codifican proteínas que forman el complejo tuberina-hamartina, el cual es esencial para la señalización de la vía mTOR (vía encargada de la regulación del crecimiento, diferenciación y proliferación celular)44. No obstante, entre los pacientes que cumplen con los criterios clínicos de ET, el 15-20% no tiene mutaciones identificables.
Neurofibromatosis tipo 1 y TNE-GEPLa NF1 o enfermedad de von Recklinghausen es un síndrome de HAD causado por mutaciones en el gen de la neurofibromatosis 1, situado en el cromosoma 17, y codifica para una proteína, denominada neurofibromina. Sin embargo, aproximadamente el 42% de las personas afectadas tienen mutaciones de novo45.
Sus manifestaciones clínicas son principalmente cutáneas y del SNC, pero, además, en torno al 1% presentan TNE-GEP. La mayoría se localiza en la región ampular del duodeno y generalmente son somatostatinomas46. No obstante, pueden ser silentes en un porcentaje elevado de casos y manifestarse con clínica derivada de efecto masa del tumor. La coexistencia de somatostatinoma y tumor del estroma gastrointestinal en un mismo paciente se puede considerar prácticamente patognomónico de NF1. Dentro de los TNEP, los insulinomas son el tipo más frecuente. En general, son menos agresivos que los esporádicos en cuanto al riesgo de metástasis47.
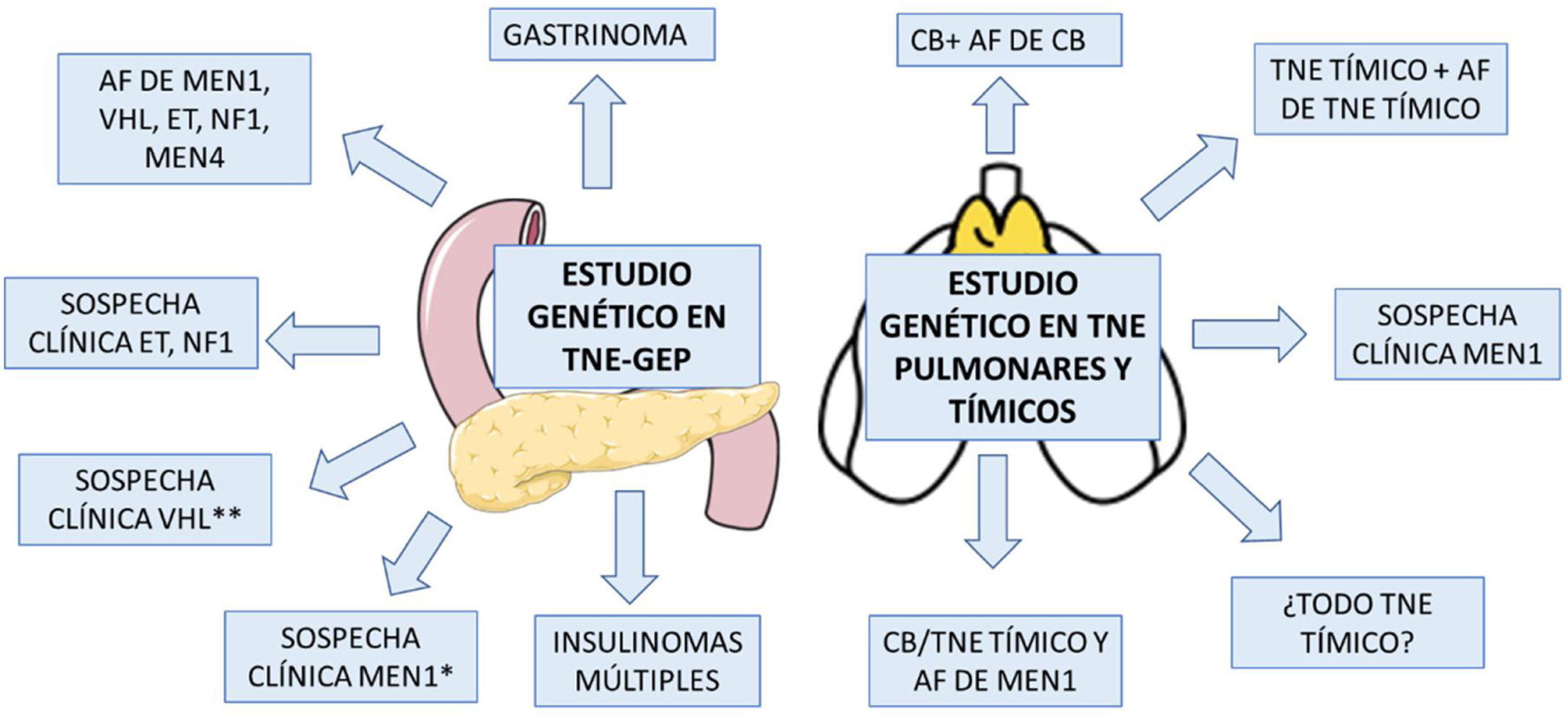
Indicaciones estudio genético en TNE-GEPEntre las indicaciones de estudio genético en pacientes que se presenten como TNE-GEP estarían: 1) gastrinoma a cualquier edad, teniendo en cuenta que el 25% de los gastrinomas ocurren en pacientes con MEN131,32; 2) insulinomas múltiples a cualquier edad (los insulinomas presentes en pacientes con MEN1 son generalmente pequeños y numerosos, los esporádicos suelen ser únicos); 3) sospecha clínica de MEN1, es decir, coexistencia de TNE-GEP e HPTP o TNE-GEP y adenoma hipofisario o de 2 o más tumores relacionados con MEN126,48; 4) sospecha clínica de VHL, es decir, un TNE-GEP y una o más lesiones asociada a VHL (hemangioblastoma, carcinoma renal de células claras, feocromocitoma, tumor de saco endolinfático medio, cistoadenoma papilar epididimal, cistoadenoma seroso pancreático)39,49; 5) TNE-GEP en pacientes con sospecha clínica de NF1,45 ET42, o MEN4 (mismos criterios para MEN1 en paciente con estudio genético para MEN1 negativo), y 6) TNE-GEP en pacientes con antecedentes familiares de MEN1, VHL, NF1, ET o MEN410 (tabla 2) (fig. 3). También se debería valorar solicitar estudio genético en pacientes con TNE-GEP que se diagnostiquen a una edad muy temprana (< 30 años), ya que podrían ser la primera manifestación de un MEN1, o incluso de otro de los síndromes de predisposición hereditaria previamente descritos.
Criterios diagnósticos de los principales síndromes hereditarios asociados a TNE-GEP
| Síndrome hereditario | Diagnóstico clínico |
|---|---|
| MEN126 | Claros criterios de MEN-1: ≥ 2 de los 3 tumores más frecuentes (paratiroides, TNE-GEP e hipofisario) |
| Sin criterios claros de MEN-1, pero sospechoso/atípico MEN-1: | |
| Dos o más tumores relacionados (paratiroides, enteropancreático, hipófisis, adrenales, lipomas, carcinoides, angiofibromas, colagenomas) | |
| Tumores de paratiroides en < 30 años | |
| Hiperparatiroidismo primario recurrente | |
| Gastrinoma a cualquier edad | |
| Múltiples tumores de islotes a cualquier edad | |
| Hiperparatiroidismo familiar aislado | |
| MEN437 | Mismos criterios que MEN1 en pacientes con estudio genético negativo para MEN1 |
| VHL38 | > 2 lesiones asociadas a VHL (hemangioblastoma, carcinoma renal de células claras, feocromocitoma, tumor de saco endolinfático medio, cistoadenoma papilar epididimal, cistoadenoma seroso pancreático, TNEP) |
| Una lesión asociada a VHL e historia familiar de lesiones asociadas a VHL | |
| Hemangioblastoma diagnosticado en < 30 años | |
| > 2 hemangioblastomas diagnosticados a cualquier edad | |
| Carcinoma de células claras renal diagnosticado en < 40 años | |
| Carcinoma de células claras renal bilateral o múltiple | |
| Feocromocitoma en < 40 años | |
| Feocromocitoma bilateral o múltiple | |
| > 1 cistoadenoma seroso pancreático | |
| > 1 TNEP | |
| Múltiples quistes pancreáticos en cualquier lesión asociada a VHL | |
| Cistoadenoma papilar epididimal a cualquier edad | |
| Quistes epididimales bilaterales | |
| ET42 | Dos o más características mayores: |
| Máculas hipomelanóticas (más de 2 y ≥ 5mm de diámetro) | |
| Angiofibromas (más de 2) o placa cefálica fibrosa | |
| Fibromas ungueales (más de 1) | |
| Parche de Shagreen | |
| Hamartomas retinianos múltiples | |
| Displasias corticales | |
| Nódulos subependimarios | |
| Astrocitoma subependimario de células gigantes | |
| Rabdomioma cardiaco | |
| Linfangioleiomiomatosis | |
| Angiomiolipomas (más de 1) | |
| Una característica mayor con al menos 2 características menores: | |
| Lesiones cutáneas de confeti | |
| Fosas de esmalte dental (más de 3) | |
| Fibromas intraorales (más de 1) | |
| Parche acrómico retiniano | |
| Múltiples quistes renales | |
| Hamartomas no renales | |
| NF145 | Se requieren 2o más criterios mayores para el diagnóstico: |
| Seis o más manchas café con leche (> 0,5cm en niños o > 1,5cm en adultos) | |
| Dos o más neurofibromas cutáneos o subcutáneos o un neurofibroma plexiforme | |
| Pecas axilares o inguinales | |
| Glioma de la vía óptica | |
| Dos o más nódulos de Lisch | |
| Displasia ósea | |
| Familiar de primer grado con NF-1 |
ET: esclerosis tuberosas; MEN4: síndrome de neoplasia endocrina múltiple tipo 4; MEN1: síndrome de neoplasia endocrina múltiple tipo 1; NF1: neurofibromatosis tipo 1; TNEP: tumor neuroendocrino pancreático; TNE-GEP: tumor neuroendocrino gastro-entero-pancreático; VHL: síndrome de von Hippel Lindau.
Indicaciones de estudio genético en TNE-GEP y TNE pulmonares y tímicos
AF: antecedentes familiares; CB: carcinoide bronquial; ET: esclerosis tuberosa; NF1: neurofibromatosis tipo 1; VHL: Von Hippel Lindau; TNE: tumor neuroendocrino.
*Coexistencia de TNE-GEP e HPTP o TNE-GEP y adenoma hipofisario o de 2 o más tumores relacionados con MEN1;
** Hemangioblastoma, carcinoma renal de células claras, feocromocitoma, tumor de saco endolinfático medio, cistoadenoma papilar epididimal, cistoadenoma seroso pancreático.
En cuanto a los TNE pulmonares, los carcinoides bronquiales (CB) suponen el 2% de las neoplasias primarias de pulmón. Los carcinomas pulmonares neuroendocrinos y los CB presentan un perfil molecular diferencial, siendo las mutaciones en P53 y RB1 los marcadores más útiles indicativos de NEC50. En el caso de los CB se han identificado mutaciones recurrentes en MEN1 en hasta el 40% de los casos, pérdida de heterogeneidad y mutaciones en PIK3CA en el 13-40% de los pacientes50. Las principales vías implicadas en la patogenia de los CB son la vía de remodelación de la cromatina, de reparación de daños en el ADN y de los telómeros (fig. 1).
En cuanto a los patrones de remodelación de cromatina y de metilación del ADN, existen pocos estudios centrados en este aspecto en los TNE pulmonares, pero se ha descrito una asociación negativa entre la sobreexpresión nuclear de la proteína arginina metiltransferasa-5 (PRMT5) y el grado tumoral51, y la presencia de un patrón de metilación diferencial entre CB típicos, atípicos y carcinomas neuroendocrinos pulmonares52.
Implicaciones clínicas del estudio molecular en TNE pulmonaresExisten algunas alteraciones moleculares y genéticas en el CB que se han asociado con resultados de supervivencia y otras que podrían ser potenciales marcadores de respuesta a terapias específicas. De esta forma, el conocimiento del perfil molecular en el CB es de gran importancia, tanto para la estratificación del riesgo de progresión, como para la individualización del tratamiento dirigido en aquellos casos no subsidiarios de la cirugía o con persistencia o progresión tumoral53. Por ejemplo, las mutaciones en MEN154 se asocian a mal pronóstico, independientemente del sexo, la edad y la presencia o la ausencia de tabaquismo; las mutaciones en ATRX se han relacionado con una menor supervivencia (hazard ratio=11, IC del 95%, 1,8-68, p=0,01)55; la inestabilidad cromosómica es un evento común en carcinoides atípicos y metastásicos, y las mutaciones en PI3K-AKT-mTOR se asocian a una mayor agresividad en CB56. Por otra parte, las mutaciones en la vía PIK3 también podrían ser un potencial marcador de respuesta a everólimus57,58.
Síndromes genéticos asociados a CBHasta un 5% de los CB se presentan en el contexto de un MEN1 y de forma mucho menos frecuente en el contexto de un síndrome de carcinoides pulmonares familiar51.
MEN1 y CBEl MEN1 puede cursar con CB en hasta el 13% de los pacientes y, por otra parte, en torno al 5% de CB ocurren en pacientes con MEN159. Sin embargo, la prevalencia de CB en MEN1 depende de los criterios que se han empleado para el diagnóstico de CB. La prevalencia es de un 6,7% cuando solo se incluyen casos de CB verificados por histología y alrededor del 30% cuando también se incluyen pequeños nódulos broncopulmonares observados en la TAC60.
En comparación con los CB esporádicos, los asociados a MEN1 se diagnostican de forma más precoz (42-40 años frente a 64 años)61, lo que en parte podría justificar que se asocien a una menor mortalidad. No parecen existir diferencias en la prevalencia en cuanto al sexo en MEN1. Suelen ser asintomáticos y se descubren generalmente en las pruebas de imagen de cribado solicitadas de rutina en el estudio de MEN1. Generalmente muestran un curso indolente, ya que la mayor parte de estos tumores son TNE bien diferenciados (CB típicos y atípicos). Por ello, los CB no disminuyen la supervivencia global de los pacientes con MEN162. Al igual que en los CB no asociados a MEN, la supervivencia es mejor en mujeres que en hombres, en CB típicos que atípicos y en CB sin metástasis que en los CB metastásicos63.
Síndrome de carcinoides bronquiales familiaresEl otro síndrome genético, mucho menos conocido, es el síndrome de CB familiar, que únicamente ha sido descrito en un trabajo publicado en el 2001, describiéndose 2 familias sin mutaciones en MEN1, en las que se evidenciaban 2 casos de CB en pacientes de entre 70-80 años en cada familia, sin otras manifestaciones de MEN1, sospechándose la existencia de otro tipo de susceptibilidad genética pero todavía no filiada64.
Indicaciones de estudio genético en el CBLas indicaciones de solicitar estudio genético en CB serían: 1) TNE pulmonar con antecedentes familiares de MEN1; 2) TNE pulmonar con antecedentes familiares de CB; 3) pacientes con TNE pulmonar y sospecha clínica de MEN1, y en 4) TNE pulmonar en paciente con otros tumores asociados a MEN1 (coexistencia de TNE-GEP e HPTP o TNE-GEP y adenoma hipofisario o de 2 o más tumores relacionados con MEN1)26 (tabla 2). La mayor parte de los TNE pulmonares en MEN son CB, por lo que el estudio genético debería plantearse principalmente en pacientes con CB y no en otros tipos de TNE pulmonares, salvo que exista historia familiar de MEN1.
TNE tímicosPerfil molecular e implicaciones clínicas del estudio molecular en TNE tímicosLos TNE tímicos representan el 0,5% de todos los TNE. En el estudio de Sakane et al.65 se describen que los genes mutados con mayor frecuencia en los TNE tímicos son el P53 (18,5%), seguido de KIT (7,4%) y PDGFRA (5,6%). En cuanto al perfil molecular, todavía no se conocen posibles biomarcadores de pronóstico ni alteraciones moleculares dirigibles en estos tumores65,66. El conocimiento del perfil de metilación en TNE tímicos es muy limitado. Un estudio centrado en este aspecto en TNE tímicos encuentra que RASSF1A estaba fuertemente hipermetilado en TNE, pero no en carcinomas tímicos o timomas. Encontrando además que el tejido tumoral de TNE de bajo grado estaba más fuertemente metilado que el de los de alto grado67.
Síndromes familiares asociados a TNE tímicosMEN1 y TNE tímicosEl único síndrome hereditario asociado a un mayor riesgo de TNE tímicos es el MEN1. De hecho, en torno al 25% de los TNE tímicos ocurren en el contexto de MEN1 y el 3,7% (rango 2,0%-8,2%) de MEN1 desarrollan un TNE tímico a lo largo del seguimiento68. Más de la mitad de los TNE tímicos se presentan con enfermedad metastásica al diagnóstico68. Es una de las principales causas de muerte en MEN1; un estudio reciente reporta que el 19% de las muertes en MEN1 fueron debidas a TNE tímicos69. La supervivencia a los 5 años es de un 69,5%.
Se han identificado algunos factores asociados a peor pronóstico, como una mayor edad (por encima de los 43,0 años), un mayor diámetro máximo del tumor (> 5,0cm) y la presencia de metástasis68. Por todo ello, es importante seguir las recomendaciones de cribado de TNE bronquiales y tímicos, y realizar TAC o resonancia magnética de tórax cada 1-2 años, ya que un diagnóstico precoz se asocia a una mayor supervivencia.
Indicaciones de estudio genético en TNE tímicosEn cuanto a las indicaciones de estudio genético, son similares a las del CB, es decir en: 1) pacientes con antecedentes familiares de MEN1 o de TNE tímico, y en 2) sospecha clínica de MEN126 (tabla 2). No obstante, teniendo en cuenta que el 25% de los TNE tímicos ocurren en el contexto de MEN, que son una de las principales causas de muerte en el MEN1 y que su diagnóstico precoz se asocia a una mayor supervivencia, se debería valorara solicitar estudio genético de MEN1 en todos los pacientes con TNE tímicos.
Estrategias para realizar el estudio genético en síndromes hereditariosAunque las guías actuales generalmente recomiendan el uso de pruebas dirigidas o de paneles de genes a pequeña escala para la identificación de los síndromes de susceptibilidad genética a tumores endocrinos hereditarios, se han desarrollado técnicas de NGS que se encuentran ampliamente disponibles en la práctica clínica diaria. La aplicación de estas técnicas permite analizar múltiples genes de manera rápida. La mejoría en la precisión diagnostica de las técnicas moleculares actuales ha permitido catalogar a una proporción significativa de pacientes con TNE aparentemente esporádicos en TNE hereditarios, por tanto, en pacientes con alta sospecha clínica de síndromes hereditarios con estudio genético negativo realizado hace años se debería plantear repetir el estudio genético si hay disponibilidad de técnicas más avanzadas, y de la inclusión de genes que previamente no se conocían (por ejemplo, CDKN1B). El estudio genético tiene implicaciones diagnósticas, de evaluación del riesgo tumoral, de cara a la selección de la terapia, el seguimiento y la planificación y el cribado de familiares. Teniendo en cuenta que el diagnóstico precoz de la mayor parte de los TNE GEP y torácicos se asocia a una mayor supervivencia, se recomienda el estudio genético de miembros de la familia asintomáticos con el fin de establecer un diagnóstico temprano70.
Pruebas genéticas dirigidas/panel de genesPara las pruebas genéticas dirigidas, la secuenciación convencional de Sanger es la técnica más empleada y considerada el método de referencia71. Esta técnica se considera relativamente rápida y barata si la región genómica de interés es pequeña, pero se convierte en una técnica de bajo rendimiento si los genes a estudio son largos o numerosos, ya que consume mucha mano de obra, tiempo y dinero. No obstante, en los casos de cribado familiar en familiares asintomáticos con antecedentes familiares de una alteración genética ya identificada o en pacientes con clínica indicativa de un síndrome genético específico, se recomienda esta técnica70.
Técnicas de secuenciación de nueva generaciónLa NGS es capaz de investigar más de 50 genes simultáneamente, a menudo a un coste menor que las pruebas dirigidas9. Los principales inconvenientes de esta técnica son que no todos los genes incluidos en paneles de genes son siempre de relevancia clínica significativa y se pueden identificar algunos hallazgos en genes con un valor clínico no claramente establecido que pueden ser difícil de interpretar. Los criterios de interpretación de variantes de secuencia como «patógenas», «probablemente patógenas», «variante de significado incierto», «probablemente benigno» y «benignos» han sido definidas por el American College of Medical Genetics and Genomics en un consenso conjunto72. La NGS se debería plantear como técnica de primera línea en pacientes en los que un tumor puede ser parte de varios síndromes hereditarios (p. ej., feocromocitomas o paragangliomas)70. Por tanto, teniendo en cuenta las indicaciones de estudio genético en TNE-GEP, TNE pulmonares y tímicos, esta técnica se empleará en una minoría de los casos.
ConclusionesEl perfil molecular de los TNE-GEP y torácicos tiene implicaciones pronósticas y de predicción de respuesta a tratamientos con terapia dirigida. El avance en las técnicas de medicina molecular, con el descubrimiento de nuevos genes y un mejor conocimiento de los ya conocidos previamente, está abriendo campo a una medicina de precisión cada vez más personalizada, permitiendo predecir tanto el pronóstico del paciente con un TNE en función de su perfil molecular, como las opciones de respuesta a tratamientos específicos.
Los síndromes hereditarios típicamente asociados a TNE-GEP son el MEN1, MEN4, VHL, ET y NF1. El 5% de los TNE pulmonares y el 25% de los TNE tímicos ocurren en el contexto de un MEN1. Es importante conocer los criterios de realización de estudio genético en estos tumores, de cara a ofrecer al paciente un adecuado consejo genético y un seguimiento personalizado.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.