La capacidad de los riñones para aumentar la tasa de filtrado glomerular (TFG) en respuesta a ciertos estímulos bajo condiciones fisiológicas o patológicas se denomina reserva funcional renal (RFR).
La TFG varía de acuerdo a la dieta y otros factores, incluso permanece normal a pesar de una disminución importante del número de nefronas. Una vez que la TFG es determinada, la RFR puede ser evaluada clínicamente con carga oral de proteínas o infusión intravenosa de aminoácidos.
La RFR se define como la diferencia entre el pico de TFG alcanzado con «estrés» y la TFG basal. Gracias a los mecanismos adaptativos, la RFR puede utilizarse parcial o completamente para alcanzar una función renal normal o por encima de lo normal en estados de hiperfiltración en los que existe una TFG alta como en el embarazo, hipertensión, nefropatía diabética, riñones únicos o donantes renales.
La RFR podría ser más sensible y precoz que la TFG para evaluar la pérdida y recuperación de la función renal. En los casos en los que el riñón presenta recuperación deficiente o fibrosis, la valoración clínica puede indicar recuperación completa si se calcula con la TFG. Sin embargo, la RFR podría estar reducida y representar un signo de reparación deficiente o de masa funcional renal disminuida. La reducción de la RFR puede representar el equivalente de la fragilidad o susceptibilidad renal al daño renal. El objetivo de este artículo de revisión sobre RFR es dar a conocer los conceptos, utilidad clínica y perspectivas de su uso.
Renal function reserve (RFR) represents the capacity of the kidney to increase glomerular filtration rate (GFR) in response to certain physiological or pathological stimuli or conditions.
Baseline GFR displays variable values according to the diet or other factors, and may be normal even when there is an important lowering of nephron number. Once baseline GFR is determined, RFR can be assessed clinically by oral protein load or intravenous aminoacid infusion.
RFR is the difference between peak (stress-induced) GFR and basal GFR. In clinical scenarios where hyper-filtration is present (high baseline GFR due to pregnancy, hypertensive or diabetic nephropathy, solitary kidney or kidney donors) RFR may be fully or partially used to achieve normal or supra-normal renal function.
RFR test may represent a sensitive and early way to asses kidney functional decline and recovery. In cases of healing with a defect and fibrosis, clinical assessment may suggest a complete recovery, but a reduced RFR may be a sign of a maladaptive repair or sub-clinical loss of renal mass. Therefore, a reduction of RFR may represent the equivalent of renal frailty or susceptibility to insults. The main aim of this article is to review the concept of RFR, its utility in different clinical scenarios and future perspective for its use.
Hay una biodiversidad significativa en la estructura renal y el número total de nefronas entre los seres humanos que viene determimada, no solamente por predisposición genética, sino que también es dependiente de factores epigenéticos como la nutrición deficiente o las alteraciones en la etapa perinatal. Esto puede afectar a las características funcionales de los riñones de un individuo, su tasa de filtrado glomerular (TFG) y su reserva funcional renal (RFR).
La TFG proporciona una estimación inexacta de la función renal, pudiendo pasar desapercibida una disfunción renal subclínica, en la que la TFG y la creatinina se conservan en rangos de normalidad. La RFR determina la capacidad renal para incrementar la TFG en condiciones de estrés renal. Este concepto clínico cobra relevancia ante la evidencia de su utilidad para evaluar la progresión del daño renal, recuperación de la función renal tras el daño renal agudo, y sus variaciones en estados fisiológicos como el embarazo y el envejecimiento, donde la TFG es normal.
Filtrado glomerular y pruebas de estrés renalLa TFG es el indicador más ampliamente utilizado para valorar la función renal en sujetos sanos. La TFG proporciona un cálculo aproximado del número funcionante de nefronas, que representa la suma de la funcionalidad de cada una de ellas. Mientras que estadísticamente se expresan valores promedio para sujetos sanos, no es posible definir la TFG normal para un individuo determinado.
La TFG basal (TFG sin estrés) está influida fundamentalmente por las condiciones hemodinámicas y la dieta de un individuo. Los valores basales para TFG también dependen de la edad, sexo y talla y es aproximadamente de 120ml/min/1,73 m2 para los hombres y de 110ml/min/1,73 m2 para las mujeres, con variaciones considerables entre individuos normales1.
A pesar de que la TFG puede presentar variaciones día a día, es notablemente estable a través de los años, con un deterioro fisiológico mínimo relacionado con la edad (0,8ml/min/1,73 m2/año después de los 30 años de edad)2–4. Se encontró que los rangos de deterioro de la TFG son menores en hombres que en mujeres sanas, sin embargo en la enfermedad renal crónica (ERC) estos rangos son similares5.
Los niveles de creatinina sérica y la TFG pueden permanecer normales en presencia de daño renal, incluso a pesar de una pérdida de hasta el 50% de las nefronas funcionantes6, por lo que, en muchas ocasiones, la TFG basal puede ser un indicador poco sensible para la detección temprana y el seguimiento de la enfermedad renal. Por el contrario, una «prueba de estrés renal» puede ser capaz de hacer que los riñones ejerzan al máximo su capacidad de filtración, por lo que sería probablemente un parámetro más sensible para la detección de daño renal subclínico cuando la creatinina todavía se encuentra en rango normal.
Las situaciones en las que la TFG se ve aumentada (estrés renal) incluyen una dieta alta en proteínas, una elevada ingesta hídrica, el embarazo, un alto gasto cardíaco y fármacos que aumentan el flujo sanguíneo renal. Entre las condiciones patológicas que inducen estrés renal se incluyen los estados de hiperfiltración como la diabetes, las glomerulonefritis y la insuficiencia cardíaca congestiva.
En 1983 Bosch et al.7 describieron los efectos a corto y largo plazo de la ingesta de proteínas en la TFG, comparando individuos normales a quienes se les dio dietas vegetarianas o dietas hiperproteicas, mostrando que la dieta con alta ingesta de proteínas producía un aumento en la TFG. Los sujetos normales mostraron un aumento significativo de la TFG de una a 2 h después de una carga aguda de proteínas (1-1,2 g/kg), independientemente de su TFG basal.
La diferencia entre el pico máximo de TFG, o TFG con estrés, y la TFG basal describe la RFR. Danilo et al. en 19938 compararon la TFG basal y TFG con estrés en individuos jóvenes sanos e individuos añosos sanos, encontrando que la RFR era significativamente menor en ancianos en comparación con los sujetos jóvenes, aunque virtualmente los valores basales de TFG de los sujetos añosos estaba en rangos normales.
Ronco et al. en 19889 demostraron la diferencia en la TFG en condiciones basales y la TFG después de una carga aguda de proteínas en sujetos normales y en mujeres embarazadas en diferentes etapas del embarazo, sin evidencia de enfermedad renal. Después de una carga aguda de proteínas, todos los sujetos mostraron un aumento significativo en la TFG, aunque la diferencia entre la TFG basal y la TFG con estrés fue mayor en el primer trimestre del embarazo. Hubo un incremento fisiológico en la TFG basal desde el primer trimestre hasta el último trimestre, lo que indica un estado de hiperfiltración fisiológica durante el embarazo.
El incremento fisiológico de la TFG durante el embarazo normal resulta del descenso en la concentración de creatinina sérica, la cual cae hasta un promedio de 0,4 a 0,8mg/dl10. Por lo tanto, una creatinina de 1mg/dl, que es normal en pacientes no embarazadas, en el embarazo puede reflejar disfunción renal mediante TFG basada en creatinina.
La RFR describe la capacidad de los riñones de aumentar la TFG bajo ciertos estímulos o demandas. Esta reserva puede ser considerada como un análogo de la reserva funcional cardíaca (como se ve en las pruebas de estrés cardíacas). Cuando las demandas fisiológicas aumentan, el corazón responde con un aumento del gasto cardíaco.
Conceptualmente, la capacidad de aumentar la TFG durante el estrés puede alterar los resultados en los estudios de función renal. En estados fisiológicos (ejemplo: embarazo, envejecimiento) o patológicos (diabetes, síndrome nefrótico, hipertensión arterial)11, la RFR permite aumentar la TFG de nefronas residuales, reemplazando la función perdida y manteniendo en rangos normales la TFG. Solamente después de que las nefronas residuales no puedan continuar compensando la funcionalidad perdida ocurrirán los cambios en la creatinina sérica y en la TFG8.
Por otro lado, un paciente con enfermedad renal y una dieta baja en proteínas puede presentar una reducción en su TFG basal no relacionada con la progresión de la enfermedad renal y, parcialmente, puede restaurar su RFR.
Métodos para la estimación de la reserva funcional renalAlgunos trabajos han descrito las bases de la RFR después de una carga de proteínas y su estimación mediante la diferencia entre la TFG basal y la TFG con estrés. Numerosos mecanismos se han considerado para explicar el aumento en la TFG después de la carga de proteínas.
Bosh et al. en 1983 y 19847 describieron la prueba de estrés mediante la carga oral de 80 g de proteínas y el uso de TFG basal y con estrés para estimar el valor de la RFR. De Nicola en 199111 llevó a cabo una prueba con estrés usando una infusión de aminoácidos para estimar la TFG en pacientes hipertensos tratados y no tratados.
Wood12 propuso que las proteínas digeridas aumentan los niveles en plasma de aminoácidos, los cuales son filtrados por el glomérulo y estimulan la absorción tubular de sodio a nivel proximal.
Esto y los mecanismos de sensibilidad en la mácula densa causan la liberación de factores relajantes derivados del endoletio como el óxido nítrico (ON) y prostaglandinas localmente, causando vasodilatación y aumento del flujo sanguíneo, lo que se traduce en un aumento de la TFG. También se ha adjudicado un posible rol del glucagón y algunos otros factores de crecimiento.
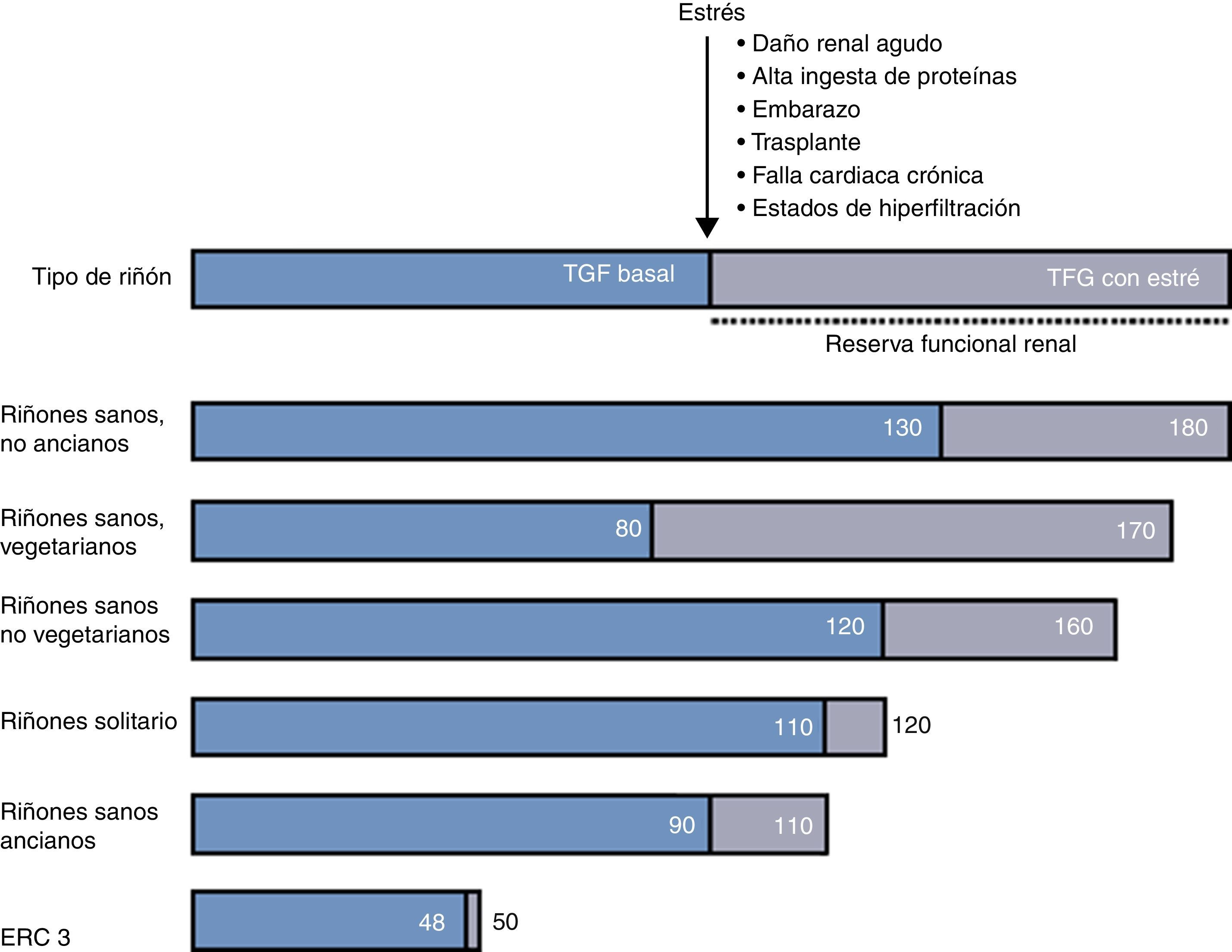
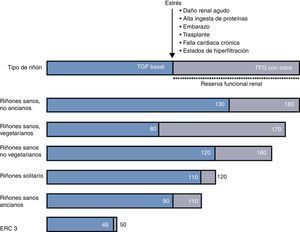
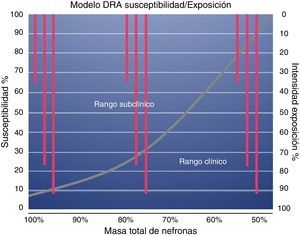
Reserva funcional renal en diferentes escenarios clínicosHay algunas condiciones clínicas en donde la RFR está reducida por un daño renal o por la demanda fisiológica de la utilización de la RFR (fig. 1).
El embarazo es un estado fisiológico de hiperfiltración. La TFG cambia significativamente durante cada trimestre, y hay un incremento significativo en la TFG basal desde el primer trimestre hasta el último trimestre. Estudios hechos en todos los trimestres en mujeres normales embarazadas han demostrado un aumento progresivo de la TFG basal con una reducción paralela de RFR, debido a su utilización progresiva. A pesar del embarazo en mujeres normales la TFG pico no cambia9. La RFR calculada antes del embarazo puede ser útil para predecir y pronosticar complicaciones en el tercer trimestre del embarazo, cuando la demanda fisiológica es muy alta.
EnvejecimientoAunque la patogénesis de los cambios morfológicos renales asociados al envejecimiento no se conoce con detalle, las adaptaciones hemodinámicas a una dieta rica en proteínas puede estar relacionada con su progresión, ya que las dietas hiperproteicas aumentan la presión y el flujo intraglomerular, lo que facilita la excreción de productos finales del metabolismo, pero da lugar a una alteración en la permeabilidad del glomérulo, lo cual ocasiona acumulación mesangial de macromoléculas, expansión mesangial y glomerulosclerosis13.
Algunos estudios reportan que, en ancianos sanos, la RFR después de una carga proteica está bien preservada14,15, mientras que, al ser evaluada mediante una infusión intravenosa de dopamina y aminoácidos, la RFR es menor en ancianos que en individuos jóvenes.
En un estudio en el que se comparararon la TFG y la RFR entre adultos sanos pertenecientes a 3 diferentes grupos de edad, se encontró que, en individuos mayores, tanto la TFG como la RFR eran ligeramente menores, mientras que la fracción de filtración se encontraba aumentada.
Al comparar la respuesta humoral al estímulo vasodilatador entre los 3 grupos de edad, se encontró que en los pacientes ancianos los niveles de ON no aumentaban y los niveles de actividad de renina plasmática no disminuían de manera significativa. En el análisis histológico se encontró que el número de glomérulos escleróticos, pero no el volumen glomerular, aumentaba con la edad, mientras que la luz de las arteriolas aferentes se encontraba disminuido16. Estudios similares han mostrado que, en pacientes ancianos, el flujo sanguíneo renal basal es menor y las resistencias vasculares renales, tanto basales como postestímulo vasodilatador, son más elevadas que en pacientes jóvenes. Además, se ha encontrado una mayor cantidad de arteriosclerosis en las arterias interlobares y arcuatas, atrofia tubular y fibrosis intersticial17.
Trasplante renalUno de los escenarios clínicos en los que la RFR podría tener más utilidad es la evaluación de binomios donante-receptor de trasplante renal, en donde el donante representa una persona con un número disminuido de nefronas, sin estímulos deletéreos ulteriores a la función renal, y el receptor representa una persona con un número de nefronas disminuido en quien, además, actúan agentes nefrotóxicos, como los fármacos inmunosupresores, que pueden afectar la capacidad funcional del riñón trasplantado.
George reportó que, 4 semanas después de la nefrectomía, 9 donantes renales voluntarios presentaban un aumento del 22,8±20,7% en la TFG, pero no incrementaban de manera significativa la TFG después de una carga proteica vía oral. Se reportó, además, que el riñón trasplantado incrementaba la TFG en un 59,7±24,4% después de 6 meses18.
En algunos estudios clínicos se encontró que en aquellos pacientes trasplantados que no tenían RFR, la TFG era significativamente más alta que en los controles y en los pacientes trasplantados con RFR, con una reducción paradójica de la TFG tras una carga proteica vía oral19,20.
Englund comparó la RFR en 36 pacientes pediátricos trasplantados renales en tratamiento con ciclosporina, 15 donantes renales y 15 niños con riñón solitario, y encontró que, si bien la TFG y el flujo sanguíneo renal eran significativamente más bajos en el grupo trasplantado, la RFR era significativamente mayor en este grupo. Se reportó, además, que no existían diferencias significativas en la TFG ni en la RFR entre los individuos de los binomios donante/receptor estudiados21.
Los datos mencionados indican que, si bien los pacientes monorrenos, donantes renales o receptores de trasplante renal pueden presentar disminuciones en la RFR, estas dependen de múltiples factores, incluyendo presencia de fármacos nefrotóxicos, rechazo al injerto y alteraciones hemodinámicas, y no solo al estado monorreno per sé.
Estados de hiperfiltración patológicaVarias enfermedades han sido asociadas con hiperfiltración glomerular incluyendo: diabetes mellitus, enfermedad de riñones poliquísticos, glomeruloesclerosis focal y segmentaria con reducción de la masa renal, anemia de células falciformes, síndrome renal de grandes alturas, obesidad, hipertensión, síndrome nefrótico22.
La hiperfiltración glomerular puede ocurrir con diferentes características en cada condición clínica. En la diabetes y la hipertensión por ejemplo, la masa renal se puede encontrar intacta y la TFG basal resultar por encima de lo normal por vasocontricción de la arteriola eferente. La hiperfiltración puede también ocurrir en nefronas residuales cuando los riñones se encuentran dañados y presentan una disminución en la masa renal residual. En el caso en que los riñones presenten un daño mayor al 50% del tejido funcionante, la hiperfiltración de las nefronas remanentes es el mecanismo compensador que garantiza que la TFG se mantenga en rangos normales. Mientras que en estados fisiológicos la hiperfiltración es debida al reclutamiento de más nefronas, en estados patológicos la hiperfiltración es probablemente debida a un aumento en la filtración de la nefronas remanentes23.
Esto se demuestra por la caída en la TFG cuando se administran inhibidores de la enzima convertidora de angiotensina a pacientes con ERC y daño renal. Ninguna definición de hiperfiltración glomerular ha sido aceptada universalmente, y los mecanismos fisiopatológicos sobre los cuales puede presentarse, dependiendo de la enfermedad subyacente, no han sido bien estudiados. La hiperfiltración glomerular en cualquier condición patológica parece ser debida a modificaciones hemodinámicas y cambios en el tono de las arteriolas aferentes y eferentes. En algunos casos, la proteinuria puede ser consecuencia de este mecanismo y es un marcador de progresión renal23.
Enfermedad renal crónicaBarai et al. estudiaron las variaciones de la RFR en distintos estadios de ERC induciendo estrés renal mediante la infusión de aminoácidos y observaron que la RFR disminuía drásticamente conforme a la progresión de la ERC en sus distintos estadios, desde un 23,4% en pacientes sanos a un 19,8% en el estadio 1; 15,4% en estadio 2; 8,9% en estadio 3 y 6,7% en estadio 4.
Se observó que la RFR puede estar completamente agotada, incluso en presencia de TFG levemente disminuida o normal, o bien estar preservada incluso en pacientes que tenían una TFG de 15mL/min24.
Reserva funcional renal como marcador de susceptibilidad y recuperación de daño renalLa TFG estimada representa un cálculo aproximado de la función renal, asumiendo un escenario clínico estable y, por tanto, no es una herramienta adecuada para determinar las variaciones funcionales en respuesta a la adaptación renal a los distintos estímulos fisiológicos o patológicos. El aumento en la creatinina en presencia del insulto renal debido a cambios funcionales se ve inherentemente retrasado, ya que los riñones tienen la habilidad innata de mantener su función mediante hiperfiltración compensatoria en la nefronas sanas remanentes, independientemente de la etiología del daño renal o de la demanda fisiológica6,25.
Esta adaptación de las nefronas permite continuar con la depuración de solutos plasmáticos, de modo que la creatinina sérica aumenta solo después de que el 50% de las nefronas se hayan perdido.
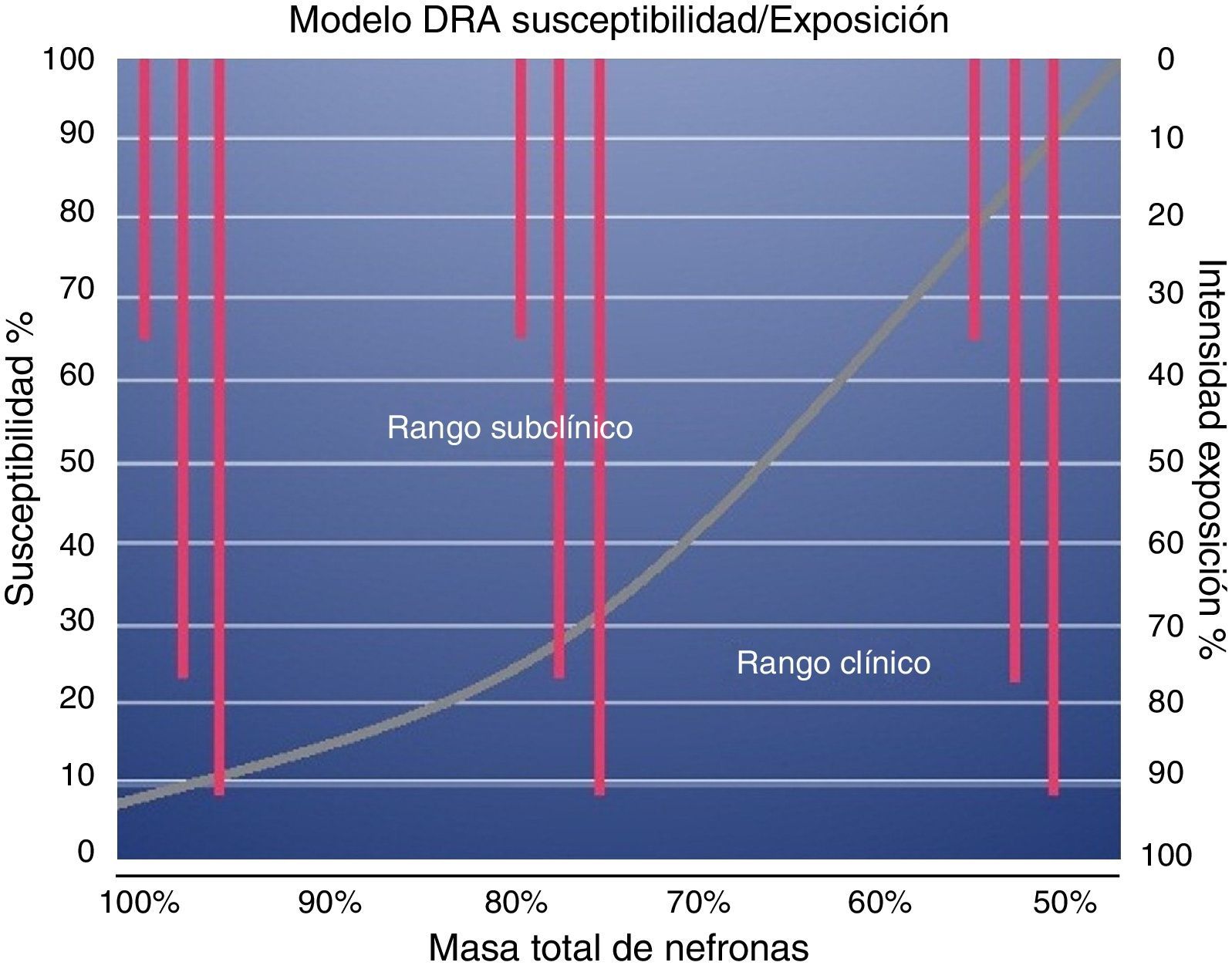
De tal manera que, en los pacientes con RFR intacta, si el insulto renal crea un daño en menos del 50% de las nefronas, el cuadro puede permanecer subclínico aunque la exposición sea considerable. Si en un insulto subsecuente se produce mayor pérdida de nefronas, y con ello, pérdida de RFR, aumentará la susceptibilidad al daño incluso en presencia de una exposición de severidad limitada.
En este contexto, la RFR es un buen parámetro para evaluar la susceptibilidad de los pacientes a desarrollar injuria renal aguda (IRA) (fig. 2).
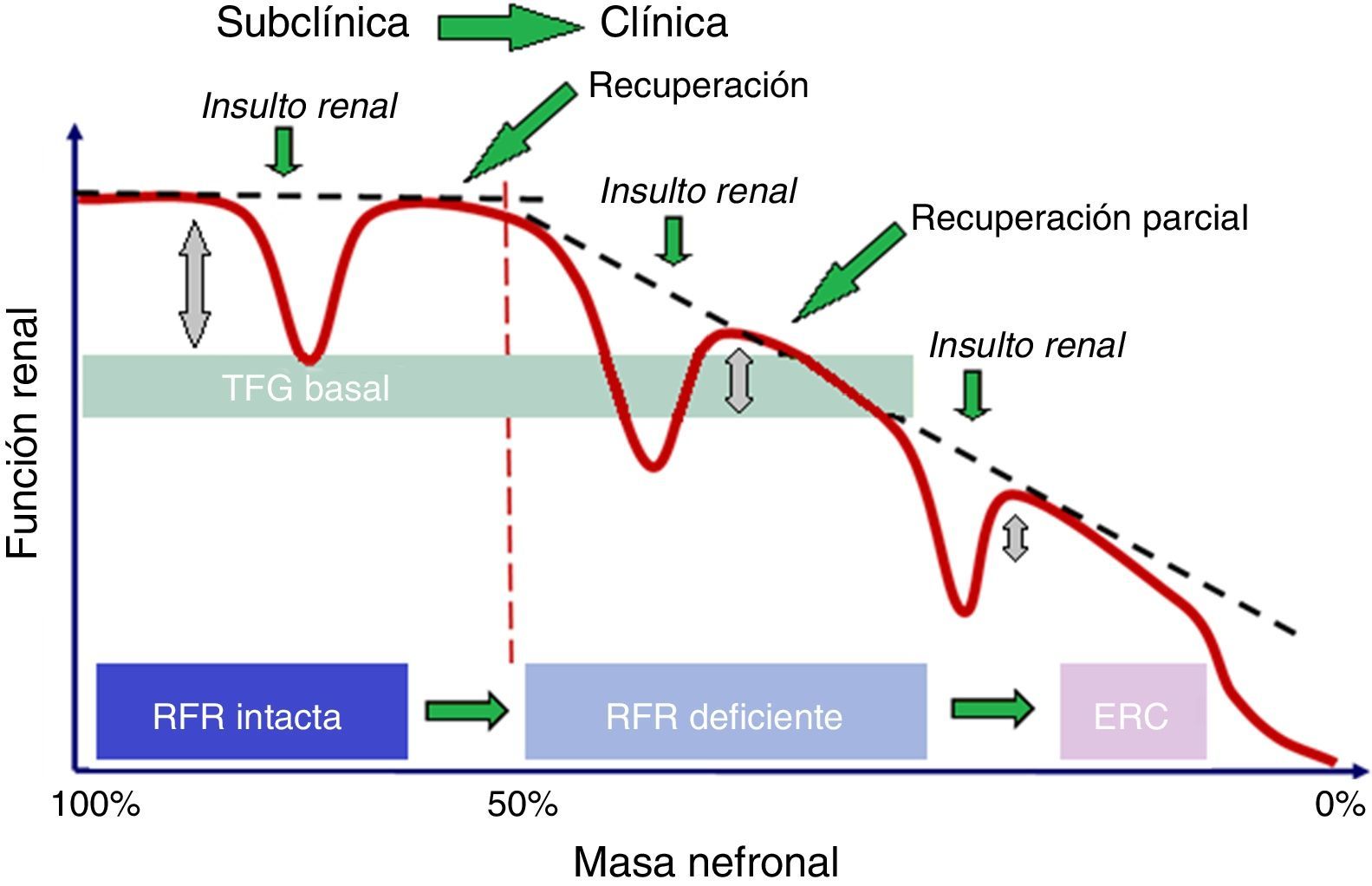
Existe controversia en cómo definir la recuperación renal después de un insulto. En el grupo ADQUI en 200425 la recuperación renal fue definida como completa si el paciente recuperaba el 50% de la creatinina basal y, parcial cuando el paciente prescindía de terapia de reemplazo renal pero la recuperación no estaba comprendida dentro del 50% de la creatinina sérica basal. La no recuperación fue definida como necesidad permanente de terapia de reemplazo renal.
Incluso si la creatinina y la TFG regresan a valores basales, puede haber ocurrido una reducción significativa de la RFR y esto supone para el paciente una mayor susceptibilidad a una injuria renal futura.
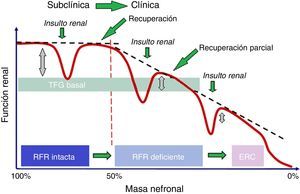
Ha sido probado que la IRA puede conducir a pérdida de nefronas6, aunque subsecuentemente la creatinina y la TFG vuelvan a rangos normales, presentando una aparente recuperación completa. Dicha recuperación puede no ser completa en caso de que los riñones hayan utilizado parte o toda la RFR para mantener la función renal normal en los casos en que se haya producido una pérdida de masa nefronal. La asociación entre IRA con recuperación incompleta o no recuperación y ERC ha sido identificada recientemente26. La posible asociación de ERC con la reducción de la RFR, incluso si hay una aparente recuperación completa, debe ser, por tanto, considerada. Esta situación está bien descrita por el concepto de IRA subclínica (fig. 3). Estudios recientes demuestran que incluso la IRA con aparente recuperación completa confiere un incremento del riesgo para el subsecuente desarrollo de ERC26,27. La RFR podría ser utilizada para evaluar la reserva biológica, el riesgo de eventos renales y la capacidad de respuesta renal a situaciones de estrés renal.
Relación entre RFR y TFG basal.El TFG basal puede diferir significativamente cuando la masa renal es mayor del 50%, gracias a la existencia de la RFR, pero cuando la masa renal es menor del 50%, la TFG presenta un deterioro progresivo, con una recuperación parcial de la RFR.ERC: enfermedad renal crónica; RFR: reserva funcional renal; TFG basal: tasa de filtración glomerular basal.
Se han desarrollado modelos de predicción de riesgo que requieren de su refinamiento y validación futura. La habilidad para identificar pacientes con recuperación de IRA y pacientes de alto riesgo de progresión renal y desarrollo de ERC es necesaria para implementar medidas preventivas, que pueden ser alcanzadas mediante la valoración de la RFR26,27.
ConclusionesLa TFG no es una función fija y puede aumentar en sujetos sanos en respuesta a diferentes estímulos. La capacidad para aumentar la TFG depende de la masa intacta de nefronas y describe la RFR. La TFG puede encontrarse en rangos normales aun cuando se haya perdido gran parte de la masa nefronal, por tanto, parece no ser un marcador sensible de deterioro de la función renal.
La estimación de la RFR, mediante una prueba de estrés renal, representa una prueba dinámica más sensible para la detección de deterioro renal que la TFG.
Aún no se han identificado los cambios esperables de la RFR en situaciones no patológicas, como crecimiento, embarazo y envejecimiento. En diversas circunstancias se ha identificado la RFR como marcador de progresión de daño renal.
Las principales limitaciones del uso de la RFR son: la heterogeneidad en los métodos de medición reportados y la falta de estudios que validen sus valores normales en individuos sanos.
Se requieren más estudios en diferentes conjuntos y grupos de la población para el claro entendimiento de los beneficios a largo plazo de la valoración de RFR.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
La Dra. Silvia González Sanchidrián ha disfrutado de la beca de la Fundación Senefro para rotación de residentes de nefrología en centros extranjeros del curso 2014-2015 y expresa su agradecimiento a la Sociedad Española de Nefrología por su ayuda para la colaboración en la actividad científica del International Renal Research Institute of Vicenza (IRRIV), Italia.