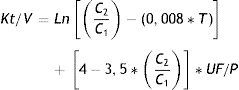Los trastornos del sueño son una de las comorbilidades más comunes en pacientes en hemodiálisis. Los objetivos del estudio fueron determinar la prevalencia de mala calidad de sueño y establecer los potenciales factores asociados a ella.
Materiales y métodosEstudio transversal analítico que enroló a pacientes con enfermedad renal crónica en hemodiálisis. La variable resultado fue calidad de sueño evaluada mediante la escala de Pittsburgh, mientras que las variables de exposición fueron el tiempo en hemodiálisis, la historia de diabetes mellitus tipo 2 y de hipertensión arterial, la presencia de sintomatología depresiva, la presencia de anemia y el compromiso urémico. Se usó el modelo de regresión de Poisson para verificar las asociaciones de interés, reportándose razones de prevalencia (RP) e intervalos de confianza al 95% (IC 95%).
ResultadosFueron enrolados un total de 450 pacientes, de los cuales, 259 (57,5%) fueron varones, y con una edad entre 18 y 97 años. La prevalencia de mala calidad de sueño fue de 79,3% (IC 95%: 75,6-83,1%). Se encontró asociación significativa entre mala calidad de sueño y sintomatología depresiva (RP=1,28; IC 95%: 1,17-1,39), anemia (RP=1,18; IC 95%: 1,04-1,34) y compromiso urémico (RP=1,26; IC 95%: 1,17-1,36) después de controlar por potenciales confusores.
ConclusionesLa presencia de sintomatología depresiva, anemia y el compromiso urémico estuvieron positivamente asociados a mala calidad de sueño en pacientes con enfermedad renal crónica en hemodiálisis. Un gran porcentaje de esta población sufre de mala calidad de sueño. Se sugiere desarrollar estrategias para mejorar la calidad de sueño en estos pacientes.
Sleep disorders are one of the most common comorbidities among patients on hemodialysis. The aims of this study were to determine the prevalence of poor sleep quality as well as to establish potential factors associated with poor sleep quality.
Materials and methodsA cross-sectional study was performed enrolling patients with chronic kidney disease on hemodialysis. The outcome was sleep quality evaluated using the Pittsburgh Scale, whereas the exposure variables were time on hemodialysis, history of type-2 diabetes and hypertension, depressive symptoms, anemia, and uremia. We used Poisson regression model to determine the association of interest, reporting prevalence ratios (PR) and 95% confidence intervals (95%CI).
ResultsA total of 450 patients were enrolled, 259 (57.5%) were male, aged from 18 to 97 years. The prevalence of poor sleep quality was 79.3% (95%CI: 75.6%–83.1%). Poor sleep quality was associated with depressive symptoms (PR=1.28; 95%CI: 1.17-1.39), anemia (PR=1.18; 95%CI: 1.04-1.34) and uremia (PR=1.26; 95%CI: 1.17-1.36) after controlling for potential confounders.
ConclusionsThe presence of depressive symptoms, anemia and uremia were positively associated with poor sleep quality among patients with chronic kidney disease on hemodialysis. A great proportion of this population had poor sleep quality. Strategies are needed to improve sleep quality in these patients.
La enfermedad renal crónica (ERC) se define como la presencia de algún marcador de daño renal o la disminución de la tasa de filtrado glomerular inferior a 60ml/min/1,73 m2 por un período igual o mayor a 3 meses1,2.
En las últimas décadas, la prevalencia de esta enfermedad ha aumentado, llegando a convertirse en un problema de salud pública. Por ejemplo, solo en los Estados Unidos, se ha proyectado que para el año 2030, aproximadamente 2,2 millones de pacientes requerirán algún tipo de diálisis o trasplante renal3. En Perú, un estudio previo muestra que la tasa de ERC en Lima fue de 122 pacientes por millón de habitantes y que el 92,8% de los casos estudiados se encontraba en hemodiálisis crónica4.
Aquellos pacientes en hemodiálisis suelen padecer diferentes problemas médicos, siendo los trastornos del sueño una de las comorbilidades más frecuentes y poco reconocidas5. Es así que se conoce que la prevalencia de los trastornos del sueño es mucho mayor en comparación con la población general6,7.
Los trastornos del sueño en los pacientes con ERC en hemodiálisis pueden ser variados y se manifiestan como insomnio, síndrome de piernas inquietas, apnea del sueño, sueño excesivo durante el día, narcolepsia, sonambulismo, entre otras. Las 3 primeras son las alteraciones principales8. Estudios recientes han reportado que hasta un 80% de los pacientes en hemodiálisis aqueja alguna de las alteraciones mencionadas6,9–11, comprometiendo de esta manera su salud debido a la disminución de la calidad de vida, al aumento de la discapacidad diaria y al aumento de la utilización de servicios de salud12,13. Más aún, se ha visto que una mala calidad de sueño aumenta el riesgo cardiovascular y, por ello, la mortalidad en pacientes en hemodiálisis14,15.
En nuestro contexto, hasta nuestro conocimiento, no existen publicaciones que brinden información acerca de la calidad del sueño en pacientes con ERC en hemodiálisis. Los objetivos del presente estudio fueron: determinar la prevalencia de mala calidad de sueño en pacientes con ERC en hemodiálisis en un centro de referencia de Lima (Perú) y establecer potenciales factores asociados a la calidad del sueño en este mismo grupo.
MétodosDiseño y lugar de estudioEstudio transversal analítico realizado en las clínicas asociadas a los Servicios de Salud de Hemodiálisis de ESSALUD (Seguro Social del Perú): Jesús María, Internacional y Santa Ana, ubicados en Lima (Perú).
Población de estudioLa población incluyó a pacientes con ERC en hemodiálisis durante un período no menor a 3 meses, enrolados en los centros previamente mencionados. Se excluyó a aquellos menores de 18 años de edad y a los pacientes que habían cambiado de diálisis peritoneal a hemodiálisis en los últimos 6 meses.
Definición de variablesLa variable resultado de interés fue calidad de sueño, la cual fue evaluada a través del Índice de Calidad de Sueño de Pittsburgh (escala de Pittsburgh). Este es un instrumento validado previamente para el español16 y usado en diferentes estudios en Perú17,18 en población general y en ciertos grupos específicos. Este instrumento consta de 19 preguntas divididas en 7 componentes: eficiencia habitual del sueño, duración total del sueño, latencia del sueño, perturbaciones del sueño, calidad del sueño, uso de medicación para dormir y disfunción diurna. Cada componente se evalúa en una escala de 0 a 3, obteniéndose una puntuación global entre 0 y 21 (puntuaciones más altas indican una menor calidad del sueño). Se considera que una puntuación mayor a 5 clasifica a los sujetos con una mala calidad de sueño16,19.
Las variables de exposición incluyeron aquellas relacionadas con la historia de ERC. Entre ellas se encontraban: el tiempo transcurrido, en meses, desde el inicio de hemodiálisis hasta el momento de la evaluación; historia de diabetes mellitus tipo 2 y de hipertensión arterial (sí/no), colectadas de la historia clínica; presencia de síntomas depresivos (sí/no); presencia de anemia (sí/no) y el compromiso urémico evaluado a través de la constante tiempo-volumen (Kt/V).
La presencia de sintomatología depresiva fue evaluada usando solo 2 preguntas de la Escala de Depresión del Centro de Estudios Epidemiológicos (CES-D)20. Estas preguntas estuvieron basadas en sintomatología de los últimos 7 días: «sentía que no podía quitarme la tristeza de encima aun con la ayuda de mi familia o amigos», y «me sentía deprimido». Las respuestas, en ambos casos, tenían 4 opciones: rara vez o ninguna vez (<1 día), alguna vez o pocas veces (1-2 días), ocasionalmente o una buena parte del tiempo (3-4 días), y la mayor parte del tiempo o todo el tiempo (5-7 días). Estas opciones, calificadas del 0 al 3 para cada pregunta, servían para crear un puntaje. Aquellos con 3 puntos o más eran calificados como que presentaban síntomas depresivos. Basados en los resultados de un piloto, la sensibilidad y especificidad del punto de corte de estas 2 preguntas estuvo por encima del 90% para la detección de síntomas depresivos.
Asimismo, se definió anemia a los niveles de hemoglobina por debajo de 12g/dL en el caso de mujeres y por debajo de 13,5 en el caso de varones, de acuerdo a recomendaciones internacionales21. De otro lado, el compromiso urémico se evaluó a través de la constante tiempo-volumen (Kt/V), el parámetro más utilizado para cuantificar la dosis de diálisis, que toma en consideración la generación de urea intradiálisis y la ganancia de peso interdiálisis. La fórmula usada fue la siguiente22:
Donde: C1= urea inicial (o nitrógeno ureico en sangre); C2= urea final; T= tiempo (en horas); y UF/P=diferencia de peso pre- y posdiálisis (en kg).También se incluyeron datos demográficos (edad, sexo, grado de instrucción, lugar de procedencia) y el autorreporte de estilos de vida (consumo de alcohol y tabaco).
ProcedimientosPrevia lectura de consentimiento informado, se aplicó el instrumento a todos los pacientes que aceptaron participar. La escala de Pittsburgh fue aplicada de manera autoadministrada para garantizar la confidencialidad de los datos. Se acudió a las clínicas de hemodiálisis durante 3 turnos de trabajo de los establecimientos. Una vez completada la encuesta, que duraba aproximadamente 20 min, a todos los participantes se les entregó un folleto informativo sobre mala calidad de sueño donde, de acuerdo con los síntomas presentados, se les sugería que acudieran a consulta con un especialista si lo consideraban necesario.
Tamaño de muestraPara el cálculo del tamaño de muestra se utilizó el programa PASS 2008. Asumiendo un poder de 80% y un nivel de significación de 95%, se requería un tamaño de muestra de 383 pacientes para encontrar una fuerza de asociación de 2,2 o mayor, considerando que aproximadamente el 78% de los pacientes tenían mala calidad de sueño y que cerca del 50% de los pacientes tendrían algunas de las variables de exposición de interés. Además, se consideró un 10% de tasa de rechazo y un 10% más debido al mal llenado de encuestas. Así, el número total de participantes necesarios fue de 450.
Análisis estadísticoLos datos colectados fueron ingresados en una hoja de cálculo en Microsoft Excel para Windows XP 2010, incluyendo un proceso de doble digitación. La hoja de cálculo se importó a STATA versión 11 (Stata Corp, College Station, TX, EE. UU.) para la realización del análisis de datos.
Inicialmente, se describió a la población de estudio usando proporciones. Luego, se compararon los antecedentes y variables de interés de acuerdo a la calidad de sueño utilizando la prueba de Chi cuadrado. Posteriormente, se procedió a comparar a cada uno de los componentes de la escala de sueño de Pittsburgh de acuerdo a las variables de exposición de interés.
El análisis bivariado y multivariado se realizó utilizando el modelo de regresión de Poisson, reportando las razones de prevalencia (PR) y los intervalos de confianza al 95% (IC 95%). En los modelos multivariados, el efecto de las exposiciones de interés fue controlado por potenciales confusores como la edad, sexo, grado de instrucción y lugar de nacimiento.
Aspectos éticosEl presente trabajo de investigación fue aprobado por el Comité de Ética en Investigación de la Universidad Peruana de Ciencias Aplicadas. Todos los pacientes incluidos en el estudio dieron su consentimiento verbal para participar.
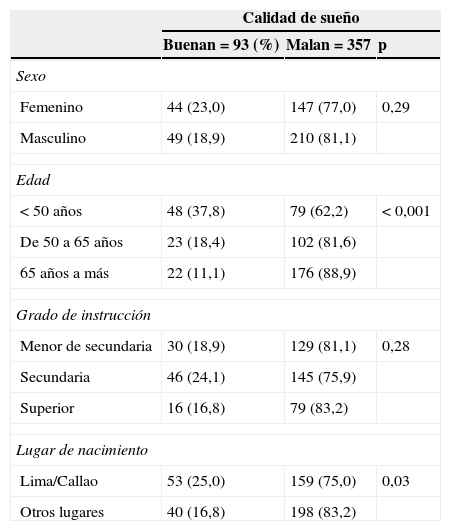
ResultadosUn total de 450 pacientes en hemodiálisis fueron enrolados. La edad promedio de los participantes fue 58,9 (rango: 18 a 97 años), y 259 (57,6%) fueron varones. La prevalencia de mala calidad de sueño fue 79,3% (IC 95%: 75,6-83,1%). Cuando las variables socio-demográficas se compararon de acuerdo a la calidad de sueño, solo la edad (p < 0,001) y el lugar de nacimiento (p=0,03) estuvieron asociados a mala calidad de sueño (ver detalles en la tabla 1).
Características socio-demográficas de la población de estudio de acuerdo a la calidad de sueño
| Calidad de sueño | |||
|---|---|---|---|
| Buenan=93 (%) | Malan=357 | p | |
| Sexo | |||
| Femenino | 44 (23,0) | 147 (77,0) | 0,29 |
| Masculino | 49 (18,9) | 210 (81,1) | |
| Edad | |||
| < 50 años | 48 (37,8) | 79 (62,2) | < 0,001 |
| De 50 a 65 años | 23 (18,4) | 102 (81,6) | |
| 65 años a más | 22 (11,1) | 176 (88,9) | |
| Grado de instrucción | |||
| Menor de secundaria | 30 (18,9) | 129 (81,1) | 0,28 |
| Secundaria | 46 (24,1) | 145 (75,9) | |
| Superior | 16 (16,8) | 79 (83,2) | |
| Lugar de nacimiento | |||
| Lima/Callao | 53 (25,0) | 159 (75,0) | 0,03 |
| Otros lugares | 40 (16,8) | 198 (83,2) | |
Los resultados pueden no sumar debido a valores que faltan.
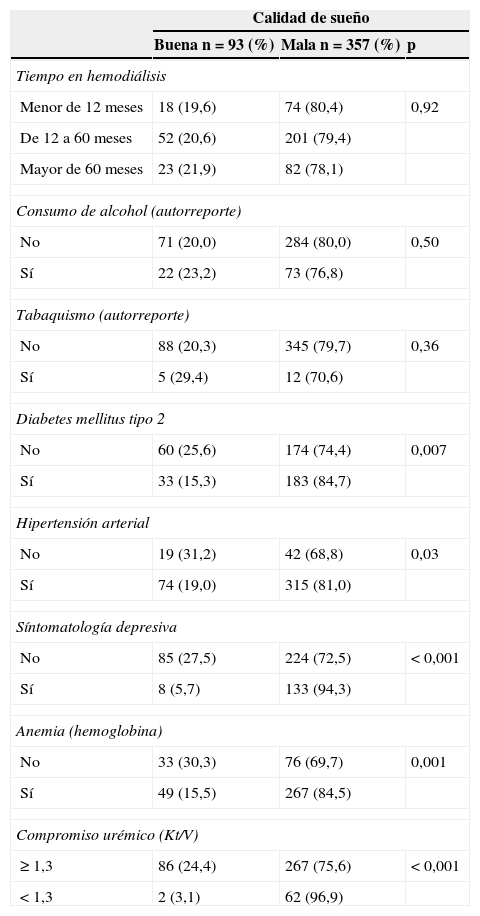
En cuanto a los antecedentes y datos de laboratorio, se encontró asociación entre mala calidad de sueño con diabetes mellitus tipo 2 (p=0,007), hipertensión arterial (p=0,03), presencia de síntomas depresivos (p<0,001), presencia de anemia (p=0,001) y con el compromiso urémico (p<0,001) (ver detalles en la tabla 2). Es de resaltar que el 31,3% de los pacientes presentaron algún grado de sintomatología depresiva, mientras que el 74,4% presentaron anemia.
Antecedentes y datos de laboratorio de la población de estudio de acuerdo a la calidad de sueño
| Calidad de sueño | |||
|---|---|---|---|
| Buena n=93 (%) | Mala n=357 (%) | p | |
| Tiempo en hemodiálisis | |||
| Menor de 12 meses | 18 (19,6) | 74 (80,4) | 0,92 |
| De 12 a 60 meses | 52 (20,6) | 201 (79,4) | |
| Mayor de 60 meses | 23 (21,9) | 82 (78,1) | |
| Consumo de alcohol (autorreporte) | |||
| No | 71 (20,0) | 284 (80,0) | 0,50 |
| Sí | 22 (23,2) | 73 (76,8) | |
| Tabaquismo (autorreporte) | |||
| No | 88 (20,3) | 345 (79,7) | 0,36 |
| Sí | 5 (29,4) | 12 (70,6) | |
| Diabetes mellitus tipo 2 | |||
| No | 60 (25,6) | 174 (74,4) | 0,007 |
| Sí | 33 (15,3) | 183 (84,7) | |
| Hipertensión arterial | |||
| No | 19 (31,2) | 42 (68,8) | 0,03 |
| Sí | 74 (19,0) | 315 (81,0) | |
| Síntomatología depresiva | |||
| No | 85 (27,5) | 224 (72,5) | < 0,001 |
| Sí | 8 (5,7) | 133 (94,3) | |
| Anemia (hemoglobina) | |||
| No | 33 (30,3) | 76 (69,7) | 0,001 |
| Sí | 49 (15,5) | 267 (84,5) | |
| Compromiso urémico (Kt/V) | |||
| ≥ 1,3 | 86 (24,4) | 267 (75,6) | < 0,001 |
| < 1,3 | 2 (3,1) | 62 (96,9) | |
Los resultados pueden no sumar debido a valores que faltan.
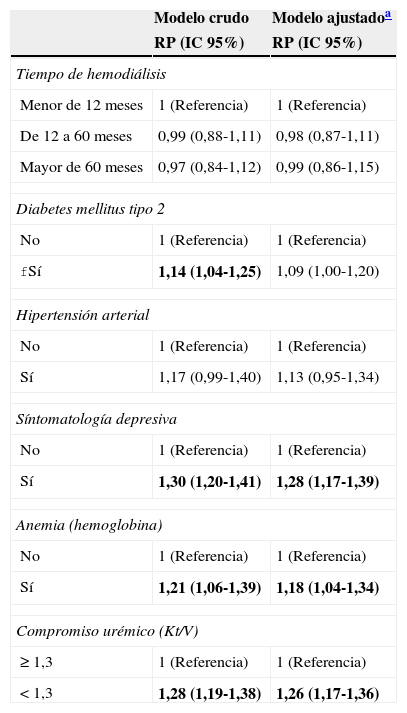
En el análisis multivariado, se encontró que la presencia de sintomatología depresiva (p<0,001), la anemia (p=0,01) y el compromiso urémico (p<0,001) fueron variables asociadas a mala calidad de sueño, después de ajustar por edad, sexo, grado de instrucción y lugar de nacimiento (ver detalles en la tabla 3).
Asociación entre las variables de interés y mala calidad de sueño en pacientes con hemodiálisis: modelos crudos y ajustados
| Modelo crudo | Modelo ajustadoa | |
|---|---|---|
| RP (IC 95%) | RP (IC 95%) | |
| Tiempo de hemodiálisis | ||
| Menor de 12 meses | 1 (Referencia) | 1 (Referencia) |
| De 12 a 60 meses | 0,99 (0,88-1,11) | 0,98 (0,87-1,11) |
| Mayor de 60 meses | 0,97 (0,84-1,12) | 0,99 (0,86-1,15) |
| Diabetes mellitus tipo 2 | ||
| No | 1 (Referencia) | 1 (Referencia) |
| fSí | 1,14 (1,04-1,25) | 1,09 (1,00-1,20) |
| Hipertensión arterial | ||
| No | 1 (Referencia) | 1 (Referencia) |
| Sí | 1,17 (0,99-1,40) | 1,13 (0,95-1,34) |
| Síntomatología depresiva | ||
| No | 1 (Referencia) | 1 (Referencia) |
| Sí | 1,30 (1,20-1,41) | 1,28 (1,17-1,39) |
| Anemia (hemoglobina) | ||
| No | 1 (Referencia) | 1 (Referencia) |
| Sí | 1,21 (1,06-1,39) | 1,18 (1,04-1,34) |
| Compromiso urémico (Kt/V) | ||
| ≥ 1,3 | 1 (Referencia) | 1 (Referencia) |
| < 1,3 | 1,28 (1,19-1,38) | 1,26 (1,17-1,36) |
Los resultados resaltados en negrita son estadísticamente significativos (p<0,05).
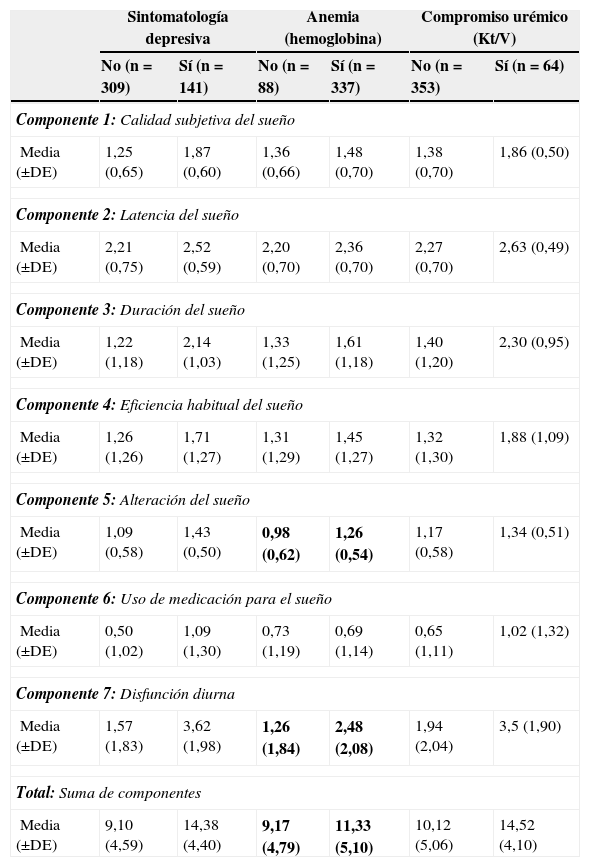
Cuando se trató de verificar si alguno de los componentes de la calidad de sueño estaba más comprometido, todos ellos eran diferentes en los pacientes con sintomatología depresiva y compromiso urémico, mientras que solo la alteración del sueño y la disfunción diurna se encontraban afectados en aquellos con anemia (tabla 4).
Puntaje de la escala de Pittsburgh de acuerdo a sus componentes y variables de interés
| Sintomatología depresiva | Anemia (hemoglobina) | Compromiso urémico (Kt/V) | ||||
|---|---|---|---|---|---|---|
| No (n=309) | Sí (n=141) | No (n=88) | Sí (n=337) | No (n=353) | Sí (n=64) | |
| Componente 1: Calidad subjetiva del sueño | ||||||
| Media (±DE) | 1,25 (0,65) | 1,87 (0,60) | 1,36 (0,66) | 1,48 (0,70) | 1,38 (0,70) | 1,86 (0,50) |
| Componente 2: Latencia del sueño | ||||||
| Media (±DE) | 2,21 (0,75) | 2,52 (0,59) | 2,20 (0,70) | 2,36 (0,70) | 2,27 (0,70) | 2,63 (0,49) |
| Componente 3: Duración del sueño | ||||||
| Media (±DE) | 1,22 (1,18) | 2,14 (1,03) | 1,33 (1,25) | 1,61 (1,18) | 1,40 (1,20) | 2,30 (0,95) |
| Componente 4: Eficiencia habitual del sueño | ||||||
| Media (±DE) | 1,26 (1,26) | 1,71 (1,27) | 1,31 (1,29) | 1,45 (1,27) | 1,32 (1,30) | 1,88 (1,09) |
| Componente 5: Alteración del sueño | ||||||
| Media (±DE) | 1,09 (0,58) | 1,43 (0,50) | 0,98 (0,62) | 1,26 (0,54) | 1,17 (0,58) | 1,34 (0,51) |
| Componente 6: Uso de medicación para el sueño | ||||||
| Media (±DE) | 0,50 (1,02) | 1,09 (1,30) | 0,73 (1,19) | 0,69 (1,14) | 0,65 (1,11) | 1,02 (1,32) |
| Componente 7: Disfunción diurna | ||||||
| Media (±DE) | 1,57 (1,83) | 3,62 (1,98) | 1,26 (1,84) | 2,48 (2,08) | 1,94 (2,04) | 3,5 (1,90) |
| Total: Suma de componentes | ||||||
| Media (±DE) | 9,10 (4,59) | 14,38 (4,40) | 9,17 (4,79) | 11,33 (5,10) | 10,12 (5,06) | 14,52 (4,10) |
Los resultados resaltados en negrita son estadísticamente significativos (p<0,05).
Este estudio demuestra que existe asociación entre la mala calidad de sueño y la presencia de sintomatología depresiva, la anemia y el compromiso urémico, evaluado a través de la dosis de diálisis (constante tiempo-volumen), después de controlar por edad, sexo, grado de instrucción y lugar de nacimiento. Asimismo, se encontró que el 80% de los pacientes con ERC en hemodiálisis presentaban mala calidad de sueño.
Comparación con otros estudiosLa sintomatología depresiva suele ser una enfermedad bastante frecuente en pacientes en hemodiálisis; en nuestro estudio, aproximadamente un tercio de los pacientes presentaron algún grado de síntomas depresivos. Más aún, la sintomatología depresiva parece afectar a todos los componentes de la calidad de sueño. Un estudio previo demuestra que su prevalencia es mucho mayor en pacientes con ERC en hemodiálisis en comparación con pacientes con solo ERC23. Un estudio realizado en diferentes países de Europa, Asia y Norteamérica mostró que la presencia de depresión fue 2 veces más frecuente en quienes tenían mala calidad de sueño y, de todas las variables estudiadas, fue la que presentó mayor asociación con la mala calidad de sueño24. Asimismo, la sintomatología depresiva puede ocasionar alteración del sueño, como insomnio, condicionando de esta manera una mala calidad de sueño en estos pacientes8.
La presencia de anemia fue otro de los factores asociados a mala calidad de sueño; además de que más de tres cuartos de la población de estudio presentaba cierto grado de anemia. Es conocida la asociación entre anemia, somnolencia y cansancio en la población general25. De acuerdo a nuestros hallazgos, la anemia estuvo más asociada a alteración del sueño y disfunción diurna. Un estudio reciente realizado en Egipto muestra que la presencia de anemia puede estar asociada a la presencia de síndrome de piernas inquietas8, lo que a su vez puede alterar la calidad de sueño. Además, se ha reportado que aquellos pacientes que son tratados con eritropoyetina recombinante para corregir la anemia secundaria a ERC reducen la intermitencia y fragmentación del sueño, lo que permite un descanso más reparador, mejorando el estado de alerta durante el día26. Más aún, en nuestro estudio, cuanto más severo era el grado de anemia, mayor era la mala calidad de sueño (datos no mostrados), lo que a su vez recalca la necesidad de corrección de los bajos niveles de hemoglobina en estos pacientes.
El compromiso urémico estuvo también asociado a mala calidad de sueño en el modelo multivariado como ha sido demostrado en estudios previos8,27. Otros autores, no obstante, no han encontrado esta asociación24,28. La causa etiológica de esto no es del todo conocida; sin embargo, altos niveles de uremia, potencialmente debido a la acumulación de homocisteína, han sido asociados al síndrome de piernas inquietas, entre otros parámetros de laboratorio alterados como la disminución de ferritina sérica, el hierro sérico bajo, y las concentraciones altas y bajas de calcio, de fosfato y de hormona paratiroidea29,30. Y de la misma forma, se ha documentado que altos niveles de hormona paratiroidea podrían estar involucrados en la mala calidad de sueño de los pacientes a través del síndrome de piernas inquietas29. Asimismo, cuanto más elevados sean los valores de paratohormona, mayor riesgo de insomnio existe, ello debido a que la osteodistrofia renal producida se puede asociar con dolor óseo y prurito31. Sin embargo, esto no pudo ser evaluado en el presente estudio.
Es importante notar que en este estudio no se encontró asociación entre la mala calidad del sueño y el tiempo de hemodiálisis como ha sido demostrado en un reporte previo32. Asimismo, nuestro estudio no encontró asociación entre calidad de sueño e historia de diabetes mellitus tipo 2, aunque en el modelo bivariado estuvieron inicialmente asociadas, e hipertensión arterial, como ha sido reportado en otros trabajos de investigación33,34. Por último, este estudio demuestra que la prevalencia de mala calidad de sueño en pacientes en hemodiálisis es elevada. Otros estudios también han hallado un porcentaje similar de mala calidad de sueño en pacientes en hemodiálisis8,13,28,35,36 donde las enfermedades más comunes que se reportan son el insomnio, la apnea del sueño y el síndrome de piernas inquietas.
Fortalezas y limitacionesEste estudio es el primero que muestra la prevalencia de mala calidad del sueño en pacientes en hemodiálisis en Perú, además de utilizar la escala de sueño de Pittsburgh, una escala validada y bastante usada para identificar de manera sencilla a aquellos pacientes con mala calidad de sueño. Sin embargo, este estudio presenta algunas limitaciones. En primer lugar, debido a que se trata de un estudio trasversal, solo se puede reportar asociación entre variables, y no causalidad. Se requieren otros estudios, especialmente longitudinales, para confirmar nuestros hallazgos. Asimismo, dado que se enroló a los participantes en clínicas en las que se requiere tener seguro para acceder a los beneficios de hemodiálisis, los resultados podrían no ser inferibles a todas las poblaciones. No se pudo, asimismo, evaluar el acceso vascular como posible causa de adecuación a hemodiálisis y, por tanto, su asociación con calidad de sueño. Asimismo, no se pudo evaluar el rol de otras potenciales causas que afecten la calidad de sueño como síndrome de piernas inquietas, marcadores hormonales, entre otros. Finalmente, no fue posible controlar por otras variables importantes, como el nivel socioeconómico u otras causas de ERC, que podrían afectar nuestros resultados.
ConclusionesLa calidad de sueño se encuentra asociada a la presencia de sintomatología depresiva, de anemia y al compromiso urémico en pacientes con ERC en hemodiálisis. Además, un gran porcentaje de estos pacientes tienen una mala calidad de sueño. Se sugiere desarrollar estrategias para mejorar la calidad de sueño en estos pacientes.
Conflicto de interesesNinguno que declarar.
FinanciaciónAutofinanciado.