Introducción
"El mejor tratamiento del hiperparatiroidismo secundario es el trasplante renal. Pero..."
Mathias Rothmund1
El trasplante paratiroideo tras paratiroidectomía total (PTT), en cualquiera de sus variantes, es un procedimiento ampliamente aceptado en el tratamiento de las complicaciones evolutivas del hiperparatiroidismo secundario2,3. Han sido descritas, con resultados variables, según las series recogidas, complicaciones tales como la falta de función tras el trasplante y persistencia o recidiva del hiperparatiroidismo secundario (HPTS), lo que constituye un problema frecuente para todos los cirujanos experimentados. Bien se realice una PTT con o sin autotrasplante o bien una paratiroidectomía subtotal (PTST) todas las glándulas deben estar expuestas. En estudios autópsicos el número de glándulas ha sido variable. Además, la distribución ectópica complica aún más el problema3,4. Se ha descrito hasta un 13 % de pacientes que tienen una o más glándulas supernumerarias, y se ha llegado a describir hasta 8 glándulas en un mismo paciente5 por lo que, hoy en día, algunos han recomendado la extirpación del timo y apertura de la celda carotídea con lo que aumenta notablemente la manipulación cervical. Ello puede explicarse por los remanentes embriológicos de tejido paratiroideo que, al sufrir una intensa estimulación en la insuficiencia renal, proliferan, lo que puede explicar las anomalías numéricas registradas. Glándulas ectópicas causan hasta un 3 % de reintervenciones en el hiperparatirodismo primario6. Si extrapolamos esta frecuencia a todos los pacientes, es posible que la prevalencia de glándulas ectópicas una o más en pacientes urémicos sea de una proporción considerable.
La disposición ectópica, incluso en el mediastino, se puede determinarla mediante estudio preoperatorio de localización con 99Tc-sestamibi (MIBI), con el fin de evitar una exploración quirúrgica incompleta. Todo ello puede resultar fundamental en el HPTS en el que la extirpación total del tejido paratiroideo es fundamental7, si bien los resultados, realizados de forma preoperatoria, hasta el momento no son excesivamente buenos y sí lo son para estudiar los casos en que se ha observado una recidiva o la persistencia tras la intervención inicial8,9.
En el HPTS por insuficiencia renal crónica (IRC) resulta insatisfactoria la PTT por persistencia o recidiva en un 10-20 % de los casos según las series publicadas6,10,11. En estos casos el éxito de la cirugía depende de la correcta identificación y extirpación de todo el tejido paratiroideo anormal11,12. En el HPTS la causa fundamental de esta persistencia y/o recidiva es que no se identifica adecuadamente todo el tejido paratiroideo anormal, que se manifiesta clínicamente porque las concentraciones de paratirina (PTH) no descienden o están elevadas al cabo de algunos meses de la cirugía y cuyo origen puede estar en el tejido trasplantado, cuando ésta es la técnica empleada, o en tejido paratiroideo no eliminado en su localización anatómica habitual.
Hay un claro consenso internacional en definir la persistencia como el mantenimiento de concentraciones de PTH por encima de 60 pg/ml inmediatamente tras la intervención quirúrgica y se entiende por recidiva la elevación de la PTH tras un período mínimo de 6 meses después de la paratiroidectomía.
Material y método
Hemos analizado los datos de los pacientes de una población en diálisis en un mismo hospital, desde enero de 1984 hasta diciembre de 2004, y que correspondía a un total de 787 pacientes y de los que desarrollaron hiperparatiroidismo secundario con indicación quirúrgica en 67 ocasiones (8,5 %) (tabla I).
La diálisis se llevó a cabo 3 veces por semana (3 a 4 h en cada sesión) con un dializado con concentraciones de 2,5 o 3,0 mEq/l de calcio, dependiendo del calcio plasmático del paciente y de las concentraciones de fósforo. Se trató a los pacientes con sales orales de calcio y de vitamina 1,25(OH)2 D3 en dosis adaptadas a su calcio de la sangre y las concentraciones de fósforo. No se administraron elementos que contuvieran Al en ninguno de ellos a partir de 1990.
Las concentraciones de PTH se obtuvieron en todos los pacientes a partir de enero de 1991 (técnica inmunométrica de quimioluminiscencia Elecsys®, Roche) de forma sistemática y de forma individualizada. Se valoraron, asimismo, albúmina, proteínas totales, calcio, magnesio y concentraciones de fosfatasa alcalina (Corning uniforme, Corning SA, Nueva York, Estados Unidos) a partir de 1989 de forma sistemática, además de las determinaciones específicas de caso y su afección renal. Se definió el hipoparatirodismo por una PTH inferior a 20 pg/ml con concentraciones normales o bajas de calcemia (normal, 8,5-10,5 mg/dl).
Análisis estadístico
Análisis porcentual de casos registrados de la enfermedad estudiada: se estableció como indicación operatoria una PTH intacta (iPTH) incontrolable (> 500 pg/ml) con o sin manifestaciones clínicas severas.
No se realizó análisis de localización preoperatorio mediante técnicas isotópicas de forma sistemática (16/67). Sí se determinó el aumento de tamaño glandular mediante ultrasonografía sistemática (58/67) y tomografía computarizada (TC) de forma individualizada (24/67).
Se recogieron datos demográficos como: edad, sexo, tiempo en diálisis, técnica de diálisis y valores preoperatorios de calcio, fósforo y fosfatasa alcalina.
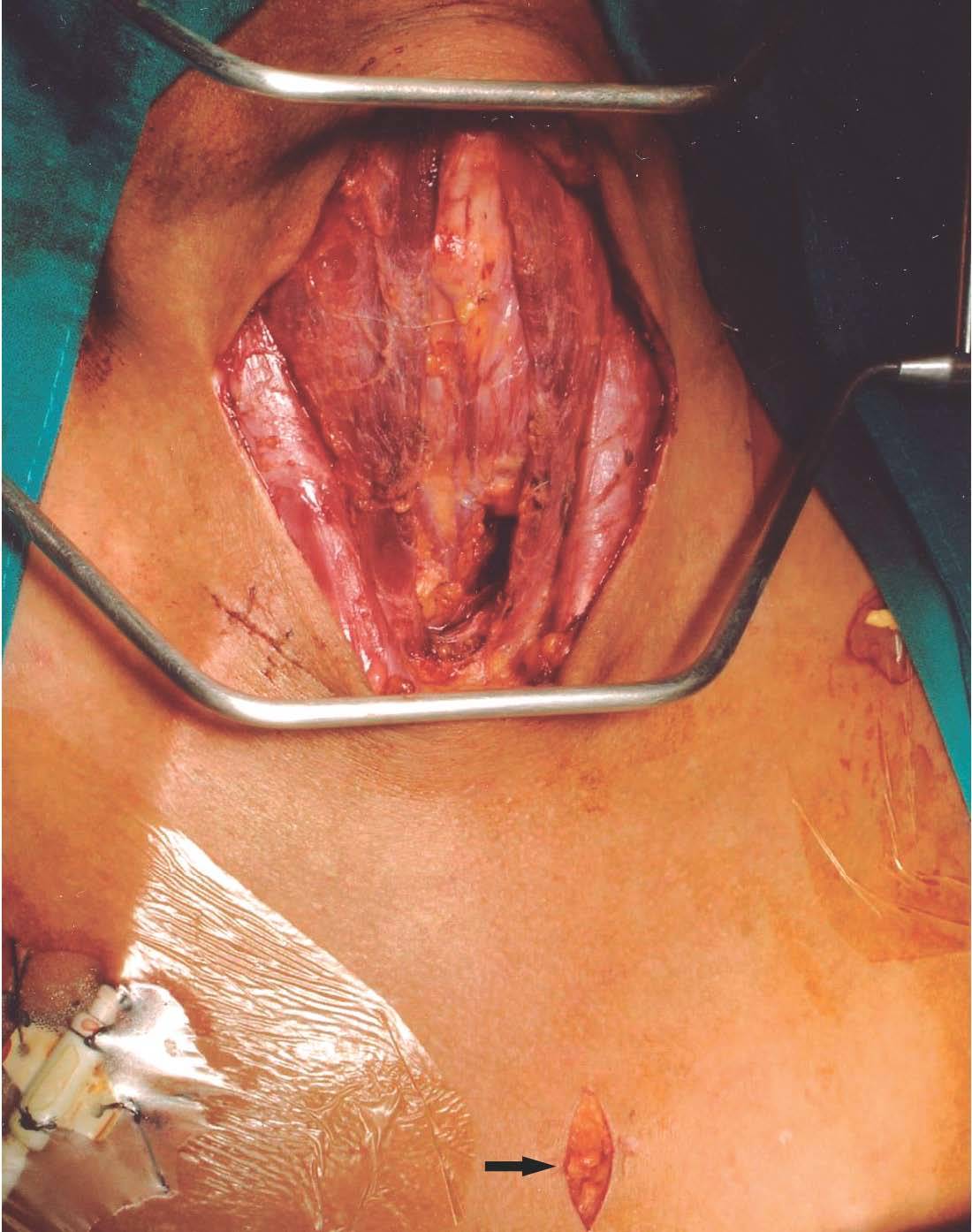
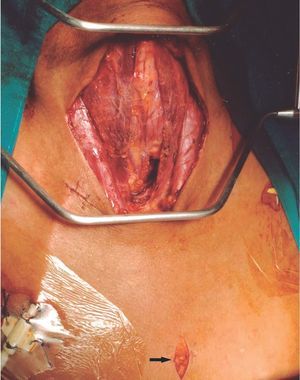
La técnica operatoria empleada fue la misma. Se realizó a través de una incisión de Kocher, con visualización de las 4 glándulas paratiroideas y su exéresis. Las gándulas fueron remitidas para estudio histopatológico, salvo un fragmento de la que no presentara áreas de nodulación. Tras paratiroidectomía las glándulas fueron examinadas por patólogos expertos (tres, según épocas) y definidas según los criterios establecidos por Ackerström et al4. Las técnicas quirúrgicas empleadas variaron en el período considerado. Entre 1984 y 2002 se indicó una parairoidectomía total con trasplante muscular antebraquial (20 fragmentos de 1 ml) y a partir de 2003 el implante se comenzó a realizar en tejido subcutáneo preesternal, y se asoció a timectomía sistemática (fig. 1).
Figura 1. Campo operatorio.
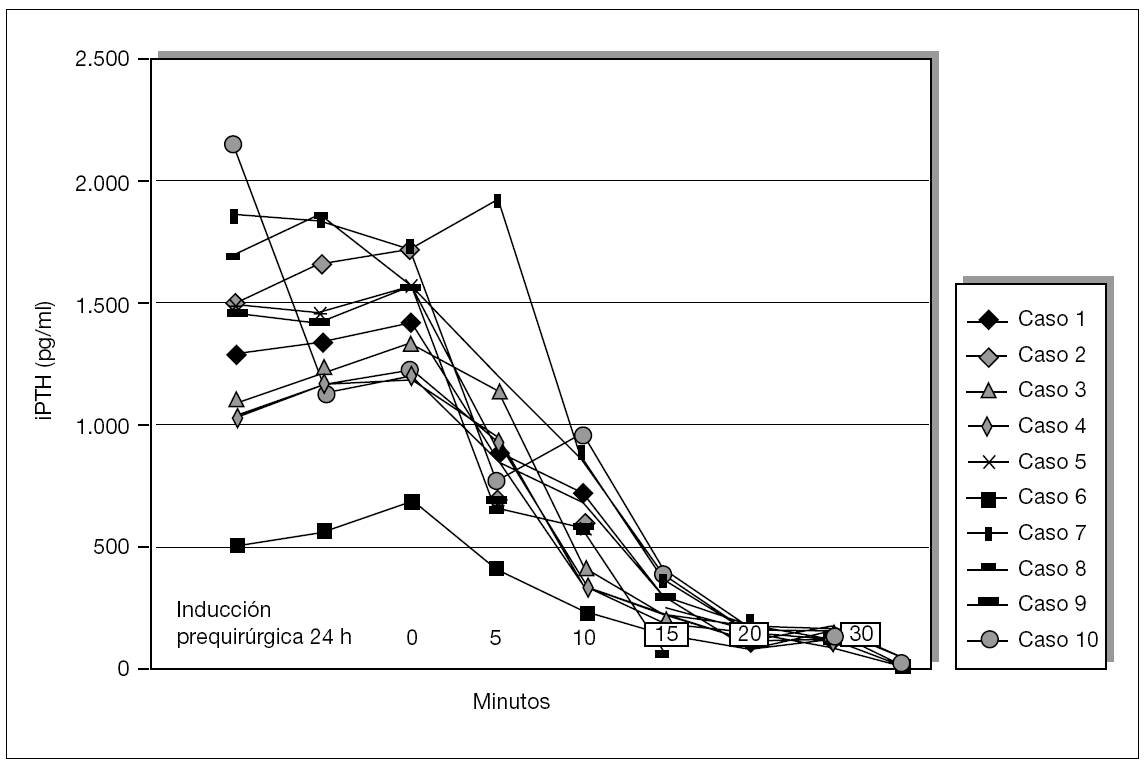
La iPTH intraoperatoria se realizó, durante los últimos 12 meses, de forma preliminar en 10 pacientes, con el fin de intentar demostrar su utilidad como indicación para eliminar todo el tejido paratiroideo. Se han analizado los valores preoperatorios y los del momento de la inducción, exéresis glandular y a los 5, 10, 15, 29 y 30 min y 24 h. Las hipótesis del trabajo han sido determinar:
1.Hipótesis principal: valorar la tasa de persistencia y recidiva en esta serie y de acuerdo con su momento de realización y la técnica empleada.
2.Indicaciones quirúrgicas y resultados de la PTT de esta serie en el tratamiento del hiperparatiroidismo secundario complicado.
3.Valorar las pautas de tratamiento seguidas en estos casos.
Resultados
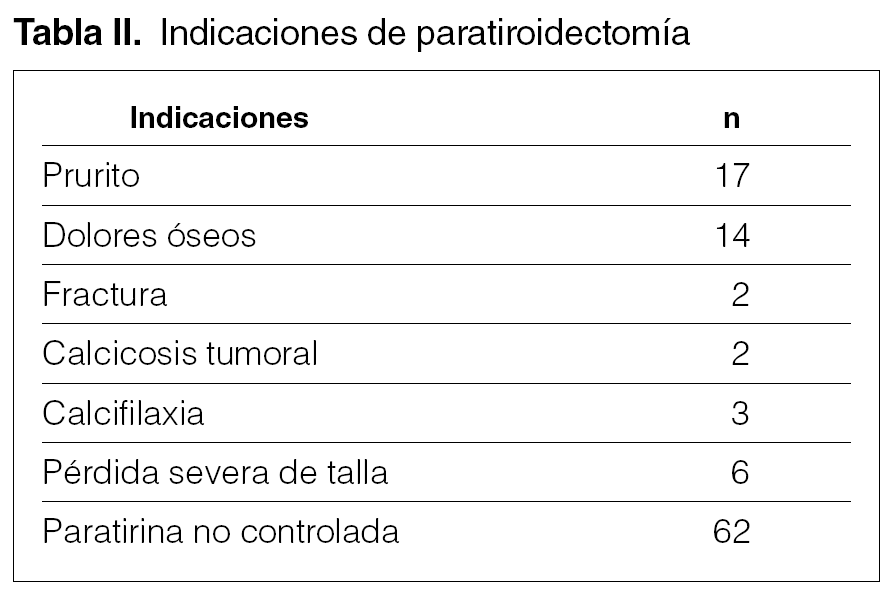
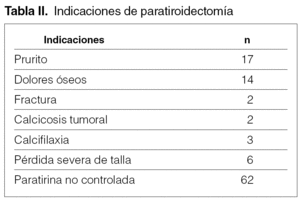
La causa de indicación quirúrgica paratiroidectomía y trasplante subcutáneo preesternal por fracaso del tratamiento médico en el control del hiperparatiroidismo secundario ha sido una iPTH no controlable y severa (> 500 pg/ml) que se ha practicado en pacientes de una población en diálisis total de 787 en 67 ocasiones (8,5 %) y, en algunos casos, con manifestaciones clínicas severas, aisladas o asociadas a prurito (17), dolores óseos (14), fractura (2), calcifilaxia (3), calcinosis tumoral (3), disminución severa de talla (6) (tabla II).
La paratiroidectomía permitió la extirpación de 4 glándulas en cada uno de los pacientes excepto en uno de ellos en el que solamente fueron extirpadas 3 y presentó un cuadro de persistencia de su hiperparatiroidismo. Asimismo, el análisis del timo, cuando la timectomía fue establecida de forma sistemática, no ha permitido detectar en éste ninguna glándula ectópica o supernumeraria.
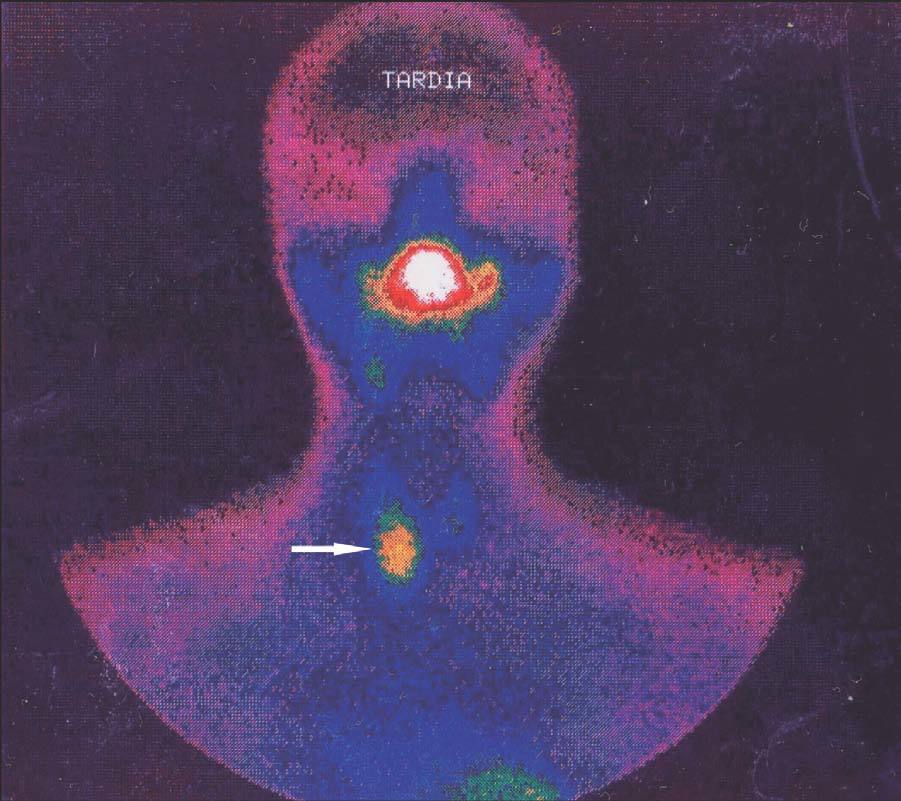
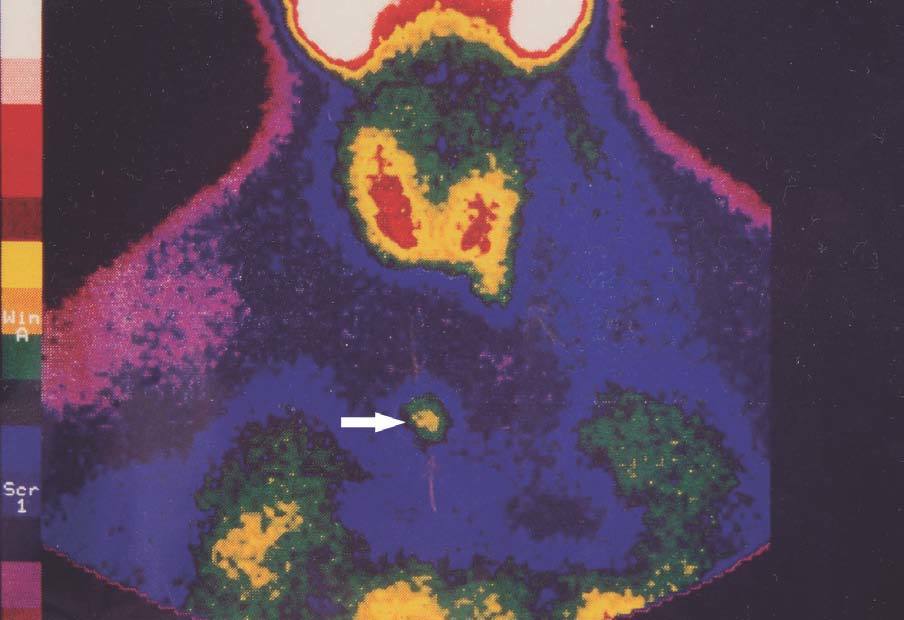
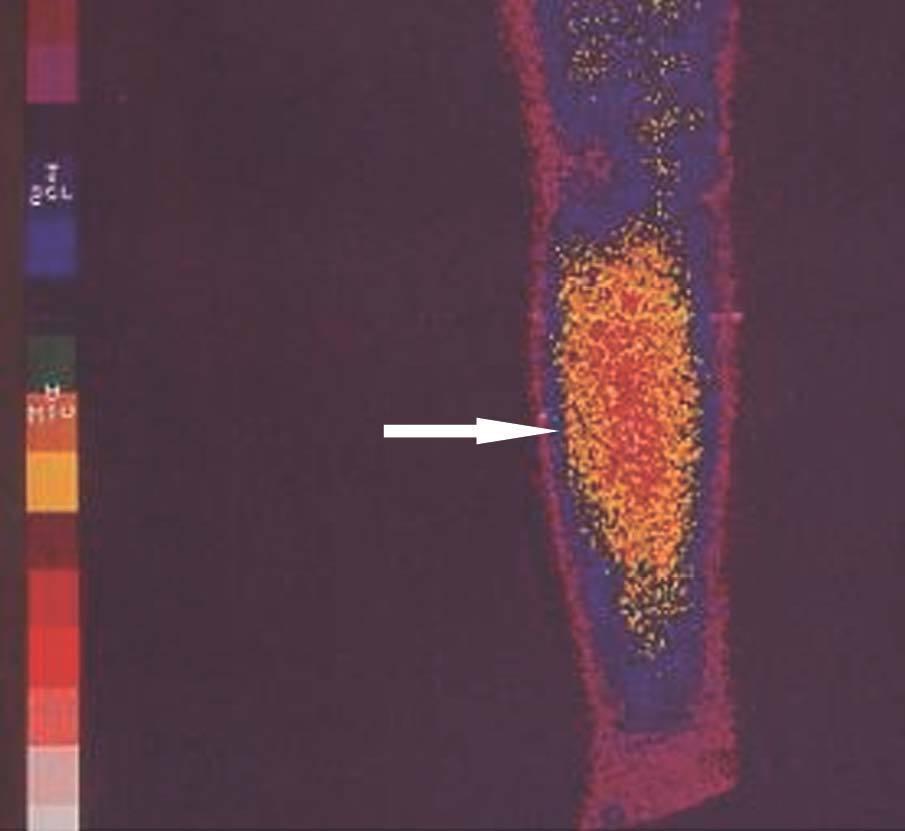
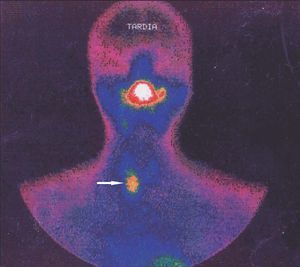
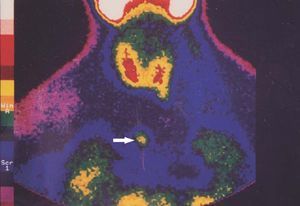
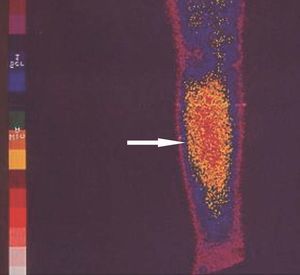
El seguimiento de estos pacientes permitió demostrar persistencia de hiperparatiroidismo en 2 pacientes (2/39) (5,1 %) tras PTT y trasplante muscular antebraquial y en ningún caso tras trasplante subcutáneo preesternal. La causa de la persistencia se debió en uno de ellos a paratiroidectomía incompleta (fig. 2) y en otro porque tenía una glándula mediastínica supernumeraria (fig. 3), que fueron reintervenidos, y se logró solucionar el problema. Asimismo, en el mismo grupo hemos observado recidiva en 3 (3/39) (7,69 %) ocasiones en relación con el tejido trasplantado a nivel antebraquial (fig. 4) que ha requerido cirugía iterativa en uno de ellos para evitar las sucesivas elevaciones de la PTH y que no se ha logrado a pesar de un segumiento de 72 meses. Sí se pudo eliminar el tejido trasplantado en los 2 restantes, con resolución del hiperparatiroidismo.
Figura 2. Gammagrafía 99Tc-sestamibi. Recidiva-persistencia por una glándula cervical olvidada.
Figura 3. Gammagrafía 99Tc-sestamibi. Recidiva-persistencia por una glándula ectópica a nivel mediastínico.
Figura 4. Gammagrafía 99Tc-sestamibi. Recidiva e infiltración antebraquial masiva en trasplante paratiroideo muscular.
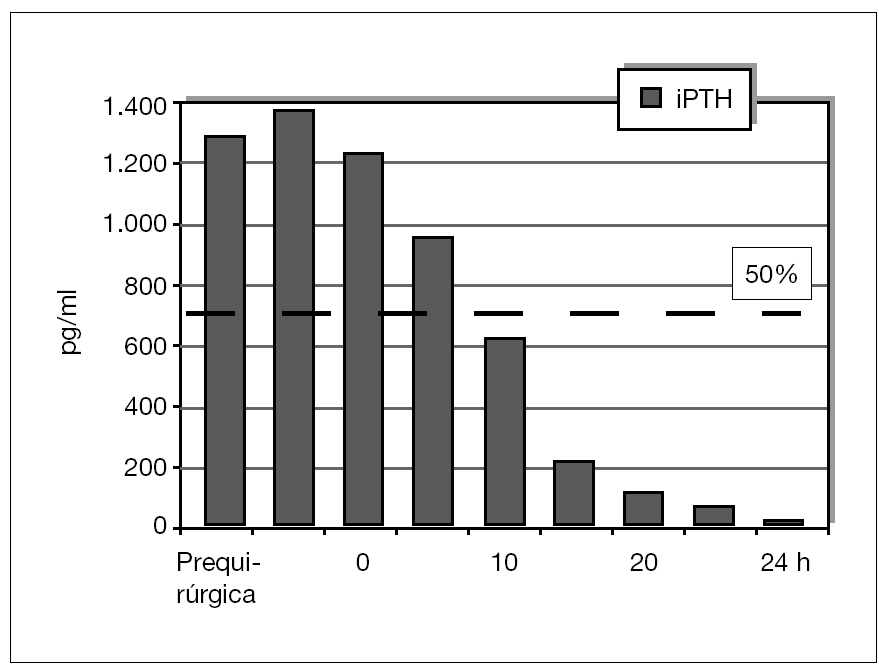
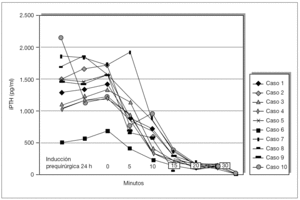
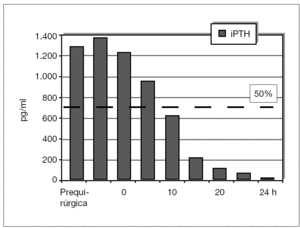
Se ha determinado la iPTH intraoperatoria, durante los últimos 12 meses, de forma preliminar en 10 pacientes y se ha demostrado válida para la eliminación de todo el tejido paratiroideo con un seguimiento medio de 6 ± 2,4 meses (figs. 5 y 6). Se aprecian descensos por debajo del 50 % de los valores iniciales a los 10 min de la exéresis paratiroidea de forma similar a como sucede en el hiperparatiroidismo primario, y ha resultado indetectable a las 24 h.
Figura 5. Evolución postoperatoria de valores de la paratirina intacta (iPTH).
Figura 6. Evolución postoperatoria de valores de la paratirina intacta (iPTH).
Discusión
La hemodiálisis ha supuesto una enorme mejora en la supervivencia de los pacientes con IRC, si bien a costa del desarrollo de numerosas complicaciones evolutivas. Sin embargo, por razones sociológicas, religiosas, económicas o de provisión de órganos, sucede que el número de trasplantes renales varíe enormemente de unos países a otros. Así, comparando la población en hemodiálisis en Japón (156.340) y en Estados Unidos (154.312) en el año 2003, vemos que se realizaron 14.561 trasplantes renales en Estados Unidos, mientras solamente 894 en Japón. Ello ha permitido establecer una gran experiencia japonesa en el seguimiento a largo plazo de pacientes en hemodiálisis y conocer y tratar mejor las complicaciones evolutivas del hiperparatiroidismo secundario. Datos de la Asociación Japonesa de Nefrología indican que a los 5 años en diálisis correcta un 5 % de los pacientes ha requerido paratiroidectomía, cifra que se incrementa al 15 % a los 10 años y al 25 % a los 20 años13.
El trasplante paratiroideo tras PTT, en cualquiera de sus variantes, es un procedimiento ampliamente aceptado en el tratamiento de las complicaciones evolutivas del hiperparatiroidismo secundario2,3.
Los mecanismos últimos de la hiperfunción paratiroidea en pacientes con IRC continúan siendo investigados en profundidad. Tres factores principales continúan siendo objeto de controversia, en algunos aspectos, en el momento actual: hipocalcemia, bajas tasas de calcitriol e hiperfosfatemia14. Sea cual fuere el mecanismo último, el efecto subsiguiente es la hipertrofia de las células paratiroideas seguida de proliferación celular15. El aumento del tamaño glandular paratiroideo es el elemento fundamental que causa la hipersecreción de paratirina16. El crecimiento suele ser generalmente de tipo monoclonal por mutación genética en alguno de los nódulos de proliferación. El control médico, aunque sea rigurosamente llevado, suele fracasar en el control de este proceso17,18, con el riesgo subsiguiente de la aparición de complicaciones evolutivas, tales como: dolores óseos, calcifilaxia, prurito, calcinosis tumoral, pancreatitis aguda, calcificaciones ectópicas de partes blandas y degeneración maligna. El tiempo medio de diálisis continúa creciendo y de ello se sigue un mayor número de pacientes que necesitan paratiroidectomía para controlar este problema.
Varias son las técnicas actualmente empleadas desde los trabajos de Wells et al19:
1.PTST20.
2.PTT21.
3.PTT con autotrasplante cervical.
4.PTT con autotrasplante antebraquial muscular19.
5.PTT con autotrasplante subcutáneo antebraquial22, abdominal23 o preesternal24.
6.PTT sin autotasplante, defendida para pacientes que no son candidatos a trasplante renal25.
Cada uno de los procedimientos está gravado por problemas evolutivos: que el injerto no funcione, la recidiva y la dificultad de reoperación ulterior26,27.
Ha sido descrita, en resultados variables, según las series recogidas, la falta de funcionalidad tras el trasplante, así como la persistencia o recidiva del HPTS.
La escisión previa de todo el tejido paratiroideo es esencial para evaluar la función del tejido trasplantado28,29. Algunos estudios (Kinnaert et al28,29) ofrecen paratiroidectomías incompletas en el 3 % de los casos que requirieron reintervención por hipercalcemia persistente, como hallazgo de una glándula supernumeraria. Asimismo, la escisión del injerto por hiperparatiroidismo recurrente fue del 12 % (7 de 59 patientes). En los comienzos de los años noventa, 2 estudios independientes30,31 registraron tasas de hipercalcemia tras PTST del 5,8 y el 6,6 % y del 6,6 y el 10,7 % tras PTT y trasplante muscular. Estudios más recientes32-36 encuentran tasas de reintervención tardías del 6-8 % tras PTST y entre el 5 y el 15 % tras PTT con autotrasplante. Higgins et al37 han observado incluso que tras 5 años el 30 % de los injertos paratiroideos han de ser eliminados por recidiva local. Todas estas publicaciones raramente diferencian entre recidiva y persistencia. En un trabajo prospectivo y aleatorizado, Rothmund et al30 compararon 20 casos de PTST con 20 casos de PTT y trasplante intramuscular con un seguimiento de 40 meses. La hipercalcemia fue menos frecuente (4 frente a 1) y ningún paciente fue reoperado tras PTT y autotrasplante. Conzo et al38 publican que los pacientes con hiperplasia nodular tienen mayores tasas de recidiva (definida como una iPTH más de dos veces el límite superior de la normalidad) que aquellos con hiperplasia difusa; sin embargo, ello no ha sido corroborado por otros autores. Kinnaerts encuentra tasas de reoperación similares en ambos grupos y las concentraciones de iPTH no fueron significativamente más altas en los casos de hiperplasia nodular.
Publicaciones recientes39-41 han demostrado que una proporción significativa de pacientes urémicos en hemodiálisis presentan cuadros de hipoparatiroidismo, arbitrariamente atribuido a las concentraciones < 20 pg/ml, y que no se puede atribuirlos a la cirugía
realizada. Dato que debe ser tenido en cuenta son los casos que se engloban dentro del proceso de la enfermedad ósea adinámica observada hasta en el 50 % de los pacientes en hemodiálisis. Al comienzo del presente estudio algunos pacientes recibieron medicación que contenía aluminio como parte del tratamiento antes de la paratiroidectomía. Dicha práctica no ha sido realizada ya en los últimos 15 años. Sabemos que el aluminio se acumula en las glándulas paratiroideas e inhibe su secreción hormonal. Recientemente se ha propuesto que la ruta ciclina D1/p16/pRB con activación del gen RB puede tener importancia en la progresión de la hiperplasia e hipertrofia en la paratiroides.
El tejido trasplantado puede sufrir un proceso de crecimiento tumoral ya descrito en casos iniciales de empleo de esta técnica y demostrable, en ocasiones, mediante simple exploración clínica42. Cuando se cumplen los criterios de recidiva del hiperparatiroidismo secundario y localizamos su origen, es necesario conocer el grado de extensión e infiltración del tejido paratiroideo en su proceso de proliferación que nos evite las resecciones iterativas e incompletas. Somos conscientes del grado de dificultad que encierra la identificación correcta de tejido paratiroideo hiperplásico cuando infiltra estructuras anatómicas diferentes. Otras veces puede infiltrar las estructuras antebraquiales musculares, lo que hace que intervenciones iterativas se sigan de impotencia funcional, como hemos observado, y recidiva o persistencia del cuadro de hiperparatiroidismo, a pesar de varias actuaciones quirúrgicas, y la imposibilidad de identificar y eliminar el tejido paratiroideo trasplantado que ha infiltrado en su crecimiento el tejido muscular que recibió el trasplante43-45. Es esencial, en estos casos, determinar el lugar y la causa de recidiva: cervical y/o antebraquial. La maniobra de compresión neumática de Casanova et al46 es útil en la diferenciación en caso de que el tejido que causa la hipersecreción sea el trasplantado al antebrazo y
permite determinar su lateralidad. Asimismo, la valoración de las concentraciones venosas de iPTH en ambas extremidades se emplea en algunos centros, con un criterio de positividad cuando la relación es superior al cociente 1,5/147.
Las tasas de mortalidad de la intervención no son despreciables (3-4 %) al tratarse de pacientes que llevan años en diálisis, con enfermedades cardíacas asociadas y disfunción cardiorrespiratoria. Además, la reintervención en áreas cervicales exhaustivamente exploradas quirúrgicamente entraña un potencial elevado de riesgo lesional añadido48.
Algunos autores recomiendan estudios de localización previos en el HPTS. Nosotros creemos que no son necesarios toda vez que hemos de abordar la totalidad del tejido paratiroideo. Tendrían su indicación en casos de persistencia y/o recidiva del hiperparatiroidismo y determinar la razón y su topografía. La gammagrafía de sustracción 201Ta-99Tc fue muy empleada inicialmente en estos estudios de localización en el HPTS y en el HPT primario32. Su sensibilidad, no obstante, era del 50 %. Actualmente, el empleo de la técnica 99mTc-sestamibi-123I ha sido valorado positivamente49 por su especificidad para adenomas, pero mucho menos para la hiperplasia y el hiperparatiroidismo secundario de origen renal9.
La adición de SPECT (single proton emission computed tomography) parece mejorar la localización espacial, pero las tasas de identificación en cuanto a sensibilidad se encuentran alrededor del 70 %. Una nueva técnica de sustracción de imágenes (99mTc-sestamibi-123I) ha sido descrita con resultados que elevan la sensibilidad al 96 % y la especificidad al 80 %8,50. La adición del trazador tiroideo permite una delineación tiroidea y su ulterior sustracción incrementa la sensibilidad tanto en el hiperparatiroidismo primario como en el secundario. La captación de MIBI ofrece además un análisis de la función glandular. Se está estudiando actualmente la relación entre la captación de MIBI, la capacidad secretora, la disminución de la inmunotinción de los receptores de sensores de calcio y las características tisulares que determinen un elevado crecimiento. En el control evolutivo del trasplante subcutáneo preesternal, estamos a la espera de realizar estudio de imagen del tejido trasplantado. Creemos que es conveniente una espera algo más prolongada y que exista una función paratiroidea límite y el riesgo de redicidiva para poder determinar el verdadero valor de los análisis de imagen en estos casos.
En pacientes trasplantados que ceden en su HPTS, la persistencia de captación en una o varias glándulas y las concentraciones elevadas de PTH deben ser orientativas de evolución hacia un hiperparatiroidismo terciario, cuyo abordaje puede ser más selectivo en cuanto al número de glándulas a extirpar sobre la base de estos conocimientos anatómicos y funcionales proporcionados por el radioisótopo.
Resultados menos satisfactorios se publican generalmente tras PTST, con tasas de recidiva del 34,7 %6,51. En pacientes con trasplante renal tras paratiroidectomía, el porcentaje se reduce al 20 %51. Obviamente, una glándula supernumeraria olvidada contribuye a la tasa de fracasos quirúrgicos. La timectomía transcervical sistemática es de gran ayuda para evitar esta complicación por el elevado porcentaje (hasta el 20 %) de posible tejido paratiroideo incluido en él52,53.
En contraste con otros autores, no realizamos sistemáticamente estudios de imagen isotópica en el preoperatorio. Sí se han realizado estudios ultrasonográficos y ocasionalmente TC, sobre todo en los primeros años. Sin embargo, en caso de persistencia-recidiva, el estudio con MIBI ha demostrado unos resultados excelentes para determinar si hay tejido paratiroideo ectópico y estudio de recidiva local, tanto tras trasplante paratiroideo como tras paratiroidectomía incompleta.
No existe conflicto de intereses.
Correspondencia: Dr. M. Echenique-Elizondo.
Unidad Docente de Medicina de San Sebastián.
Universidad del País Vasco.
Paseo Dr. Beguiristain, 105.
20014 San Sebastián. Guipúzcoa. España.
Correo electrónico: gepecelm@sc.ehu.es
Recibido el 11-12-2006; aceptado para su publicación el 5-2-2007.