Por la importancia de minimizar el daño renal, por isquemia/reperfusión, en el trasplante de órganos, evaluamos tratamientos profilácticos para controlar la respuesta inflamatoria, utilizando diferentes donadores de óxido nítrico (NO).
MétodosEmpleamos modelos experimentales de isquemia/reperfusión y trasplante renal utilizando los donadores LA-803, LA-807, LA-810 y molsidomina. Estudiamos función renal, infiltración neutrofílica, estrés oxidativo, citocinas proinflamatorias y antiinflamatorias, NO, interacción leucocito-endotelio y transcripción nuclear.
ResultadosLA-803 demostró la mayor efectividad en el control de la respuesta inflamatoria y fue seleccionado para continuar el estudio. Demostramos una disminución del estrés oxidativo y de la infiltración neutrofílica, una menor lesión endotelial con preservación de la función orgánica y una disminución de la respuesta inflamatoria.
ConclusionesConsideramos que el empleo de donadores de NO específicos es de extraordinario interés en el trasplante de órganos, incrementando la viabilidad celular y la función orgánica postrasplante.
Given the importance of minimizing renal damage due to ischemia/reperfusion in organ transplants, we evaluated prophylactic treatments to control inflammatory response, using distinct nitric oxide donors.
MethodsWe used experimental models of ischemia/reperfusion and kidney transplants using LA-803, LA-807, LA-810 donors and molsidomine. Renal function, neutrophil infiltration, oxidative stress, pro- and anti-inflammatory cytokines, nitric oxide, leukocyte-endothelium interaction and nuclear transcription were studied.
ResultsLA-803 demonstrated the greatest effectiveness in controlling inflammatory response and was selected to continue the study. We found a decrease in inflammatory response, oxidative stress and neutrophil infiltration and lesser endothelial damage with preservation of organ function.
ConclusionsWe believe that the use of specific nitric oxide donors could be highly useful in organ transplantation, increasing cellular viability and organ function post-transplantation.
El fallo renal agudo por isquemia-reperfusión (I/R) es un problema clínico muy importante1 que, a pesar de los avances terapéuticos, sigue asociado con alta morbimortalidad y coste económico1,2. Acontece a través de una compleja interacción entre efectos hemodinámicos, mediadores de la inflamación y daño tubular y endotelial3,4.
Tanto el daño por I/R secundario a la extracción, almacenaje e implante renal como la respuesta inflamatoria originada durante ésta afectan a la recuperación del injerto, siendo la inflamación uno de los mecanismos más importantes en el fallo funcional del órgano3.
El óxido nítrico (NO) juega un papel protector en modelos de fallo renal in vivo5. Varios estudios han demostrado que el NO exógeno aumenta la supervivencia y disminuye el daño renal inducido por I/R en ratas6–9.
Estudiamos la importancia de la respuesta inflamatoria y su regulación para obtener una mayor viabilidad celular y una mejor respuesta funcional del órgano trasplantado utilizando profilácticamente nuevos donadores de NO.
MétodosDonadores de óxido nítrico
LA-803, LA-807, LA-810, a una dosis de 1,8μmol/kg, químicamente definidos como nitrosotioles, sintetizados por Lacer®, diseñados para liberar diferentes dosis a distintos tiempos.
Molsidomina® (Molsidain®, Hoechst), utilizada como hipotensor rápido en clínica, a una dosis de 4mg/kg.
Estudios de isquemia/reperfusión renalCincuenta ratas macho Wistar (250–275g) (Charles River, Margate, UK).
Anestesia intraperitoneal con 75mg/kg de ketamina (Parke-Davis, España)+50mg/kg de diazepam (Roche, España) y 20mg/kg de atropina (Braun, España).
I/R según García Criado6,8: laparotomía media, oclusión pedículo renal izquierdo con micropinza vascular durante 60min. Antes de finalizar la isquemia nefrectomía derecha y reperfusión de 4h a 7 días.
A los animales divididos en grupos se les administró i.v. LA-803, LA-807, o LA-810, 30min antes de la reperfusión; al grupo control se le administró el solvente al mismo tiempo.
A las 4h posreperfusión se tomaron muestras de sangre y riñón, y en el seguimiento de 7 días los animales permanecieron estabulados en jaulas metabólicas para realizar estudios de supervivencia y función renal.
Estudios de trasplante renal en rataVeinte ratas machos Fischer consanguíneas (200–225g), (F.344/ICO, Iffa Credo, Francia).
Anestesiada la rata, según protocolo anterior, se realizó laparotomía media e identificaron el riñón y el uréter, la vena y la arteria renal izquierdas, la vena cava inferior y la aorta abdominal; administramos 100UI de heparina Rovi®. Realizamos técnica modificada de trasplante renal ultrarrápido sobre la descrita por Neblina10, utilizando cuff para las anastomosis venosa y uretral y telescopaje en la arteria renal. Finalmente, nefrectomía derecha, reperfusión de 3h y toma de muestras (sangre y riñón). Los riñones fueron perfundidos, extraídos y preservados con solución EuroCollins a 4°C durante 24h.
Grupos: simulado (n=4), trasplante control (n=4+4) y trasplante+LA-803 en las soluciones de perfusión y preservación y al receptor del órgano 30 min antes de la reperfusión (n=4+4).
Estudios de transplante renal en cerdoTreinta y cinco cerdos minipig machos (18–20kg) (Harlan Laboratories SRI).
Después de administración i.m. de ketamina de 2mg/kg, diazepam de 10mg y atropina de 1mg, se induce anestesia con propofol de 1,5mg/kg i.v. y se realiza intubación orotraqueal con ventilación mecánica (Boyle, 2000), manteniendo la anestesia con propofol (3–4mg/kg/h), fentanilo (2μg/kg/h) y mivacurio (1mg/kg/h), para analgesia postoperatoria de 2g de metamizol magnésico.
Se cateterizan la vena yugular interna y la arteria carótida; se realiza laparotomía media, disección de la aorta abdominal y arterias renales (ligando ramas suprarrenal inferior y gonadal) hasta bifurcación aórtica, disección del uréter respetando la grasa periureteral y procediéndose a la perfusión renal con EuroCollins a 4°C y 1mg/kg de heparina sódica. Preservación con EuroCollins a 4°C durante 24h y autotrasplante heterotópico siguiendo técnicas quirúrgicas y terapéuticas idénticas a las utilizadas en clínica humana.
Grupos: simulado (n=5), trasplante control (n=5) y trasplante molsidomina en soluciones de perfusión y preservación y al receptor del órgano 30 min antes de la reperfusión (n=5). Tiempos de reperfusión de 24h, 3 y 7 días.
Variables analizadasPruebas de función renal.
Modelo I/R: 48h posreperfusión.
Modelo trasplante cerdo: 7 días postrasplante.
Las concentraciones de creatinina en plasma y orina se determinaron utilizando un método automatizado basado en la reacción de Jaffé (analizador automático Hitachi 747-200, reactivos de Boehringer Mannheim, Indianápolis, IN). El aclaramiento de creatinina fue calculado utilizando la fórmula convencional.
Radicales libres del oxígeno.
Modelo I/R: 4h posreperfusión.
El estrés oxidativo en el riñón fue estudiado mediante los niveles de superóxido dismutasa, según las técnicas de Misra y Fridovich y el anión superóxido (ASO) por adaptación de Boveris y Forman, descrito previamente6.
Para la concentración de proteínas se utilizó un kit de Bio-Rad, basado en el método de Lowry (1951).
Mieloperoxidasa.
Modelo I/R: 4h posreperfusión.
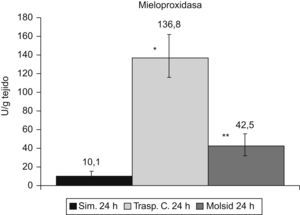
Modelo trasplante cerdo: 24h postrasplante.
La actividad de la mieloperoxidasa (MPO) en el riñón, como marcador de infiltración neutrofílica, fue analizada según la técnica de Bradley modificada por Mullane, descrita previamente6.
Citocinas.
Modelo I/R: 24h posreperfusión.
Modelo trasplante rata: 3h posreperfusión.
Los niveles de factor de necrosis tumoral alfa (TNF-α), interleucina (IL)-1β, IL-6 e IL-10 fueron determinados en suero empleando kits basados en la técnica ELISA (DuoSet® ELISA Development System rat R&D Systems).
Estudio de la sintasa inducible del óxido nítrico (iNOS), molículas de adhesión celular (CAMs) y factor transcripcional (κB).
Modelo trasplante rata: (molícula de adhesión celular vascular-1 soluble [sICAM-1] y molícula de adhesión celular vascular-1 soluble [sVCAM-1] 3h postrasplante.
Modelo trasplante cerdo: (sICAM-1, molícula de adhesión celular intracelular-1 [ICAM-1], sVCAM-1 y molícula de adhesión celular vascular-1 [VCAM-1], factor nuclear κB [NFkB] e iNOS) 7 días postrasplante.
La expresión de iNOS, sVCAM-1, VCAM-1, sICAM-1, ICAM-1 y NFκB fueron evaluadas por western blot según se describe previamente9.
Estudio estadístico.
Todos los valores han sido representados como media±error estándar de la media.
La inferencia se realizó con ANOVA (test de Scheffé o Kruskal-Wallis) y Kaplan Meier. Un valor de p<0,05 se aceptó como resultado significativo.
ResultadosModelo de isquemia-reperfusiónFunción renal
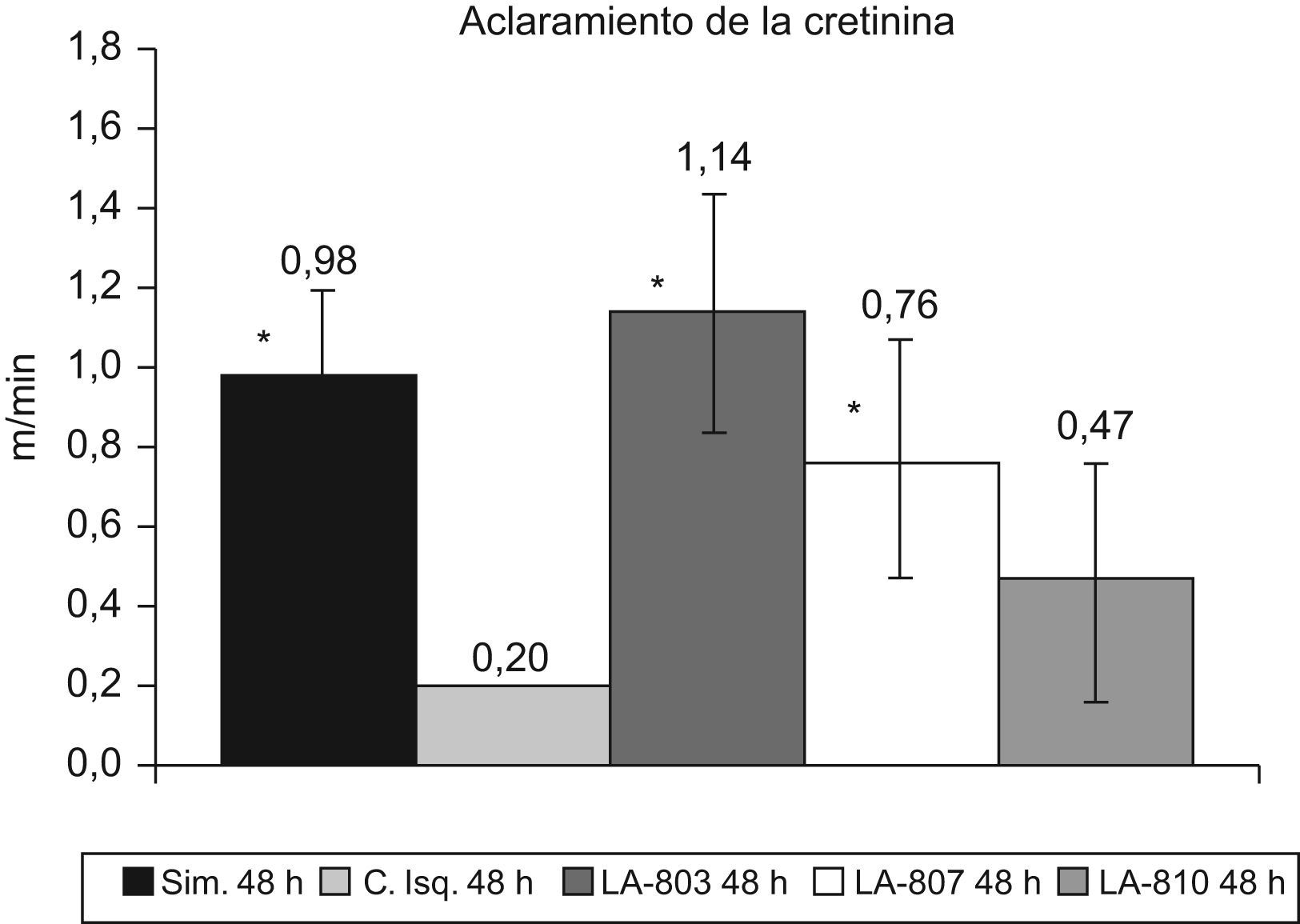
La creatinina obtuvo valores en los grupos tratados con NO, LA-803 de 200mg/ml y LA-807 de 240mg/ml, que no se diferencian del grupo simulado (140mg/ml), existiendo diferencias (p<0,05) con los del grupo isquemia-control (510mg/ml) y el tratado con LA-810 (470mg/ml).
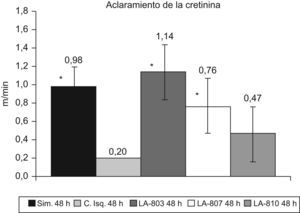
El aclaramiento de creatinina en los grupos tratados con LA-803 y LA-807 y el grupo simulado presenta diferencias con el grupo de isquemia-control (p<0,01) (fig. 1).
Estrés oxidativo
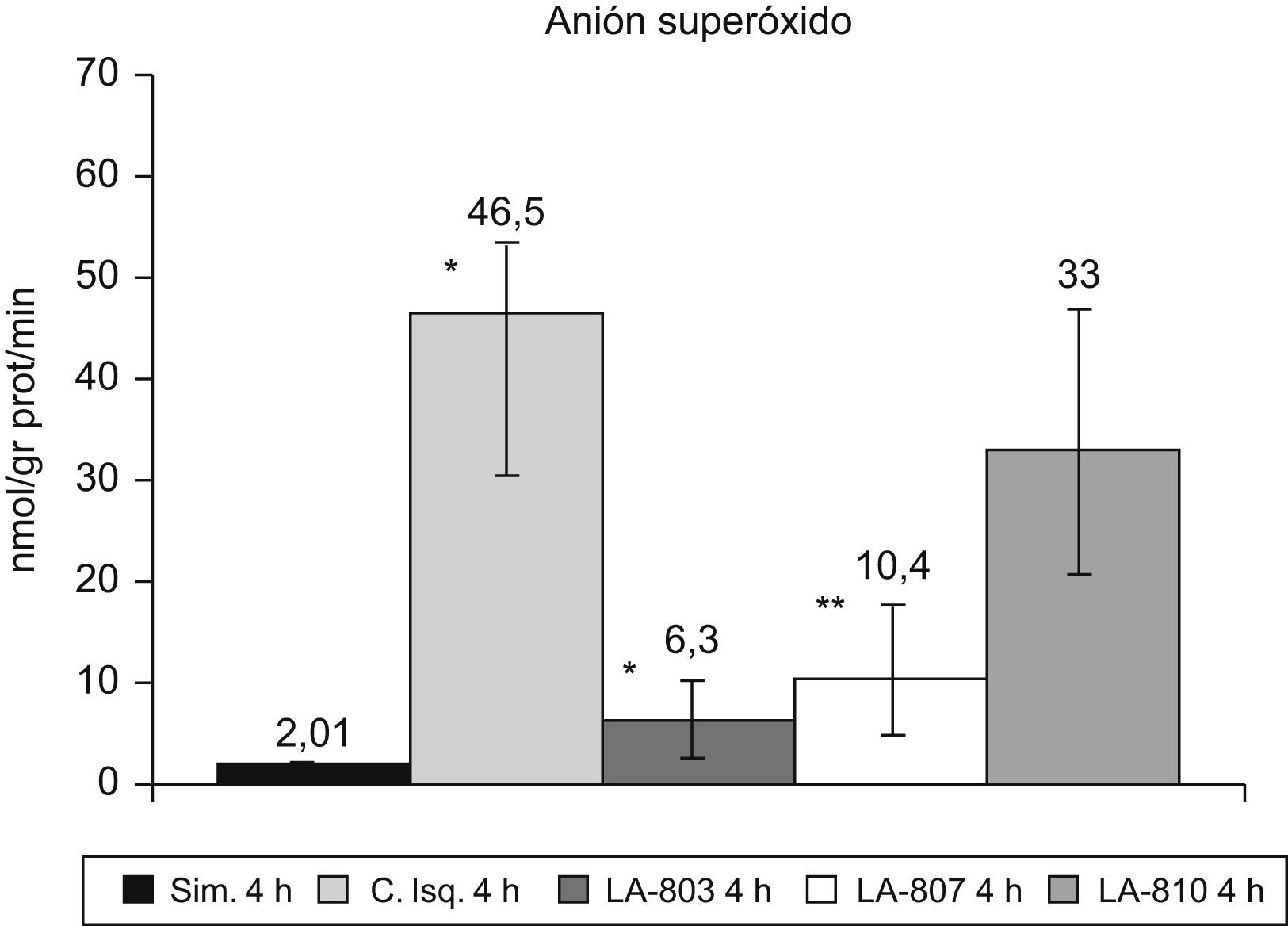
La I/R en el grupo control de 309U/mgprot induce un incremento de superóxido dismutasa con respecto al grupo simulado, de 58,1U/mgprot (p<0,01). Los grupos LA-803 de 73,8U/mgprot y LA-807 de 100U/mgprot presentan una disminución (p<0,01) con respecto al grupo control y LA-810.
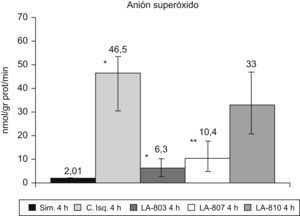
El ASO aumenta en el grupo control con respecto al grupo simulado (p<0,001). En los grupos LA-803 y LA-807 disminuye con respecto al grupo control (p<0,001) y LA-810 (p<0,01) (fig. 2).
Infiltración neutrofílica
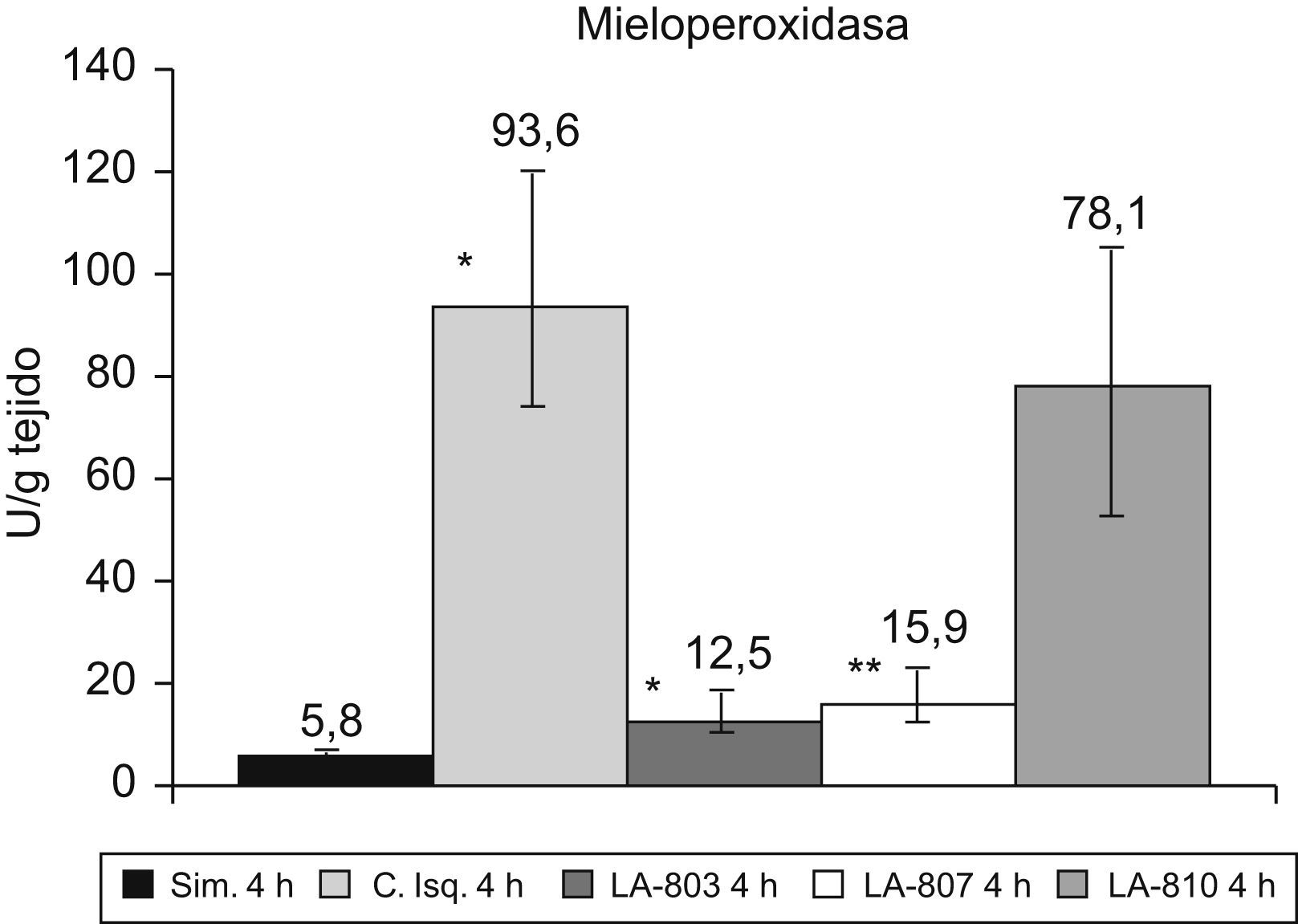
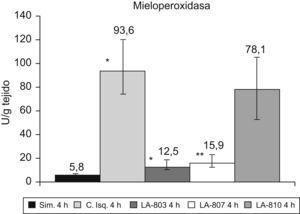
La MPO aumenta (p<0,001) en el grupo control vs. el grupo simulado. Los grupos LA-803 y LA-807 presentan una disminución con respecto al grupo control y LA-810 (p<0,001) (fig. 3).
Modelo de trasplante renal en rataCitocinas proinflamatorias
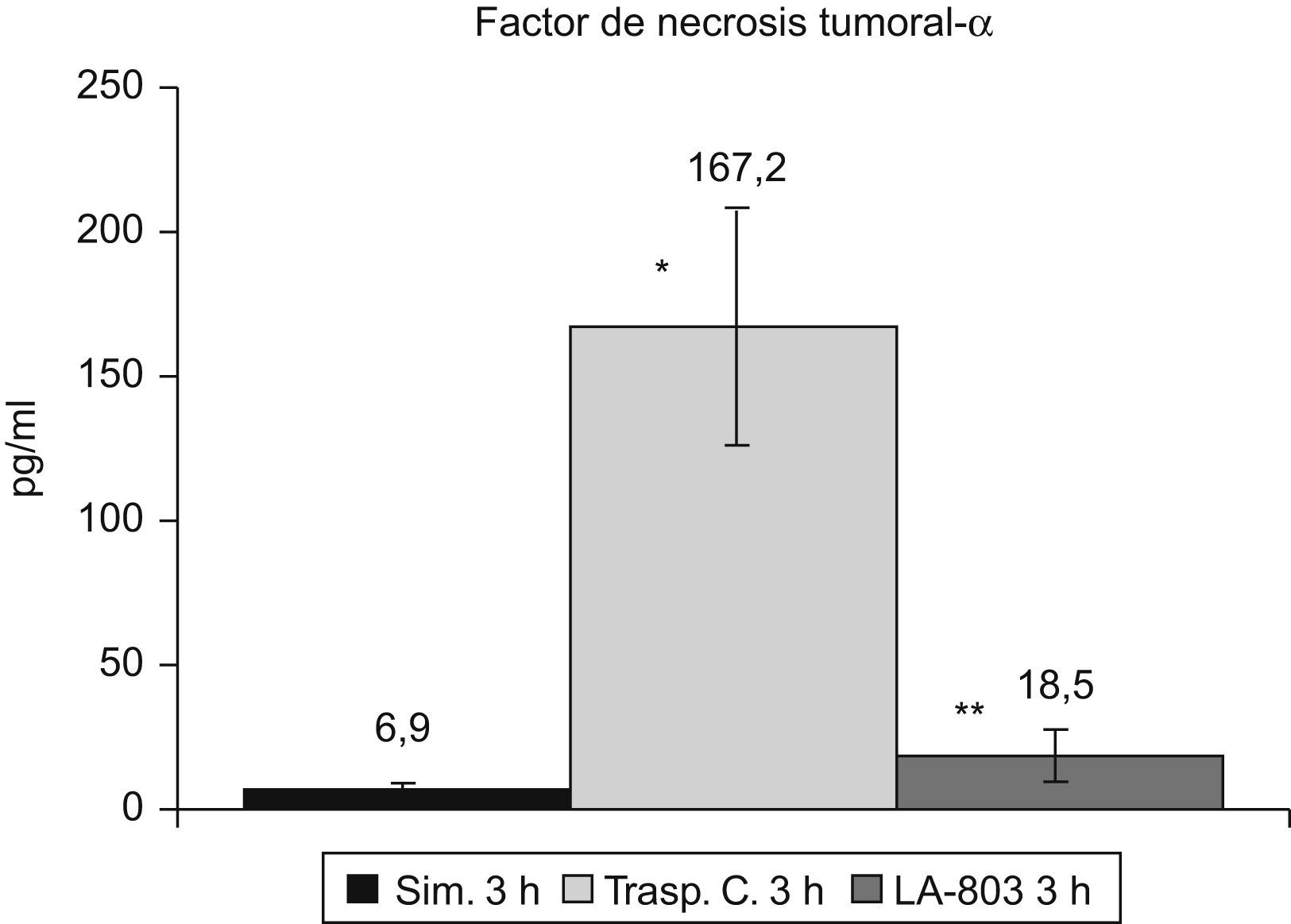
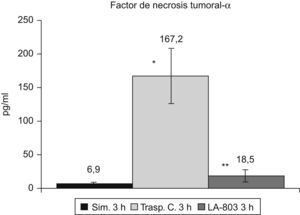
El TNF-α se incrementa (p<0,01) en el grupo trasplante-control respecto al grupo simulado, disminuyendo (p<0,01) en el grupo LA-803 (fig. 4).
La IL-1β, incrementada en el trasplante-control (197,6pg/ml), con respecto al trasplante NO (73pg/ml).
Daño endotelial
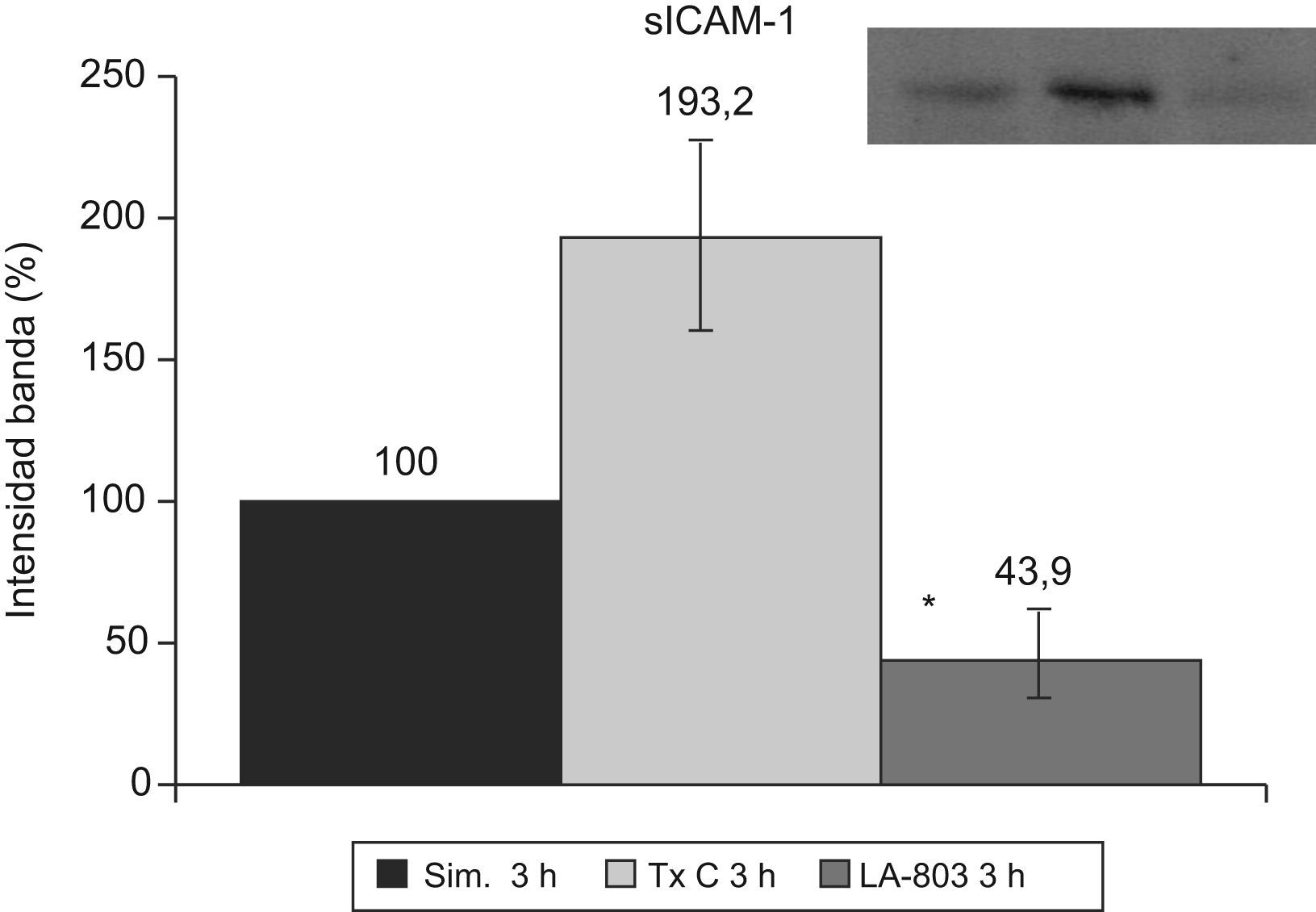
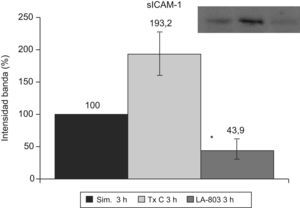
La sICAM-1 presenta una disminución en el grupo LA-803 y un aumento en el grupo trasplante-control (fig. 5).
La sVCAM está elevada en el grupo trasplante-control (318,7%) (p<0,01) con respecto al grupo simulado (100%), mientras que en el trasplante LA-803 (123%) disminuye (p<0,01) hasta alcanzar los valores del grupo simulado.
Modelo de trasplante renal en cerdoFunción renal
La creatinina, al séptimo día postrasplante, presentó un incremento (p<0,001) en el grupo trasplante-control (3,8mg/ml). No observamos diferencias entre los grupos simulado (1,2mg/ml) y trasplante-molsidomina (0,9mg/ml).
El aclaramiento de creatinina no difiere en el grupo tratado (8,7ml/min) con respecto al grupo simulado (11,3ml/min). Fue significativa la diferencia entre el grupo molsidomina (8,7ml/min) y el grupo control (4,5ml/min) (p<0,01).
Infiltración neutrofílica
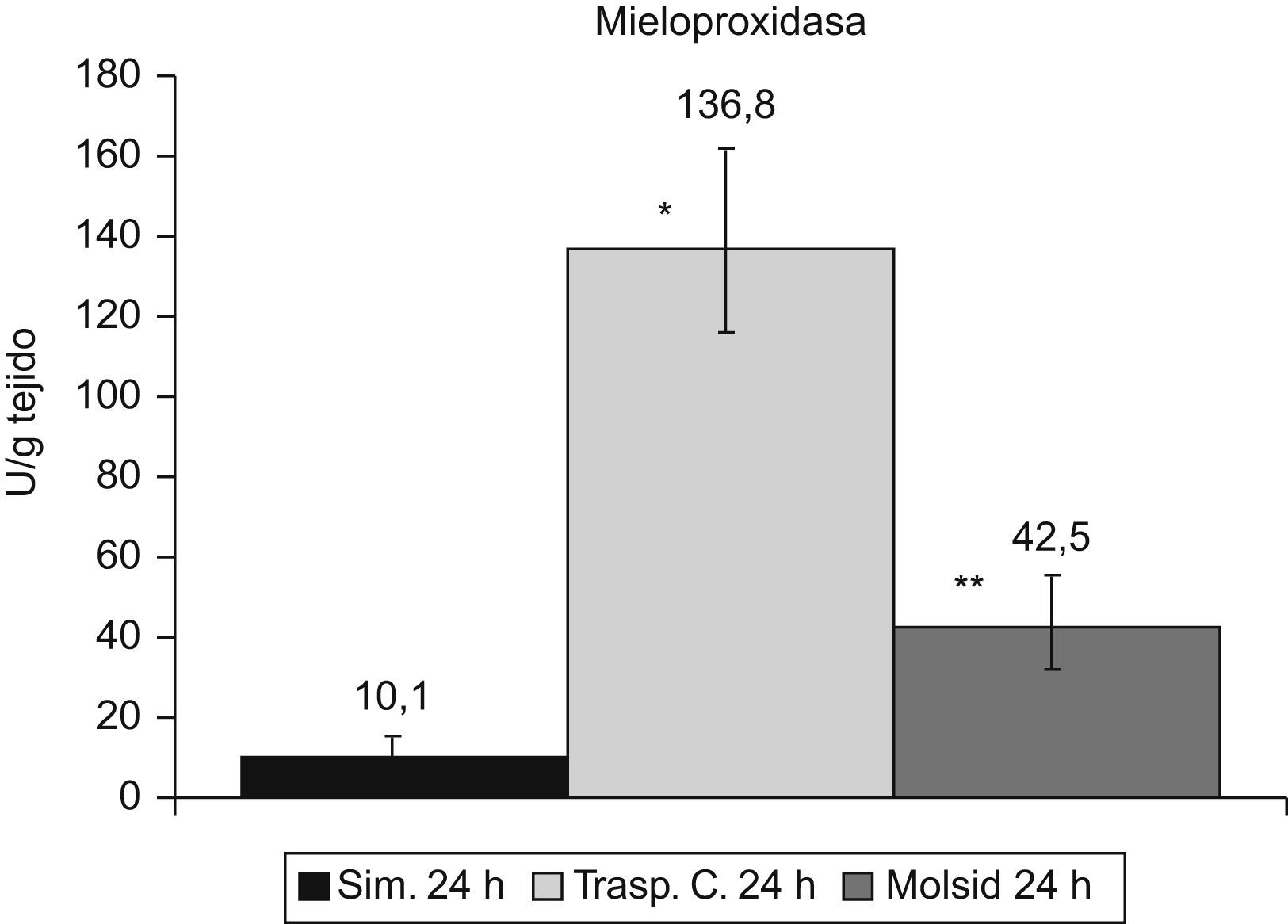
Incremento de MPO (p<0,001) en el grupo control respecto al grupo simulado. A pesar de la disminución en el grupo trasplante-molsidomina, sigue siendo superior a la del grupo simulado (p<0,05) (fig. 6).
Citocinas antiinflamatorias
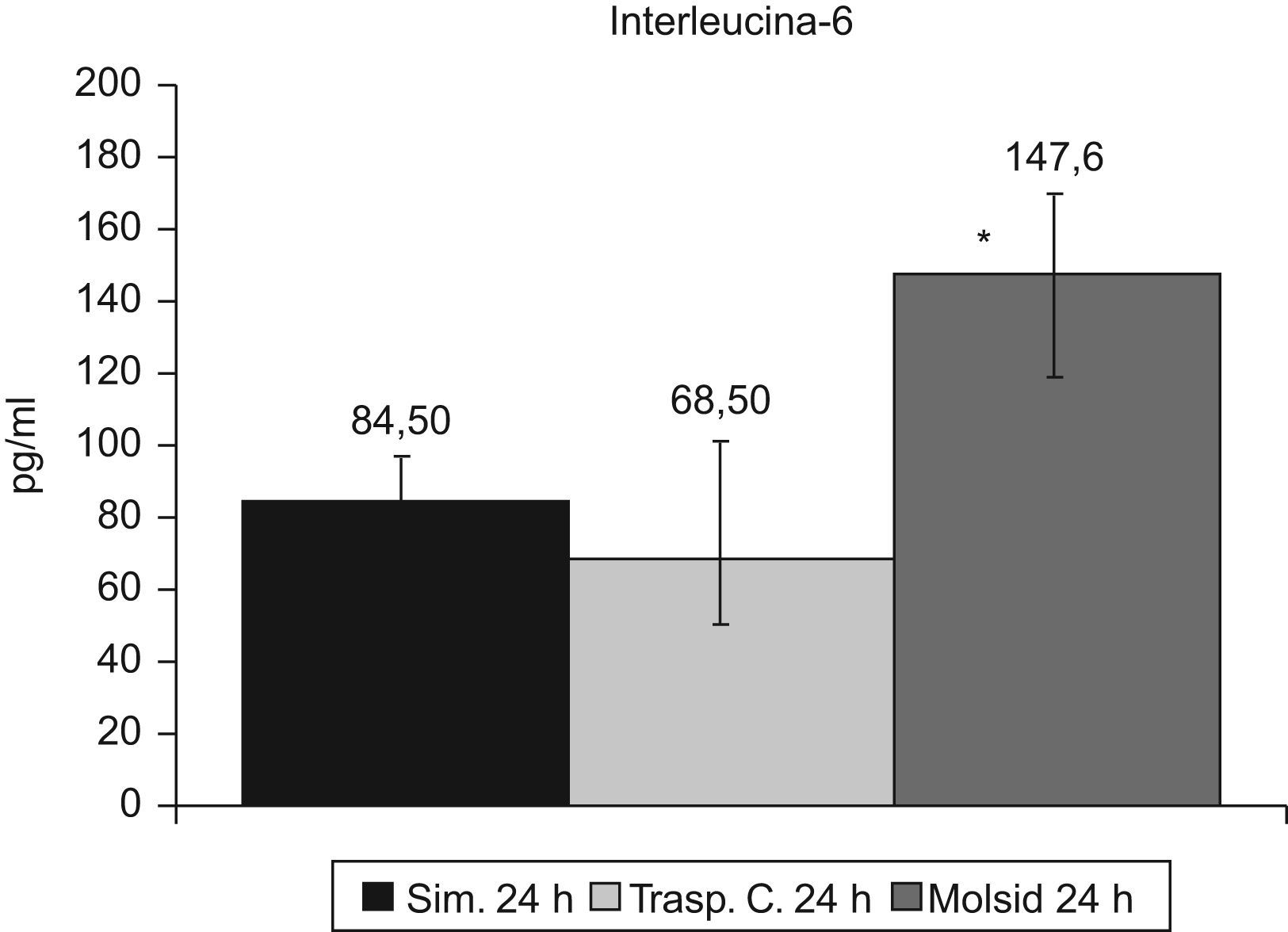
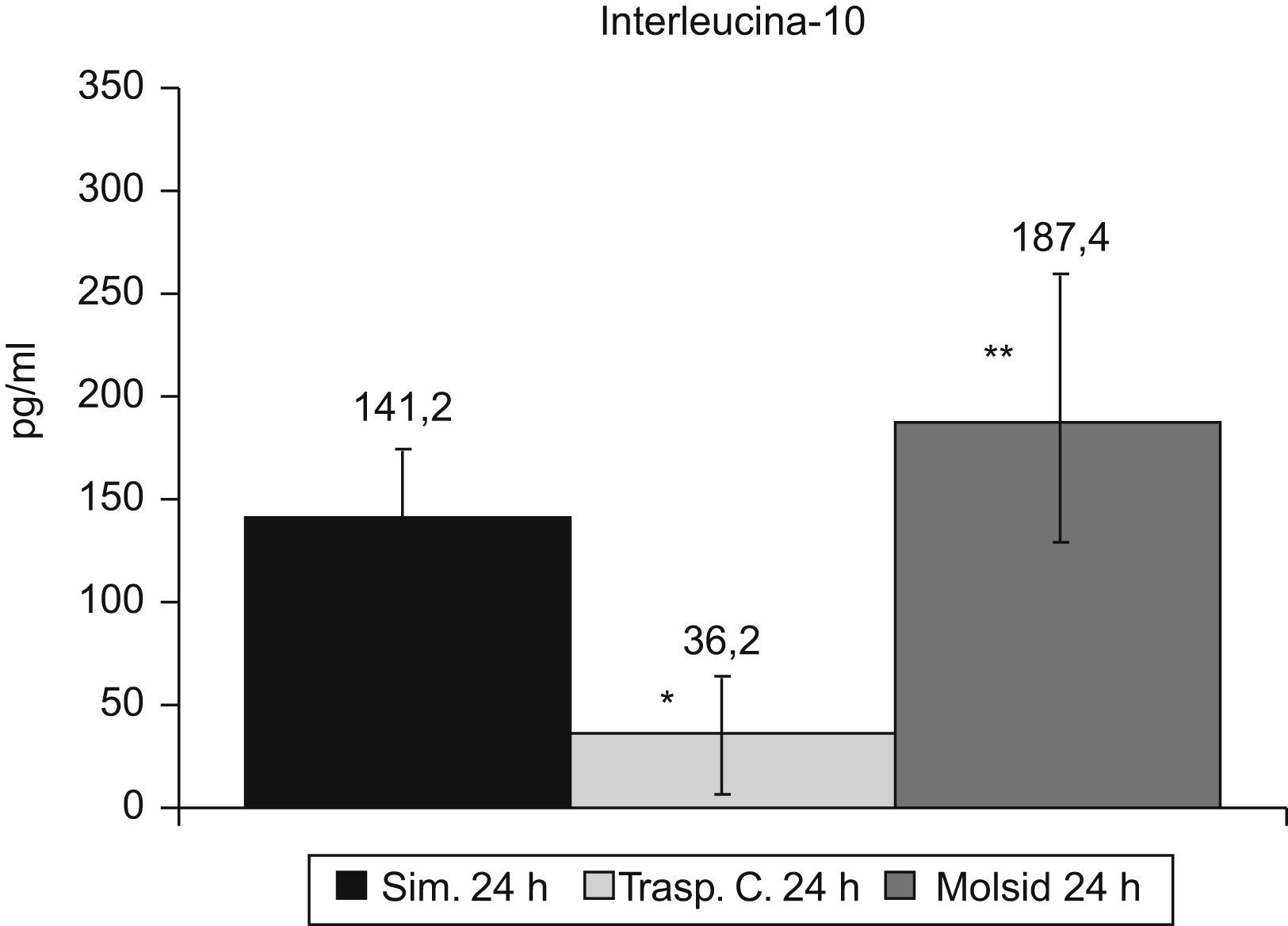
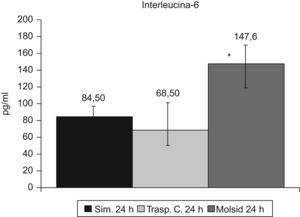
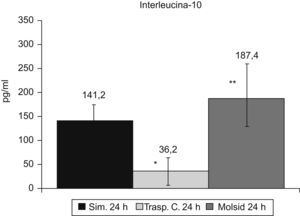
Las IL-6 e IL-10 presentaron un incremento (p<0,01) en el grupo trasplante-molsidomina. La IL-10 disminuyó (p<0,01) en el grupo control (figs. 7 y 8).
Óxido nítrico
La concentración de nitritos demostró un incremento (p<0,001) en el grupo trasplante-control (24h=48,2nM; 7d=34,3nM) respecto al grupo simulado (24h=6,1nM; 7d=4,6nM) y al grupo molsidomina (24h=11,1nM; 7d=8nM); en éste observamos una disminución significativa (p<0,05) a los 7 días respecto de la evaluada a las 24h.
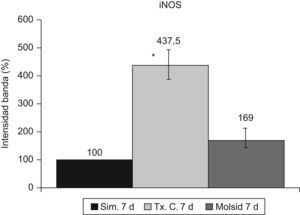
La expresión de la iNOS objetivó un incremento (p<0,001) en el grupo trasplante-control respecto al grupo simulado y al grupo molsidomina (fig. 9).
Interacción leucocito-endotelio
La ICAM-1 aumentó (p<0,01) en el grupo trasplante-control (158,4%) con respecto al grupo simulado y al grupo molsidomina (117,8%). La sICAM-1 experimentó un incremento (p<0,001) en el grupo trasplante-control (198,2%) con respecto al grupo molsidomina (43%), que descendió (p<0,01) por debajo de los valores del grupo simulado.
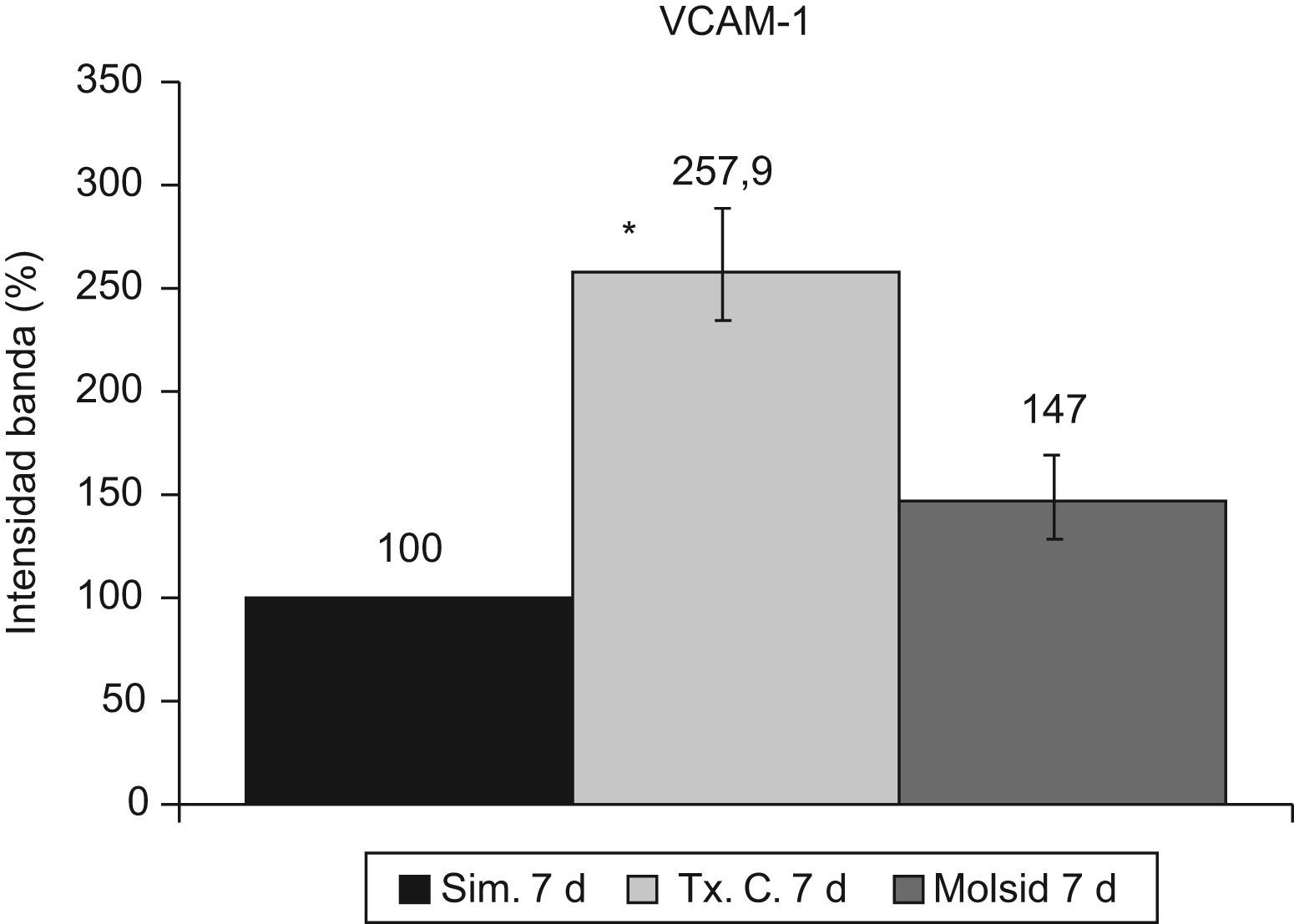
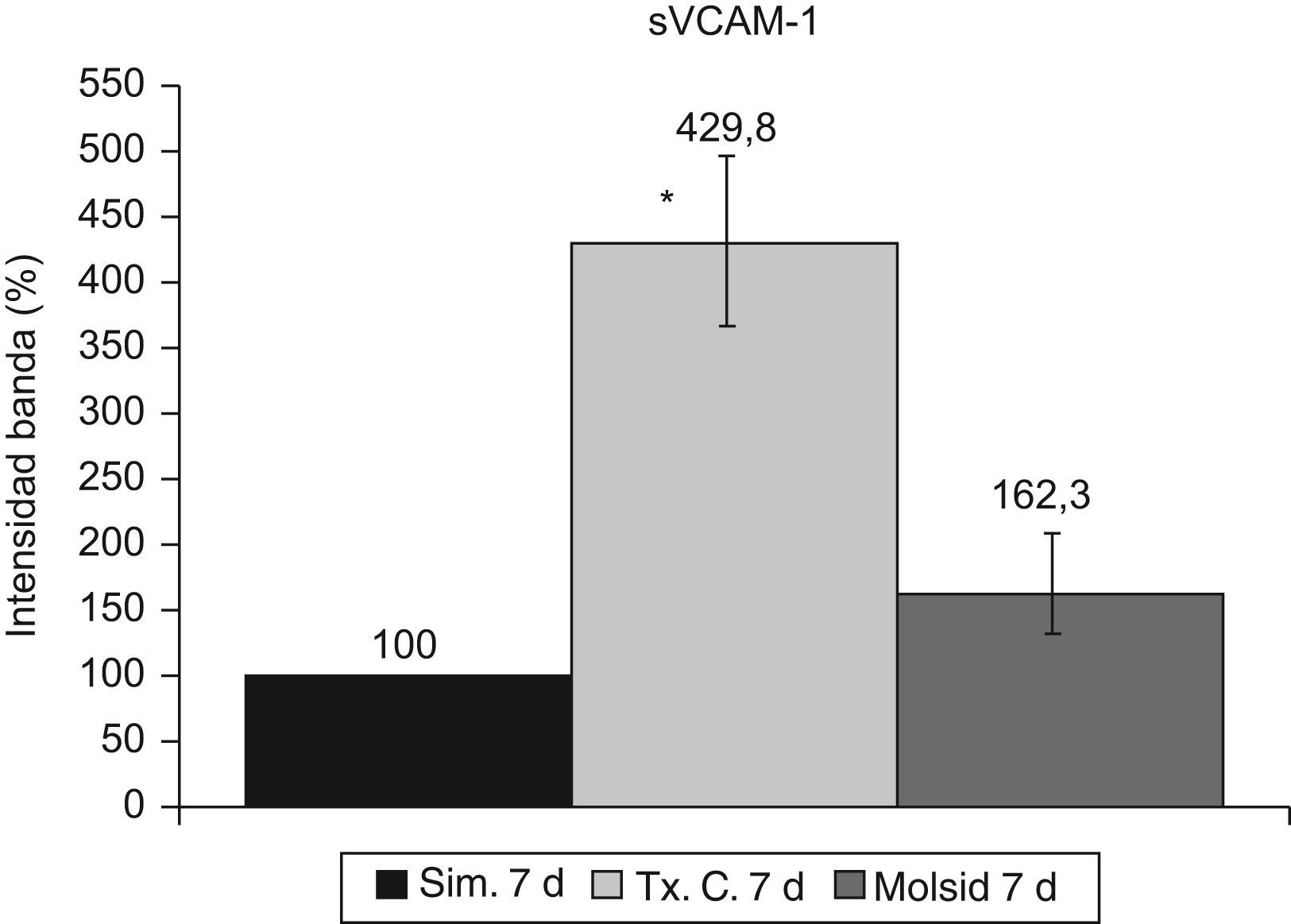
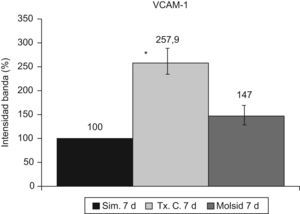
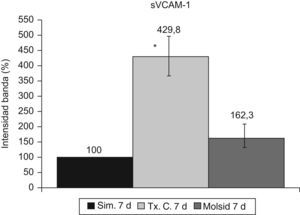
La VCAM-1 aumentó (p<0,05) en el grupo trasplante-control con respecto al grupo simulado y al grupo molsidomina (fig. 10). Igual comportamiento tuvo la sVCAM-1 (fig. 11).
Regulación transcripcional
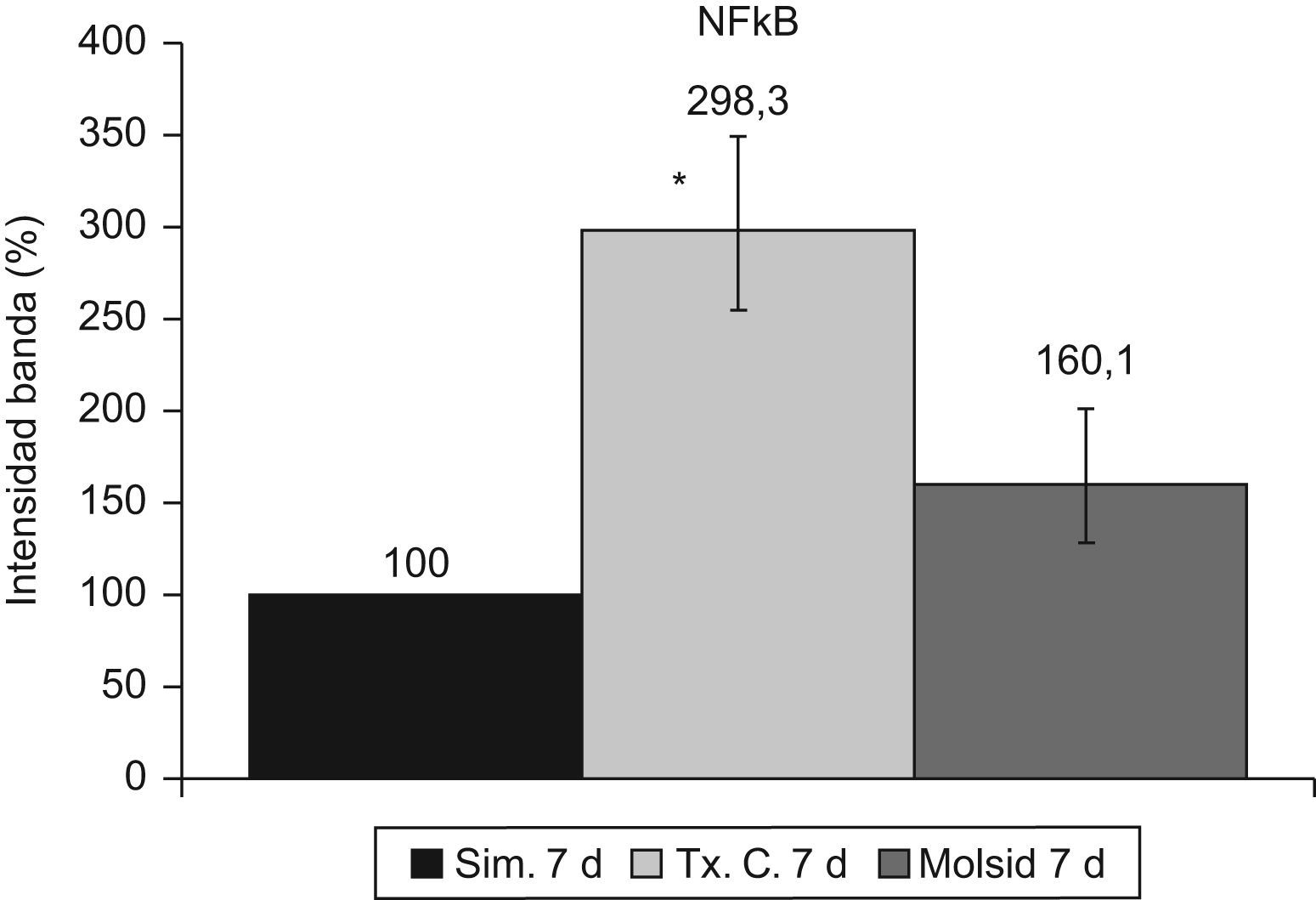
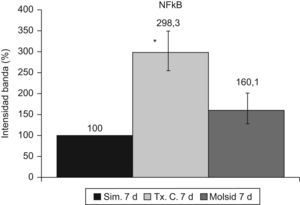
La activación de κB se mantuvo incrementada (p<0,001) en el grupo trasplante-control a los 7 días posreperfusión. El grupo molsidomina no experimentó cambios con respecto al grupo simulado (fig. 12).
DiscusiónEl diseño experimental desarrollado plantea estudiar la respuesta inflamatoria, sus consecuencias en el trasplante de órganos y su control profiláctico con donadores de NO.
La función renal demuestra la agresividad de los modelos aplicados y un mantenimiento de ésta en los animales tratados. Este mantenimiento podría deberse a la síntesis de sustancias vasodilatadoras y el bloqueo de las vasoconstrictoras, mediante una disminución del efecto de contracción mesangial inducida por los RLO, una disminución de la producción de NO por la enzima renal iNOS, junto con la síntesis de NO por la enzima cNOS, esencial en la conservación de la función renal11–13.
El estado oxidativo demuestra un fuerte incremento de la actividad enzimática del sistema defensivo en los controles que se corrobora con la elevación del ASO14–16; las causas de la disminución de radicales libres del oxígeno (RLO) en los grupos tratados podrían ser la inhibición por el NO exógeno de la NADPH-oxidasa17 y la xantinooxidasa, la reacción del NO con el ASO, la disminución de la activación e infiltración neutrofílica por bloqueo de los RLO con NO, la menor producción de TNF-α y de otros mediadores de la respuesta inflamatoria6,8 y el control de la transcripción nuclear, como veremos más adelante.
El incremento de la infiltración neutrofílica en los grupos control y su relación directamente proporcional con el daño ocasionado en la inflamación ha sido ampliamente demostrado18–20. La significativa disminución de la actividad de la MPO detectada en los grupos tratados con los donadores de NO6,8 nos revela la modulación en la activación leucocitaria e interacción leucocito-endotelio. Bath et al21 demuestran in vitro cómo el NO exógeno puede disminuir la quimiotaxis, resultado coincidente con nuestra menor infiltración en los grupos tratados. Los RLO, entre otros mediadores, son responsables de incrementar la llegada al foco de las células inflamatorias, de la activación de los leucocitos polinucleares neutrófilos y de la expresión de las CAMs por parte del endotelio y de los leucocitos, iniciándose de este modo la infiltración; estos aspectos son claves para la migración.
Las citocinas proinflamatorias inducen la expresión de CAMs; el TNF-α estimula la adhesividad neutrofílica y la activación del factor transcripcional κB. Por estos motivos sospechamos que un posible mecanismo de acción en el efecto beneficioso del NO podría ser la regulación de la producción de citocinas. Los resultados evidencian un incremento de las citocinas proinflamatorias (TNF-α e IL-1β) en los grupos control que disminuye de forma significativa al ser tratados. Los mecanismos implicados podrían deberse a una disminución de la activación neutrofílica: el TNF-α liberado por neutrófilos induciría la liberación de RLO por parte de otros neutrófilos, quienes, a su vez, aumentarían el daño, entre otras, en las células endoteliales, favoreciéndose así el fenómeno de migración leucocitaria. El descenso del TNF-α bloquearía este proceso de activación autocrina y conduciría a una menor activación del NFκB y, por tanto, menor expresión de CAMs; esto último conllevaría una disminución en la infiltración neutrofílica. El NFκB, también está implicado en la síntesis de citocinas proinflamatorias; por tanto, al disminuir los RLO (menor infiltración neutrofílica), en mayor o menor medida con los diferentes tratamientos empleados, disminuye el ambiente oxidativo intracelular que favorece la activación del NFκB y, de esta manera, la producción de estas citocinas6,8,22.
Tanto la citocina antinflamatoria IL-6 como la IL-10 en los grupos tratados con NO presentan un importante incremento, y, por tanto, un mayor control de la respuesta inflamatoria, ya que son citocinas inmunomoduladoras que juegan un importante papel en la supresión de la respuesta inflamatoria23,24. Se ha demostrado que la administración de IL-10 disminuye el daño renal por I/R25, y el tratamiento con anti-IL-10 lo exacerba. En trabajos in vitro las incubaciones con molsidomina aumentan la actividad de las citocinas antiinflamatorias26.
El NO es uno de los más importantes mediadores de la respuesta inflamatoria; su producción aumenta de forma significativa en los grupos trasplante-control, debido a la activación de la iNOS, dependiente de la producción de RLO, la liberación de citocinas proinflamatorias, la activación de NFκB, etc., ocasionando, como resultado final, una mayor lesión inflamatoria. Los niveles altos de NO producidos por la iNOs se han implicado en el daño renal asociado con la reperfusión. Varias investigaciones in vivo e in vitro han demostrado que la inhibición de la expresión y de la actividad de la iNOs puede prevenir la lesión renal mediada por NO27.
La expresión de eNOs y de iNOs puede ocurrir simultáneamente tras la reperfusión, y los efectos beneficiosos que ejerce a nivel local la actividad de la eNOS sobre la vascularización renal no serían contrarrestados por el perjudicial efecto citotóxico que ejerce la iNOS desde la infiltración macrofágica.
Hemos hallado una disminución significativa de la expresión de las CAMs estudiadas en los animales tratados, que puede deberse a diferentes factores; en principio, la regulación de la propia respuesta inflamatoria con la disminución en la producción de citocinas proinflamatorias28, pero no podemos olvidar la posible modulación de la activación de proteínas transcripcionales como NFκB.
La disminución de la expresión de las moléculas de adhesión celular estudiadas determinarán una menor interacción leucocito-endotelio y, consecuentemente, una menor infiltración neutrofílica, fenómeno directamente relacionado con el daño posreperfusión.
La menor activación e infiltración neutrofílica29,30 conducirá a una menor producción de RLO causantes de lesión tisular. Éstos, a su vez, son mediadores inflamatorios capaces de activar factores transcripcionales como κB, causante de la producción de diferentes citocinas proinflamatorias responsables del incremento de la expresión de CAMs31,32 y, además, en el caso del TNF-α, del incremento en la producción de RLO. Todo ello redundará en una menor lesión tisular, con un mantenimiento de la función del órgano y, consecuentemente, un efecto protector en el síndrome de la respuesta inflamatoria por I/R, que podría ser la clave del efecto beneficioso del tratamiento con el donador de NO en el trasplante renal.
La administración de los donadores de NO tiene efectos protectores sobre la función renal e inhibe la respuesta inflamatoria inducida por la I/R renal en el trasplante renal. Estos efectos parecen estar mediados por el menor estrés oxidativo, la disminución de citocinas proinflamatorias con un aumento de los sistemas de autocontrol inflamatorio, la menor interacción leucocito-endotelio y, consecuentemente, una menor infiltración neutrofílica y daño endotelial33–37.
Estos datos sugieren la posibilidad de utilizar un donador de NO para trasplante renal con el objetivo de preservar la función del injerto y hacer disminuir la incidencia de fallo del injerto postrasplante.
AgradecimientosTrabajo financiado por: Investigación y Desarrollo de Lacer S.A., Ministerio de Ciencia y Tecnología (SAF2007-63893), Instituto Carlos III de Investigación Sanitaria (RedinRen, 206/0016), Junta de Castilla y León (SA001/C05) y Fundación Renal Íñigo Álvarez de Toledo.