Analizamos la eficacia y la eficiencia en términos de mantenimiento de los niveles previos de hemoglobina (Hb) y de equivalencia de dosis del tratamiento mensual con CERA (Mircera®) subcutánea en pacientes en hemodiálisis (HD) en comparación con el tratamiento previo con eritropoyetina subcutánea semanal.
MetodologíaEstudio prospectivo de 6 meses en el que incluimos 30 pacientes en HD con dosis estable de eritropoyetina subcutánea durante los 3 meses previos, sustituida por una dosis subcutánea mensual equivalente de CERA según la ficha técnica. Se realizaron mediciones mensuales de Hb, ferritina y saturación de transferrina (IST) ajustando la dosis de CERA para mantener la Hb entre 11 y 13 g/dl.
ResultadosDe los 30 pacientes que iniciaron el estudio, 13 salieron por exitus, trasplante o proceso que pudiera interferir con la cifra de Hb. De los 17 pacientes que completaron los 6 meses de estudio, 12 (70,6%) presentaron niveles estables de Hb con variaciones menores de ± 1g/dl. Los niveles medios de Hb, ferritina e IST también se mantuvieron estables y sin diferencias entre el periodo basal y a los 6 meses (Hb 11,6 ± 0,6 vs 11,5 ± 0,9g/dl). No obstante, precisaron un aumento de la dosis media de CERA de 160,3 ± 40,6 en el período basal a 200,0 ± 95,2μg/mes a los 6 meses (ns). El cambio medio de dosis fue un incremento del 27,9 ± 5,9%. El coste mensual medio por paciente pasó de 174,3 ± 85,4 € (EPO) a 290,1 ± 69,0 € (CERA basal) y finalmente a 361,6 ± 169,3 € (CERA 6 meses).
ConclusiónLa sustitución de eritropoyetina subcutánea por CERA subcutánea consiguió mantener la Hb dentro de las cifras basales pero a costa de un aumento de la dosis y del coste, aunque lo escaso de nuestra muestra nos impide alcanzar la significación estadística.
To analyze the effectiveness and efficiency of monthly treatment with subcutaneous CERA (Mircera®) in terms of maintaining previous levels of hemoglobin (Hb) and dose equivalence in patients on hemodialysis (HD) compared with previous treatment with weekly subcutaneous erythropoietin.
MethodologyWe conducted a 6-month prospective study that included 30 HD patients with a stable dose of subcutaneous erythropoietin for the previous 3 months, replaced by an equivalent dose of monthly subcutaneous CERA administered according to the official data sheet. Hb, ferritin and the transferrin saturation index (TSI) were measured monthly and the dose of CERA was adjusted to maintain Hb between 11 and 13g/dl.
ResultsOf the 30 patients who began the study, 13 were withdrawn because of death, transplantation or a process that might interfere with the Hb level. Of the 17 patients who completed the 6-month study, 12 (70.6%) had stable Hb levels with minor variations of ± 1g/dl. Mean levels of Hb, ferritin and TSI also remained stable and no differences were found between levels at baseline and 6 months later (Hb 11.6±0.6 vs. 11.5±0.9g/dl). However, an increase in the average dose of CERA was required from 160.3±40.6 at baseline to 200.0±95.2mg/month after 6 months (ns). The mean change in dose was an increment of 27.9±5.9%. The average monthly cost per patient increased from 174.3±85.4€ (erythropoietin) to 290.1±69.0€ (baseline CERA) and finally to 361.6±169.3€ (6-month CERA).
ConclusionReplacement of subcutaneous erythropoietin by subcutaneous CERA maintained Hb within baseline levels but with an increased dose and cost. However, because of the small sample size, our results were not statistically significant.
La anemia se asocia con frecuencia a la insuficiencia renal crónica (IRC)1 y contribuye a una mayor morbimortalidad2,3 y a una disminución de la calidad de vida4.
La introducción de los agentes estimuladores de la eritropoyesis (AEE) en la década de los 80 supuso una mejoría espectacular en el manejo de la anemia de los pacientes con IRC y un aumento en la calidad de vida y en la supervivencia2. Desde entonces han aparecido varios AEE que han sido eficaces en la corrección de la anemia asociada a IRC. El primero de ellos fue la eritropoyetina recombinante humana (eritropoyetina alfa y beta)5, a finales de los 90 se introdujo la darbepoetina alfa6 y recientemente se ha introducido la eritropoyetina delta y biosimilares de eritropoyetina alfa, como la eritropoyetina zeta7.
A pesar de ello, muchos pacientes tienen dificultades en alcanzar y mantener niveles de hemoglobina (Hb) óptimos2. Las guías para el control de la anemia en pacientes con IRC, K/DOQI y European Renal Best Practice (ERBP), recomiendan niveles objetivo de Hb por encima de 11g/dl en todos los pacientes, con un rango objetivo entre 11 y 12g/dl, y desaconsejan cifras de Hb por encima de 13g/dl8-12.
Por otra parte, los niveles de Hb fluctúan en cortos períodos de tiempo, de forma que muchos pacientes que alcanzan la Hb objetivo no se mantienen dentro del rango durante períodos de tiempo prolongados13,14.
Recientemente se ha desarrollado una nueva molécula eritropoyética, un activador continuo del receptor de la eritropoyetina (CERA), con un mecanismo de acción diferente que permite la corrección de la anemia y la estabilidad de la Hb en intervalos de administración prolongados. CERA tiene un mayor peso molecular, el doble que el de la eritropoyetina15, y presenta propiedades farmacocinéticas diferentes y características de unión al receptor únicas, distintas de las de eritropoyetina y darbepoetina, actuando de forma distinta a nivel del receptor con una vida media más larga (130h aproximadamente) y un menor aclaramiento16.
Presentamos los resultados de un estudio cuyo objetivo fue evaluar la eficacia respecto a la estabilidad de los niveles de Hb y la equivalencia de dosis del tratamiento mensual con CERA (Mircera®) subcutánea en pacientes en hemodiálisis (HD), en comparación con el tratamiento previo con eritropoyetina subcutánea de 1 a 3 veces por semana.
Pacientes y métodosDiseñoEstudio prospectivo de 6 meses de duración.
Población a estudioPacientes seleccionados de la unidad de HD del hospital Virgen de los Lirios de Alcoy.
Criterios de selecciónPacientes > 18 años, permanencia en HD > 6 meses, Kt/V ≥ 1,2, tratamiento previo con eritropoyetina alfa o beta administrada vía subcutánea de 1 a 3 veces por semana con dosis estable durante 3 meses, niveles de Hb basal (media de Hb mensual de los 3 meses previos) entre 10,5-13g/dl y parámetros férricos adecuados: ferritina sérica ≥100 ng/ml y saturación de transferrina (IST) ≥ 20%.
Criterios de exclusiónTransfusiones, cirugía mayor en los 3 meses previos, intervenciones sobre el acceso vascular en los 3 meses previos, tensión arterial no controlada (≥ 160/100mmHg), enfermedades hematológicas sistémicas, enfermedades inflamatorias sintomáticas o infecciones no controladas. Durante el estudio, fueron retirados del mismo los pacientes que presentaron procesos clínicos que influyeran en los valores de Hb.
IntervenciónAl inicio del estudio, la eritropoyetina fue sustituida por una dosis subcutánea mensual equivalente de CERA. La dosis inicial se calculó adaptando las recomendaciones de la ficha técnica. Dosis semanal previa de eritropoyetina subcutánea < 2.000 UI = 75μg, 2.000-5.000 UI = 100μg, 5.000-8.000 UI = 150μg, 8.000-16.000 UI = 200μg y > 16.000 UI = 250μg de CERA subcutánea una vez al mes. La dosis de CERA se ajusta en función de los resultados para mantener la Hb entre 11 y 13g/dl, siempre con una única administración subcutánea mensual. Cuando la Hb se mantenía en el rango, no se modificaba la dosis; cuando la Hb era > 13g/dl y ≤ 14g/dl, se reducía la dosis un 25%; si la Hb era > 14g/dl, se suspendía la administración de dicho mes. Si la Hb era ≥ 9g/dl y < 11g/dl se aumentaba la dosis un 25%; si era < 9g/dl se aumentaba un 50%. Mircera® fue suministrada por Roche Ltd. y se administró en jeringas precargadas de 0,3ml de 50, 75, 100, 150, 200 y 250μg. Todos los pacientes recibían una dosis semanal de 100mg de hierro sacarosa (Venofer®) para mantener un rango de ferritina entre 100 y 500 ng/ml e IST ≥ 20%. Cuando la analítica mostraba niveles de ferritina > 400 ng/ml con IST > 20%, se suspendía la administración de hierro hasta que en la siguiente determinación volvieran a niveles inferiores.
VariablesAl inicio del estudio se recogen variables demográficas y de comorbilidad (sexo, edad, tiempo en diálisis, tipo de acceso vascular, presencia de HTA, diabetes, dislipidemia y otros factores de riesgo vascular como cardiopatía isquémica, arteriopatía periférica o enfermedad cerebrovascular). Durante 6 meses, se realizaron mediciones mensuales de Hb, IST y ferritina. De forma mensual también, se recogieron las dosis de CERA empleadas.
Análisis estadísticoLos datos se expresan como media±DE. Las variables fueron analizadas mediante t de Student para datos no pareados (muestra total) y pareados (pacientes que finalizaron el estudio) en los valores cuantitativos con distribución normal (Hb y ferritina), y mediante test de Mann Whitney (muestra total) y test de Wilcoxon (pacientes que finalizaron el estudio), en los que presentaban una distribución asimétrica (ferritina y dosis de CERA). Asumimos p < 0,05 como rango de significación estadística.
ResultadosLos 30 pacientes seleccionados eran 19 varones y 11 mujeres de edad media 71,7±13,8 años y permanencia en diálisis de 50,2±41,9 meses. De los 30 pacientes que iniciaron el estudio solo 17 (56,7%) completaron los 6 meses de seguimiento. Dos pacientes abandonaron el estudio debido a incumplimiento del protocolo, 2 salieron por trasplante renal, 2 fallecieron por causas vasculares, en 3 se realizaron intervenciones sobre el acceso vascular (trombectomías, angioplastias o recambios de permcath), 3 presentaron infecciones (bacteriemia por gramnegativos, síndrome febril y sepsis en relación con absceso hepático) y en una paciente se realizó una histerectomía.
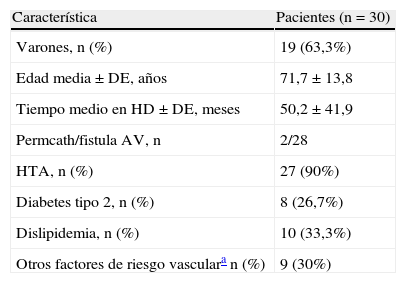
En la tabla 1 se muestran los datos demográficos y la comorbilidad basal de los pacientes. Un 90% de pacientes (27 de 30) eran hipertensos aunque con tensión arterial controlada, 8 pacientes (26,7%) tenían diabetes tipo 2 y 10 (33,3%) hiperlipidemia. Nueve pacientes (30%) presentaban otros factores de riesgo vascular solos o combinados (cardiopatía isquémica, arteriopatía periférica o enfermedad cerebrovascular).
Datos demográficos y comorbilidad basal de los pacientes
| Característica | Pacientes (n=30) |
| Varones, n (%) | 19 (63,3%) |
| Edad media±DE, años | 71,7±13,8 |
| Tiempo medio en HD±DE, meses | 50,2±41,9 |
| Permcath/fistula AV, n | 2/28 |
| HTA, n (%) | 27 (90%) |
| Diabetes tipo 2, n (%) | 8 (26,7%) |
| Dislipidemia, n (%) | 10 (33,3%) |
| Otros factores de riesgo vasculara n (%) | 9 (30%) |
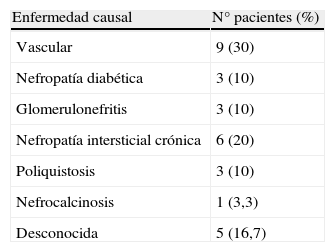
Respecto a la etiología de la IRC los datos se expresan en la tabla 2.
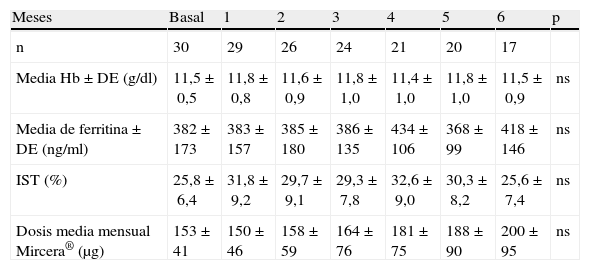
De los 30 pacientes, 26 (86,7%) recibían tratamiento con eritropoyetina beta y 4 (13,3%) con eritropoyetina alfa. La dosis previa programada de eritropoyetina semanal al inicio del estudio (administrada vía subcutánea de 1 a 3 veces/semana) fue de < 8.000 UI en 20 pacientes (66,7%) y entre 8.000-16.000 UI en 10 (33,3%). Ningún paciente recibía > 16.000 UI de eritropoyetina semanal. En la tabla 3 se muestran las medias mensuales de Hb, ferritina, IST y dosis media mensual de CERA. No se objetivó en ningún paciente Hb < 9g/dl y solo hubo 2 determinaciones de Hb > 14g/dl (Hb = 14,1g/dl en 2 pacientes). Durante todo el estudio se mantuvieron niveles medios estables de Hb entre 11,4-11,8g/dl, así como de ferritina superiores a 100 ng/ml. Solo hubo un registro de ferritina < 100 ng/ml durante el estudio. La dosis media previa de epoetina fue de 97,5±60,0 UI/kg/sem y se sustituyó por una dosis media mensual de CERA de 153,3±41μg que pasó a 200±95μg a los 6 meses (ns). Aunque se precisó un aumento del 30% de la dosis inicial de CERA, las diferencias no alcanzaron significación estadística.
Media mensual de Hb, ferritina, IST y dosis media mensual de CERA (todos los pacientes incluidos en el estudio)
| Meses | Basal | 1 | 2 | 3 | 4 | 5 | 6 | p |
| n | 30 | 29 | 26 | 24 | 21 | 20 | 17 | |
| Media Hb±DE (g/dl) | 11,5±0,5 | 11,8±0,8 | 11,6±0,9 | 11,8±1,0 | 11,4±1,0 | 11,8±1,0 | 11,5±0,9 | ns |
| Media de ferritina±DE (ng/ml) | 382±173 | 383±157 | 385±180 | 386±135 | 434±106 | 368±99 | 418±146 | ns |
| IST (%) | 25,8±6,4 | 31,8±9,2 | 29,7±9,1 | 29,3±7,8 | 32,6±9,0 | 30,3±8,2 | 25,6±7,4 | ns |
| Dosis media mensual Mircera® (μg) | 153±41 | 150±46 | 158±59 | 164±76 | 181±75 | 188±90 | 200±95 | ns |
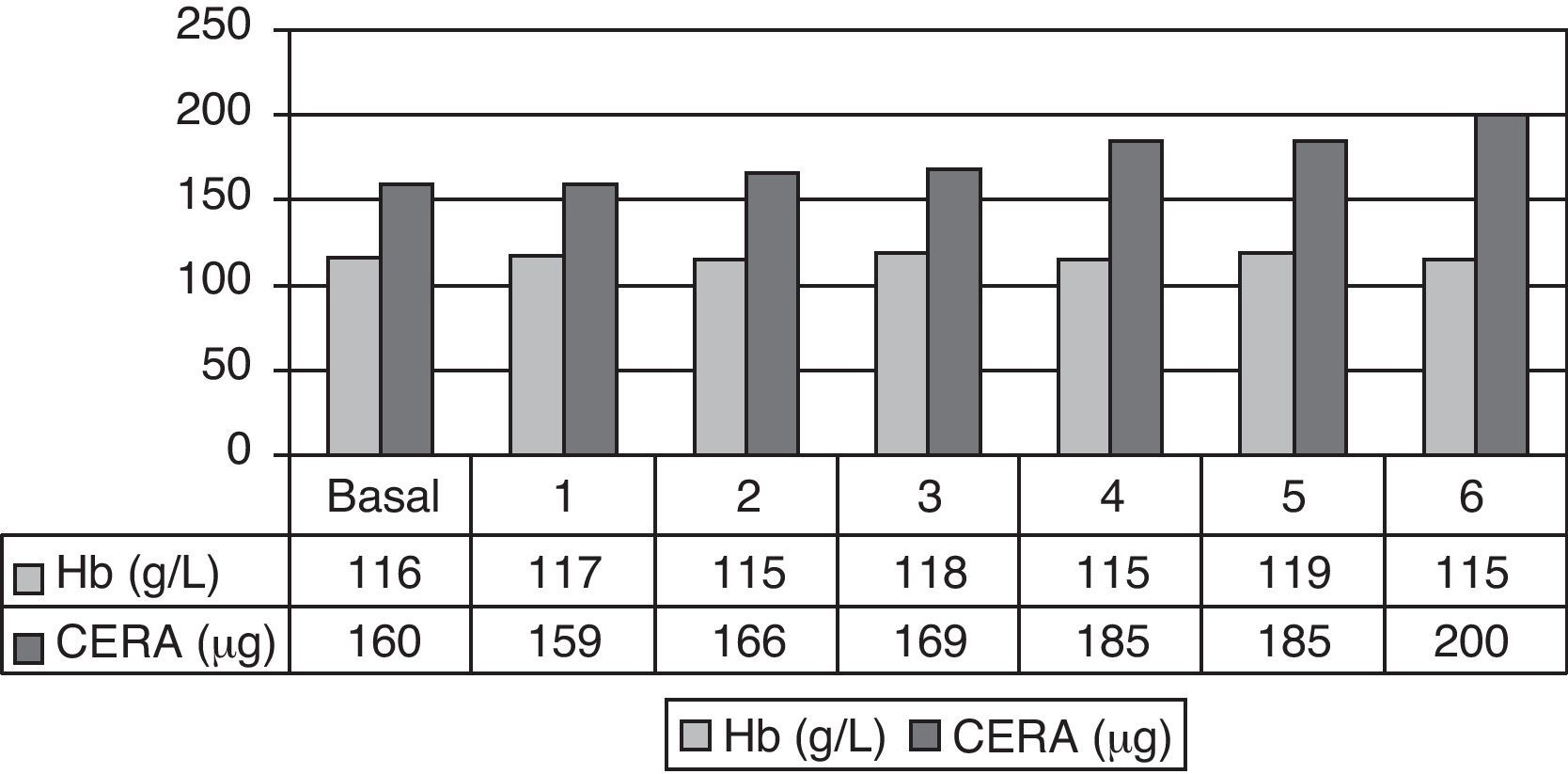
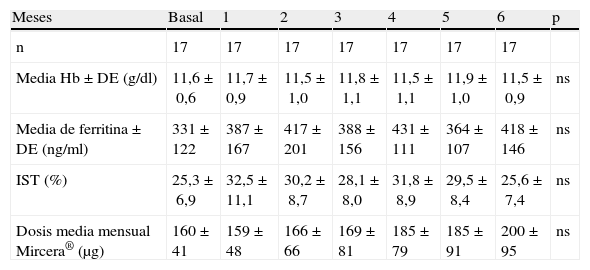
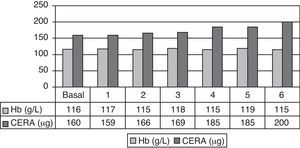
De los 17 pacientes que completaron los 6 meses de estudio, 12 (70,6%) presentaron niveles estables de Hb con variaciones menores a ±1g/dl. Los 5 pacientes restantes (29,4%) presentaron una variación mayor de ±1g/dl. De ellos, 2 (11,8%) tuvieron un descenso y 3 (17,6%) un ascenso de Hb superior a 1gr/dl. En la tabla 4 se muestran las medias mensuales de Hb, ferritina, IST y dosis media mensual de CERA. En el mes 6 de tratamiento con CERA, el rango de Hb fue 10,4-14,1g/dl, estando fuera de rango 5 pacientes (29,4%). De ellos, 3 con Hb entre 10-11g/dl y 2 con Hb > 13g/dl. Se precisó un aumento de la dosis media de CERA desde 160,3±41μg/mes en el período basal hasta 200±95μg/mes a los 6 meses (ns) (fig. 1). Diez pacientes (58,8%) requirieron aumento de dosis, en 3 (17,6%) se redujo la dosis y en 4 (23,5%) se mantuvo la dosis inicial. El cambio medio de dosis fue un incremento del 27,9±5,9%.
Media mensual de Hb, ferritina, IST y dosis media mensual de CERA (17 pacientes que completaron los 6 meses de estudio)
| Meses | Basal | 1 | 2 | 3 | 4 | 5 | 6 | p |
| n | 17 | 17 | 17 | 17 | 17 | 17 | 17 | |
| Media Hb±DE (g/dl) | 11,6±0,6 | 11,7±0,9 | 11,5±1,0 | 11,8±1,1 | 11,5±1,1 | 11,9±1,0 | 11,5±0,9 | ns |
| Media de ferritina±DE (ng/ml) | 331±122 | 387±167 | 417±201 | 388±156 | 431±111 | 364±107 | 418±146 | ns |
| IST (%) | 25,3±6,9 | 32,5±11,1 | 30,2±8,7 | 28,1±8,0 | 31,8±8,9 | 29,5±8,4 | 25,6±7,4 | ns |
| Dosis media mensual Mircera® (μg) | 160±41 | 159±48 | 166±66 | 169±81 | 185±79 | 185±91 | 200±95 | ns |
De los 30 pacientes, el porcentaje que recibía hierro parenteral al inicio del estudio fue del 46,7% (14 de 30). Si analizamos los 17 pacientes que finalizaron el estudio, 9 (52,9%) recibían hierro en el período basal y solo 4 (23,5%) recibían hierro a los 6 meses (p < 0,05). Por tanto, el porcentaje de pacientes en tratamiento con hierro se redujo a la mitad (46,7 vs 23,5%).
El coste mensual medio por paciente pasó de 174,3±85,4€ (EPO) a 290,1±69,0€ (CERA basal) y finalmente a 361,6±169,3€ (CERA 6 meses).
En todos los casos, CERA fue bien tolerado y no se objetivó ningún efecto adverso achacable al tratamiento. Los eventos clínicos observados durante el estudio se relacionaron con la comorbilidad preexistente y fueron los esperados en este grupo de pacientes.
DiscusiónEl uso de los AEE de forma habitual en la IRC permite mantener un elevado porcentaje de pacientes con niveles de Hb dentro de los rangos que marcan las guías8–12, aunque en muchas ocasiones a expensas de una elevada variabilidad de la Hb y de un porcentaje de pacientes con Hb fuera de rango por defecto o por exceso, con la mayor morbimortalidad que ello conlleva17.
Los nuevos AEE aportan una vida media más larga y mayor estabilidad de la Hb con menos ajustes de dosis en intervalos de administración prolongados18. Hay varios estudios que han mostrado la eficacia de CERA para mantener la estabilidad de la Hb en intervalos de administración prolongados tanto en HD19–21 como en pacientes con insuficiencia renal no en diálisis22,23. En HD, el estudio PROTOS19 mostró la eficacia de CERA en administración subcutánea mensual para mantener la estabilidad de la Hb en pacientes previamente tratados con eritropoyetina subcutánea. Otros estudios en HD pusieron de manifiesto la eficacia de CERA en administración intravenosa en pacientes previamente tratados con darbepoetina intravenosa20 o eritropoyetina intravenosa21. Por otro lado, la darbepoetina alfa también ha sido eficaz para mantener los niveles de Hb en intervalos de administración prolongados tanto en prediálisis como en pacientes en HD y diálisis peritoneal24–26.
En nuestra muestra, CERA fue eficaz en mantener los niveles de Hb en intervalos de administración prolongados en pacientes previamente tratados con eritropoyetina. Se seleccionó un grupo de pacientes en HD que recibían tratamiento con eritropoyetina subcutánea de 1 a 3 veces/semana y se convirtieron a una dosis equivalente de CERA administrada vía subcutánea una vez al mes. Tras un seguimiento mensual durante 6 meses, los niveles medios de Hb se mantuvieron estables entre 11,4-11,8g/dl. Si analizamos por separado los pacientes que llegaron al final del estudio (17/30), el nivel medio de Hb también se mantuvo estable entre 11,5 y 11,9g/dl. Los niveles de ferritina e IST también se mantuvieron estables tanto en el total de la muestra como en los 17 pacientes que llegaron al final del estudio, y no hubo diferencias entre el período basal y a los 6 meses respecto a los niveles medios de Hb, ferritina e IST. De estos 17 pacientes, 12 (70,6%) tuvieron una variabilidad de la Hb menor de 1g/dl y al final del estudió 1/3 de pacientes presentó Hb fuera de rango.
Al inicio del estudio, aproximadamente la mitad de los pacientes recibían hierro parenteral y, al final, este porcentaje se redujo a la mitad, ya que, a pesar del mayor requerimiento de dosis de CERA, los niveles de ferritina y saturación fueron adecuados.
La dosis de CERA aumentó un 30% respecto a la dosis inicial, tanto en el total de pacientes como en los 17 pacientes que llegaron al final del estudio, aunque sin diferencias significativas. Sulowicz et al.19 describen también un aumento de dosis de CERA subcutánea de 120μg/mes en el período basal a 150μg/mes en el período de evaluación que se mantienen hasta el final del estudio.
El coste mensual medio por paciente también se incrementó, prácticamente se duplicó. No obstante, este oscilaría según los ajustes de precios, que pueden ser diferentes en cada hospital.
En general, hubo una relación directa entre las dosis de eritropoyetina previas y las dosis de CERA final, de forma que los pacientes que tenían dosis altas de eritropoyetina precisaron dosis más altas de CERA y más aumentos de dosis para mantener las cifras de Hb dentro del rango. Sin embargo, no hubo diferencias significativas por tratarse de una muestra pequeña. A este respecto, hay que tener en cuenta que, según las tablas de conversión recomendadas en la ficha técnica de (Mircera®), para un rango amplio de dosis de EPO semanal previa, correspondería la misma dosis de CERA mensual, con la consiguiente variabilidad en la respuesta y requerimiento final de dosis que esto puede suponer. Nosotros calculamos la dosis inicial de CERA adaptando las recomendaciones de la ficha técnica.
Respecto a las características basales y de comorbilidad de nuestros pacientes, estas fueron las habituales de los pacientes en diálisis, con alta prevalencia de comorbilidad previa. Los 2 éxitus se debieron a causas vasculares en pacientes con varios factores de riesgo previos. Uno de ellos presentó isquemia arterial aguda en EEII que no sería atribuible a CERA ya que era un paciente que presentaba riesgo vascular elevado (HTA, diabetes de larga evolución, vasculopatía periférica, edad) y las cifras de Hb fueron inferiores a 12g/dl durante el estudio. Los pacientes con problemas de acceso vascular presentaban niveles de Hb dentro del rango.
La eficacia de CERA en mantener la estabilidad de los niveles de Hb se debe a las propiedades farmacológicas únicas respecto a su interacción con el receptor de la eritropoyetina16,27,28, que permiten mantener los niveles de Hb dentro del rango en intervalos de administración prolongados.
Las diferencias farmacocinéticas y farmacodinámicas de los distintos AEE hacen que cada uno de ellos requiera intervalos de administración diferentes. Macdougall et al.28 objetivan una vida media de eliminación más larga de CERA (130h aproximadamente tras administración subcutánea o intravenosa) comparado con eritropoyetina alfa y beta (7-9h en administración intravenosa y 19-24h en administración subcutánea) y darbepoetina (25h tras administración intravenosa y 49h tras la inyección subcutánea)5,6.
Por otro lado, los AEE se administran generalmente por vía intravenosa en las unidades de HD, aunque dependiendo del tipo de AEE, la vía subcutánea proporcionaría la misma eficacia con menos requerimientos de dosis. En nuestra unidad de HD, tanto la eritropoyetina como la darbepoetina se administran vía subcutánea. Este hecho se justifica por la mayor vida media de estos AEE tras administración subcutánea respecto a la intravenosa (hasta 3 veces mayor la eritropoyetina y el doble la darbepoetina)5,6. Como hemos comentado anteriormente, en el caso de CERA, dadas las distintas características farmacológicas que presenta, la vida media tras administración intravenosa y subcutánea es superponible (134 y 139h respectivamente)28 y considerablemente más larga que la de eritropoyetina y darbepoetina. Por tanto, no habría diferencias de eficacia en función de la vía de administración para una misma dosis de CERA.
Nuestros resultados son similares a los de otros trabajos en los que los pacientes se convierten de eritropoyetina o darbepoetina semanal o quincenal a CERA mensual tanto subcutánea18,19 como intravenosa20,21 y muestran que CERA es eficaz, vía subcutánea, en mantener los niveles de Hb dentro de los rangos establecidos. Nosotros utilizamos esta vía para que la extrapolación de los resultados fuese más sencilla, dado que el resto de AEE en nuestra unidad de HD se administran vía subcutánea.
El uso de CERA permitiría intervalos de administración prolongados, con el consecuente ahorro del número de inyecciones y descarga de trabajo en las unidades de HD19, con la misma eficacia en administración intravenosa y más estabilidad de la Hb con menos ajustes de dosis. CERA también ofrecería ventajas en los pacientes prediálisis o en diálisis peritoneal en los que la administración es vía subcutánea, por el propio paciente o su entorno, y en los que la administración en períodos prolongados supondría una ventaja. No obstante, hay que tener en cuenta que un AEE de vida media prolongada también dificultaría los cambios rápidos de posología cuando estos son necesarios, sobre todo en los casos de exceso de Hb.
Somos conscientes de que nuestro trabajo está realizado sobre una muestra pequeña de pacientes, el seguimiento es corto y no hay grupo control. No obstante, en la literatura hay varios estudios sobre el uso de CERA en HD, tanto en administración intravenosa20,21 como subcutánea18,19, o en prediálisis22,23, que coinciden, como en nuestro estudio, en que CERA mantiene la estabilidad de la Hb en intervalos de administración prolongados.
No obstante, habría que reflexionar sobre el sentido de la utilización de un AEE que, por un lado, ofrece estabilidad de la Hb con menos ajustes de dosis y en intervalos de administración prolongados, misma eficacia independientemente de la vía de administración y potencial ventaja en pacientes ambulatorios (prediálisis y en diálisis peritoneal) en los que el espaciamiento de las dosis podría suponer una mayor autonomía, pero, por otro, un AEE de vida media prolongada podría suponer un inconveniente por los cambios lentos, sobre todo en los casos de exceso de Hb. Además, en nuestro trabajo, para una misma eficacia, dentro de los objetivos de Hb que marcan las guías, precisamos un aumento de dosis de CERA respecto a la basal, con el consiguiente incremento del coste, aunque este dependerá finalmente de los precios de cada hospital.
Otros trabajos como el de Cuesta et al.29, muestran una eficacia similar de epoetina alfa y darbepoetina alfa en pacientes en HD con un coste mayor asociado a esta última29, aunque, según nuestros resultados, CERA tendría un coste superior a estos. No obstante, la relación coste-eficacia es una circunstancia que puede variar con el tiempo, por lo que las conclusiones de los estudios comparativos de costes dependerán de los precios del mercado30. Por ello, los resultados a este respecto deberían interpretarse en cada contexto30.
Así, en nuestra experiencia, la sustitución de eritropoyetina subcutánea por CERA subcutánea consigue mantener la Hb dentro de cifras basales con escasa variabilidad y ausencia de complicaciones pero a costa de un aumento de la dosis y del coste, aunque este puede ser variable. También se mantienen estables los parámetros férricos y hay un consumo menor de hierro. Quizás, en trabajos posteriores, con un mayor número de pacientes, un grupo control que permita comparar los resultados y un período de seguimiento más prolongado, se obtengan resultados más concluyentes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.