El hierro administrado en anemia y enfermedad renal crónica (ERC) se estima en 500-600mg/mes. La determinación de la cinética del hierro (CH), índice de saturación de transferrina (IST) y ferritina son necesarios.
ObjetivoEvaluar el apego a las guías de uso de hierro en anemia y ERC en hemodiálisis (HD).
MétodosUn total de 117 pacientes con ERC, HD y suplementación de hierro: grupo A, 2 sesiones de HD; grupo B, 3 sesiones de HD. Se determinó CH, IST, ferritina, Hb, reticulocitos y PFH.
ResultadosHombres (58%), edad 37+16 DE; Hb: 11,9mg/dl y reticulocitos: 0,9%. Dosis de hierro: 200mg/semana/3 años. Grupo A: IST 100%; grupo B: 90%. Ambos IST mayor, transferrina grupo A: 122mg/dl; grupo B: 137mg/dl. PFH normales.
ConclusionesEl hierro no se calculaba, vigilaba ni supervisaba a mediano plazo. Y no resulta apegado a lineamientos recomendados.
Iron administered in anemia and chronic kidney disease (CKD) an estimated 500-600mg/month, the determination of iron kinetics (CH), transferrin saturation index (IST) and ferritin are necessary.
ObjetiveEvaluate adherence to guidelines for use of iron in anemia and CKD in hemodialysis (HD).
MethodsA total of 117 patients with CKD, HD and iron supplementation: Group A, 2 HD session, Group B 3 sessions HD. CH, IST, ferritin, Hb, reticulocyte and PFH were determined.
ResultsMen: 58%, age 37+16 SD, Hb 118°c/dl and reticulocyte 0,9%. Doses of 200mg/week/3 iron years. Group A: IST 100%; Group B: 90%. Both greater IST, transferrin group to 122mg/dl; group B 137mg/dl. Normal PFH.
ConclusionIron not be calculated, monitored or supervised in the medium term. And not attached to recommended guidelines.
La anemia es un hallazgo en la enfermedad renal crónica (ERC) en más del 90% de los pacientes en programa sustitutivo, que afecta a distintos órganos y sistemas: sistema cardiovascular, función cognitiva y sistema endocrino1.
La aplicación de hierro parenteral es una de las estrategias recomendadas por la NKF-DOQI en el 2007 y las guías SLAHN del 2009 para el tratamiento de la anemia asociada a la ERC2,3.
Los objetivos principales son: alcanzar y mantener Hb de 11mg/dl y que los indicadores de la determinación de la cinética del hierro (CH) deban ser interpretados conjuntamente con el valor de la Hb y la dosis del AEE. En pacientes anémicos (Hb < 11g/dl) en hemodiálisis (HD), los valores adecuados a alcanzar y mantener son: ferritina sérica entre 200-500μg/l, IST entre 30-40%3,4.
La CH ha sido mejor caracterizada en la población en HD, evidenciándose que estos pacientes requieren valores de ferritina e IST más elevados, especialmente cuando están recibiendo AEE5–7.
En los pacientes con ERC la homeostasis del hierro se encuentra alterada por la inadecuada absorción del hierro de la dieta, por pérdidas digestivas aumentadas, por HD (1 a 3g/año) y por el incremento en la demanda debido al uso de AEE o al bloqueo del sistema retículo-endotelial para liberar el Fe necesario3,8,9.
La anemia se debe a la deficiencia de eritropoyetina y otras como: deficiencia de hierro, ácido fólico y vitamina B12, pérdidas sanguíneas, hiperparatiroidismo y hemólisis10,11.
Generalmente, la anemia se presenta cuando el aclaramiento de creatinina desciende por debajo de 30ml/min o, más tempranamente, de 45ml/min en pacientes diabéticos12,13.
Las guías SLANH definen la anemia cuando el valor de la Hb es menor a 13,5g/dl en el varón y menor a 12mg/dl en la mujer, independientemente de la edad; mientras que las guías KDOQUI la definen con niveles de Hb menores a 11g/dl o hematocrito menor a 33%2,3,7.
Uno de los principales mecanismos implicados en la anemia es la eritropoyesis inadecuada y el acortamiento de la vida media del hematíe favorecido por hemólisis crónica14,15.
La deficiencia de Fe es causa de anemia por sí misma, y la primera causa de escasa respuesta al tratamiento con AEE, por lo que los 2 tipos de déficit férrico son16:
- -
Déficit absoluto de hierro: ferritina sérica < 100μg/l o IST < 20%.
- -
Déficit funcional de hierro: ferritina > 100μg/l o IST < 20%.
El déficit funcional es más frecuente en los pacientes en HD tratados con AEE y se explica por un excesivo requerimiento de Fe al estimular la eritropoyesis o por una insuficiente liberación del hierro de los depósitos hacia la transferrina circulante3,14,15.
De acuerdo a las guías SLAHN los objetivos de la suplementación de hierro son3,4:
- 1.
Balance de Fe para alcanzar y mantener una Hb de 11g/dl.
- 2.
Los valores de CH deben ser interpretados con el valor de la Hb y la dosis del AEE, si se está administrando.
- 3.
En pacientes con Hb < 11g/dl, en estadios 3 a 4 (clasificación NKF-DOQI) o en diálisis peritoneal, los niveles mínimos de indicadores férricos deben ser:
- -
Ferritina sérica = 100μg/l
- -
IST=20%
- 4.
En pacientes anémicos (Hb < 11g/dl) en HD crónica, los valores a alcanzar y mantener son:
- -
Ferritina sérica: 200-500μg/l
- -
IST: entre 30 y 40%
- 1.
En los primeros meses de reposición férrica parenteral, la dosis es de 25 y 300mg por semana, adecuándola de acuerdo a la situación clínica, y la dosis de mantenimiento es de 25 a 200mg por mes3,17.
El IST no debe ser superior a 50% y la ferritina sérica no mayor de 800μg/l, con el fin de evitar la toxicidad por Fe16,18.
De acuerdo a las guías SLANH, en pacientes con Hb en rango recomendado, que no reciben AEE, con ferritina = 100μg/l e IST > 20% se debe realizar control de CH cada 6 meses, en fase de corrección, mientras no se obtenga la Hb deseada. La CH debe realizarse cada 1-3 meses si reciben hierro intravenoso. Una vez logrado el nivel de Hb recomendado, el IST y la ferritina sérica podrán medirse cada 3-6 meses3,19,20.
Las guías SLANH recomiendan que el rango de Hb en tratamiento con AEE debe ser entre 10,5 y 12g/dl en cualquier etapa de la enfermedad para obtener beneficios del propio tratamiento3,21,22.
El tratamiento con AEE se indica cuando la concentración de Hb sea menor a 10g/dl en forma persistente. La dosis inicial depende de la gravedad, del número de transfusiones recibidas, del tipo de AEE y de la vía de administración. La dosis de mantenimiento debe ajustarse según la evolución clínica y paraclínica23.
En la fase de corrección, la dosis se ajusta para aumentar la Hb entre 1 y 2g/dl por mes; si el aumento de la Hb es menor a 1g/dl, se incrementa un 25% y si el aumento de Hb es superior a 2g/dl por mes, se disminuye entre 25 y 50%, o se suspende transitoriamente3,17,23.
Durante el tratamiento con AEE en pacientes portadores de ERC, pueden presentarse eventos adversos. El más frecuente e importante es el aumento de la presión arterial3,24.
ObjetivoEvaluar el apego a las guías actuales del uso del hierro parenteral en el tratamiento de anemia en pacientes con ERC en HD.
Material y métodosEstudio observacional, descriptivo. Durante 2012-2013 se incluyó a 117 pacientes con ERC en tratamiento sustitutivo de HD, que cumplieron con los criterios de inclusión. Se excluyó a 17 pacientes: aquellos con reacción alérgica al hierro, pacientes con diagnóstico reciente de ERC, pacientes trasplantados, defunciones, aquellos que cambiaron de tratamiento sustitutivo y por seguimiento incompleto.
Se dividieron en 2 grupos: grupo A: 2 sesiones de HD; grupo B: 3 sesiones de HD. Se determinaron variables sociodemográficas (edad y género), así como el tiempo de padecimiento de la enfermedad, tiempo de tratamiento con HD, tiempo de uso de hierro dextrán y la dosis utilizada.
Para la determinación de la CH se evaluó el IST, el cual en pacientes con ERC en esta modalidad de tratamiento se debe considerar entre 30 y 40%. Se determinó el grado de anemia con relación a la cifra de Hb reportada en la biometría hemática, considerada con cifras menores de 13,5mg/dl en el hombre y 12mg/dl en la mujer(guías SLAHN 2009) y la cuantificación de reticulocitos para evaluación de necesidad de administración de hierro. La determinación de toxicidad hepática fue a través de registro de PFH (ALT, AST).
El proyecto Efecto de la administración no calculada de hierro parenteral en pacientes en hemodiálisis y anemia asociada a enfermedad renal crónica fue enviado para su revisión al Comité Local de Investigación 1006, autorizado con el folio R -20121006-8.
ResultadosDel total de pacientes registrados (n=146) se incluyeron 117 expedientes que cumplieron los criterios de inclusión. Del total (n=117), el 58% (n=67) fueron del género masculino y el 42% del género femenino (n=50) con una media de edad de 37±16 DE.
Los pacientes presentaron un tiempo de evolución de la enfermedad con una media de 4±2 DE, y un tiempo en HD con una media de 3±2 DE mientras que el tiempo del uso de hierro fue con una media de 3±1 DE.
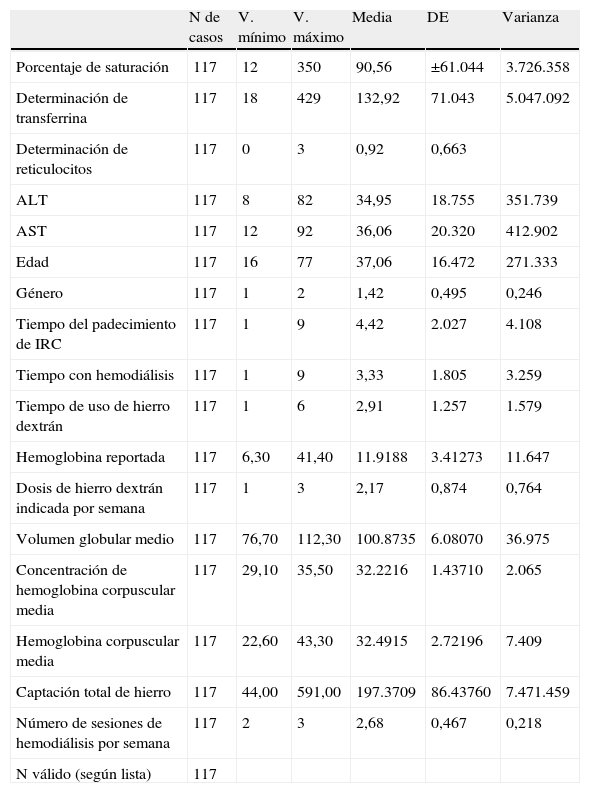
La dosis de hierro utilizada durante la HD por semana en el grupo A fue de 200mg/dl±50 DE de media y en el grupo B de 200mg/dl±80 DE de media (tabla 1).
| N de casos | V. mínimo | V. máximo | Media | DE | Varianza | |
| Porcentaje de saturación | 117 | 12 | 350 | 90,56 | ±61.044 | 3.726.358 |
| Determinación de transferrina | 117 | 18 | 429 | 132,92 | 71.043 | 5.047.092 |
| Determinación de reticulocitos | 117 | 0 | 3 | 0,92 | 0,663 | |
| ALT | 117 | 8 | 82 | 34,95 | 18.755 | 351.739 |
| AST | 117 | 12 | 92 | 36,06 | 20.320 | 412.902 |
| Edad | 117 | 16 | 77 | 37,06 | 16.472 | 271.333 |
| Género | 117 | 1 | 2 | 1,42 | 0,495 | 0,246 |
| Tiempo del padecimiento de IRC | 117 | 1 | 9 | 4,42 | 2.027 | 4.108 |
| Tiempo con hemodiálisis | 117 | 1 | 9 | 3,33 | 1.805 | 3.259 |
| Tiempo de uso de hierro dextrán | 117 | 1 | 6 | 2,91 | 1.257 | 1.579 |
| Hemoglobina reportada | 117 | 6,30 | 41,40 | 11.9188 | 3.41273 | 11.647 |
| Dosis de hierro dextrán indicada por semana | 117 | 1 | 3 | 2,17 | 0,874 | 0,764 |
| Volumen globular medio | 117 | 76,70 | 112,30 | 100.8735 | 6.08070 | 36.975 |
| Concentración de hemoglobina corpuscular media | 117 | 29,10 | 35,50 | 32.2216 | 1.43710 | 2.065 |
| Hemoglobina corpuscular media | 117 | 22,60 | 43,30 | 32.4915 | 2.72196 | 7.409 |
| Captación total de hierro | 117 | 44,00 | 591,00 | 197.3709 | 86.43760 | 7.471.459 |
| Número de sesiones de hemodiálisis por semana | 117 | 2 | 3 | 2,68 | 0,467 | 0,218 |
| N válido (según lista) | 117 |
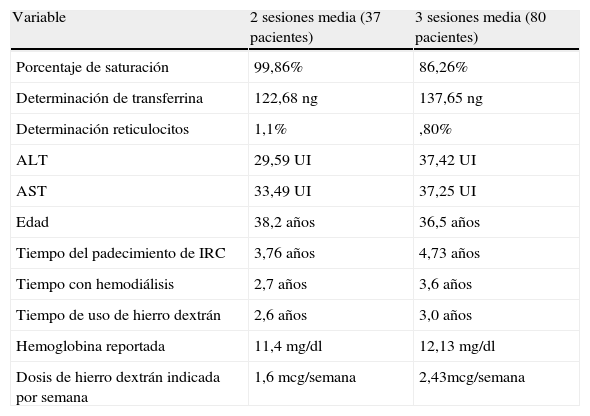
De acuerdo a la determinación de la CH en el grupo A con relación al IST se encontró un rango de 21 hasta 350% con una media de 100%±60 DE y en el grupo B se encontró un rango de 12 hasta 350% con una media de 90%±60 DE.
En el grupo A se encontró una media de Hb de 11mg/dl±2 DE mientras que el grupo B se encontró una media de Hb de 12mg/dl±4 DE. Ambos grupos con porcentaje de reticulocitos con una media de 1%±0,6 DE (tabla 2).
| Variable | 2 sesiones media (37 pacientes) | 3 sesiones media (80 pacientes) |
| Porcentaje de saturación | 99,86% | 86,26% |
| Determinación de transferrina | 122,68 ng | 137,65 ng |
| Determinación reticulocitos | 1,1% | ,80% |
| ALT | 29,59 UI | 37,42 UI |
| AST | 33,49 UI | 37,25 UI |
| Edad | 38,2 años | 36,5 años |
| Tiempo del padecimiento de IRC | 3,76 años | 4,73 años |
| Tiempo con hemodiálisis | 2,7 años | 3,6 años |
| Tiempo de uso de hierro dextrán | 2,6 años | 3,0 años |
| Hemoglobina reportada | 11,4 mg/dl | 12,13 mg/dl |
| Dosis de hierro dextrán indicada por semana | 1,6 mcg/semana | 2,43mcg/semana |
La determinación de las pruebas de funcionamiento hepático en el grupo A encontró una media de ALT de 30Ul±15 DE y una media de AST de 33Ul±17 DE. Por su parte, el grupo B tuvo una media de ALT de 37Ul±20 DE y una media de AST de 37Ul±21 DE.
DiscusiónLa asociación entre anemia y ERC fue descrita por primera vez en 1836 por Bright, y se presenta en más del 90% en pacientes en programa sustitutivo25.
De acuerdo a las guías SLANH, la anemia se establece cuando la Hb es menor a 13,5g/dl. Su causa principal es la producción insuficiente de eritropoyetina endógena, por lo que uno de los puntos fundamentales en su diagnóstico y tratamiento es la estimación de los depósitos férricos y su disponibilidad para la eritropoyesis a través de la ferrocinética3.
De acuerdo a los parámetros establecidos como diagnóstico de anemia, tenemos que todos los pacientes incluidos en el estudio requieren del uso suplementario de hierro con relación a los valores de Hb, con una media de Hb en nuestra población estudiada de 11,9mg/dl. De acuerdo al número de sesiones de HD en el grupo A, este tiene una media de 11,4mg/dl y el grupo B de 12,3mg/dl, cumpliendo uno de los objetivos principales que es llegar a una Hb de 11mg/dl en pacientes en esta modalidad de tratamiento. Las guías KDOQUI 2007, con relación a los valores óptimos de Hb que se recomiendan en un paciente con ERC, deben tener un balance férrico adecuado para alcanzar y mantener un valor de Hb de 11mg/dl21.
La ferritina sérica evalúa el hierro del depósito tisular, cuyo valor se ve influenciado por procesos inflamatorios, hepatopatías o neoplasias, mientras que el IST estima el hierro circulante unido a la transferrina. Ambos parámetros tienen limitaciones para estimar el estatus férrico, particularmente en la población con ERC, por lo que varios estudios han evaluado su sensibilidad y especificidad como indicadores de carencia férrica, concluyéndose que un IST < 20% tiene una aceptable sensibilidad (59-88%) y que no debe sobrepasar el 50% para evitar la toxicidad hepática. Esto se contrapone a los resultados, ya que en ambos grupos estudiados sobrepasa dicho porcentaje y los valores de PFH se encuentran dentro de parámetros normales, indicándonos al momento que no hay toxicidad. En nuestra población, el grupo A (n=37) tiene una media de ALT de 29,59 Ul y de AST de 33,49 UI y el grupo B (n=80) una media de ALT de 37,42 Ul y de AST de 32,25 Ul. Es importante mencionar que Restrepo et al. (Sociedad Colombiana de Nefrología) en su proyecto denominado «Eficacia y seguridad del hierro parenteral en el tratamiento de anemia ferropénica en pacientes con enfermedad renal crónica» mencionan que para que exista sobrecarga de hierro a nivel hepático y, por consiguiente, daño a este nivel, debe presentarse una ferritina sérica de más de 800mg/dl, y el IST se debe encontrar por encima del 50%.En cambio, la Sociedad Internacional de Diálisis Peritoneal muestra que la ferritina debe sobrepasar los 2.000mg/dl para llegar a producir hemocromatosis, aumentando la toxicidad potencial de este con daño celular y vascular por estrés oxidativo. La dosis media de Fe que se utiliza en nuestra población varía de acuerdo a las sesiones de HD. En el grupo A, se utiliza una dosis promedio de 1,6 mcg/semana y en el grupo B, 2,43 mcg/semana por un tiempo en promedio de 3 años.
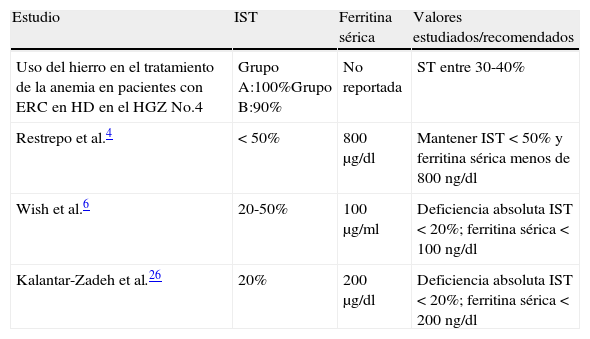
La ferrocinética ha sido mejor caracterizada en la población con HD de acuerdo a las guías KDOQUI 2007, evidenciando que estos pacientes requieren valores de ferritina e IST aún más elevados, especialmente cuando están recibiendo AEE, basados en análisis de estudios controlados y aleatorizados que muestran que es más probable mejorar los niveles de Hb con una mejor dosis de AEE si se mantiene la ferritina sérica mayor de 200μg/l y el IST entre 30 y 40%. Robinson, en su estudio realizado en el 2008, muestra que el aporte de hierro parenteral intravenoso en pacientes con HD crónica con ferritina > 500g/l se asocia a mejor control de la anemia sin efectos secundarios significativos durante el periodo de observación,comparado con el estudio prospectivo realizado en un grupo seleccionado al azar. Apoyan lo anterior realizado por Coyne et al. en el 2007 y de esta manera brindar suficiente evidencia relativa a la seguridad de aportar hierro parenteral en pacientes con ferritina elevada (tabla 3).
Tabla comparativa de valores recomendados de CH
| Estudio | IST | Ferritina sérica | Valores estudiados/recomendados |
| Uso del hierro en el tratamiento de la anemia en pacientes con ERC en HD en el HGZ No.4 | Grupo A:100%Grupo B:90% | No reportada | ST entre 30-40% |
| Restrepo et al.4 | < 50% | 800μg/dl | Mantener IST < 50% y ferritina sérica menos de 800ng/dl |
| Wish et al.6 | 20-50% | 100μg/ml | Deficiencia absoluta IST < 20%; ferritina sérica < 100ng/dl |
| Kalantar-Zadeh et al.26 | 20% | 200μg/dl | Deficiencia absoluta IST < 20%; ferritina sérica < 200ng/dl |
La revisión de Fishbane así como una reciente revisión sistemática y el metaanálisis de Rozen-Zviet al. apoyan estas recomendaciones. A partir del análisis de estudios con grupo control seleccionado al azar, 7 de los cuales involucran a pacientes en HD y 6 se refieren a población con ERC sin tratamiento sustitutivo, se concluye que el Fe parenteral es la mejor opción para la población en HD. En los primeros meses de reposición férrica, la dosis es entre 25 y 300mg de Fe por semana, adecuándola de acuerdo a la situación clínica y la dosis de mantenimiento es de 25 a 200mg por mes considerando un IST no superior a 50% y la ferritina sérica no mayor a 800μg/l. Se ha descrito que puede presentarse toxicidad por hierro con niveles de ferritina superiores a 800μg/l, asociada a depósitos tisulares y daño celular, aunque un estudio clínico observacional en el que se evaluó a más de 50.000 pacientes en HD, mostró que la mayor mortalidad observada es cuando la ferritina es superior a ese valor y se asocia a la coexistencia de un síndrome de inflamación-malnutrición de acuerdo a Kalantar-Zadeh26 en su estudio realizado en el 2005 con relación a la mortalidad de paciente en HD y el uso de hierro parenteral.
La administración de hierro en pacientes con ERC para corrección de anemia debe ser supervisada y vigilada a través de control de CH de acuerdo a las recomendaciones de las guías actuales de ERC. En nuestra población, la dosis de hierro manejada está calculada con relación a los reportes de CH, y por lo tanto no se tienen objetivos claros con relación a los niveles de Hb para evaluar la respuesta al tratamiento ni a la dosis de AEE utilizada. El reporte de PFH de manera periódica es importante para dar seguimiento y vigilancia a mediano plazo de los probables efectos colaterales de uso de hierro.
El reporte de reticulocitos normal es de 0 a 1,5% e indica que no tienen anemia arregenerativa, tipo de anemia más común en ERC. En los pacientes que están sometidos a 3 sesiones de HD indica que tienen un efecto más disminuido de los AEE, ya que el hierro no modifica los valores de estos.
En pacientes que reciben AEE en fase de corrección, mientras no se obtiene la Hb deseada, la CH debe realizarse cada 1 a 3 meses y una vez logrado, IST y la ferritina podrán medirse cada 3-6 meses.
Considerando que los pacientes sometidos a tratamiento sustitutivo de HD no tienen uremia, para la absorción de hierro a nivel intestinal pueden utilizarse presentaciones polimaltosadas, generando menor costo y mayor beneficio, evitando complicaciones hepáticas ya que el hígado es el principal depósito y destoxificador del hierro. Cabe añadir que Li Wang, en su estudio comparando la biodisponibilidad de las presentaciones parenterales y orales, demuestra que el hierro parenteral tiene mejor efecto en los niveles de Hb.
ConclusiónEl uso suplementario de hierro parenteral en pacientes con ERC en tratamiento sustitutivo de HD es frecuente.
El hierro parenteral se utiliza de forma no calculada al inicio y no vigilada ni supervisada a mediano plazo. Su uso probablemente no se apega a los lineamientos generales recomendados por las guías de tratamiento de ERC y sin embargo al momento no se demuestra efectos secundarios a nivel hepático.
Por el número de pacientes estudiados y por el diseño del estudio, podemos concluir que las dosis de hierro utilizadas en este tipo de pacientes permite una menor utilización de agentes estimulantes de eritropoyetina que son de mayor costo.
Una de las limitaciones de nuestro estudio es que no se cuenta con reporte sérico de ferritina ni control seriado de reporte de ferrocinética, como indican las guías, cada 3 o 6 meses. Se debería apartar de su utilización, y de acuerdo a los resultados en conjunto de exámenes bioquímicos complementarios como lo son la biometría hemática con cuenta de reticulocitos y PHF para vigilancia, ajustar la dosis adecuada. Por lo anterior, este estudio puede marcar la pauta para que se realice de forma sistemática el seguimiento del suplemento del hierro parenteral y que no se realice de manera empírica a una dosis no calculada y sin vigilancia, para evitar complicaciones a mediano y largo plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.