evaluar la mejora en la efectividad del cribado de trisomía 21 (T21) desde la implementación del programa y en función de las distintas estrategias empleadas.
Material y métodoshemos realizado un cribado temprano de T21 en todas las gestaciones únicas atendidas en nuestro centro desde octubre del 2003 hasta noviembre del 2009, combinando la edad materna, la medición de la translucencia nucal (TN) y la determinación de los marcadores bioquímicos de proteína plasmática A asociada al embarazo (PAPP-A) y β-gonadotropina coriónica humana libre (β-hCG). Desde octubre de 2008 se ha incorporado la medición del índice de pulsatilidad del ductus venoso (IPDV) en el cálculo del índice de riesgo. Los parámetros bioquímicos se han determinado mediante el analizador Kryptor, en una estrategia en un tiempo (determinación analítica y ecográfica el mismo día) o en dos tiempos (determinación analítica entre 2 y 4 semanas previas a la medición de la TN). El cálculo del índice de riesgo combinado de T21 se ha efectuado mediante el programa comercializado SsdwLab5-Software.
Resultadosse incluye un total de 13.132 gestaciones, con 61 casos de T21. Se describen las curvas propias de normalidad de parámetros bioquímicos y ecográficos. Desde el año 2003 se han ido incorporando diferentes estrategias a fin de mejorar la efectividad del cribado de síndrome de Down (SD), las cuales permiten observar una mejoría de la tasa de detección (TD) (84,4 frente a 100%) y una reducción de la tasa de falsos positivos (TFP) (5,8 frente a 3,6%). Asumiendo una TD del 85%, la TFP desciende significativamente del 7,6 al 1,3%.
Conclusionesnuestra experiencia refleja una efectividad mayor del cribado de SD si disponemos de curvas propias de normalidad de los parámetros bioquímicos, actualizamos periódicamente sus valores de normalidad, realizamos el cribado en una estrategia en dos tiempos e incorporamos el valor del IPDV como parámetro de primera línea en el cálculo del índice de riesgo. Sugerimos incorporar estas estrategias en el cribado estándar de T21 en centros con experiencia con el fin de reducir las pruebas invasivas innecesarias.
To evaluate the improvement in the effectiveness of trisomy 21 (T21) screening according to the different strategies employed.
Material and methodsAn early T21 screening was performed on all single pregnancies from October 2003 to November 2009, combining maternal age, the measurement of nuchal translucency (NT), and the determination of the biochemical markers, pregnancy- associated plasma protein A (PAPP-A) and free human chorionic gonadotropin (β-hCG). Measurement of the ductus venosus pulsatility index (DVPI) has been included in the assessment of the risk index since October 2008. The biochemical parameters were measured using the Kryptor analyser, in a one time (analytical determinations and ultrasound on the same day) or a two time strategy (analytical determinations between 2 and 4 weeks prior to the measurement of NT). The calculation of the combined T21 risk index was performed using the program marketed by SsdwLab5-Software.
ResultsA total of 13,132 pregnancies were included, with 61 cases of T21. Distribution curves of the biochemical and ultrasound parameters are described. Different strategies have been introduced since 2003 with the purpose of improving the effectiveness of Down's syndrome (DS) screening. These have led to an improvement in the detection rate (DR) (84.4% to 100%), and a reduction in the false positive rate (FPR) (5.8% to 3.6%). Assuming a DR of 85%, the FPR have significantly decreased from 7.6% to 1.3%.
ConclusionsThe effectiveness of SD screening improves when we use our own distribution curves of the biochemical parameters available, we periodically update their values, when we move from one to two-time screening strategy, and incorporate the DVPI as a first line parameter in the assessment of the risk index. We suggest including these strategies in the standard T21 screening policies in experienced centres in order to reduce unnecessary invasive tests.
Recientemente las guías de actuación de nuestra sociedad profesional han ampliado la recomendación de cribado de trisomía 21 (T21) a todas las gestantes, independientemente de la edad materna. El cribado recomendado incluye la medición de la translucencia nucal (TN) y la valoración de marcadores bioquímicos maternos (proteína plasmática A asociada al embarazo [PAPP-A] y β-gonadotropina coriónica humana libre [β-hCG]). En Cataluña se sigue este mismo protocolo desde enero de 2009 1. A pesar de estas recomendaciones, en la ciudad de Barcelona el 28% de gestantes se realiza amniocentesis genética, la mayoría sin indicación médica2.
La importancia de la ecografía de 11-14 semanas viene dada por las repercusiones clínicas que su resultado conlleva. La evaluación de los marcadores ecográficos durante este período gestacional permite individualizar el riesgo de cromosomopatía, malformaciones estructurales, afección sindrómica y resultado perinatal adverso, con implicaciones relevantes de seguimiento y manejo en cada caso (indicación de técnica invasiva de diagnóstico prenatal, seguimiento ecográficos y fluxométrico estricto, control de la longitud cervical, etc.). El cribado combinado temprano es el método actual más efectivo en la detección de SD3. Incluye la determinación de parámetros bioquímicos (β-hCG y PAPP-A), que se basan en técnicas de laboratorio automatizadas y estandarizadas, y la medición ecográfica de marcadores, como la TN, medición manual, dependiente del operador y con controles de calidad recientemente establecidos, ambas en un período gestacional óptimo. Diferentes características maternas, como la raza, el hábito tabáquico, la diabetes gestacional o las técnicas de reproducción asistida, modifican los resultados de los parámetros del cribado bioquímico, por lo que deben tenerse en cuenta para su cálculo4. La introducción de otros marcadores ecográficos5 (hueso nasal, ductus venoso, regurgitación tricuspídea, ángulo facial) puede mejorar los resultados del cribado, fundamentalmente con disminución de la tasa de falsos positivos (TFP), aunque precisan de un entrenamiento adecuado.
El objetivo de este artículo es describir nuestra experiencia en el cribado combinado temprano de SD, aportando nuestra casuística y resultados, así como revisar la efectividad de las diferentes estrategias implantadas durante un período de 6 años en nuestra población.
Material y métodosHemos analizado todas las ecografías realizadas en el contexto del cribado combinado temprano de SD desde octubre 2003 a noviembre 2009. Hemos incluido las gestaciones en las que se ha completado el cribado combinado, restringiendo el análisis a las ecografías con una medida de longitud craneocaudal (LCC) inferior a 85mm. El estudio ecográfico lo han realizado 8 expertos en ecografía, vía transvaginal, abdominal o combinando ambas vías, según las características de la exploración, a fin de conseguir un estudio morfológico fetal óptimo y una valoración fiable de los marcadores ecográficos de aneuploidía. Hemos incluido de forma sistemática la medición de la TN y el índice de pulsatilidad del ductus venoso (IPDV) según los criterios de la Fetal Medicine Foundation6,7. Los parámetros bioquímicos PAPP-A y β-hCG se han determinado mediante el analizador Kryptor (Brahms Diagnostica), en una estrategia en un tiempo (extracción sanguínea y medición de la TN en una sola visita) o en dos tiempos (extracción sanguínea entre 2 y 4 semanas previas a la medición de la TN). Inicialmente se implementó el cribado combinado mediante una estrategia en un tiempo, con la extracción de la sangre materna para la determinación de β-hCG y PAPP-A el mismo día de realizar la ecografía, con LCC de 35-65mm (octubre 2003-enero 2007). Desde febrero de 2007 se implementó el protocolo en dos tiempos, con extracción sanguínea entre 2 y 4 semanas antes de la medición de la TN (test sanguíneo ajustado a LCC 15-85mm, TN ajustado a LCC 45-85mm). Los marcadores bioquímicos en suero materno, expresados en múltiplos de la mediana (MoM), se han ajustado por el peso materno, etnia, el hábito tabáquico y el diagnóstico de diabetes mellitus de tipo 1. Los cálculos se han realizado mediante el software para el cribado de aneuploidías SsdwLab5 (SPB Soft 2007 S.L.), estimando el índice de riesgo (IR) de SD integrando los valores de la edad materna, los marcadores bioquímicos (curvas propias), la TN (curvas publicadas por Nicolaides8) y el IPDV (curvas propias). El estudio citogenético se recomienda cuando el IR combinado (ajustado al momento de la ecografía) es superior a 1/270. Los resultados del estudio se expresan y distribuyen en los apartados siguientes: distribución propia de valores de normalidad de los marcadores bioquímicos, distribución propia de los valores de normalidad del IPDV y la TN, comparación de la efectividad del cribado entre las estrategias en uno y dos tiempos, efectividad del cribado tras la integración del IPDV y efecto de la inclusión de nuevos factores de corrección según método de concepción. La efectividad de las diferentes estrategias de cribado (definidas como perfiles) se evalúa en términos de tasa de detección (TD) y TFP. Analizamos los perfiles de cribado siguientes: Perfil A (octubre de 2003-febrero de 2007), cribado en un tiempo con curvas de normalidad propias para los parámetros bioquímicos; Perfil B (febrero de 2007-enero de 2008), cribado en dos tiempos con curvas de normalidad propias y actualizadas para los parámetros bioquímicos, extrapolando los valores en edades gestacionales tempranas; Perfil C (febrero de 2008-octubre de 2008), cribado en dos tiempos con curvas de normalidad de parámetros bioquímicos propias en todas las semanas; Perfil D (a partir de octubre de 2008), perfil C incluida la medición del IPDV en el cálculo del IR; Perfil E (mayo de 2009), perfil D con actualización de medianas de los parámetros bioquímicos; Perfil F (julio-noviembre de 2009), perfil E añadiendo un factor de corrección en gestaciones procedentes de técnica de fecundación in vitro (FIV), según datos propios.
ResultadosSe han incluido 13.132 gestaciones únicas. Dentro de este grupo se identificaron 61 casos de T21. La edad materna media fue de 33 años (rango 15-46, 33% superior a 35 años). La edad gestacional media en el momento de la ecografía para la valoración de la TN fue de 12,2 semanas (LCC medio de 59mm, rango 34-85mm). Las estrategias que en el período de estudio se incorporaron fueron: 1. Establecer la distribución de los parámetros bioquímicos y ecográficos en nuestra población; 2. El desplazamiento de la estrategia de cribado de un tiempo a dos tiempos; 3. Incorporación del IPDV como nuevo marcador ecográfico de primera línea, incluido en el cálculo del IR de forma sistemática; 4. Incorporación de factores de corrección en las gestaciones conseguidas mediante técnicas de FIV, y 5. Comparación de la efectividad del programa de cribado según la estrategia implementada.
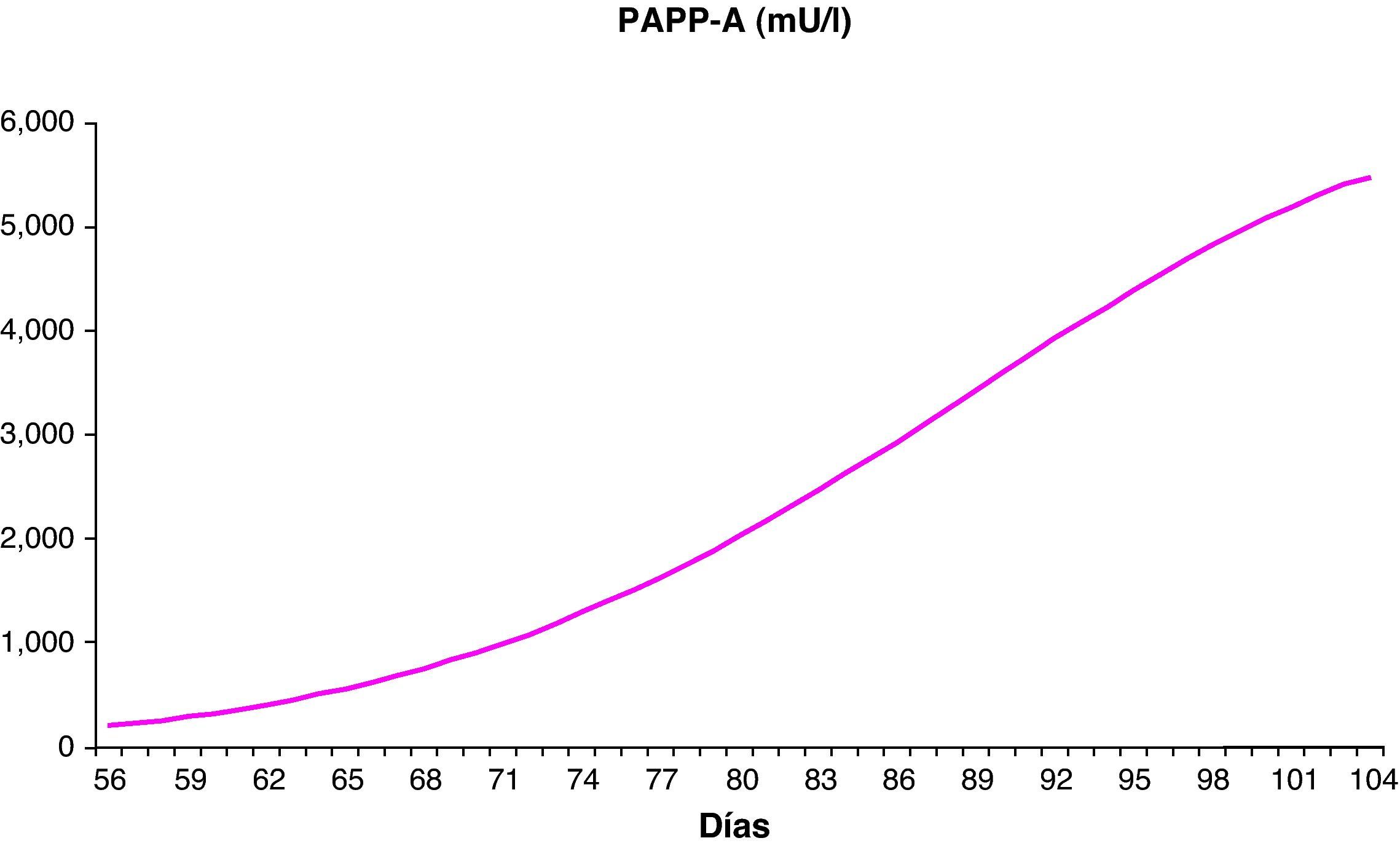
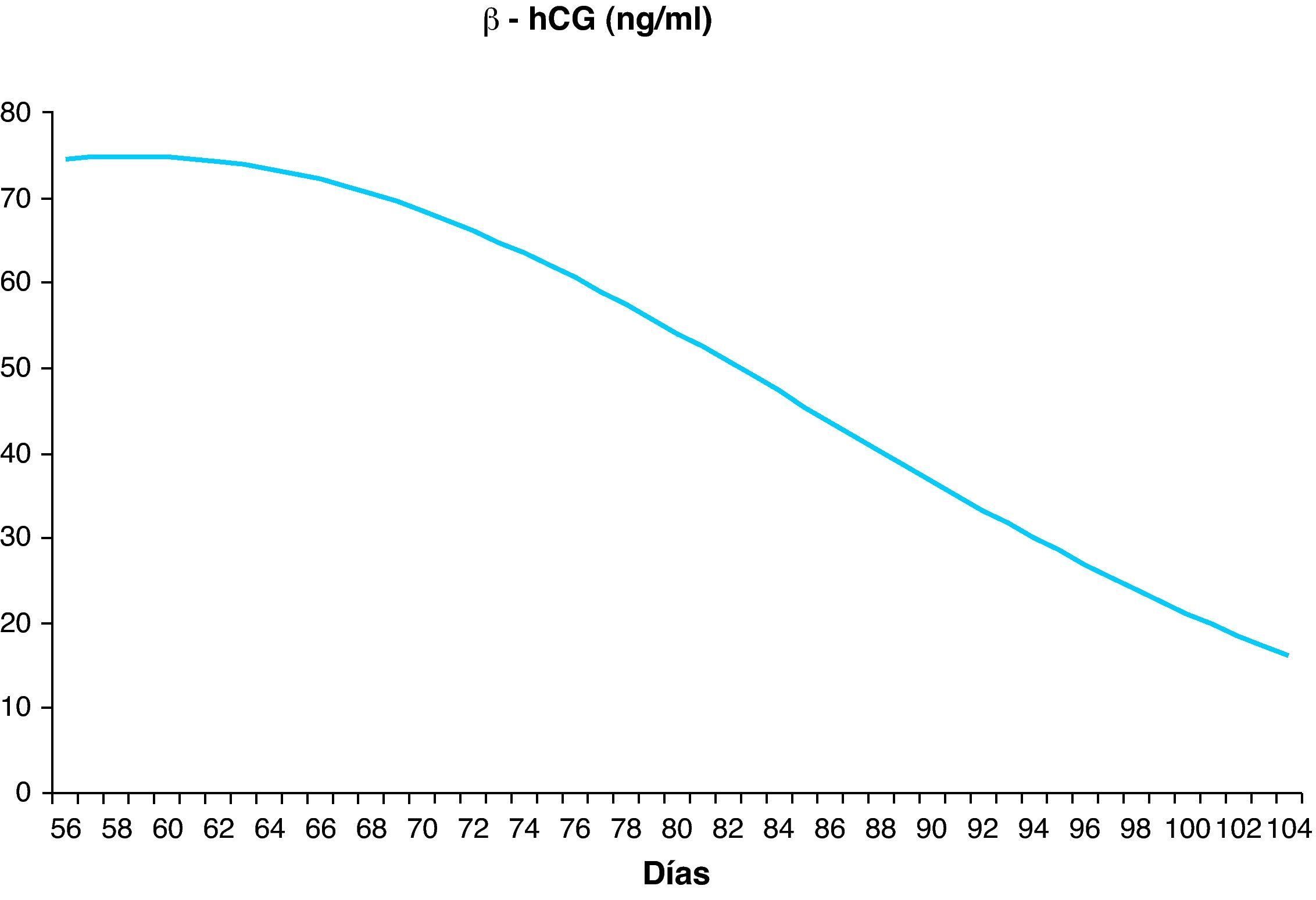
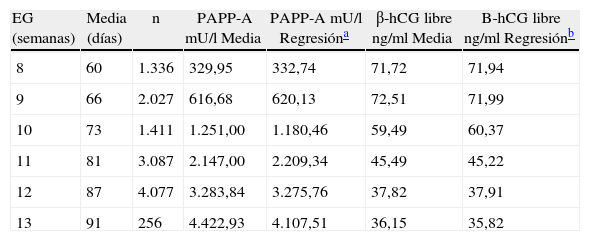
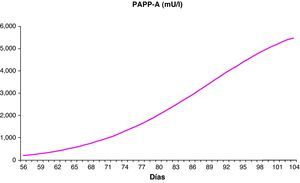
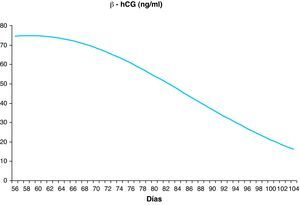
Establecer la distribución de los parámetros bioquímicos y ecográficos en nuestra poblaciónHemos establecido los valores de normalidad de los parámetros bioquímicos PAPP-A y β-hCG, excluidas las anomalías cromosómicas, entre las semanas 8 y 13, con un número de muestras entre 256 (semana 13) y 4.077 (semana 12). Estos valores se distribuyen de forma continua ajustándose a las fórmulas polinómicas descritas en la tabla 1 y siguen la distribución reflejada en las figuras 1 y 2.
Distribución de los valores de normalidad de los parámetros bioquímicos
| EG (semanas) | Media (días) | n | PAPP-A mU/l Media | PAPP-A mU/l Regresióna | β-hCG libre ng/ml Media | B-hCG libre ng/ml Regresiónb |
| 8 | 60 | 1.336 | 329,95 | 332,74 | 71,72 | 71,94 |
| 9 | 66 | 2.027 | 616,68 | 620,13 | 72,51 | 71,99 |
| 10 | 73 | 1.411 | 1.251,00 | 1.180,46 | 59,49 | 60,37 |
| 11 | 81 | 3.087 | 2.147,00 | 2.209,34 | 45,49 | 45,22 |
| 12 | 87 | 4.077 | 3.283,84 | 3.275,76 | 37,82 | 37,91 |
| 13 | 91 | 256 | 4.422,93 | 4.107,51 | 36,15 | 35,82 |
EG: edad gestacional; n: número de casos.
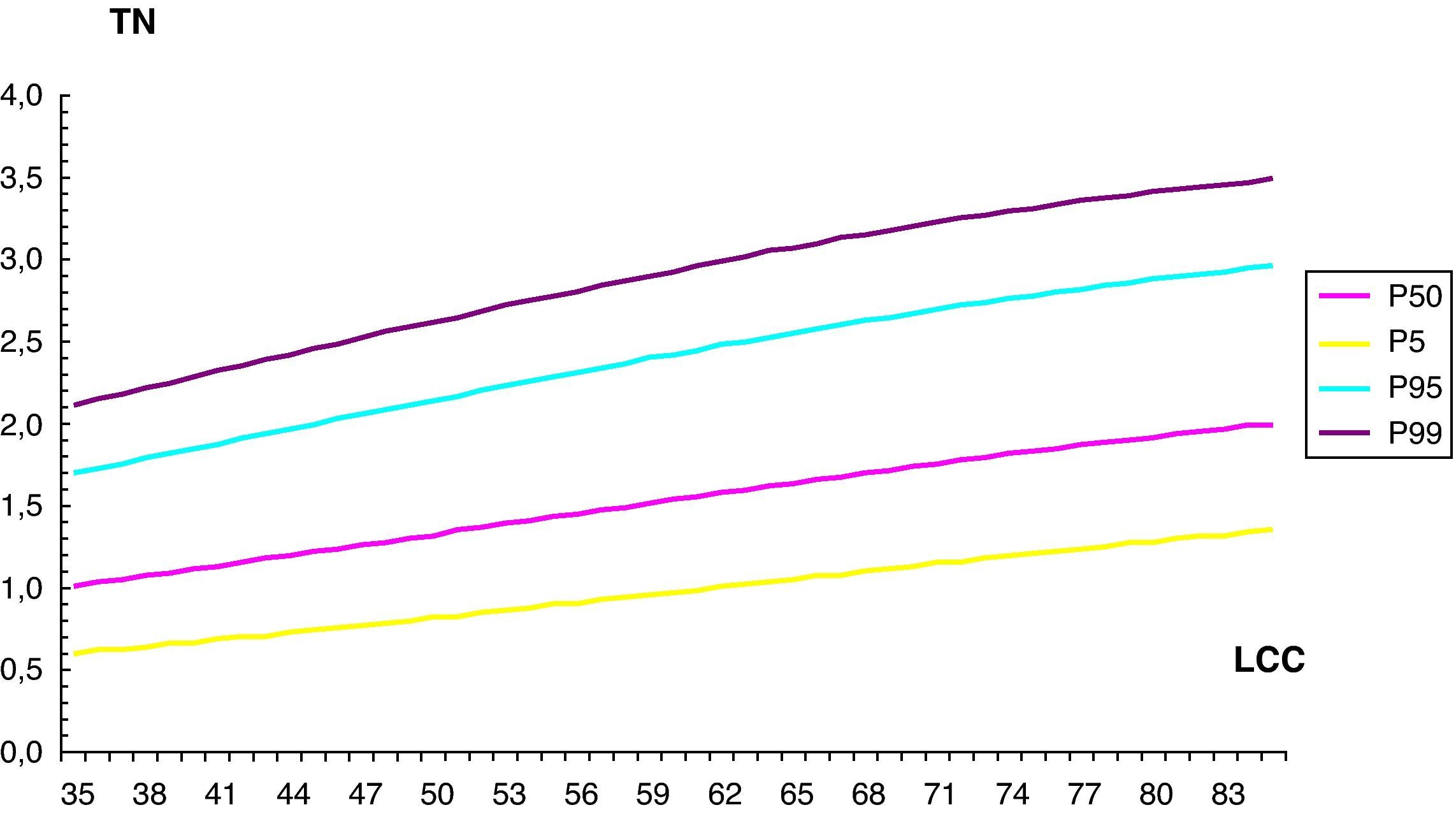
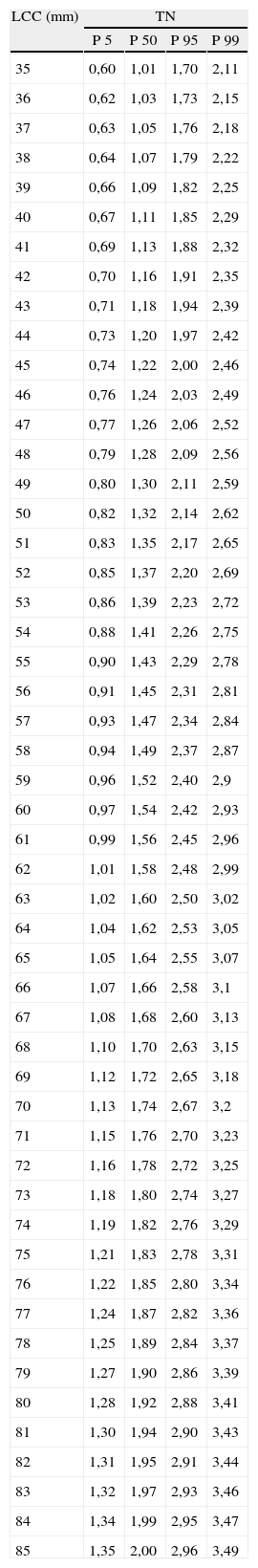
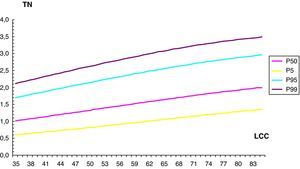
De forma similar, hemos establecido los valores de normalidad de la TN, según el modelo: Media TN=EXP (–0,360995903045+0,0123391107846×CRL –5,353051761109e×CRL 2) (tabla 2, fig. 3).
Valores de normalidad de translucencia nucal
| LCC (mm) | TN | |||
| P 5 | P 50 | P 95 | P 99 | |
| 35 | 0,60 | 1,01 | 1,70 | 2,11 |
| 36 | 0,62 | 1,03 | 1,73 | 2,15 |
| 37 | 0,63 | 1,05 | 1,76 | 2,18 |
| 38 | 0,64 | 1,07 | 1,79 | 2,22 |
| 39 | 0,66 | 1,09 | 1,82 | 2,25 |
| 40 | 0,67 | 1,11 | 1,85 | 2,29 |
| 41 | 0,69 | 1,13 | 1,88 | 2,32 |
| 42 | 0,70 | 1,16 | 1,91 | 2,35 |
| 43 | 0,71 | 1,18 | 1,94 | 2,39 |
| 44 | 0,73 | 1,20 | 1,97 | 2,42 |
| 45 | 0,74 | 1,22 | 2,00 | 2,46 |
| 46 | 0,76 | 1,24 | 2,03 | 2,49 |
| 47 | 0,77 | 1,26 | 2,06 | 2,52 |
| 48 | 0,79 | 1,28 | 2,09 | 2,56 |
| 49 | 0,80 | 1,30 | 2,11 | 2,59 |
| 50 | 0,82 | 1,32 | 2,14 | 2,62 |
| 51 | 0,83 | 1,35 | 2,17 | 2,65 |
| 52 | 0,85 | 1,37 | 2,20 | 2,69 |
| 53 | 0,86 | 1,39 | 2,23 | 2,72 |
| 54 | 0,88 | 1,41 | 2,26 | 2,75 |
| 55 | 0,90 | 1,43 | 2,29 | 2,78 |
| 56 | 0,91 | 1,45 | 2,31 | 2,81 |
| 57 | 0,93 | 1,47 | 2,34 | 2,84 |
| 58 | 0,94 | 1,49 | 2,37 | 2,87 |
| 59 | 0,96 | 1,52 | 2,40 | 2,9 |
| 60 | 0,97 | 1,54 | 2,42 | 2,93 |
| 61 | 0,99 | 1,56 | 2,45 | 2,96 |
| 62 | 1,01 | 1,58 | 2,48 | 2,99 |
| 63 | 1,02 | 1,60 | 2,50 | 3,02 |
| 64 | 1,04 | 1,62 | 2,53 | 3,05 |
| 65 | 1,05 | 1,64 | 2,55 | 3,07 |
| 66 | 1,07 | 1,66 | 2,58 | 3,1 |
| 67 | 1,08 | 1,68 | 2,60 | 3,13 |
| 68 | 1,10 | 1,70 | 2,63 | 3,15 |
| 69 | 1,12 | 1,72 | 2,65 | 3,18 |
| 70 | 1,13 | 1,74 | 2,67 | 3,2 |
| 71 | 1,15 | 1,76 | 2,70 | 3,23 |
| 72 | 1,16 | 1,78 | 2,72 | 3,25 |
| 73 | 1,18 | 1,80 | 2,74 | 3,27 |
| 74 | 1,19 | 1,82 | 2,76 | 3,29 |
| 75 | 1,21 | 1,83 | 2,78 | 3,31 |
| 76 | 1,22 | 1,85 | 2,80 | 3,34 |
| 77 | 1,24 | 1,87 | 2,82 | 3,36 |
| 78 | 1,25 | 1,89 | 2,84 | 3,37 |
| 79 | 1,27 | 1,90 | 2,86 | 3,39 |
| 80 | 1,28 | 1,92 | 2,88 | 3,41 |
| 81 | 1,30 | 1,94 | 2,90 | 3,43 |
| 82 | 1,31 | 1,95 | 2,91 | 3,44 |
| 83 | 1,32 | 1,97 | 2,93 | 3,46 |
| 84 | 1,34 | 1,99 | 2,95 | 3,47 |
| 85 | 1,35 | 2,00 | 2,96 | 3,49 |
LCC: longitud craneocaudal; P: percentil; TN: translucencia nucal.
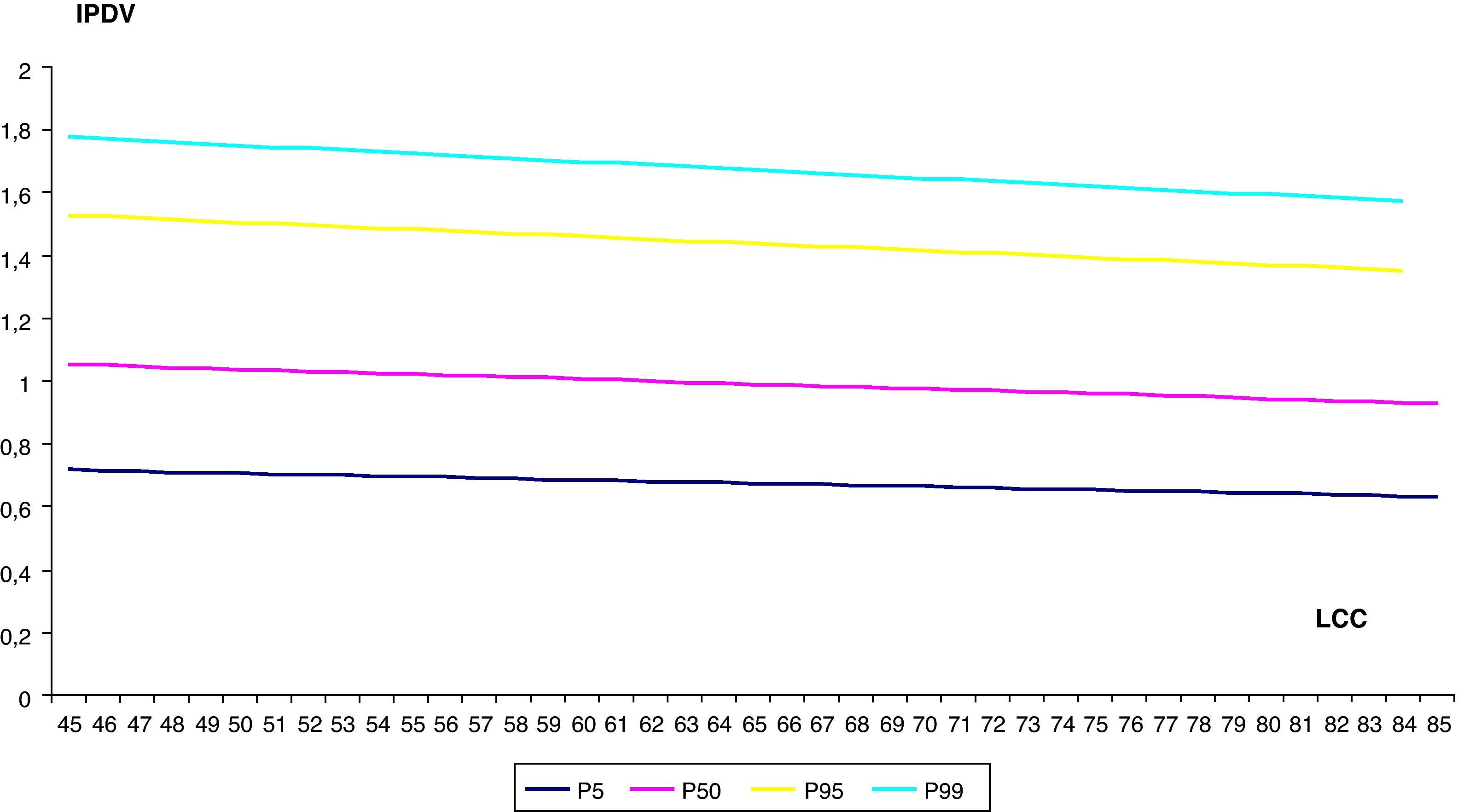
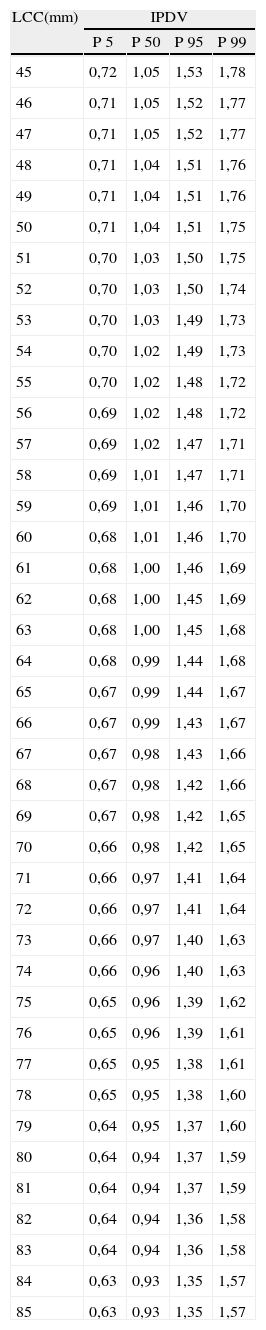
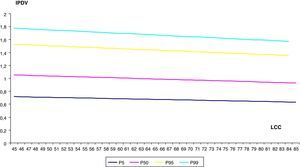
Finalmente, hemos establecido los valores de normalidad del IPDV, según el modelo: Media IPDV=EXP(–0,2277417054+0,119299157×CRL –0,0001180264×CRL 2) (tabla 3, fig. 4).
Valores de normalidad de índice de pulsatilidad de ductus venoso
| LCC(mm) | IPDV | |||
| P 5 | P 50 | P 95 | P 99 | |
| 45 | 0,72 | 1,05 | 1,53 | 1,78 |
| 46 | 0,71 | 1,05 | 1,52 | 1,77 |
| 47 | 0,71 | 1,05 | 1,52 | 1,77 |
| 48 | 0,71 | 1,04 | 1,51 | 1,76 |
| 49 | 0,71 | 1,04 | 1,51 | 1,76 |
| 50 | 0,71 | 1,04 | 1,51 | 1,75 |
| 51 | 0,70 | 1,03 | 1,50 | 1,75 |
| 52 | 0,70 | 1,03 | 1,50 | 1,74 |
| 53 | 0,70 | 1,03 | 1,49 | 1,73 |
| 54 | 0,70 | 1,02 | 1,49 | 1,73 |
| 55 | 0,70 | 1,02 | 1,48 | 1,72 |
| 56 | 0,69 | 1,02 | 1,48 | 1,72 |
| 57 | 0,69 | 1,02 | 1,47 | 1,71 |
| 58 | 0,69 | 1,01 | 1,47 | 1,71 |
| 59 | 0,69 | 1,01 | 1,46 | 1,70 |
| 60 | 0,68 | 1,01 | 1,46 | 1,70 |
| 61 | 0,68 | 1,00 | 1,46 | 1,69 |
| 62 | 0,68 | 1,00 | 1,45 | 1,69 |
| 63 | 0,68 | 1,00 | 1,45 | 1,68 |
| 64 | 0,68 | 0,99 | 1,44 | 1,68 |
| 65 | 0,67 | 0,99 | 1,44 | 1,67 |
| 66 | 0,67 | 0,99 | 1,43 | 1,67 |
| 67 | 0,67 | 0,98 | 1,43 | 1,66 |
| 68 | 0,67 | 0,98 | 1,42 | 1,66 |
| 69 | 0,67 | 0,98 | 1,42 | 1,65 |
| 70 | 0,66 | 0,98 | 1,42 | 1,65 |
| 71 | 0,66 | 0,97 | 1,41 | 1,64 |
| 72 | 0,66 | 0,97 | 1,41 | 1,64 |
| 73 | 0,66 | 0,97 | 1,40 | 1,63 |
| 74 | 0,66 | 0,96 | 1,40 | 1,63 |
| 75 | 0,65 | 0,96 | 1,39 | 1,62 |
| 76 | 0,65 | 0,96 | 1,39 | 1,61 |
| 77 | 0,65 | 0,95 | 1,38 | 1,61 |
| 78 | 0,65 | 0,95 | 1,38 | 1,60 |
| 79 | 0,64 | 0,95 | 1,37 | 1,60 |
| 80 | 0,64 | 0,94 | 1,37 | 1,59 |
| 81 | 0,64 | 0,94 | 1,37 | 1,59 |
| 82 | 0,64 | 0,94 | 1,36 | 1,58 |
| 83 | 0,64 | 0,94 | 1,36 | 1,58 |
| 84 | 0,63 | 0,93 | 1,35 | 1,57 |
| 85 | 0,63 | 0,93 | 1,35 | 1,57 |
IPDV: índice de pulsatilidad de ductus venoso; LCC: longitud craneocaudal; P: percentil.
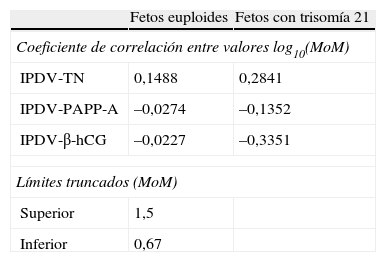
Analizamos el grado de correlación entre los marcadores considerados en el cálculo de riesgo, observando una correlación positiva entre los valores de TN e IPDV en fetos euploides, y de manera más relevante en afectados de T21 (tabla 4). En la integración de ambos marcadores en el cálculo del IR consideramos esta correlación, a fin de corregir el peso específico individual de los marcadores incluidos.
Correlación entre marcadores en fetos euploides y afectos de trisomía 21
| Fetos euploides | Fetos con trisomía 21 | |
| Coeficiente de correlación entre valores log10(MoM) | ||
| IPDV-TN | 0,1488 | 0,2841 |
| IPDV-PAPP-A | –0,0274 | –0,1352 |
| IPDV-β-hCG | –0,0227 | –0,3351 |
| Límites truncados (MoM) | ||
| Superior | 1,5 | |
| Inferior | 0,67 | |
β-hCG:β-gonadotropina coriónica humana libre; IPDV: índice de pulsatilidad de ductus venoso; log10: logaritmo en base 10; MoM: múltiplos de la mediana; PAPP-A: proteína plasmática A asociada al embarazo; TN: translucencia nucal.
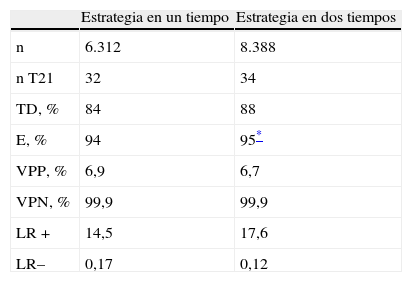
Utilizando los modelos matemáticos de simulación, comparamos la efectividad del cribado en la estrategia en uno y dos tiempos (tabla 5). La estrategia en dos tiempos, evaluando los parámetros bioquímicos y ecográficos en dos tiempos diferenciados, y cada uno de ellos en su período óptimo, muestra una mayor TD y especificidad (E). Durante el primer período de estudio, el cribado de SD se llevó a cabo con el protocolo en un tiempo, de manera que se realizaba la extracción de los parámetros bioquímicos en sangre materna el mismo día de la ecografía. Nuestra experiencia ha demostrado una efectividad mayor cuando la bioquímica se realiza de modo más temprano (TD y E del 84 y el 94%, respectivamente, en la estrategia en un tiempo, y del 88 y el 95%, respectivamente, en la estrategia en dos tiempos).
Comparación entre estrategia de cribado en un tiempo y en dos tiempos
| Estrategia en un tiempo | Estrategia en dos tiempos | |
| n | 6.312 | 8.388 |
| n T21 | 32 | 34 |
| TD, % | 84 | 88 |
| E, % | 94 | 95* |
| VPP, % | 6,9 | 6,7 |
| VPN, % | 99,9 | 99,9 |
| LR+ | 14,5 | 17,6 |
| LR– | 0,17 | 0,12 |
E: especificidad; LR: likelihood ratio; n: número de casos; T21: trisomía 21; TD: tasa de detección; VP: valor predictivo.
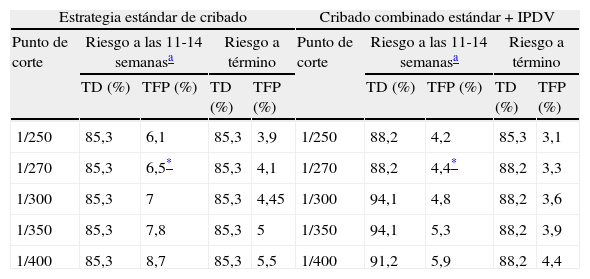
Hemos comparado la efectividad del programa de cribado mediante la estrategia estándar (IR calculado a partir de la edad materna, TN, PAPP-A y β-hCG) y la estrategia de añadir la evaluación sistemática del IPDV (tabla 6). Asumiendo un punto de corte de 1/270, observamos un aumento significativo de la TD (de un 85,3 a un 88,2%), con una significativa reducción de la TFP (de un 6,5 a un 4,4%) (p<0,001). A la luz de estos resultados y considerando la aceptabilidad de la incorporación sistemática de dicho marcador y la infraestructura de nuestro servicio, a partir de octubre de 2008 se decidió la integración sistemática del IPDV en el cálculo del IR de SD.
Comparación entre la estrategia de cribado estándar y la estrategia de inclusión sistemática del índice de pulsatilidad del ductus venoso
| Estrategia estándar de cribado | Cribado combinado estándar+IPDV | ||||||||
| Punto de corte | Riesgo a las 11-14 semanasa | Riesgo a término | Punto de corte | Riesgo a las 11-14 semanasa | Riesgo a término | ||||
| TD (%) | TFP (%) | TD (%) | TFP (%) | TD (%) | TFP (%) | TD (%) | TFP (%) | ||
| 1/250 | 85,3 | 6,1 | 85,3 | 3,9 | 1/250 | 88,2 | 4,2 | 85,3 | 3,1 |
| 1/270 | 85,3 | 6,5* | 85,3 | 4,1 | 1/270 | 88,2 | 4,4* | 88,2 | 3,3 |
| 1/300 | 85,3 | 7 | 85,3 | 4,45 | 1/300 | 94,1 | 4,8 | 88,2 | 3,6 |
| 1/350 | 85,3 | 7,8 | 85,3 | 5 | 1/350 | 94,1 | 5,3 | 88,2 | 3,9 |
| 1/400 | 85,3 | 8,7 | 85,3 | 5,5 | 1/400 | 91,2 | 5,9 | 88,2 | 4,4 |
IPDV: índice de pulsatilidad del ductus venoso; TD: tasa de detección; TFP: tasa de falsos positivos.
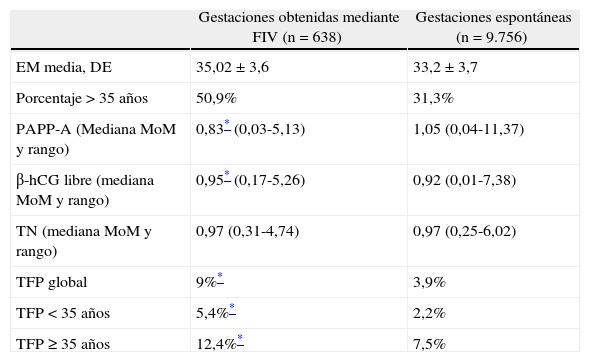
Hemos comparado los valores de normalidad de los parámetros bioquímicos PAPP-A y β-hCG en 9.756 gestaciones únicas espontáneas (grupo control) y 638 gestaciones únicas sometidas a técnicas de FIV (grupo de estudio, incluidas técnica de FIV y FIV con inyección intracitoplásmica) (tabla 7). Los valores de los parámetros bioquímicos observados son distintos, con valores significativamente inferiores de PAPP-A y discretamente superiores de β-hCG en las gestaciones conseguidas con tratamiento de reproducción asistida. No se observan diferencias en relación con los valores de normalidad de la medición de la TN. La TFP del cribado combinado de primer trimestre (ajustados por grupos de edad materna) fue significativamente superior en el grupo de FIV que en el grupo control (9,0 frente a 3,9%; p<0,05). Estos resultados apoyan la recomendación de disponer de unas curvas específicas en los parámetros bioquímicos de primer trimestre en gestaciones obtenidas mediante técnicas de FIV. A partir de estos resultados, desde la fecha del estudio en nuestro centro consideramos un factor de corrección en el cálculo del IR en base al método de concepción de la gestación.
Valores de normalidad de parámetros bioquímicos en gestaciones espontáneas y gestaciones sometidas a técnicas de reproducción asistida
| Gestaciones obtenidas mediante FIV (n=638) | Gestaciones espontáneas (n=9.756) | |
| EM media, DE | 35,02±3,6 | 33,2±3,7 |
| Porcentaje>35 años | 50,9% | 31,3% |
| PAPP-A (Mediana MoM y rango) | 0,83* (0,03-5,13) | 1,05 (0,04-11,37) |
| β-hCG libre (mediana MoM y rango) | 0,95* (0,17-5,26) | 0,92 (0,01-7,38) |
| TN (mediana MoM y rango) | 0,97 (0,31-4,74) | 0,97 (0,25-6,02) |
| TFP global | 9%* | 3,9% |
| TFP < 35 años | 5,4%* | 2,2% |
| TFP ≥ 35 años | 12,4%* | 7,5% |
DE: desviación estándar; EM: edad materna; FIV: fecundación in vitro; MoM: múltiplos de la mediana; TFP: tasa de falsos positivos; TN: translucencia nucal.
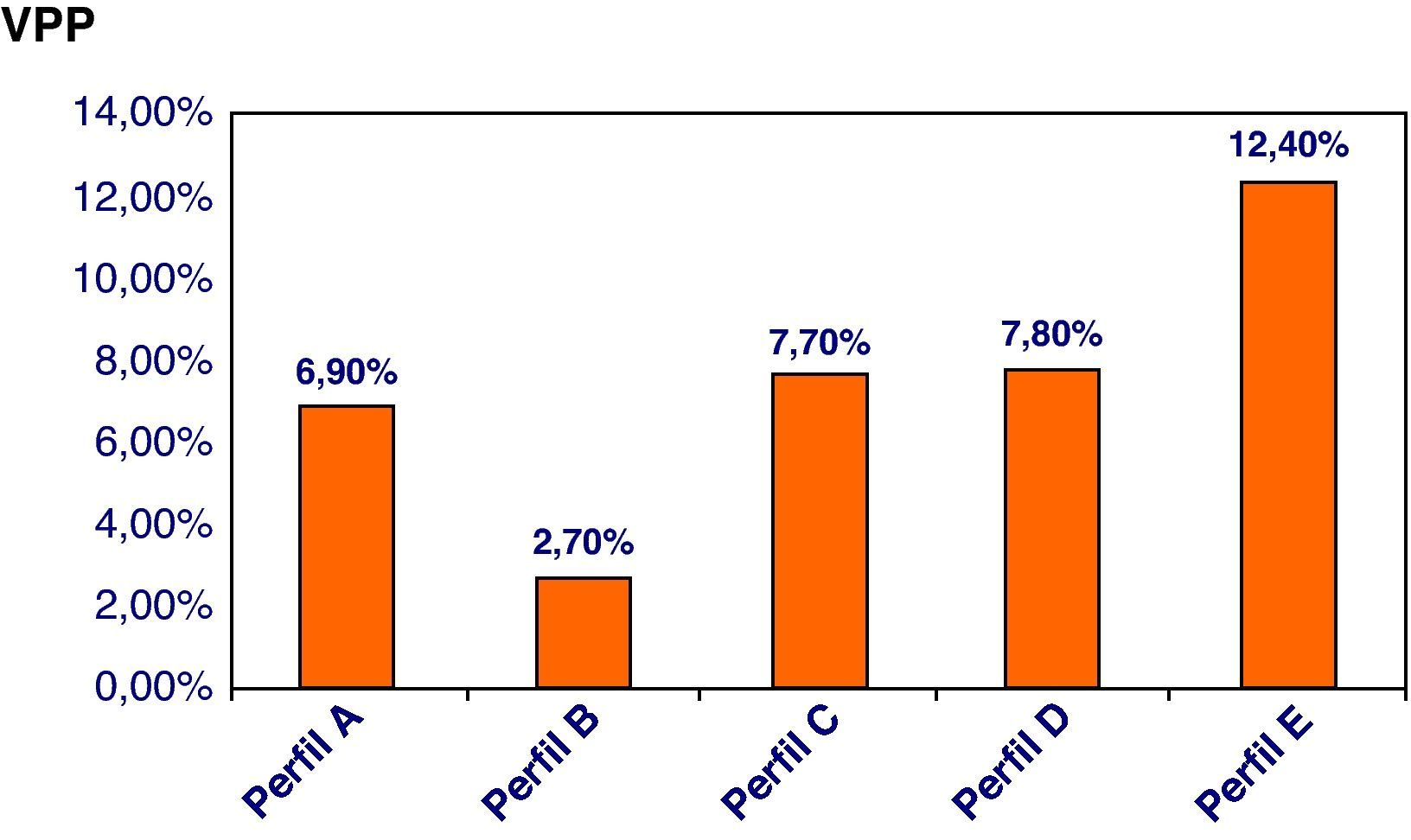
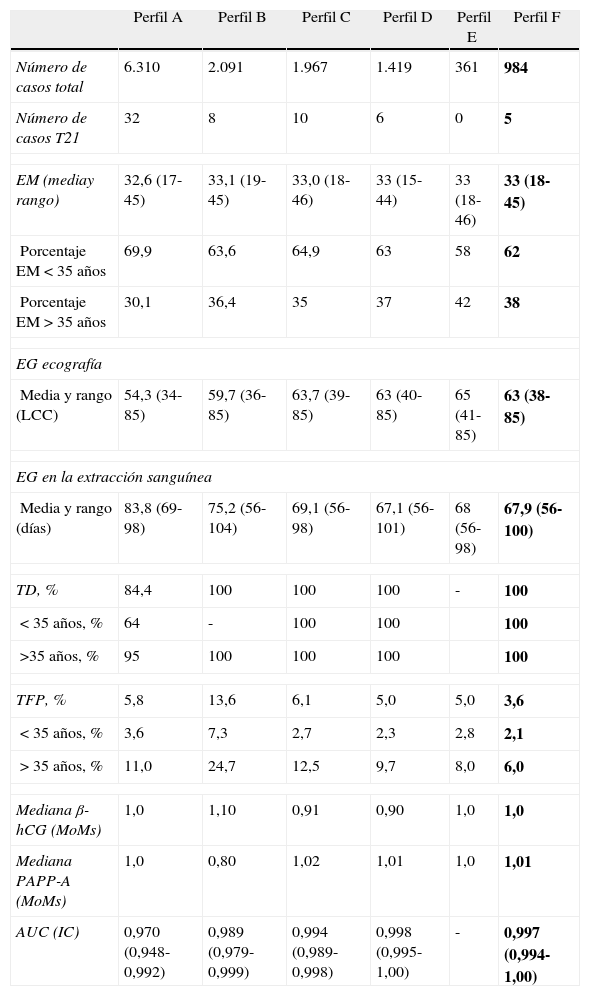
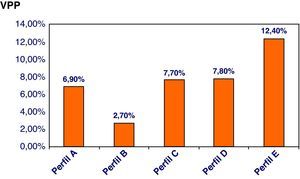
Desde el año 2003 se han ido incorporando diferentes estrategias a fin de mejorar la efectividad del cribado de SD, las cuales permiten observar una mejoría de la TD (el 84,4 frente al 100%) y una reducción de la TFP (el 5,8 frente al 3,6%) (tabla 8). Asumiendo una TD del 85%, si comparamos el perfil inicial empleado en el 2003 (Perfil A) en relación con el perfil actual (Perfil F), la TFP desciende significativamente del 7,6 al 1,3%. En la figura 5 se muestra el valor predictivo positivo (VPP) de SD según el perfil utilizando, mostrando un valor máximo (12,4%) cuando se combinan todas las estrategias comentadas.
Resultados con los diferentes perfiles utilizados durante el periodo de estudio
| Perfil A | Perfil B | Perfil C | Perfil D | Perfil E | Perfil F | |
| Número de casos total | 6.310 | 2.091 | 1.967 | 1.419 | 361 | 984 |
| Número de casos T21 | 32 | 8 | 10 | 6 | 0 | 5 |
| EM (mediay rango) | 32,6 (17-45) | 33,1 (19-45) | 33,0 (18-46) | 33 (15-44) | 33 (18-46) | 33 (18-45) |
| Porcentaje EM<35 años | 69,9 | 63,6 | 64,9 | 63 | 58 | 62 |
| Porcentaje EM>35 años | 30,1 | 36,4 | 35 | 37 | 42 | 38 |
| EG ecografía | ||||||
| Media y rango (LCC) | 54,3 (34-85) | 59,7 (36-85) | 63,7 (39-85) | 63 (40-85) | 65 (41-85) | 63 (38-85) |
| EG en la extracción sanguínea | ||||||
| Media y rango (días) | 83,8 (69-98) | 75,2 (56-104) | 69,1 (56-98) | 67,1 (56-101) | 68 (56-98) | 67,9 (56-100) |
| TD, % | 84,4 | 100 | 100 | 100 | - | 100 |
| < 35 años, % | 64 | - | 100 | 100 | 100 | |
| >35 años, % | 95 | 100 | 100 | 100 | 100 | |
| TFP, % | 5,8 | 13,6 | 6,1 | 5,0 | 5,0 | 3,6 |
| < 35 años, % | 3,6 | 7,3 | 2,7 | 2,3 | 2,8 | 2,1 |
| > 35 años, % | 11,0 | 24,7 | 12,5 | 9,7 | 8,0 | 6,0 |
| Mediana β-hCG (MoMs) | 1,0 | 1,10 | 0,91 | 0,90 | 1,0 | 1,0 |
| Mediana PAPP-A (MoMs) | 1,0 | 0,80 | 1,02 | 1,01 | 1,0 | 1,01 |
| AUC (IC) | 0,970 (0,948-0,992) | 0,989 (0,979-0,999) | 0,994 (0,989-0,998) | 0,998 (0,995-1,00) | - | 0,997 (0,994-1,00) |
AUC: área bajo la curva; EG: edad gestacional; EM: edad materna; IC: intervalo de confianza; LCC: longitud craneocaudal; T21: trisomía 21; TD: tasa de detección; TFP: tasa de falsos positivos; MoMs: múltiplos de la mediana.Perfil A: cribado en un tiempo con normalidades propias de los parámetros bioquímicos; Perfil B: cribado en dos tiempos con normalidades propias de los parámetros bioquímicos, extrapolando los valores en edades gestacionales tempranas; Perfil C: cribado en dos tiempos con normalidades propias de los parámetros bioquímicos en todas las semanas; Perfil D: perfil C añadiendo la valoración de índice de pulsatilidad del ductus venoso; Perfil E: perfil D con actualización de valores de medianas; Perfil F: perfil E añadiendo factor de corrección en gestaciones con fecundación in vitro, según datos propios.
Nuestra experiencia muestra una efectividad en concordancia con la de los programas de cribado de SD de primer trimestre publicados en la bibliografía3,6,9–11. Actualmente, el principal objetivo de las estrategias de cribado se centra en intentar reducir la tasa de técnicas invasivas innecesarias (o TFP). En este sentido, la implementación progresiva de las diferentes estrategias descritas nos ha permitido mejorar progresivamente la especificidad de nuestro programa de cribado, a la vez que generalizar su recomendación a toda la población, independientemente del grupo de edad materna. Esta mejoría se refleja en la variación del VPP de SD de los distintos perfiles empleados (riesgo de estar afectado de la condición cribada ante un cribado positivo), con un valor máximo en la estrategia que combina todas las anteriores. Las estrategias incorporadas incluyen el establecimiento de nuestra distribución de normalidad de los parámetros bioquímicos y ecográficos en nuestra población general, con la actualización periódica de sus medianas, el desplazamiento del cribado de una estrategia en un tiempo a dos tiempos, la incorporación del IPDV como nuevo marcador ecográfico de primera línea, y la incorporación de factores de corrección en las gestaciones conseguidas mediante técnicas de FIV.
Para conseguir que las concentraciones de los marcadores bioquímicos y la medición de los parámetros ecográficos sean independientes del momento del embarazo en que se efectúa su determinación y, a su vez, conseguir un mejor ajuste a una curva de Gauss, aquéllas deben transformarse a MoM. El primer paso para dicha transformación implica disponer de las medianas de cada marcador, calculadas a partir de una muestra suficientemente amplia de gestantes no portadoras de fetos aneuploides, y específicas para cada momento de la gestación en el que habitualmente se determinan. Se recomienda el cálculo de medianas propias por cada laboratorio, para evitar diferencias metodológicas o poblacionales, y específicas para cada semana de gestación (a partir de un mínimo de 100 muestras para cada intervalo gestacional definido), para cada marcador y para la población que habitualmente atiende, y que periódicamente se actualicen sus valores. En segundo lugar, a partir de estas medianas calculadas para cada semana de gestación, y ponderando por el número de determinaciones disponibles en cada semana (la ponderación incrementa la precisión), se obtiene una curva de regresión que se expresa matemáticamente mediante funciones polinómicas de segundo, tercer o cuarto grado, según el comportamiento de cada marcador. En este sentido, nuestra experiencia sobre una amplia muestra poblacional permite disponer de valores de normalidad para la PAPP-A y β-hCG, TN e IPDV, que pueden ser útiles para poblaciones afines a la nuestra y no dispongan del volumen adecuado para generar sus propias normalidades.
Diferentes estudios publicados muestran la utilidad de la incorporación del DV en el cálculo del IR en la reducción de la TFP del cribado de SD12–14, entre ellos trabajos propios de nuestro grupo15. De forma similar, en nuestro centro la integración sistemática del IPDV ha resultado ser una herramienta útil para mejorar la especificidad del cribado, y con ello el número de técnicas invasivas innecesarias. Sin embargo, a diferencia de los estudios previos, que evalúan este parámetro de forma cualitativa (considerando la evaluación de la velocidad en la contracción atrial)11 o en población preferentemente de riesgo alto12,13, nuestro estudio evalúa la integración de esta parámetro de forma continua y agrupa una amplia casuística de población predominantemente de riesgo bajo.
La concentración de los marcadores bioquímicos en suero materno, además de modificarse con la edad gestacional, también varía específicamente, para cada uno de ellos, con el peso materno y por determinadas características de cada gestante, los denominados «factores de corrección» o «covariables». Además de la corrección para el peso materno, los valores de los marcadores bioquímicos deben corregirse en función de las características propias de cada gestante, como mínimo, en lo relativo a raza, consumo de tabaco y diabetes insulinodependiente, preferiblemente a partir de parámetros poblacionales calculados por el propio centro para su población habitual. Sin embargo, hay otros factores de corrección para otras covariables, como el método de concepción, que afectan la concentración sérica de algunos marcadores bioquímicos, aunque con una influencia sobre ella menor, y que no suelen estar incorporados asistencialmente en la corrección de los múltiplos de la mediana. Nuestra experiencia, en concordancia con los trabajos publicados16,17, demuestra que la corrección de la covariable del método de concepción (FIV), especialmente en la valoración de la PAPP-A, es relevante y mejora la especificidad del cribado.
La estrategia de cribado combinado en dos tiempos, en la que se evalúan los parámetros bioquímicos y ecográficos en dos tiempos diferenciados y se adecua cada uno de ellos a su período más optimo, muestra una efectividad mayor, en concordancia con otros estudios publicados18. De forma similar, nuestra experiencia ha demostrado una efectividad mayor cuando la determinación bioquímica se realiza de modo más temprano. En base a los resultados obtenidos, a partir de febrero de 2007 se decidió utilizar de forma sistemática y preferente la estrategia de cribado en dos tiempos.
El cribado combinado temprano es actualmente el método de elección para la detección de SD, con una TD aproximada de un 90% con una TFP de 5%3,6. Sin embargo, la efectividad del programa es fuertemente dependiente del operador, por lo que sería aconsejable un buen entrenamiento y una auditoría tanto de los marcadores ecográficos, como de los parámetros bioquímicos. En este sentido, contrariamente a lo que ocurre en el ámbito del laboratorio clínico, donde las pruebas analíticas están sometidas a estrictos controles de calidad para determinar y confirmar su fiabilidad19,20, en el campo de la medicina fetal, y más concretamente en el ámbito de la ecografía prenatal, el concepto de evaluación de la calidad y la certificación sólo ha sido objeto de interés recientemente21–26. En todo programa de cribado prenatal, aunque la tasa de detección sigue siendo una prioridad y un indicador de su efectividad, este parámetro no puede utilizarse como un marcador fiable de la calidad de éste, fundamentalmente debido a la baja prevalencia de esta condición. Los esfuerzos en el control de calidad del cribado prenatal de aneuploidías deben incluir indicadores más fiables, realistas y de aplicación individualizada20.
ConclusionesLa incorporación de diferentes estrategias ha mejorado la efectividad del programa de cribado de aneuploidías, sobre todo en la reducción de la tasa de falsos positivos. Estas estrategias, como mostramos en nuestra serie, incluyen establecer unas curvas propias de normalidad en los parámetros bioquímicos y ecográficos considerados en el cálculo del IR, una actualización continua de los valores de sus medianas, ajustar los parámetros bioquímicos al método de concepción, adelantar la determinación de los parámetros bioquímicos (estrategia en dos pasos) e introducir el IPDV como marcador de primera línea en el cálculo del IR. Sugerimos incorporar estos pasos en el cribado estándar de SD en centros con experiencia a fin de reducir las pruebas invasivas innecesarias generadas por éste.
Conflicto de interesesJosep Sabrià Rius es el director de la compañía SBP Soft 2007 SL que produce el programma SsdwlLab para la detección prenatal de las aneupllidías. El resto de autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido realizado bajo los Auspicios de la Càtedra d’ Investigació en Obstetrícia i Ginecologia de la Universitat Autònoma de Barcelona.
Este trabajo fue presentado en International Workshop on Prenatal Screening (5-6 marzo del 2010, Berlín [Alemania]).