Com o progressivo avanço da Medicina Fetal e a vulgarização de procedimentos invasivos fetais, diagnósticos e/ou terapêuticos, é mandatório repensar se a dor fetal é ou não uma realidade.
MétodosEfectuou-se uma pesquisa bibliográfica utilizando o motor de busca Pubmed acerca do conhecimento científico actual no que respeita a dor fetal e suas implicações clínicas.
ResultadosDevido às limitações éticas e práticas implicadas na investigação do feto humano, a maioria da evidência que existe nesta área resulta de estudos realizados em animais e em recém-nascidos pré-termo. A percepção dolorosa é inferida através da evidência da integridade de estruturas neuroanatómicas, da sua funcionalidade, bem como das alterações endócrinas, hemodinâmicas e comportamentais associadas à dor. Antes das 29-30 semanas de gestação, a percepção dolorosa é pouco provável. A exposição a estímulos nóxicos durante o período perinatal parece condicionar alterações no neurodesenvolvimento e no comportamento futuro, podendo a analgesia/anestesia fetal atenuar a resposta a esse stress e, deste modo, prevenir efeitos deletérios a longo prazo.
Conclusões/DiscussãoSendo a dor uma experiência subjectiva, a sua compreensão neurobiológica é muito mais complexa do que o conhecimento anatómico e fisiológico das vias nociceptivas. Os dados apresentados pelos principais estudos nesta área não têm em conta o meio intra-uterino e as suas idiossincrasias, e, como tal, não permitem afirmar inequivocamente a percepção consciente de dor fetal. Por outro lado, é ainda necessária uma investigação mais aprofundada para clarificar o impacto da nocicepção fetal no neurodesenvolvimento pós-natal, bem como avaliar a necessidade de analgesia/anestesia fetal.
With the evolution of Fetal Medicine and the increasing use of invasive techniques, it is mandatory to investigate if fetal pain is really an issue.
MethodsA bibliographic search on scientific knowledge of fetal pain, its neuroanatomical and neurophysiological bases, consequences and clinical implications was conducted in Pubmed.
ResultsDue to practical and ethical restrictions in using the human fetus in research, most of the evidence in this area is indirectly inferred from animal studies and through observations made in preterm human newborns. Pain perception is assumed from the integrity of neuroanatomic structures and its functionality, as well as from the endocrinal, hemodynamic and behavioral changes associated with pain. This perception is not likely to exist before 29-30 weeks of gestational age. The exposure to noxious stimulus in the perinatal period seems likely to cause to neurological development and behavioral changes, thereby fetal analgesia/anesthesia can mitigate the reaction to stress and thus avoid these deleterious long-term effects.
ConclusionsGiven that pain is a subjective experience, its neurobiological understanding is far more complex than the basic knowledge of the anatomical and physiological ways of nociception. Available data derived from main studies in this area do not take into account the intrauterine environment idiossincracies and so can not prove the existence of fetal pain awareness. On the other hand, further investigation is needed to clarify the impact of fetal nociception in postnatal neurodevelopment, as well as the need for fetal analgesia/anesthesia.
Será o feto capaz de percepcionar a dor tal como a concebemos? Em que período da vida embrionária já existe suporte anatómico com funcionalidade que permita afirmar a possibilidade do ponto de vista biológico de o feto sentir dor? Será que o meio intra-uterino com as suas idiossincrasias vai modelar essa possibilidade biológica do feto percepcionar a dor? No caso do feto humano ser capaz de percepcionar dor, quais serão as repercussões a curto e longo prazo? O avanço da Medicina Fetal, especificamente no âmbito do diagnóstico pré-natal, levanta estas questões pertinentes dada a introdução vulgarizada de técnicas invasivas de diagnóstico e intervenções terapêuticas intra-uterinas1–5.
A evidência científica da dor fetal é, logicamente, limitada, pela inexistência de um método objectivo de avaliação da dor no meio intra-uterino. Por outro lado, experiências efectuadas em fetos humanos são dificilmente exequíveis e/ou eticamente inaceitáveis. Assim, a maioria da evidência actual existente é extrapolada de modelos experimentais animais ou, indirectamente, de recém-nascidos pré-termo2,6. Estudos nesta área podem ser divididos em: evidência anatómica (determinação da idade gestacional a partir da qual se constituem as vias neuronais necessárias para estabelecer o circuito neuroanatómico da dor); evidência fisiológica (comprovação da funcionalidade desses circuitos neuronais); respostas ao stress (alterações hemodinâmicas e neuroendócrinas que se verificam aquando da ocorrência de dor) e alterações comportamentais associadas à exposição a estímulos nóxicos 6–9.
O objectivo deste trabalho é efectuar uma revisão acerca da evidência científica sobre a capacidade fetal de percepcionar a dor e suas implicações clínicas, nomeadamente no neurodesenvolvimento futuro e na necessidade de administração de analgésicos ou anestésicos aquando de intervenções na área da medicina fetal.
Material e métodosDe modo a recolher evidência científica sobre o tema da dor fetal procedeu-se à pesquisa de artigos através do motor de busca PubMed publicados em português ou inglês até 31 de Dezembro de 2009 e de nível de evidência III. Foram seleccionados estudos realizados em animais, fetos ou recém-nascidos pré-termo ou de termo que procuraram: a) estudar o desenvolvimento das vias nociceptivas e sua funcionalidade; b) avaliar a resposta a estímulos nóxicos, nomeadamente alterações comportamentais, endócrinas ou hemodinâmicas; c) avaliar metodologia anestésica/analgésica no âmbito das técnicas invasivas diagnósticas e de terapêutica fetal.
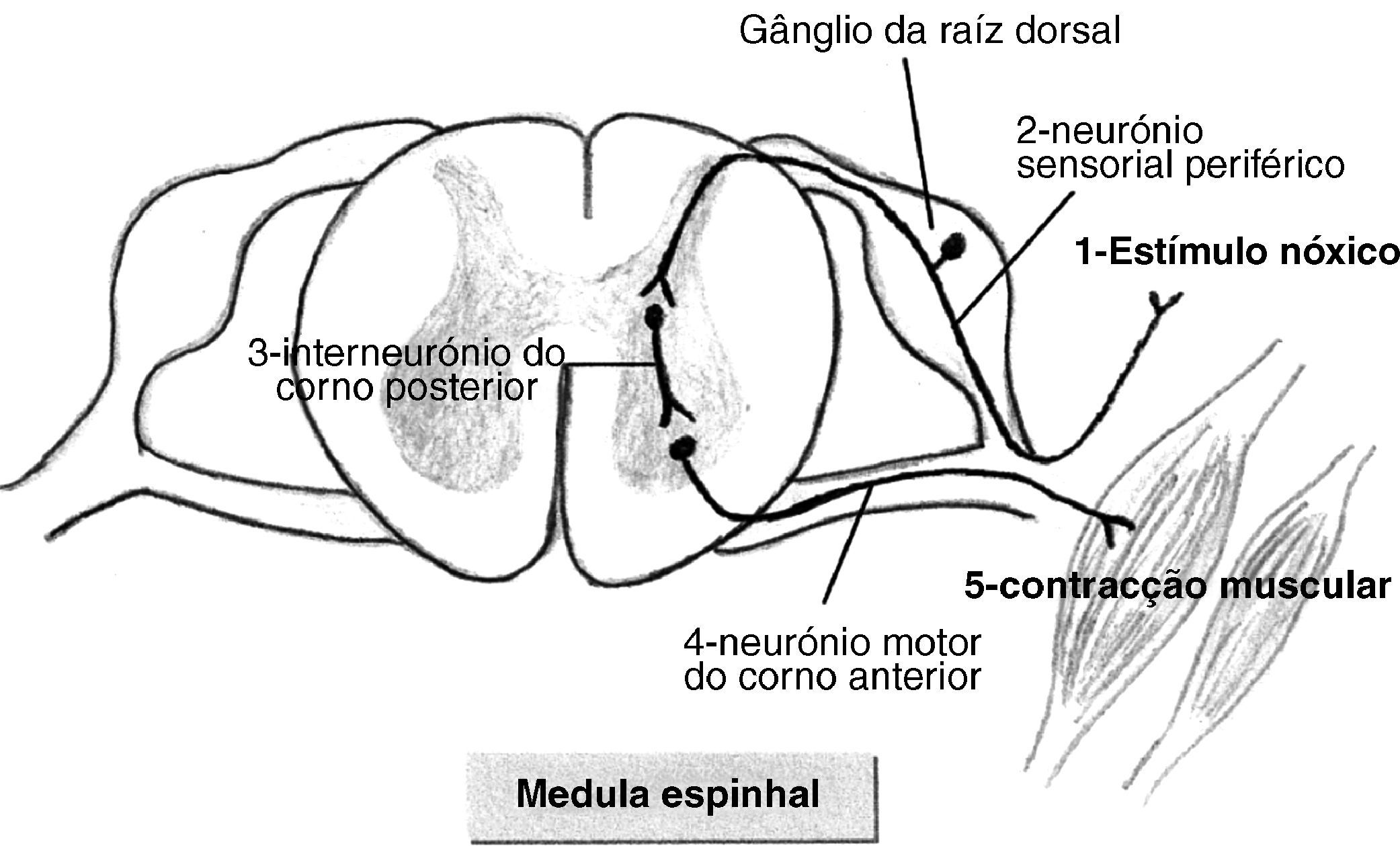
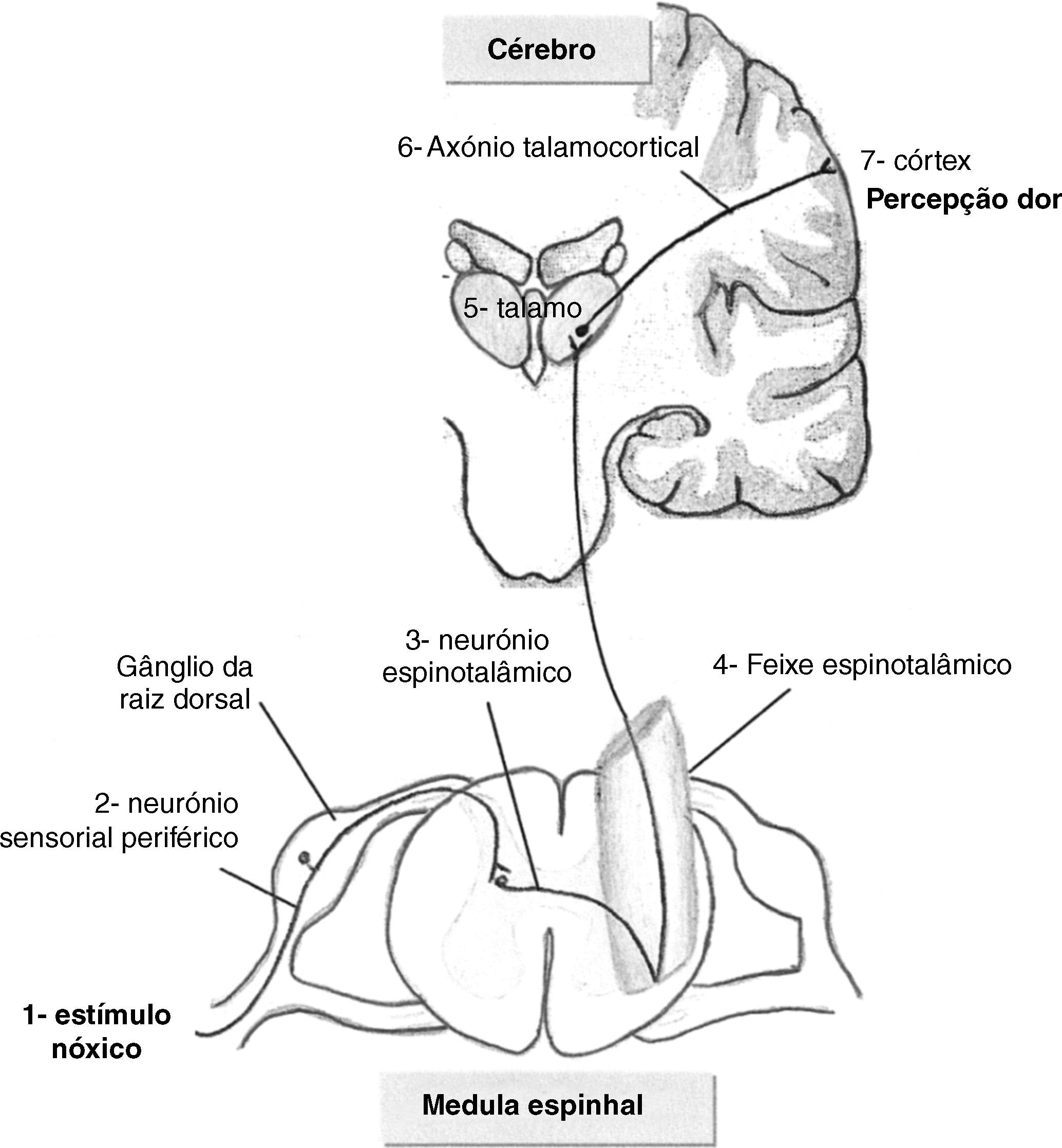
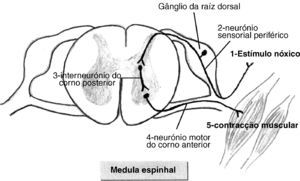
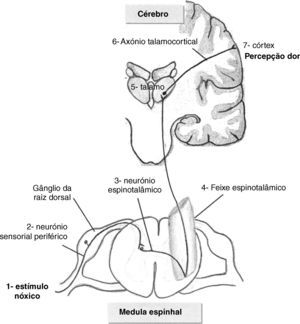
ResultadosDor versus NocicepçãoSegundo a Associação Internacional para o Estudo da Dor (IASP- International Association for the study of Pain), esta define-se como uma experiência emocional e sensorial desagradável associada a lesão tecidular potencial ou real10. Neste contexto torna-se fundamental a distinção entre dor e nocicepção. A nocicepção implica apenas a activação física das vias nociceptivas por um estímulo nóxico, desencadeando-se um circuito medular que não envolve as vias corticais superiores. Na percepção dolorosa, pelo contrário, após activação dos neurónios sensoriais periféricos pelo estímulo nóxico (fig. 1), este progride via feixe espinotalâmico até ao tálamo e posteriormente atinge o córtex cerebral. A experiência dolorosa é assim um fenómeno consciente 8,11. Cada indivíduo reconhece a dor tendo em conta as suas experiências prévias. Assim, a problemática da percepção fetal da dor passa obrigatoriamente pelo conceito de consciência. Não se sabe ainda se a consciência se inicia durante a vida fetal ou apenas numa fase mais tardia da vida extra-uterina, dado que a sua base biológica não está completamente compreendida11–13. Contudo, não se manifesta como um fenómeno de tudo ou nada, a consciência desenvolve-se progressivamente. O feto não possui a mesma condição física para a experiência consciente da dor, tal como ela ocorre em adultos humanos, mas pelo menos do ponto de vista teórico, esta poder-se-ia iniciar na vida intra-uterina 1,11,13–15.
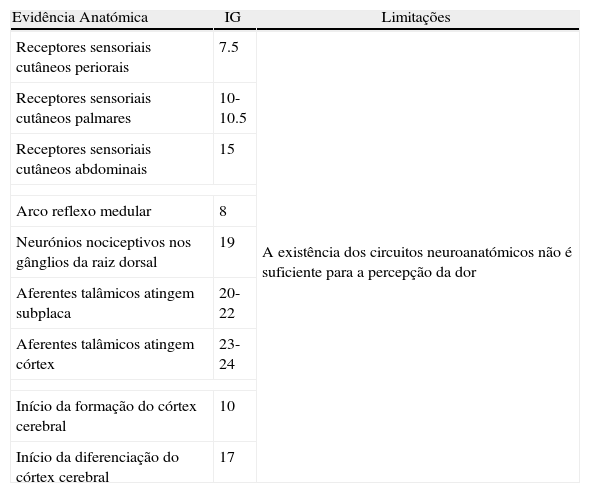
Evidência científicaAnatómicaPerante os pressupostos da percepção consciente do estímulo nóxico, os estudos de evidência nesta área tentam estudar em primeira instância o desenvolvimento completo das vias neuronais essenciais a todo o circuito de percepção da dor (fig. 2). Sem estabelecimento das vias neuroanatómicas a percepção fetal da dor não é possível em termos biológicos2,8,15,16. Assim, é necessária a conexão entre os receptores periféricos e o sistema nervoso central (SNC), o que implica a ligação dos nociceptores à medula espinhal, o aparecimento das fibras espinotalâmicas, bem como das fibras talamocorticais que conduzem a informação ao cortéx somatossentitivo8,16–18. Apesar do córtex cerebral se começar a formar a partir das 10 semanas, só após as 17 semanas se inicia a complexa diferenciação estrutural e a maturação cortical que só terminarão após o nascimento8,17,18. As fibras talamocorticais são as últimas conexões neurais a completarem a integridade da via neuroanatómica da percepção da dor e são as últimas a desenvolverem-se na vida intrauterina. Há aqui alguma controvérsia quanto à necessidade do seu completo desenvolvimento para a percepção de dor. A maioria dos autores referem que estas conexões devem estar bem estabelecidas para a percepção de dor poder ocorrer, enquanto outros afirmam que as ligações talamocorticais também se podem estabelecer indirectamente, se existirem sinapses entre os aferentes talâmicos e os neurónios da subplaca8,16,17,19,20. A subplaca é uma estrutura neuroanatómica fetal de transição, constituída por uma camada de neurónios localizados abaixo da placa cortical, que funciona como um compartimento de espera, recebendo vários aferentes (incluindo os talâmicos) e direccionando-os para o córtex16,19–21. Esta estrutura específica do feto forma-se às 15 semanas de gestação, expande-se consideravelmente entre as 17 e as 20 semanas, desaparecendo quase totalmente após as 32 semanas, aquando da maturação do córtex cerebral em seis camadas. Não existem, no entanto, estudos em humanos que avaliem especificamente sinapses entre neurónios da subplaca e os da placa cortical, que veiculem informação relativamente ao estímulo doloroso20,21. A idade gestacional, na qual existe evidência de aparecimento das referidas estruturas neuroanatómicas integradas no circuito de percepção consciente de dor, encontra-se descrita na tabela 1.
Evidência anatómica – idade gestacional em que existe evidência de aparecimento das estruturas neuroanatómicas integradas no circuito de percepção consciente de dor 6,11–13,16–21
| Evidência Anatómica | IG | Limitações |
| Receptores sensoriais cutâneos periorais | 7.5 | A existência dos circuitos neuroanatómicos não é suficiente para a percepção da dor |
| Receptores sensoriais cutâneos palmares | 10-10.5 | |
| Receptores sensoriais cutâneos abdominais | 15 | |
| Arco reflexo medular | 8 | |
| Neurónios nociceptivos nos gânglios da raiz dorsal | 19 | |
| Aferentes talâmicos atingem subplaca | 20-22 | |
| Aferentes talâmicos atingem córtex | 23-24 | |
| Início da formação do córtex cerebral | 10 | |
| Início da diferenciação do córtex cerebral | 17 | |
Legenda:IG – idade gestacional expressa em semanas.
A mera existência dos circuitos neuroanatómicos não é suficiente para existir percepção fetal da dor e, apesar de o feto apresentar fibras talamocorticais directas entre 23-24 semanas de gestação, é necessária evidência (directa ou indirecta) da sua funcionalidade. Neste sentido, tem-se recorrido a algumas técnicas entre as quais se destaca o electroencefalograma (EEG)7,8,11,16.
O primeiro registo de actividade electroencefalográfica surge cerca da 20ª semana de gestação. Entre as 24-30 semanas de IG a actividade cerebral é descontínua, tornando-se contínua a partir dessa altura. A sincronia inter-hemisférica é observada desde as 24 semanas de gestação8,22,23. Alguns autores referem que os padrões electroencefalográficos de vigília podem indiciar percepção consciente. Em recém-nascidos pré-termo, esse padrão é demonstrável, pela primeira vez, às 30 semanas de gestação8,22–26. A EEG permite detectar actividade eléctrica cerebral, nomeadamente cortical e subcortical8,22,23. Apresenta, no entanto, algumas limitações. A actividade electroencefalográfica isolada não prova funcionalidade, pois o recém-nascido anencéfalo pode apresentar actividade electroencefalográfica. Por outro lado os padrões electroencefalográficos de alterações de consciência não são aplicáveis à análise da EEG neonatal e mesmo os EEG dos recém-nascidos pré-termo podem não ser extrapoláveis ao feto. Além disso, não existem padrões eletroencefalográficos específicos para a dor8,22–24.
Tal como foi exposto anteriormente a consciência é fundamental na percepção da dor. Torna-se assim essencial introduzir aqui o conceito de vígilia e diferenciá-lo da consciência. O estado vigil resulta de actividade talâmica e do tronco cerebral, sendo um estado de ‘alerta–não-sono‘, enquanto que a consciência requer um processamento cortical. O sono é um estado de inconsciência despertável. É possível estar acordado e não consciente (como no coma vegetativo persistente) ou acordado e consciente, mas não é possível estar adormecido e consciente12,24,25. Desta forma, sendo demonstrável que o feto pode estar acordado durante a gestação, ainda que por breves períodos, há a possibilidade de estar consciente 7,8,12,14,15,25. No final da gestação, tal como na vida pós-natal, definem-se claramente dois estados de sono: o activo/REM e o calmo/NREM. São estados episódicos e durante cada estado o feto exibe comportamentos específicos7,8,26. Na segunda metade da gestação os estados de sono REM e NREM representam 95% da actividade electroencefalográfica fetal, e portanto em 95% do tempo não existe possibilidade de consciência e consequente capacidade de percepcionar a dor pelo feto. Não se concluiu ainda se nos restantes 5% do tempo o feto se encontra num estado de transição entre os dois sonos ou em vigília 7,8,24,26. Não existe, no entanto, consenso se este comportamento de vigília representa verdadeiramente um tipo diferente de estado, ou seja, um estado consciente 7,8,24,26. No âmbito deste tema levanta-se também a dúvida se o feto pode, sob condições fisiológicas, ser despertado por estimulação nociceptiva externa. Constatou-se que, ao contrário do que se observava no período pós-natal, em que o estímulo nóxico se associa a um aumento do estado de alerta, mesmo nos recém-nascidos pré-termo, no feto há uma inibição da actividade fetal. O meio intra-uterino parece proporcionar um conjunto de condicionantes, quer químicas, quer físicas, que promovem a inibição da actividade neuronal fetal, mantendo o feto num estado não vigil 7,8,27. Estas acções neuroinibitórias resultam da acção combinada de substâncias endógenas, tais como a adenosina, alopregnanolona, pregnanolona, prostaglandina D2 (PGD2) entre outras, associadas a um meio intra-uterino hipertérmico. Como resultado desta interacção de múltiplos factores, muitos dos quais ainda por caracterizar, o meio intra-uterino, no qual o feto se encontra, constitui um ambiente idiossincrático único, que o protege da estimulação mecânica potencialmente nociva 7.
A espectroscopia de infravermelhos tem sido utilizada para avaliar alterações hemodinâmicas corticais e assim permitir determinar quais as áreas corticais mais activas num determinado momento, tendo em conta a hemoglobina oxigenada. Dois estudos caso-controlo em recém-nascidos pré-termo, utilizaram este método para determinar as alterações hemodinâmicas no córtex somatossensorial quando estes foram expostos a um estímulo nóxico e a um estímulo táctil, tendo verificado um aumento significativo da concentração da hemoglobina oxigenada no córtex somatossensorial contralateral ao estímulo nóxico. Nestes estudos, estas respostas foram observadas em recém-nascidos com apenas 25 semanas28,29.
Estudos comportamentaisVários trabalhos procuraram estudar as respostas comportamentais associadas a estímulos nociceptivos como forma indirecta de comprovar a dor fetal. A partir das 26 semanas de gestação foi identificado o reflexo de retirada em recém-nascidos pré-termo, quando expostos a um estímulo nóxico 2,15,30. A demonstração exclusiva da existência deste tipo de reflexos não evidencia a capacidade fetal para a percepção dolorosa consciente, uma vez que estes reflexos de retirada resultam da actividade ao nível da medula espinhal sem intervenção dos circuitos neuronais a montante, ou seja sem activação do córtex cerebral. Estes reflexos podem ser observados em recém-nascidos anencéfalos 8,16,30. Quando estes reflexos são comparados com a resposta do adulto a um estímulo nóxico, nos recém-nascidos pré-termo são desencadeados por um estímulo de menor intensidade e são hiper-activos 8,11,30. A explicação fisiológica passa pelo atraso do desenvolvimento das vias inibitórias descendentes, que só são funcionais no período pós-natal e que modulam e inibem a resposta à dor 1,11,15,30. Progressivamente vai havendo um aumento do limiar da resposta, o que sugere a maturação da capacidade de distinção entre o estímulo nóxico e não nóxico, reflectindo uma maior organização do sistema nervoso (SN)8,15,28. Os estudos comportamentais também identificaram em recém-nascidos pré-termo, expressões faciais em resposta a estímulos nóxicos, como a picada do calcanhar, a partir das 26 semanas de gestação, sendo estes movimentos semelhantes aos observados no adulto aquando da experiência dolorosa 7,11,15,30–33. No entanto, outros trabalhos mostraram que, na presença de patologia neurológica com lesão cortical, estas respostas também estavam presentes, reflectindo a opinião de que estes não são controlados pelo cortéx, e por isso não representam necessariamente percepção consciente da dor8,11,34.
Respostas ao stressAs alterações hemodinâmicas e endócrinas em resposta ao stress, desencadeadas por procedimentos invasivos, têm sido utilizadas para inferir acerca da percepção dolorosa1,8,27. Sabe-se que o estímulo nóxico condiciona a activação do eixo hipotálamo-hipófise-supra-renal, bem como do sistema nervoso autónomo, com um aumento de noradrenalina, cortisol e βendorfina 11,15,27,35. As respostas ao stress não constituem, porém, evidência inequívoca de dor fetal, pois estes sistemas podem ser activados sem processamento cortical consciente e em situações não dolorosas. No entanto, se estas respostas não ocorrem, então é muito pouco provável que o feto esteja a experimentar dor num dado momento1,7,8,11,27. Por outro lado, a sua presença de uma forma contínua ou repetitiva ao longo do tempo revelou a possibilidade de acarretar consequências a longo prazo e, quando inibidas por analgesia ou anestesia fetal poderão associar-se a um melhor prognóstico3,8,27,36. Os estudos neste âmbito mostram que desde as 16 semanas de IG há um aumento significativo dos valores de noradrenalina e βendorfina após exposição a procedimentos invasivos, e a partir da 20ª semana há um aumento do valor do cortisol nas mesmas condições (facto este que se parece relacionar com a maturação mais tardia da glândula supra-renal) 8,35,37. Verificou-se um aumento significativo das concentrações plasmáticas fetais de cortisol, β-endorfina e noradrenalina associados a transfusão sanguínea via veia intra-hepática, procedimento que implica a punção através do abdómen fetal. Esses resultados não foram observados quando a transfusão se realizou ao nível da inserção placentar do cordão umbilical, região não enervada 35,37. Observou-se que, a partir das 16 semanas de IG, quer na colheita, quer na transfusão de sangue ao nível da veia intra-hepática, havia uma redistribuição da circulação sanguínea, com um aumento do fluxo ao nível cerebral, o que não foi detectado quando a intervenção ocorreu no cordão umbilical 38. Foi demonstrado que esta resposta hemodinâmica e endócrina poderia ser atenuada pela administração de analgésicos9,39. Alterações da frequência cardíaca, da frequência respiratória e da saturação de oxigénio também têm sido utilizadas para indirectamente avaliar a dor no período neonatal em recém-nascidos pré-termo; no entanto, na maioria dos estudos estas não diferem significativamente em procedimentos dolorosos e não dolorosos7,8,31.
Efeitos a longo prazoA importância do conhecimento da dor fetal, independentemente da capacidade do feto percepcionar a dor de forma consciente, prende-se com a hipótese de a exposição in utero ao estímulo nóxico se poder relacionar com repercussões neurológicas a longo prazo, nomeadamente sensibilização futura a experiências dolorosas ou de stress, alterações do comportamento, da atenção ou da aprendizagem 1,7,9,11,19,27. A evidência, tal como foi dito anteriormente, provém de estudos realizados em animais e recém-nascidos pré-termo.
Os estudos animais sugerem que o stress fetal e neonatal pode acarretar efeitos a longo prazo, devido a alterações no eixo hipotálamo-hipófise-GSR40–44. Trabalhos realizados em ratos constataram que o estímulo stressante induz um aumento permanente da densidade de receptores glicocorticóides no hipocampo e, como tal, das respostas comportamentais ao stress ao longo da vida40. A administração de hormonas de stress a grávidas-rato, bem como situações de stress provocado no período pré-natal a grávidas-macaco, estiveram associadas a aumento das respostas hormonais e comportamentais a novos agentes potencialmente agressivos41,42. Crias de macacos rhesus, cuja progenitora foi exposta a situações de stress durante a gestação, apresentavam valores basais de ACTH e cortisol mais elevados e evidenciavam menores níveis de atenção e de maturidade motora, comparativamente ao grupo controlo43,44.
Existe evidência humana de que uma única experiência dolorosa ou stressante no período neonatal pode condicionar efeitos a longo prazo 1,8,9,19. Estudos efectuados em recém-nascidos masculinos, que foram circuncisados no período neonatal, mostraram respostas de comportamento à dor mais intensas na vacinação subsequente (4 a 6 meses depois), do que aqueles que não haviam sido circuncisados. A administração prévia dum analgésico tópico no grupo circuncisado associou-se a respostas mais atenuadas na vacinação posterior45. Os recém-nascidos pré-termo estão sujeitos, durante o internamento hospitalar, a múltiplos procedimentos invasivos potencialmente dolorosos, tais como a entubação endotraqueal e a colocação de acessos venosos46. Tal facto, associado à imaturidade que lhes é inerente, parece conduzir a inúmeras alterações, nomeadamente das respostas do eixo hipotálamo-hipófise-GSR, do desenvolvimento cerebral, da sensibilidade à dor e comportamentais. Nos cuidados de rotina não dolorosos (por exemplo a mudança de fralda) estes recém-nascidos demonstraram uma hipersensibilidade46,47. Em relação ao tipo de parto, estudos realizados no ser humano verificaram que, os bebés nascidos de parto vaginal instrumentado apresentavam uma maior elevação do cortisol salivar, bem como um maior período de choro aquando da vacinação, às 8 semanas de vida, comparativamente aos que nasceram de parto eutócico. Os bebés nascidos por cesariana electiva apresentaram menores níveis de catecolaminas e cortisol e a menor resposta ao estímulo doloroso48. Catástrofes naturais, como a tempestade de gelo vivida no Quebeque em 1998, permitiram comprovar que a exposição da grávida a tais situações de stress pode influenciar o feto. Essas crianças, quando avaliadas aos 5 anos de idade, apresentavam diminuição das capacidades cognitivas e da linguagem49.
Implicações clínicasAo longo das últimas décadas, houve um grande avanço no campo da terapia fetal nomeadamente na cirurgia fetal. Perante as possibilidades terapêuticas actuais, levantou-se a questão da necessidade de administração de analgesia/anestesia ao feto 3,4. No âmbito da medicina fetal, são realizados vários procedimentos terapêuticos, destacando-se a cirurgia fetal invasiva (acesso fetal por laparotomia e histerotomia), a cirurgia fetal minimamente invasiva (acesso fetal via endoscópica ou por meio de agulha) e a terapia fetal não cirúrgica (como por exemplo, as transfusões sanguíneas e a administração de fármacos ao feto). A maioria destas intervenções é efectuada a partir do 2° trimestre 3,4,50.
A evidência da existência de dor fetal não é imprescindível para justificar a anestesia/analgesia fetal3,4,8,50, que cumprem muitos outros objectivos não relacionados com a dor fetal: imobilização fetal (melhorando o acesso ao feto e optimizando o sucesso da técnica invasiva); prevenção de respostas hormonais ao stress (as quais estão associadas a mau desfecho cirúrgico nos recém-nascidos); estabelecimento e manutenção do relaxamento uterino (o que permite um melhor acesso cirúrgico, prevenção do parto pré-termo e descolamento placentar); bem como garantir a oxigenação fetal e a segurança materna 3,50.
Vários estudos sugerem que a anestesia/analgesia fetal poderá inibir a dor, caso o feto tenha capacidade de a percepcionar, limitando os possíveis efeitos a longo prazo dessa experiência intra-uterina desagradável. Quando a preocupação primordial é garantir o bem-estar fetal, então, apesar da discussão acerca da existência ou não da dor fetal, a anestesia e analgesia fetais, desde que não sejam prolongadas, assumem-se como fundamentais durante os procedimentos invasivos. Muitos trabalhos confirmam que, a resposta ao stress resultante de procedimentos invasivos pode ser atenuada pelo uso de anestésicos/analgésicos 3,4,35,39. Um exemplo é a administração prévia de fentanil por via intravenosa a fetos entre as 20-35 semanas de gestação, que atenuou significativamente a subida de valores de β endorfina e a resposta cerebrovascular, aquando da realização de transfusão sanguínea via VIH, sendo esta resposta semelhante à observada nos fetos que realizaram a transfusão via inserção placentar do cordão umbilical39. Outros autores discutiram a utilidade da analgesia fetal antes ou imediatamente a seguir a um parto vaginal instrumentado, para impedir os efeitos da resposta ao stress exagerada neste tipo de parto48,49.
A escolha da analgesia/anestesia no âmbito da medicina fetal é muito variável entre os diferentes centros e segundo os vários procedimentos1,3–5,8,50. Na cirurgia fetal invasiva, que exige a laparotomia/histerotomia, é necessário garantir a anestesia materna e fetal e a manutenção da tocólise intra-operatória, pelo que se recomenda a anestesia geral. No entanto, é de salientar, que a anestesia geral na grávida se associa a um aumento da morbimortalidade materna, relacionada com complicações respiratórias e hemorrágicas3,4,50. Relativamente às intervenções menos invasivas, realizadas por via endoscópica ou através do uso de agulhas e guiadas por ecografia, estas podem ser realizadas com a administração de analgesia local ou regional materna. No entanto, por vezes, a mãe recebe sedação endovenosa para redução da ansiedade3,50. Não há nestes casos protocolos bem definidos de analgesia fetal, porém, é importante garantir a imobilidade fetal. Têm sido propostas algumas técnicas, nomeadamente a administração directa de fármacos ao feto, via materna por infusão contínua ou por via amniótica3,5,50.
ConclusãoA dor é uma experiencia sensorial e emocional subjectiva, que implica o reconhecimento consciente de um estímulo como desagradável. Sendo o feto incapaz de nos dizer o que sente, não existe nenhum método directo de a quantificar. Assim, a existência de dor fetal constitui ainda uma incógnita a que se tem associado crescente investigação e muita controvérsia.
À luz dos conhecimentos actuais, extrapolados a partir de estudos animais e de recém-nascidos pré-termo, o feto não tem capacidade neuroanatómica e funcional de percepcionar a dor antes das 28-30 semanas, altura em que a vigília é evidente, ainda que transitoriamente, podendo indicar a possibilidade deste atingir um estado de consciência. A compreensão neurobiológica da dor é muito mais complexa do que o conhecimento do desenvolvimento anatómico e fisiológico das vias nociceptivas. Os dados apresentados acerca dos principais estudos nesta área não têm em conta as idiossincrasias inerentes ao meio intra-uterino, e não permitem afirmar inequivocamente a percepção consciente de dor fetal perante a exposição a um estímulo nóxico.
Independentemente de se comprovar essa capacidade, existe evidência científica directa e indirecta de que experiências nóxicas, únicas ou repetidas, após as 16 semanas, quando o sistema nervoso ainda se está a desenvolver, podem condicionar o neurodesenvolvimento e associar-se a alterações comportamentais e endócrino-metabólicas a longo prazo. Os efeitos resultantes da experiência dolorosa no período fetal foram, no entanto, ainda pouco explorados, mas alertaram para a possível necessidade de analgesia/anestesia em procedimentos fetais.
Investigação aprofundada nesta área é necessária no momento em que assistimos ao progressivo avanço da Medicina Fetal. É necessário clarificar o impacto da nocicepção fetal no neurodesenvolvimento futuro, bem como avaliar neste âmbito a necessidade de analgesia/anestesia fetal. (tabela 2)
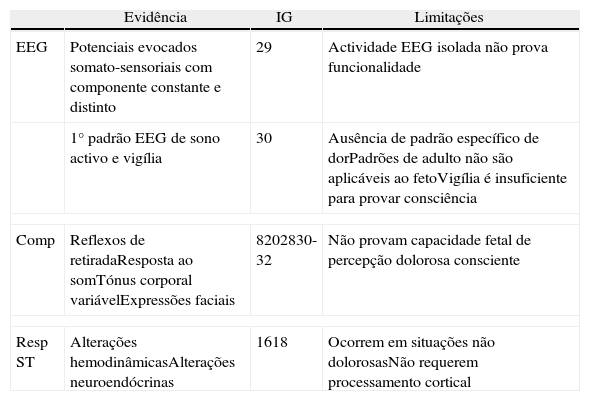
Evidência fisiológica, estudos comportamentais e respostas ao stress – idade gestacional em que existe evidência de funcionalidade das estruturas neuroanatómicas integradas no circuito de percepção consciente de dor4,6–8,11–13,22–44
| Evidência | IG | Limitações | |
| EEG | Potenciais evocados somato-sensoriais com componente constante e distinto | 29 | Actividade EEG isolada não prova funcionalidade |
| 1° padrão EEG de sono activo e vigília | 30 | Ausência de padrão específico de dorPadrões de adulto não são aplicáveis ao fetoVigília é insuficiente para provar consciência | |
| Comp | Reflexos de retiradaResposta ao somTónus corporal variávelExpressões faciais | 8202830-32 | Não provam capacidade fetal de percepção dolorosa consciente |
| Resp ST | Alterações hemodinâmicasAlterações neuroendócrinas | 1618 | Ocorrem em situações não dolorosasNão requerem processamento cortical |
Legenda:Comp – estudos comportamentais; Resp St – respostas ao stress; IG – idade gestacional expressa em semanas.