El diagnóstico de una masa anexial es un problema frecuente en la consulta ginecológica. El principal objetivo de la evaluación de una masa anexial es el diagnóstico o exclusión de malignidad, dado que el cáncer de ovario es la neoplasia ginecológica más letal y que una cirugía inicial adecuada es uno de sus principales factores pronósticos. La evaluación ecográfica continúa siendo el mejor método para clasificar las masas anexiales. Si existe la sospecha de malignidad de la lesión, la paciente debe ser remitida a un centro especializado en ginecología oncológica. Sin embargo, si la sospecha es de benignidad, se puede optar por una actitud expectante o por un tratamiento quirúrgico conservador.
El objetivo de este artículo es revisar los sistemas de clasificación de las lesiones anexiales más importantes y más ampliamente empleados, analizando su metodología y los resultados de su aplicación en los principales estudios de validación publicados hasta el momento.
The diagnosis of an adnexal mass is a common problem in gynaecological consultation. The main objective of an adnexal mass evaluation is the diagnosis or exclusion of malignancy. This is the case because ovarian cancer is the most lethal gynaecological neoplasia and appropriate initial surgery is one of the main prognostic factors. Ultrasound scans continue to be the best method of classifying an adnexal mass. If there is any suspicion of a malignant tumour, the patient must be referred to a specialist gynaecological oncology centre. However, if there is any suspicion of a benign tumour, watchful waiting or minimally invasive surgery may be indicated.
The objective of this article is to carry out a review of the most important and widely used classification systems of adnexal masses, analysing their methodology and the results of their application in the main validation studies published to date.
Las masas anexiales constituyen un problema frecuente en la consulta ginecológica y una de las dolencias que más dudas genera a la hora de realizar un diagnóstico preciso y su posterior enfoque terapéutico. Se estima que un 13-21% de las pacientes con una masa pélvica presentarán una neoplasia ovárica epitelial invasiva1. Además, el cáncer de ovario es uno de los más letales en los países desarrollados —es la sexta causa de muerte oncológica entre las mujeres europeas— por lo que resulta fundamental realizar un diagnóstico preciso con relación a su benignidad o malignidad2.
Las lesiones con alta sospecha de benignidad pueden ser manejadas de forma expectante o con cirugía conservadora en centros no especializados, mientras que las probablemente malignas deben ser remitidas a centros especializados en ginecología oncológica, dado que un diagnóstico temprano y preciso y una adecuada cirugía inicial de estadificación y citorreducción se encuentran entre los factores pronósticos más importantes del cáncer de ovario. Sin embargo, menos de la mitad de estas pacientes son intervenidas inicialmente por ginecólogos oncólogos especializados, lo que en la mayoría de los casos se produce por un inadecuado diagnóstico preoperatorio3–8.
De los 3parámetros empleados clásicamente en el diagnóstico diferencial de las masas anexiales: 1) la exploración física, 2) los niveles de marcadores tumorales y 3) la ecografía, los 2primeros han demostrado un valor diagnóstico limitado, por lo que la valoración ecográfica sigue siendo la mejor herramienta para establecer una sospecha de benignidad o malignidad con una precisión adecuada. Aunque en muchos casos las características ecográficas de una masa anexial orientan hacia su naturaleza exacta, el objetivo de su estudio no debe ser tanto establecer este diagnóstico de certeza «anatomopatológico» como determinar la probabilidad de su benignidad o malignidad.
El análisis ecográfico de las lesiones anexiales puede realizarse con la simple valoración subjetiva del ecografista (pattern recognition), lo que puede superar el 90% de precisión diagnóstica en manos expertas, o con la aplicación de sistemas o modelos matemáticos predictivos basados en la presencia o ausencia de determinadas características morfológicas de las lesiones. Estos modelos de predicción, desarrollados desde principios de los años 90, no han demostrado hasta ahora mejorar el rendimiento diagnóstico de la valoración subjetiva por ecografistas expertos. Además, ninguno de ellos ha logrado extenderse en la práctica clínica diaria7,9–15.
En este artículo nos planteamos realizar una revisión de los sistemas de clasificación de las lesiones anexiales más importantes y más utilizados en la práctica clínica, analizando su metodología y los resultados de su aplicación en los principales estudios de validación publicados hasta el momento.
Sistemas de clasificación de las lesiones anexialesEl análisis ecográfico de una masa anexial no debe limitarse a describir su apariencia morfológica, pero tampoco debe pretender sistemáticamente dar un diagnóstico específico e histológico de esta. Su objetivo fundamental debe ser realizar su clasificación o triaje para establecer su riesgo de malignidad, lo que puede realizarse de forma subjetiva o mediante sistemas objetivos.
Una crítica general al uso de la ecografía como único test diagnóstico para las lesiones anexiales es su subjetividad y su rendimiento dependiente de la experiencia y la habilidad del ecografista. Por eso, se han propuesto modelos predictivos basados en variables tanto ecográficas como epidemiológicas, clínicas o analíticas, con los objetivos de calcular individualmente el riesgo de malignidad de la lesión, apoyar a ecografistas menos experimentados de una forma objetiva y orientar a los clínicos en el manejo terapéutico de la paciente.
Desde que Grandberg et al.16 señalaran en 1989 que la valoración ecográfica por vía vaginal de una masa ovárica podía predecir la probabilidad de su malignidad, se han sucedido las propuestas de sistemas de puntuación y modelos predictivos basados en la ecografía con el objetivo de generar reglas y patrones de interpretación que ayuden a ecografistas menos experimentados a reproducir los resultados de los expertos para clasificar las masas ováricas con un nivel de precisión aceptable17. Sin embargo, ninguno de estos modelos ha sido aceptado de forma general para ser aplicado en la práctica clínica diaria. En 2revisiones recientes se ha señalado la existencia de 116 diferentes modelos de predicción desarrollados para clasificar las masas anexiales como benignas o malignas, lo que da idea tanto de los esfuerzos realizados en este campo como de la falta de consistencia de los resultados11,15.
En cualquier caso, en todo estudio ecográfico de una lesión anexial, además de su descripción morfológica, se debería incluir la valoración de su riesgo de malignidad, aun teniendo en cuenta que tanto para su diagnóstico definitivo como para la posterior actitud terapéutica se han de considerar otros factores de la paciente como su edad, antecedentes personales y familiares, estado menopáusico, síntomas y situación clínica.
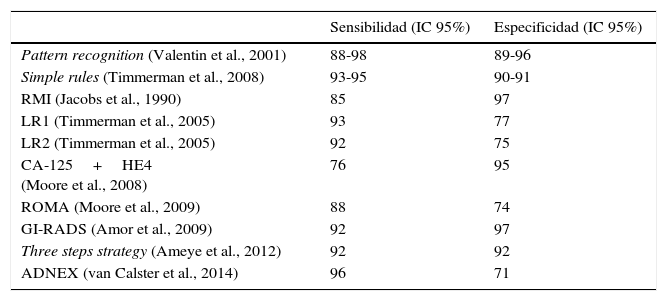
Clasificación subjetivaEl término pattern recognition fue introducido por Valentin en 1999 para referirse a la capacidad de un ecografista de establecer un diagnóstico específico o la probabilidad de benignidad o malignidad de una lesión ovárica con la simple valoración subjetiva de sus características ecográficas18. Diversos estudios han demostrado que este sistema, realizado por ecografistas experimentados, es el más preciso para caracterizar una masa anexial19–21: puede alcanzar una sensibilidad del 88-98% y una especificidad del 89-96% para establecer la probabilidad de su benignidad o malignidad, o superar el 90% de precisión al realizar su diagnóstico específico9,22.
En algunos trabajos, el rendimiento diagnóstico del pattern recognition en el triaje de las masas anexiales ha superado al de los algoritmos y modelos objetivos, como los modelos de regresión logística de Taylor y Timmerman, el sistema de puntuación Risk of Malignancy Index (RMI) o el basado únicamente en niveles de biomarcadores Risk of Ovarian Malignancy Algorithm (ROMA)2,22,23 (tabla 1).
Rendimiento diagnóstico de los principales sistemas de clasificación de las lesiones anexiales
| Sensibilidad (IC 95%) | Especificidad (IC 95%) | |
|---|---|---|
| Pattern recognition (Valentin et al., 2001) | 88-98 | 89-96 |
| Simple rules (Timmerman et al., 2008) | 93-95 | 90-91 |
| RMI (Jacobs et al., 1990) | 85 | 97 |
| LR1 (Timmerman et al., 2005) | 93 | 77 |
| LR2 (Timmerman et al., 2005) | 92 | 75 |
| CA-125+HE4 (Moore et al., 2008) | 76 | 95 |
| ROMA (Moore et al., 2009) | 88 | 74 |
| GI-RADS (Amor et al., 2009) | 92 | 97 |
| Three steps strategy (Ameye et al., 2012) | 92 | 92 |
| ADNEX (van Calster et al., 2014) | 96 | 71 |
ADNEX: Assessment of Different Neoplasias in the adneXa; HE4: human epididymis 4; LR: logistic regresión model; RMI: Risk of Malignancy Index; ROMA: Risk of Ovarian Malignancy Algorithm.
Sin embargo, a pesar de que el pattern recognition se ha señalado como la mejor forma de diagnóstico de cáncer ovárico, algunos estudios han mostrado que un 10% de los tumores son difíciles de clasificar incluso por ecografistas experimentados (borderline, cistoadenofibromas, cistoadenomas, fibromas y tumores benignos raros). En este grupo de tumores la precisión global del diagnóstico por un experto se sitúa alrededor del 68%, con pobres sensibilidad y especificidad, lo que señala la conveniencia de contar con un test secundario seguro. En este sentido, se ha propuesto tanto la aplicación de los sistemas objetivos de triaje como la medición aislada de marcadores tumorales (como el CA125 y la proteína epididimal humana 4 [HE4]), o su incorporación a modelos predictivos como el ROMA, con resultados contradictorios hasta el momento23.
Clasificación objetivaEl triaje subjetivo de las lesiones anexiales presenta una precisión diagnóstica y una reproducibilidad interobservador limitadas en caso de examinadores poco experimentados. Durante las últimas 3décadas se han propuesto múltiples modelos predictivos con el fin de proporcionar a ecografistas y clínicos herramientas que contribuyan a realizar este triaje de forma más objetiva y con un rendimiento diagnóstico similar al alcanzado por la valoración subjetiva de ecografistas expertos. Algunos de estos modelos valoran exclusivamente las características ecográficas de las lesiones, otros emplean únicamente los niveles de marcadores tumorales y la mayoría combinan variables epidemiológicas, ecográficas, clínicas y analíticas, valoradas con reglas de presencia/ausencia, sistemas de puntuación multimodales, modelos de regresión logística o algoritmos matemáticos.
Para poder ser utilizados en la práctica clínica, los modelos predictivos deben poder proporcionar un diagnóstico preciso, ser de aplicación simple y resultar útiles en la práctica habitual. Además, requieren ser validados externamente ya que tienden a ser sobrevalorados al aplicarlos en la población con la que fueron desarrollados15.
Reglas ecográficasEl grupo International Ovarian Tumour Analysis (IOTA) propuso en 2008 las denominadas simple rules, consistentes en valorar la existencia o ausencia de determinadas características típicas de las lesiones benignas y malignas24.
Para elaborar estas «reglas simples», el grupo IOTA aplicó retrospectivamente a 1.233 lesiones anexiales diferentes combinaciones de variables ecográficas testando su capacidad para predecir benignidad o malignidad mediante el cálculo de su sensibilidad, especificidad, valor predictivo positivo y negativo y curva ROC. Finalmente fueron elegidas 10reglas en función de estos resultados, de la experiencia clínica de los miembros de IOTA y de su aplicabilidad al mayor número de tumores (tabla 2). Las simple rules pudieron ser aplicadas al 76% de los 1.233 tumores, con una sensibilidad del 93%, una especificidad del 90%, un valor predictivo positivo del 80% y un valor predictivo negativo del 97%, mientras que un 24% de los tumores no pudieron ser clasificados con ellas. Después, fueron evaluadas prospectivamente en 507 lesiones: pudieron ser aplicadas también al 76% de ellas, con una sensibilidad del 95% y una especificidad del 91%24.
Parámetros ecográficos valorados en las simple rules (Timmerman et al., 2008)
| Reglas para predecir malignidad (M-rules) |
| M1 Tumor sólido irregular |
| M2 Presencia de ascitis |
| M3 Al menos 4estructuras papilares |
| M4 Tumor multilocular sólido irregular con diámetro ≥100mm |
| M5 Flujo sanguíneo muy intenso (score de color 4) |
| Reglas para predecir benignidad (B-rules) |
| B1 Unilocular |
| B2 Presencia de componentes sólidos donde el mayor tiene un diámetro mayor a 7mm |
| B3 Presencia de sombras acústicas |
| B4 Tumor multilocular liso con diámetro < 100mm |
| B5 Ausencia de flujo sanguíneo (score de color 1) |
Teniendo en cuenta los buenos resultados, la aplicación de estas reglas podría ofrecer a ecografistas con poca experiencia una buena precisión diagnóstica, además de ser un método de aplicación sencilla en la práctica clínica. Sin embargo, una importante limitación de este sistema de clasificación es el alto porcentaje de lesiones (alrededor del 25%) en las que estas reglas no son aplicables, debido a que no todas las masas anexiales presentan características claramente predictivas de benignidad o malignidad. Cuando no son aplicables, las opciones podrían consistir en remitir a la paciente a un ecografista experto como un segundo test diagnóstico, considerar como malignas las lesiones no concluyentes o realizar una resonancia magnética en las masas difíciles de clasificar25.
Sistemas de puntuaciónSe han propuesto diversos sistemas de puntuación o scores que pretenden objetivar y hacer posible la reproducción interobservador de la valoración de las lesiones ováricas y que ecografistas menos expertos consigan una mayor precisión diagnóstica26. De estos, el RMI, desarrollado por Jacobs et al. en 1990, es probablemente el más usado, dado que no es necesaria una gran experiencia para detectar las características ecográficas que deben ser puntuadas; incluso se ha propuesto en una revisión sistemática reciente como el sistema de clasificación con un mejor rendimiento12,15. Además, es el modelo para el cual se han realizado más trabajos de validación externa15.
Este índice se calcula por un algoritmo basado en diferentes variables y se define como RMI=U×M×CA125, donde U es el score ecográfico, M el estado menopáusico y CA125 el nivel del marcador. U es calculado dando un punto a distintos parámetros ecográficos (multilocularidad, áreas sólidas, bilateralidad, ascitis y metástasis intraabdominales), de forma que un score de 0, 1 y ≥2 puntos otorga a la variable U los valores de 0, 1 y 3 respectivamente. La variable M adquiere valor de 1 en caso de premenopausia y de 3 en caso de posmenopausia. Estos valores, junto al de CA125 en U/ml, son introducidos en la ecuación, de forma que un valor ≥200 es sugestivo de malignidad2,12.
En diversos estudios este modelo ha mostrado buenos resultados en cuanto a su rendimiento diagnóstico general y en su comparación con modelos totalmente objetivos como el ROMA, aunque resulta inferior al ser comparado con el pattern recognition1,2,15,27,28.
Modelos de regresión logísticaLos modelos de regresión logística tienen como objetivo estimar una probabilidad (un riesgo individualizado de malignidad) en función de factores o variables predictoras o independientes. Presentan el inconveniente de que necesitan un software informático y que en ocasiones su aplicación puede resultar compleja. Además, se ha apuntado que su aplicación no mejora los resultados del pattern recognition.
Los primeros modelos de regresión logística desarrollados para el triaje de las lesiones anexiales fueron propuestos a finales de los años 9019,29. Sin embargo, los resultados de los primeros estudios de validación externa no fueron demasiado prometedores, con sensibilidad y especificidad en alguno de ellos del 62 y 79%, respectivamente22. Para mejorar estos resultados, el grupo IOTA desarrolló en 2005 un modelo, el LR2 (Logistic Regresión model), en un estudio con 1.066 pacientes y con la valoración de más de 50 variables30. Inicialmente fue desarrollada una versión con las 12variables más importantes para el cálculo de probabilidad de malignidad (LR1) y se propuso posteriormente un modelo reducido con las 6variables con mayor impacto (LR2): edad (1), ascitis (2), flujo sanguíneo en proyección papilar (3), diámetro máximo del componente sólido (4), paredes quísticas internas irregulares (5) y sombras acústicas (6).
LR2 estima la probabilidad de malignidad para una lesión anexial con la fórmula 1/(1+exp(−z)), donde z=−5,3718+0,0354(1)+1,6159(2)+1,1768(3)+0,0697(4)+0,9586(5)−2,9486(6), considerándose un punto de corte de probabilidad de 0,1 (10%) para clasificar las lesiones como benignas o malignas. Una ventaja de LR2 es que proporciona un riesgo absoluto de presentar un cáncer de ovario, lo cual puede contribuir a aconsejar a la paciente y tomar una decisión terapéutica compartida25. Además, aunque la fórmula matemática anterior pueda parecer de cálculo complejo, para facilitar su aplicación práctica, el grupo IOTA ha desarrollado aplicaciones para dispositivos móviles que permiten obtener su resultado de forma inmediata para una lesión anexial sin necesidad de realizar cálculos matemáticos complejos.
En los estudios de validación interna y externa de este modelo los resultados han sido favorables, con una sensibilidad por encima del 90% en todos ellos y un mejor rendimiento diagnóstico en su comparación con otros sistemas como RMI o ROMA29–31. De forma general, los modelos propuestos por el grupo IOTA han presentado mejores resultados que los modelos no desarrollados por IOTA: son LR1 y LR2 los que han mostrado el mejor rendimiento diagnóstico32.
Marcadores tumoralesPara dotar de la mayor objetividad posible a los modelos predictivos, se han desarrollado algoritmos que incluyen únicamente el uso de biomarcadores para realizar el triaje de las lesiones anexiales, como el ROMA o el OVA-18,33.
El marcador tumoral clásicamente empleado en el diagnóstico de las masas anexiales ha sido el CA125. Su valor es limitado al encontrarse elevado en menos de la mitad de las neoplasias ováricas en estadios tempranos, no ser expresado en un 20% de los tumores epiteliales de ovario y estar aumentado en enfermedades ginecológicas benignas en mujeres premenopáusicas y en enfermedades médicas en la posmenopausia, por lo que su uso sistemático no aporta mejor información clínica que la ecografía realizada por expertos8,21,34,35.
El nuevo biomarcador que ha mostrado mejores resultados ha sido el HE4, secretado, entre otros tejidos, por el aparato genital femenino y sobreexpresado en cánceres ováricos serosos y endometrioides. Está elevado en más del 80% de las neoplasias epiteliales ováricas y menos frecuentemente que el CA125 en enfermedad benigna en mujeres premenopáusicas. Además, aumenta en más del 50% de los tumores que no expresan CA125, con lo que la suma de HE4 a CA125 permite la detección de neoplasia en pacientes con tumores que no expresan CA125, lo que aumenta la sensibilidad para la determinación del riesgo de malignidad de una masa anexial36,37.
La combinación de HE4 y CA125 presenta la más alta sensibilidad entre las diversas combinaciones de marcadores tumorales37, lo que fue empleado en 2009 en el desarrollo del ROMA, incorporando ambos marcadores a una serie de algoritmos matemáticos para clasificar las masas anexiales en bajo o alto riesgo de malignidad8.
En estudios de validación posteriores los resultados han sido contradictorios. Mientras en algunos de ellos el ROMA se presenta con mejores resultados que otros modelos como el RMI, argumentando que los algoritmos basados en los biomarcadores presentan inherentemente una naturaleza objetiva y que la omisión de medidas subjetivas facilita la reproducibilidad entre centros8, en otros se señala que este algoritmo o el uso del HE4 no supera a otros test diagnósticos que emplean CA125 como biomarcador único31,38, y que pueden incluso empeorar el rendimiento diagnóstico global en caso de emplearse tras la valoración ecográfica por un experto23.
Nuevas estrategias de triajeLa utilidad relativa en la práctica clínica de los diferentes modelos predictivos propuestos y los resultados en muchos casos contradictorios de los estudios en los que se han evaluado han llevado a que se hayan propuestos nuevas estrategias para lograr una mayor precisión en la clasificación de las lesiones anexiales.
Uno de estos nuevos modelos consiste en un sistema en 2pasos. En un primer paso se realiza la valoración ecográfica subjetiva de la lesión anexial y posteriormente se mide el nivel sérico de HE4 o se aplica el algoritmo ROMA. Sin embargo, en un estudio de validación de este modelo, si en un primer paso el ecografista proponía un diagnóstico de benignidad o malignidad, la medición posterior del HE4 o la aplicación del ROMA mejoraba muy ligeramente, e incluso en algunos casos empeoraba, los resultados en términos de sensibilidad y especificidad. Incluso al aplicar el segundo paso a las lesiones difíciles de clasificar para un ecografista experimentado, se obtuvo una baja capacidad de clasificación con una pobre sensibilidad, con lo que esta estrategia en 2pasos no parece útil para mejorar el rendimiento diagnóstico de la valoración ecográfica por expertos (tabla 3)23.
Rendimiento diagnóstico de la estrategia en 2pasos para la clasificación de las lesiones anexiales (Kaijser et al., 2014)
| Sensibilidad (IC 95%) | Especificidad (IC 95%) | |
|---|---|---|
| Masas anexiales clasificadas como benignas | ||
| IS | 97,2 | 89,8 |
| IS+HE4 (<70pmol/l) | 97,9 | 79,6 |
| IS+ROMA | 97,9 | 75,9 |
| Masas anexiales clasificadas como malignas | ||
| IS | 97,2 | 89,8 |
| IS+HE4 (≥70pmol/l) | 73,6 | 94,9 |
| IS+ROMA | 83,3 | 91,7 |
HE4: human epididymis 4; IS: impresión subjetiva; ROMA: Risk of Ovarian Malignancy Algorithm.
Otra de estas nuevas estrategias consiste en un modelo de valoración ecográfica de las lesiones anexiales que supone tanto una clasificación de su riesgo de malignidad como un nuevo sistema de comunicación de la información para los clínicos, denominado GI-RADS (Gynecologic Imaging Reporting and Data System) y basado en el sistema BI-RADS empleado para las lesiones mamarias. Clasifica las lesiones anexiales en GI-RADS 1 (definitivamente benigna), GI-RADS 2 (muy probablemente benigna), GI-RADS 3 (probablemente benigna), GI-RADS 4 (probablemente maligna) y GI-RADS 5 (muy probablemente maligna). Esta clasificación define el riesgo de malignidad basado en datos de estudios previos y orienta al clínico en el abordaje terapéutico: conducta expectante frente a cirugía por el ginecólogo general o cirugía por un ginecólogo oncólogo39. El modelo ha sido validado internamente con resultados prometedores (sensibilidad del 92% y especificidad del 97%) y externamente por 2grupos, que han obtenido también un buen rendimiento diagnóstico (sensibilidad del 99% y especificidad del 86-90%)39–42.
Recientemente el grupo IOTA ha propuesto un sistema de triaje basado en la aplicación de 3pasos (three-step strategy) que parece proporcionar mejores resultados que los modelos previos y una mayor aproximación a la realidad clínica. En un primer paso denominado «diagnóstico fácil inmediato» (easy «instant» diagnosis), a las lesiones anexiales les son aplicados 6descriptores (4 de benignidad y 2de malignidad) basados en la información ecográfica y en los niveles del CA125 (tabla 4), de forma que, si ninguno de los 6descriptores es aplicable a la lesión o se pueden aplicar uno benigno y uno maligno, el diagnóstico es considerado difícil y «no inmediato». En un segundo paso, los casos en los que no se puede realizar el diagnóstico inmediato son valorados a través de las simple rules. Finalmente, el tercer paso consiste en la valoración subjetiva por un ecografista experto en los casos en los que no pueda realizarse un diagnóstico con los 2pasos previos. En la estrategia en 3pasos se apuntó en su estudio de validación interna una sensibilidad y especificidad global por encima del 92%: se observó que aproximadamente el 50% de las lesiones pueden ser diagnosticadas de forma inmediata, sin dificultad, por la mayoría de los clínicos (paso 1) y que el 80% son diagnosticadas con los 2primeros pasos por ecografistas no expertos. Cuando los 2primeros pasos no son concluyentes, la evaluación subjetiva por un experto (paso 3) es el test diagnóstico más preciso, mientras que RMI, LR1 y LR2 no resultan útiles43. En los escasos estudios de validación externa de este sistema realizados hasta el momento, los resultados han sido todavía mejores que los iniciales, con una sensibilidad del 93-94% y una especificidad del 92-95%44,45. De esta forma, esta valoración combinada podría cambiar la práctica clínica, al proporcionar una clasificación precisa e inmediata de la mayoría de las masas anexiales: es reducido el número de pacientes que requerirían ser derivados a un centro de referencia para el examen ecográfico por un experto.
Descriptores instantáneos en el sistema de diagnóstico en 3pasos de IOTA (Ameye et al., 2012)
| Predictores de benignidad |
| Tumor unilocular con ecogenicidad en vidrio esmerilado en mujer premenopáusica |
| Tumor unilocular con ecogenicidad mixta y sombras acústicas en mujer premenopáusica |
| Tumor unilocular anecoico con paredes regulares y máximo diámetro<100mm |
| Tumor unilocular restante con paredes regulares |
| Predictores de malignidad |
| Tumor con ascitis y al menos flujo vascular moderado con Doppler color en mujer posmenopáusica |
| Edad>50 años y CA125>100 U/ml |
Por último, también el grupo IOTA ha desarrollado recientemente el modelo predictivo de regresión logística multinomial Assessment of Different Neoplasias in the adneXa (ADNEX) con el objetivo de dar un paso más en la discriminación entre tumores ováricos benignos y malignos al intentar discriminar entre 5tipos de tumores anexiales (benignos, borderline, invasivos en estadio I, invasivos en estadios II-IV y metastásicos). Para ello valora 3variables clínicas (edad, nivel de CA125 y tipo de centro hospitalario) y 6ecográficas (diámetro máximo de la lesión, proporción de tejido sólido, presencia de más de 10lóculos, número de proyecciones papilares, presencia de sombra acústica y presencia de ascitis). En su estudio de validación interna, el rendimiento diagnóstico del modelo mostró en la discriminación entre lesiones benignas y malignas (con un punto de corte del 10% para predecir malignidad) una sensibilidad del 96,5% y una especificidad del 71,3%, con una buena capacidad para distinguir entre sí los 5tipos de tumores, lo que es planteado por los autores como un sistema con una buena capacidad para mejorar las decisiones terapéuticas en mujeres con lesiones anexiales46.
Limitaciones en la aplicación clínica de los modelos predictivosNinguno de los modelos predictivos propuestos para la clasificación de las lesiones anexiales ha logrado una aceptación generalizada ni su empleo sistemático en la práctica clínica habitual. Esto puede obedecer a las limitaciones que han mostrado los estudios tanto de propuesta como de validación de los modelos.
Existen pocos trabajos de validación externa para la mayoría de los modelos de predicción: hasta 2013, solo 19 de los 116 modelos propuestos habían sido validados externamente en al menos 2 estudios11. Además la mayoría de ellos son de tipo retrospectivo y con sesgos en su diseño como la falta de la valoración ciega por parte de los investigadores o ecografistas. De hecho, en los trabajos de validación realizados prospectivamente la mayoría de los modelos presentaron peores resultados que en los estudios en los que fueron creados17.
Tampoco se han desarrollado muchos trabajos de comparación directa entre modelos, entre otros motivos porque los puntos de corte adoptados varían y porque en algunos casos cada uno emplea variables diferentes, lo que complica la interpretación y la comparación de resultados. Además, la mayoría de los estudios de validación no estratifican los resultados en función de variables importantes como el estado menopáusico, por lo que las conclusiones podrían no ser del todo correctas cuando no se produce esta estratificación o se realiza con posterioridad a la clasificación de las lesiones.
Además, aunque su objetivo es que ecografistas con un nivel bajo de competencia puedan proporcionar un diagnóstico de benignidad/malignidad con una precisión adecuada, muchos modelos han sido desarrollados y validados por ecografistas expertos que habrían podido determinar el diagnóstico mediante el pattern recognition, lo que habría contribuido positivamente a la precisión de estos modelos16.
Muchos estudios se han desarrollado en centros de referencia con unidades de ecografía especializada y con una alta prevalencia de lesiones malignas, lo que implica una influencia en los resultados de los valores predictivos. De esta forma, en centros de referencia, la mayor prevalencia de cáncer de ovario haría que el valor predictivo positivo tendiera a disminuir, mientras que en hospitales pequeños con baja prevalencia de cáncer ovárico, un test con la misma sensibilidad y especificidad tendría un valor predictivo positivo más bajo. Además, en los centros de referencia la experiencia de los ecografistas es mayor y, en consecuencia, mejor el rendimiento diagnóstico ecográfico.
Por otra parte, la mayoría de los trabajos están realizados con pacientes intervenidas quirúrgicamente, con el estudio histológico como gold standard de diagnóstico final. Sin embargo, existe poca información de pacientes en las que se haya optado por una conducta expectante y sobre los resultados de esta opción terapéutica en forma de errores de clasificación, complicaciones o transformación maligna. Además, en gran parte de los estudios solo se valora la variable dicotómica «benigno/maligno», sin considerar que existen diversos tipos de enfermedad maligna (borderline, estadio temprano/avanzado, metástasis de neoplasias no ováricas) cuyo manejo terapéutico es diferente.
Finalmente otro problema que ha hecho que estos sistemas predictivos no se hayan consolidado ha sido la falta de semejanza de las condiciones de los estudios con la práctica clínica habitual. Los estudios realizados para su desarrollo y validación han incluido todo tipo de lesiones anexiales, con independencia de si en la práctica clínica real estas lesiones podrían haber sido fácilmente diagnosticadas por los ecografistas. Como resultado, la precisión diagnóstica de estos test probablemente haya sido sobrestimada y su rendimiento puede resultar peor del esperado al ser aplicados en la clínica más allá del entorno de investigación43.
ConclusionesEl diagnóstico preciso y precoz de la benignidad o malignidad de una lesión anexial resulta fundamental para la orientación terapéutica adecuada de las pacientes, con la ecografía como el método de elección en este proceso diagnóstico. Hasta el momento, el método de triaje que ha demostrado mejores resultados ha sido la valoración subjetiva de ecografistas expertos, aunque presenta los inconvenientes de su gran dependencia de la subjetividad y competencia del ecografista y de la dificultad para su reproducibilidad interobservador.
Para intentar lograr una mayor objetividad en la clasificación de las lesiones anexiales y un más alto nivel de precisión diagnóstica por ecografistas con menos nivel de experiencia, se han desarrollado múltiples modelos predictivos basados en el análisis de variables ecográficas, epidemiológicas y clínicas de las pacientes, así como en el valor de diferentes marcadores tumorales, sin que ninguno de ellos haya demostrado mejores resultados que la valoración subjetiva por expertos, lo que puede deberse en gran medida a la dificultad y a los sesgos en el planteamiento y diseño de los estudios para su desarrollo y validación.
Como nuevas estrategias de clasificación se han propuesto modelos consistentes en la aplicación sucesiva de diferentes sistemas de triaje complementarios, para intentar mejorar los resultados de la aplicación de cada uno de ellos de forma aislada. Aunque los buenos resultados obtenidos en la validación interna de algunos de ellos y su accesible aplicación práctica señalan que podrían proporcionar una buena aproximación a la realidad clínica, deben realizarse más estudios para su validación externa. Esto resulta de gran importancia, dado que se ha observado que los modelos diagnósticos predictivos presentan mejores resultados al aplicarlos en las poblaciones en las que fueron desarrollados, por lo que debe comprobarse si mantienen su rendimiento diagnóstico en diferentes poblaciones y situaciones clínicas.
Conflicto de interesesLos autores firmantes de este artículo declaran no haber contado con fuentes de financiación para su elaboración ni presentar ningún tipo de conflicto de intereses que pueda ser relevante para su publicación.