La invasión trofoblástica es crítica para el establecimiento de la circulación uteroplacentaria. La fase inicial de este proceso se realiza en ambientes hipóxicos que patológicamente durante la preeclampsia permanecen sostenidos. Por tanto, es importante entender el comportamiento de las células placentarias frente a estos estímulos. En el presente trabajo se utilizan cultivos primarios de células trofoblásticas (CT), fibroblastos de las vellosidades y células endoteliales de cordón umbilical, aisladas de placentas pretérmino y a término (con y sin preeclampsia), para explorar el efecto de la presión de oxígeno en la expression y síntesis de VEGF, sVEGFR-1, HIF-1α y 2α. Nuestros resultados muestran que la presión reducida de oxígeno resultó en un incremento significativo del ARNm y la proteína del receptor sVEGF-R1 de manera selectiva en las CT. La expresión y síntesis de VEGF se encontraron elevadas en los 3 tipos celulares, pero la proteína libre (no unida al sVEGF-R1) se encontró disminuida en las CT. Por otro lado, no hubo diferencias significativas en la expresión del ARNm de HIF-1α o 2α, pero sí en la proteína de HIF-2α. Para evaluar la relación de HIF-2α y el incremento del receptor sVEGFR-1, se utilizó siARNHIF2 α. En respuesta a la inhibición, la expresión del receptor sVEGF-R1 disminuyó dramáticamente. El bloqueo de HIF-2α no alteró la expresión de VEGF. Nuestros resultados son los primeros en proponer que el factor de transcripción HIF-2α es un regulador de la expresión selectiva del receptor sVEGF-R1 por CT en hipoxia.
Trophoblast invasion is critical for the establishment of uteroplacental circulation. At the early phases of this process, local oxygen pressure in the placenta is lower, which pathologically remains constant in preeclampsia. Consequently, understanding the response of placental cells to these stimuli is important. In the present study, we used primary cultures of trophoblast cells (TCs), fibroblasts from villous cells, and human umbilical endothelial cells isolated from preterm and term placentas (with and without preeclampsia) to explore the effect of oxygen pressure on the expression and synthesis of VEGF, sVEGFR-1/sFlt-1, and HIF-1α and-2α. Our results show that low oxygen pressure led to a significant selective increase in mRNA and the sVEGF-R1 receptor protein in TCs. VEGF expression and synthesis was elevated in three cell types, but free protein (not bound to sVEGF-R1) was decreased in TCs. Expression of HIF-1α or -2α mRNA in cells was similar in all the types of placentas, but the increase in HIF-2α protein was greater in the TCs of preeclamptic placentas. To evaluate the relationship between HIF-2α and the increase in the sVEGFR-1 receptor, we used siRNAHIF2α. In response to inhibition, expression of the sVEGF-R1 receptor diminished dramatically. HIF-2α blockade did not alter VEGF expression. Our data are the first to indicate that the HIF-2α transcription factor protein is one of the molecules involved in the selective expression of the sVEGF-R1 receptor in TCs during hypoxia.
La preeclampsia es una enfermedad tardía del embarazo con gran importancia en la morbimortalidad materna y neonatal1. La enfermedad se inicia con síntomas y signos vasculares tardíos de hipertensión, proteinuria y edema en diferentes grados de severidad, y ocasiona un grave riesgo materno-fetal2. Aunque hay diferentes puntos de vista acerca de la causa inicial que lleva a la progresión del proceso, la fisiopatología ha demostrado claramente que la enfermedad solamente ocurre en presencia de placenta, y remite rápidamente después de que ésta se ha retirado posparto3. Es así que las placentas de mujeres con preeclampsia muestran signos histológicos de baja perfusión e isquemia que globalmente se atribuyen a fallo en la invasión trofoblástica y a una deficiente remodelación de las arterias espirales uterinas4–6. Estas zonas isquémicas placentarias llevan a la producción de diferentes factores inflamatorios que al ingresar en la circulación materna ocasionan una progresiva disfunción endotelial característica central en la enfermedad7,8. Concomitantemente, se ha demostrado que entre estos factores liberados se encuentran moléculas antiangiogénicas producidas secundariamente a los ciclos de isquemia. Una de estas moléculas es el receptor soluble-1 del factor de crecimiento de endotelio vascular (sVEGF-R1 o sFlt-1), el cual se une directamente a moléculas angiogénicas como el VEGF o el factor de crecimiento placentario PIGF y ocasiona un síndrome similar a preeclampsia9–12. Sin embargo, se conoce poco acerca de cómo la isquemia/hipoxia puede afectar el balance angiogénico placentario debido a que el VEGF, una molécula proangiogénica, también está sobreexpresado en hipoxia13. Por otro lado, en los últimos años las consecuencias moleculares de la hipoxia celular se han revisado exhaustivamente y se ha demostrado la expresión de varios genes que modulan una respuesta adaptativa a este proceso14. La familia de genes más estudiada y relacionada en dicha respuesta forma parte de un grupo de factores de transcripción denominados factores inducidos por hipoxia HIF-1α15 y HIF-2α16. Ambas proteínas heterodimerizan con la proteína translocadora nuclear ARNT o HIF-1β14,15 para luego unirse a los elementos de respuesta a hipoxia en los genes. Aunque la identidad del sensor de oxígeno y los elementos de señalización celular ríoarriba aún permanecen sin conocer17, los mecanismos moleculares de la activación de HIF por hipoxia incluyen procesos como la estabilización de la proteína a degradación18,19, regulación redox con grupos tiol20 e interacción con la molécula CBP/p30021,22. Adicionalmente, se ha demostrado que los factores HIF son importantes en el desarrollo placentario en etapas primarias cuando la presión de oxígeno es baja (aproximadamente 20mmHg), y que su regulación en el proceso es proteico y no en el ARN mensajero (ARNm)23,24.
En este trabajo se reportan evidencias de los efectos de la hipoxia en la fisiopatología de la preeclampsia al demostrar: primero, que el aumento del receptor soluble-1 del VEGF es selectivo en células trofoblásticas (CT) en respuesta a valores bajos de oxígeno; segundo, que ese incremento está fuertemente ligado a la elevación del factor de transcripción HIF-2α en las CT, y tercero, que las CT, fibroblastos de las vellocidades (FV) y endoteliales de vena umbilical (HUVEC) de placentas preeclámpticas son más sensibles a la respuesta hipóxica que las de otro origen. Finalmente, la elevación del receptor soluble sVEGFR-1 en CT en respuesta a HIF-2α puede explicar un estado antiangiogénico que lleva a la remodelación deficiente de la vasculatura que se encuentra en la preeclampsia.
MATERIAL Y MÉTODOSÉticaTodos los procedimientos y permisos para el uso de tejidos placentarios se aprobaron por el Comité de Ética e Investigación del Hospital Nacional del Sur CASE EsSalud y mediante consentimiento informado de cada paciente.
Obtención de células y tejidos placentariosLos tejidos placentarios del primer trimestre (10–12 semanas de gestación) se obtuvieron de abortos espontáneos de 7 pacientes con consentimiento (pretérmino). Se extrajeron quirúrgicamente, de manera programada por cesárea, 7 placentas completas de 7 pacientes nulíparas por grupo del tercer trimestre (28–38 semanas de gestación) con y sin preeclampsia. El diagnóstico de preeclampsia se diagnosticó por médicos especialistas y de acuerdo con los criterios internacionales de la Sociedad Americana de Gineco-Obstetricia1. Ninguna de las pacientes tuvo eclampsia ni síndrome HELLP.
La placenta es un órgano heterogéneo, y más aún en la preeclampsia, donde hay zonas isquémicas focales que dependen del número de arterias espirales uterinas ausentes o con remodelación incompleta. Por tal motivo, conclusiones tomadas de estudios realizados por biopsias simples pueden estar equivocadas25. Para disminuir el sesgo de la heterogeneidad del tejido, inmediatamente después de la extracción placentaria se tomaron 16 muestras de manera sistemática (en rejilla), como reportaron anteriormente Mayhew et al25. Cada muestra de 0,5g incluyó decidua basal y vellosidades placentarias pero no la placa coriónica. Ocho de las muestras se lavaron en suero salino y se congelaron en nitrógeno líquido para su transporte al laboratorio y posterior evaluación de proteínas totales. El aislamiento de células y la subsiguiente extracción de ARNm y de proteínas se realizaron de los 8 tejidos biopsiados restantes de cada placenta. Los procedimientos para aislar CT de tejidos placentarios se comunicaron anteriormente26. Ocho de las 16 muestras por placenta se homogeneizaron y digirieron en PBS con un 0,125% de tripsina, 0,4mM de MgSO4 y 20 U/ml DNasa tipo 1 (Gibco BRL) por 30min a 37°C. El tejido digerido se pasó en una malla de 100μm de poro y las células se separaron utilizando gradientes de densidad en 3 capas de percoll (4ml al 40%, 4ml al 25% y hasta 15ml al 0%). Luego de centrifugar a 2.000rpm durante 20min, se recolectaron las células ubicadas entre las 2 capas más densas y se incubó con anticuerpos antiCD9 unidos a perlas magnéticas (30min a 4°C) para separar células estromales (Dako, Japan). Las células fibroblásticas FV se aislaron de las CT gracias al anticuerpo. Después de remover las perlas magnéticas de acuerdo con las instrucciones del fabricante, se procedió a cultivar en frascos utilizando medio 199 (Sigma) suplementado con 10% de suero fetal bovino (FBS, Sigma) y cubiertos con fibronectina. La pureza de los cultivos de las células CT y FV se confirmó por tinciones con anticitoqueratina y antivimentina26. Para el análisis de proteínas totales por western blot se analizaron las 8 biopsias restantes por placenta (56 muestras por grupo) evitando el sesgo por heterogeneidad del tejido25.
Cultivos de células endoteliales de venas umbilicalesLas células endoteliales de venas umbilicales (HUVEC) se obtuvieron de cordones umbilicales de las mismas pacientes, de donde se obtuvieron las placentas inmediatamente después del parto. La técnica de aislamiento también se ha comunicado anteriormente27,28. Las células aisladas se cultivaron con medio endotelial básico suplementado con un 1% de suero fetal bovino, factor de crecimiento fibroblástico, heparina, hidrocortisona, factor de crecimiento epidermal y factor de crecimiento similar a la insulina-1 (EGM-2, CAMBREX Bio Sciences). Las superficies de los frascos de cultivo se cubrieron con fibronectina (Sigma Chemical).
Estímulo hipóxicoLas condiciones de exposición al oxígeno se regularon por un incubador celular multigas (Sanyo-MCO-5M). Las células CT, FV y HUVEC se cultivaron en condiciones normóxicas (5% de CO2, 21% de O2 y 74% de N2 a 37°C) hasta alcanzar el 75% de confluencia; luego se trasplantaron a platos de 30mm cubiertos con fibronectina a una concentración de 1 × 104 células/ml en un volumen de 2ml, donde, al cabo de 3h se les aplicó la siguiente condición: 5% de CO2, 2% de O2 y 93% de N2 (a 37°C). Los grupos control continuaron con condiciones previas normóxicas. Las evaluaciones se realizaron 72h después del estímulo.
Ensayos inmunoenzimáticosLos sobrenadantes de los cultivos celulares en condiciones normóxicas e hipóxicas se recolectaron 72h después del inicio de los estímulos. Las concentraciones de VEGF libre y sVEGFR-1 se midieron utilizando ELISA tipo sándwich (R&D Systems). Las concentraciones de VEGF total (libre y unida) se evaluaron con EIA competitivo (Chemikine EIA, Chemicon Internacional). La dosis mínima detectable de los ensayos fue 7,5pg/ml para VEGF libre, 10pg/ml para sVEGFR-1 y 150pg/ml para VEGF total. Cuando las concentraciones fueron menores a los límites detectables se registraron como cero.
PCR en tiempo realEl ARN total se aisló de las células y tejidos utilizando un kit comercial de Trizol (Invitrogen Corp., México, DF). El ARN se cuantificó por espectrofotometría, tratado con ADNasa libre de ARNasa y pasado a cADN (Invitrogen Corp.). El cADN purificado se llevó a reacción de PCR en tiempo real. Las secuencias de primer y temperaturas de alineamiento se describen en la tabla I. Los transcriptos se cuantificaron usando SYBR Green en un ABI Prism 7000 (Applied Biosystems) y se analizaron por su propio software.
Secuencias de prímer para la RT-PCR en tiempo real
| SECUENCIA DEL PRIMER | TEMPERATURA ALINEAMIENTO (°C) | REFERENCIA | |
| VEGF | S:5-CGAAACCATGAACTTTCTGC-3 | ||
| A:5-CCTCAGTGGGCACACACTCC-3 | 63 | 12 | |
| sVEGF-R1 | S:5-GCACCTTGGTTGTGGCTGACT-3 | ||
| A:5-GAGCCCGGGGGTCTCATTATT-3 | 63 | 12 | |
| msVEGF-R1 | S:5-GCACCTTGGTTGTGGCTGACT-3 | ||
| A:5-CCCTTCTGGTTGGTGGCTTTG-3 | 60 | 12 | |
| HIF-1α | S:5-GCCCTAACGTGTTATCTGTCG-3 | ||
| A:5-TTGCTCCATTCCATTCTGTTC-3 | 63 | 29 | |
| HIF-2α | S:5-CAGCTCAGAGCTGAGGAAGG-3 | ||
| A:5-GTTGTAGACTCACTTGCC-3 | 65 | 30 | |
| β-actina | S:5-CGACAACGGCTCCGGCATGTGC-3 | ||
| A:5-CGTCACCGGAGTCCATCACGATGC-3 | 63 | 12 |
Las secuencias flanqueadas para VEGF toman regiones compartidas de las variantes de VEGF.
Las proteínas totales de los tejidos placentarios se extrajeron utilizando buffer Laemmli 1X (50mM de Tris–HCl [pH 6.8], 2% de SDS y 10% de glicerol) que contenía 7M de urea, 5mM de ditiotreitol, 0,5mM de fenilmetil sulfonil fluoruro y 1μg/ml de los inhibidores de proteasas leupeptina, aprotinina y pepstatina. Los tejidos se homogeneizaron durante 1min con un Tekmar Tissuemizer. El crudo se centrifugó a 6.000rpm a 4°C por 5min y el sobrenadante sonicado moderadamente por 10s. Luego se guardó el sobrenadante a −70°C hasta su determinación.
Para la extracción de proteínas de los cultivos celulares, se utilizó un kit de extracción (Pierce, Rockford) que utiliza PBS adicionado a 10μg/ml de fenilmetil sufonil fluoruro y 1:100 del cóctel de inhibidores de proteasa SET III (Calbiochem, San Diego). Se cargaron 20 a 50μg de proteína en geles con gradientes del 4-20% (Gradipore, French Forest) y corridos a 100V por 2,5h. Luego las proteínas se transfirieron a membranas de nitrocelulosa con alta afinidad de unión a proteínas (90V por 2h a 4°C). La cantidad de carga y transferencia de proteínas se evaluó inicialmente por tinción con Ponceau-S (Sigma Diagnostics). Después de bloquear la unión inespecífica con un 5% de leche sin grasa en buffer tris salino con un 0,1% de tween-20 por 3h a temperatura ambiente, las membranas se incubaron con un anticuerpo monoclonal anti-HIF-1α (dilución 1:200, BD Biosciences), o un anticuerpo policlonal contra HIF-2α (dilución 1:500, Novus Biologicals). Como control de carga se utilizó un anticuerpo monoclonal anti-β-actina (dilución 1:2.000, Sigma Diagnostics). Las membranas se lavaron en buffer TBS-T 3 veces por 10min cada uno y se incubaron con un anticuerpo secundario conjugado a peroxidasa (dilución 1:5.000, Sigma Diagnostics) por 1h a temperatura ambiente. Las membranas se lavaron nuevamente en PBS con y sin tween-20 3 veces por 10min. La quimioluminiscencia se adquirió usando un escáner con el programa NIH Image 1.63. La concentración de la proteína se determinó usando el kit Micro Bicinchoninic Acid Protein Assay (Pierce).
ARN de interferencia frente a HIF-2α en células células trofoblásticasLos ARN de interferencia frente a HIF-1α y HIF-2α (HIFα-siARN) se sintetizaron por xeragon/qiagen (Colonia, Germany). Como control negativo se usó siARN que secuencia luciferasa para el vector pGL2 (siARN 5 CGUACGCGGAAUACUUCGAdTdT)31. Todo el siARN se reconstituyó en condiciones libres de ARNasas de acuerdo con los protocolos del fabricante. Las CT de los 3 grupos (pretérmino, término con y sin preeclampsia) se transfectaron con el siARN cuando se encontraban al 70% de confluencia utilizando oligofectamina (Invitrogen) en medio de cultivo con antibiótico y libre de suero.
Análisis de datosLa prueba de Wilcoxon para datos independientes y para datos pareados permitió comparaciones para datos obtenidos de cultivos, en los que las células se aislaron de la misma placenta y se usaron en 2 condiciones de oxígeno diferentes (al 20 y al 2%). En cada experimento n = 7, que son el número de mujeres de las que se extrajeron las células y/o tejidos placentarios. Para la comparación de proporciones se utilizó la prueba de la χ2. Para evaluar las diferencias en las edades de las pacientes y demostrar la homogeneidad de los grupos estudiados se utilizó la prueba ANOVA de una vía y la prueba post-hoc de Tukey. En los análisis de resultados de PCR en tiempo real, la cantidad de ARNm se expresa como el número de transcriptos de interés normalizados con (β-actina. Todos los valores se presentaron como medias ± desviación estándar y se consideró como significativo valores de p < 0,05.
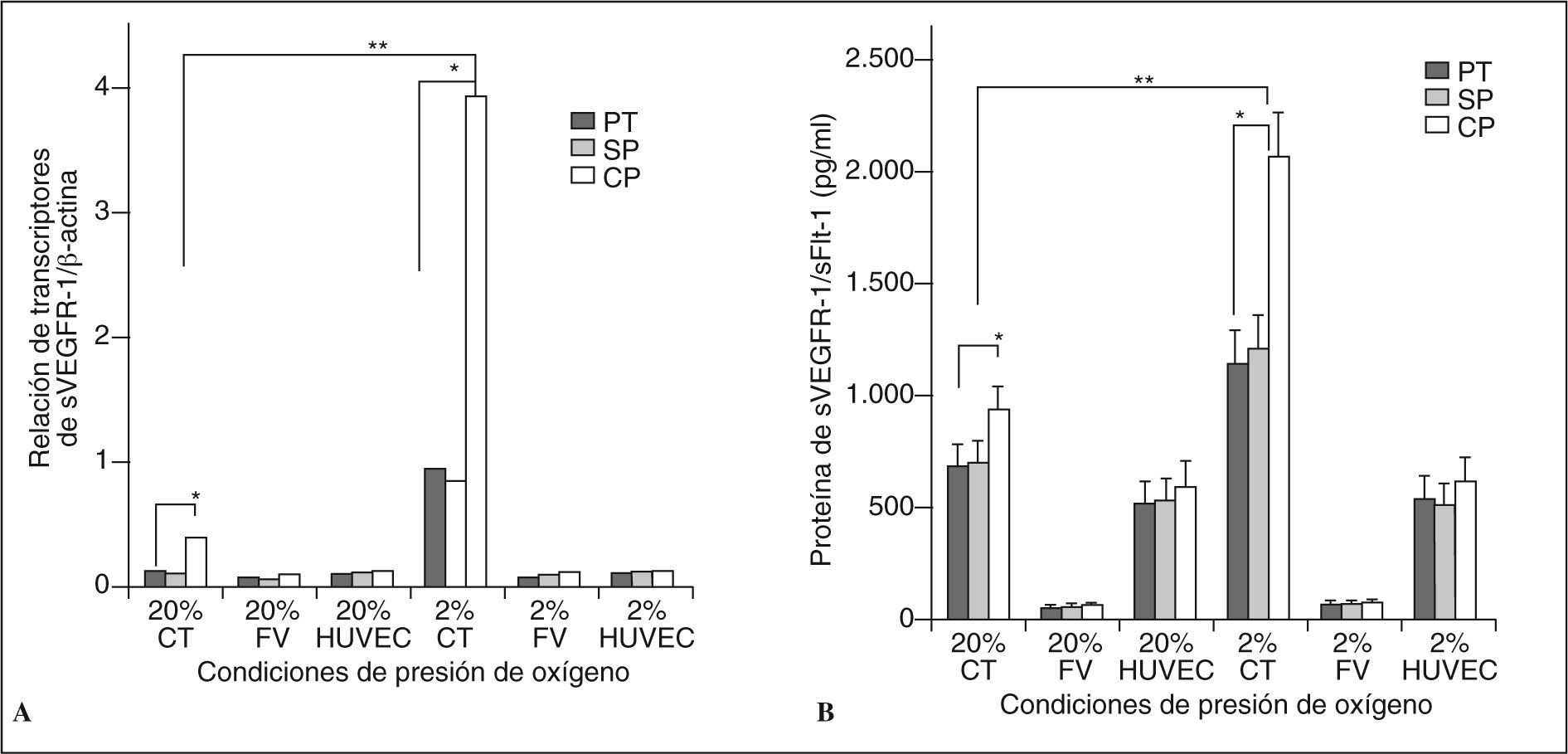
RESULTADOSExpresión y secreción de sVEGF-R1 en células placentariasDe manera preliminar, se observó la respuesta basal a hipoxia en las células placentarias extraídas (CT, FV y HUVEC) para determinar su viabilidad frente a condiciones bajas de oxígeno. Nuestros datos mostraron un incremento en la proliferación de hasta un 15% a las 72h postestímulo en las CT, de acuerdo con estudios anteriores12,32. Las células FV y HUVEC no tuvieron cambios significativos en este parámetro. Para determinar si la expresión de sVEGF-R1 (sFlt-1) está regulada por estímulos hipóxicos y las posibles diferencias entre células de placentas sanas frente a preeclámpsticas, se evaluó la expresión de ARNm del receptor de manera cuantitativa utilizando RT-PCR en tiempo real (fig. 1). Nuestros resultados muestran claramente que ante un estímulo hipóxico evaluado a las 72h, las CT incrementan significativamente su expresión (6,4 ± 2,2 veces en CTpt [pretérmino], 7,2 ± 2,34 veces en CTsp [sin preeclampsia] y 9,51 ± 2,65 veces en CTcp [con preeclampsia] al comparar con el estado normóxico; p < 0,01). Curiosamente, las células FV y las HUVEC no presentaron cambios importantes en la expresión del receptor frente a hipoxia (p > 0,05). A ambas condiciones de oxígeno las CT de pacientes preeclámpsticas presentaron una mayor respuesta traducida en la expresión del receptor comparadas a las provenientes de placentas sanas a término y pretérmino (3,78 ± 1,09 veces más que las FV y 3,55 ± 1,11 veces más que las HUVEC; p < 0,01) (fig. 1A). De manera similar, se observó un incremento en la expresión de la isoforma del receptor adherida a membrana msVEGF-R1 (2,31 ± 0,6 veces en CTpt; 2,48 ± 0,71 veces en CTsp, y 4,52 ± 1,21 veces en CTcp; p < 0,01 [datos no presentados en la fig. 1]). Para esta isoforma unida a membrana (msVEGFR-1) las células HUVEC también presentaron un incremento de la expresión frente a hipoxia (HUVECpt 0,9 ± 0,33 veces, HUVECsp 1,1 ± 0,32 veces, HUVECcp 1,51 ± 0,2 veces; p < 0,05, [datos no presentados en fig. 1]). Las concentraciones proteicas del receptor sVEGF-R1 en sobrenadantes del cultivo de CTcp evaluadas a las 72h mostraron un comportamiento similar al encontrado en la expresión del ARNm. Los valores de la proteína en condiciones normóxicas fueron de 934 ± 170pg/ml frente a 2.062 ± 203pg/ml en condiciones hipóxicas (p < 0,01) (fig. 1B). Los valores de la proteína en medios de cultivo de los 3 grupos de FV y HUVEC no difirieron entre las condiciones normóxica e hipóxica (FVcp: 55 ± 15pg/ml al 20% de O2 y 58 ± 12pg/ml al 2% de O2; HUVECcp: 590 ± 108pg/ml al 20% de O2 y 616 ± 102pg/ml al 2% de O2; p > 0,05). El comportamiento en las células con preeclampsia mostró también mayor cantidad de proteína secretada, tal como se observó en el análisis del sVEGF-R1-ARNm. Estos resultados certifican que las CT en ambientes hipóxicos son más sensibles a la expresión del receptor soluble-1 del VEGF a diferencia del resto de las poblaciones celulares.
Expresión y síntesis del receptor sVEGFR-1/sFlt-1 en células placentarias. A) Expresión del ARNm evaluado por PCR en tiempo real a las 72h de cultivo, sin y con el estímulo hipóxico. Los valores están representados por la media de la relación de transcriptos del receptor sFlt-1 entre los de β-actina ± DE. B) Síntesis de la proteína sFlt-1 evaluada en el sobrenadante de los cultivos celulares mediante ELISA tipo sándwich a las 72h, con y sin estímulo hipóxico. Los valores representan la cantidad de proteína en pg/ml ± DE.
*Comparaciones entre las CTpc frente a las CTpt y sp; p < 0,01. **Comparación entre las CT sometidas a hipoxia frente a las CT control; p < 0,01.
CP: con preeclampsia; CT: células trofoblásticas; FV: células de los fibroblastos de las vellosidades; HUVEC: células endoteliales de vena umbilical. PT: pretérmino; SP: sin preeclampsia. N = 7 para cada grupo, n es el número de placentas de donde se aislaron las células.
Los análisis en CT mostraron un incremento importante de VEGF-ARNm después de 72h con estímulo hipóxico del 2% de O2 con respecto a la expresión normóxica (3,4 ± 0,7 en CTpt, 3,7 ± 0,64 en CTsp y 5,1 ± 0,86 veces en CTcp; p < 0,01). Las células FV y las HUVEC también mostraron cambios importantes en la expresión de VEGF frente a la hipoxia (FV: 1,8 ± 0,3 en FVpt, 1,67 ± 0,32 en FVsp y 2,3 ± 0,7 veces en FICP; p < 0,05; HUVEC: 4,5 ± 1,1 en HUVECpt, 4,8 ± 1,5 en HUVECsp y 6,2 ± 1,2 veces en HUVECcp; p < 0,01) (fig. 2A). En ambas condiciones de oxígeno, las células CT, FV y HUVEC con preeclampsia presentaron mayores valores de ARNm que los grupos pretérmino y término sin preeclampsia (p < 0,05). Los ensayos ELISA tipo sándwich se utilizaron para evaluar el VEGF libre no unido al receptor sFlt-1 coexisten te en el medio de cultivo; mientras que el inmunoanálisis competitivo permitió evaluar el VEGF total11,12. Los valores de VEGF libre en los sobrenadantes de cultivo, en condiciones normóxicas, de las CT obtenidas de placentas pretérmino y a término sin preeclampsia fueron 14 ±4pg/ml y 16 ± 4,5pg/ml, mientras que no fueron detectables en los cultivos de CT pertenecientes a las pacientes preeclámpsticas (límite de detección del método, 7,5pg/ml). En condiciones hipóxicas los valores no fueron detectables en ninguno de los grupos de las CT (fig. 2B). En las células FV y HUVEC los valores de VEGF libre sí se incrementan significativamente en condiciones hipóxicas (p < 0,01), pero no presentan diferencias cuando se evalúa el factor de procedencia (pretérmino, sin preeclampsia y con preeclampsia, p > 0,05) (20% de O2: FVpt 19,3 ± 8,4pg/ml, FVsp 21,7 ± 9,2pg/ml, FVcp 24,5 ± 7,6pg/ml, HUVECpt 51,3 ± 14pg/ml, HUVECsp 53,3 ± 16,3pg/ml y HUVECcp 59,6 ± 17pg/ml, frente al 2% de O2: FVpt 44,2 ± 12,5pg/ml, FVsp 44,2 ± 15,1pg/ml, FVcp 50,4 ± 13,2pg/ml, HUVECpt 102,1 ± 24,5pg/ml, HUVECsp 103,7 ± 26,8pg/ml y HUVECcp 119,17 ± 32,5pg/ml).
Expresión y secreción de VEGF en células placentarias. A) Expresión del ARNm de VEGF después de 72h de estímulo hipóxico. Los 3 tipos celulares tienen índices similares en expresión del ARNm y presentan incrementos significativos en respuesta a hipoxia; p < 0,01. Todas las células del grupo con preeclampsia mostraron mayor incremento comparado con el resto, p < 0,05. Los valores representan la media de la relación entre el número de transcriptos de VEGF y el valor de β-actina ± DE obtenidos de 7 cultivos por tipo de célula producto de la lisis de 8 biopsias por placenta (n = 7) (véase detalles en «Material y métodos»).
*Comparación entre células sometidas a hipoxia frente a controles; p < 0,01.
**Comparación entre células provenientes de placentas con preeclampsia frente a las provenientes de placentas pretérmino y sin preeclampsia a 20% de O2; p < 0,05.
¿ Comparación entre células provenientes de placentas con preeclampsia frente a las provenientes de placentas pretérmino y sin preeclampsia a 2% de O2; p < 0,01. B) Secreción de VEGF-total y VEGF-libre por CT. Utilizando 2 métodos enzimáticos se determinaron los valores de VEGF-total y VEGFlibre (no unido a sFlt-1) 72h después del estímulo hipóxico. Las cantidades de VEGF libre no fueron detectables (< al límite de detcción de 7,5pg/ml) en condiciones de hipoxia a 2% de O2 ni en CTcp a 20%O2.
*Comparación entre CTpt y CTsp; p > 0,05.
**Comparación entre CTcp frente a CTpt o CTsp; p < 0,05.
***Comparaciones entre el grupo de CT a 20% de O2 frente a CT a 2% de O2; p < 0,01.
Los valores se expresan en pg/ml y representan la media ± DE.
CP: con preeclampsia; CT: células trofoblásticas; FV: células de los fibroblastos de las vellosidades; HUVEC: células endoteliales de vena umbilical. PT: pretérmino; SP: sin preeclampsia.
La concentración de proteína VEGF total en cultivos presentó un incremento en los estados de hipoxia en los 3 tipos celulares de manera significativa, con una mayor importancia en las células CTcp y HUVECcp, que mostraron un incremento de más del doble coincidente con la expresión del ARNm descrito más arriba (20% de O2: CTpt 197,3 ± 54pg/ml, CTsp 211,5 ± 45,1pg/ml, CTcp 302,4 ± 63,3pg/ml, frente al 2%O2: CTpt 315,6 ± 62,7pg/ml, CTsp 324,0 ± 70pg/ml, CTcp 451,5 ± 51,0pg/ml; p < 0,01) (fig. 2B). De manera similar a lo observado en la figura 1A, las concentraciones de proteínas totales fueron similares entre las células pretérmino y a término sin preeclampsia, pero ambas fueron diferentes de las células con la enfermedad (p < 0,01) (20% de O2: FVpt 89,3 ± 21pg/ml, FVsp 91,4 ± 20,2pg/ml, FVcp 133,0 ± 18,4pg/ml, HUVECpt 138,6 ± 58pg/ml, HUVECsp 142 ± 62,3pg/ml y HUVECcp 179,4 ± 70,1pg/ml, frente al 2% de O2: FVpt 122,4 ± 45pg/ml, FVsp 130,0 ± 41,5pg/ml, FVcp 184,7 ± 34,1pg/ml, HUVECpt 201,6 ± 34pg/ml, HUVECsp 212,0 ± 36,1pg/ml y HUVECcp 367,9 ± 46,6pg/ml). Estos resultados ratifican el hecho que frente a estados hipóxicos las células placentarias responden positivamente expresando VEGF, pero su presencia efectiva (VEGF libre) en el medio extracelular a las CT es contrarrestada por la sobreexpresión de sVEGF-R1. Nuestros datos indican que en preeclampsia las células presentan este fenómeno de manera más marcada.
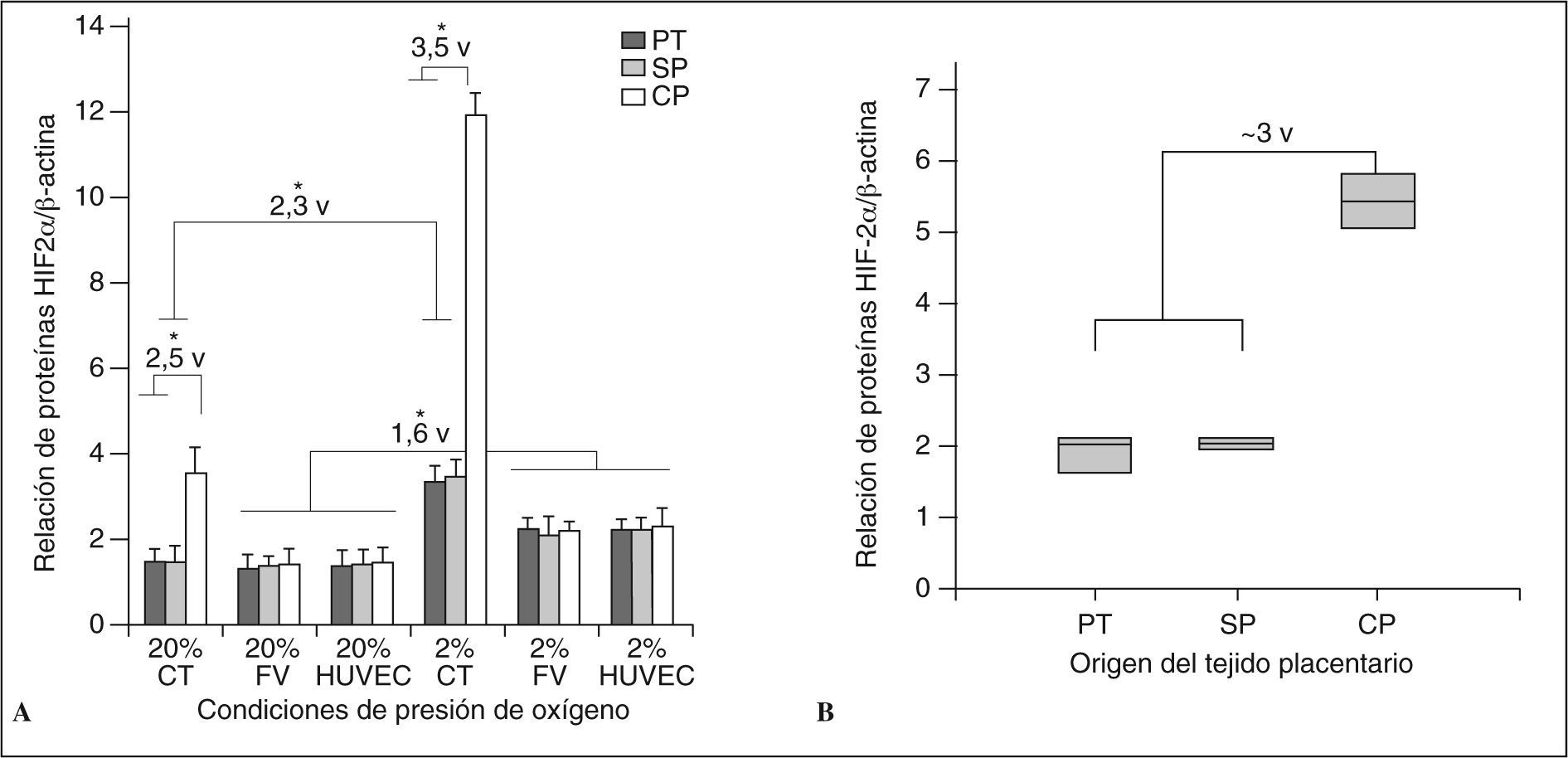
Expresión génica y de las proteínas de HIF-1α y HIF-2α en células placentariasLa tabla II resume los valores obtenidos de la relación de transcriptos de HIF-1α y 2α frente a β-actina. Los datos muestran que la expresión de ambos factores no es diferente estadísticamente entre los estados de procedencia de las células (pretérmino, sin preeclampsia y con preeclampsia) (p > 0,05) ni entre el tipo de célula. Sin embargo, frente a condiciones de hipoxia, la respuesta en las células CT es mayor para HlF-2a comparada con las células FV y HUVEC (p < 0,01), que incrementan también significativamente su expresión; pero nuevamente no existen diferencias entre las células procedentes de placentas pretérmino y a término con o sin preeclampsia (p > 0,05). Contradictoriamente a los hallazgos del ARNm, las proteínas de HIF-2α se encontraron incrementadas de manera significativa en las células CT comparadas con el resto, y más aún durante estados hipóxicos (fig. 3A). Además, de manera similar a lo observado con el receptor sVEGF-R1, las células CT provenientes de placentas con preeclampsia presentaron mayor incremento con respecto al resto en ambas condiciones de oxígeno (p < 0,01). La figura 3A muestra el incremento de la relación entre las proteínas HIF-2α/β-actina de 2,5 veces en células CT con preeclampsia con respecto a las células de placentas sanas (p < 0,01). Las células FV y HUVEC de placentas preeclámpsticas, en cambio, presentaron un incremento no significativo con respecto a las células correspondientes en placentas sanas. Sin embargo, la respuesta frente a hipoxia demostró un incremento en la producción de la proteína en todos los tipos celulares con respecto al estado normóxico, aunque las células CTcp incrementaron 3,5 veces el valor encontrado en las otras CT (pretérmino y sin preeclampsia) durante la hipoxia (p < 0,001). Concomitantemente, las células FV y HUVEC de pacientes preeclámpsticas sí presentaron un incremento significativo con respecto a sus correspondientes de tejidos sanos (p < 0,05) pero independientemente del origen como se observó en la expresión de su ARNm. Estos resultados confirman nuevamente la sensibilización de las CT en estado hipóxico y, más aún, durante estados patológicos sometidos a bajas presiones de oxígeno durante períodos prolongados, como es característico de preeclampsia.
Relación de la expresión de ARNm de HIF-1α y 2α normalizado con β-actina en diferentes células placentarias extraídas de tejidos pretérmino y a término con y sin preeclampsia
| OXÍGENO 20% | OXÍGENO 2% | |||||
| PRETÉRMINO (MEDIA ± DE) | TÉRMINO SIN PREECLAMPSIA (MEDIA ± DE) | TÉRMINO CON PREECLAMPSIA (MEDIA ± DE) | PRETÉRMINO (MEDIA ± DE) | TÉRMINO SIN PREECLAMPSIA (MEDIA ± DE) | TÉRMINO CON PREECLAMPSIA (MEDIA ± DE) | |
| HIF-1α/β-actina | ||||||
| CT | 1,23 ±.0,22 | 1,15 ± 0,19 | 1,27 ± 0,14 | 1,65 ± 0,31 | 1,58 ± 0,36 | 1,64 ± 0,27 |
| FV | 0,97 ± 0,16 | 0,99 ± 0,21 | 1,10 ± 0,24 | 1,62 ± 0,25 | 1,61 ± 0,38 | 1,65 ± 0,24 |
| HUVEC | 1,20 ± 0,2 | 1,22 ± 0,13 | 1,20 ± 0,25 | 1,62 ± 0,41 | 1,63 ± 0,38 | 1,62 ± 0,31 |
| HIF-2α/β-actina | ||||||
| CT | 1,74 ± 0,35 | 1,66 ± 0,42 | 1,79 ± 0,47 | 2,91 ± 0,35 | 2,89 ± 0,32 | 2,95 ± 0,41 |
| FV | 1,65 ± 0,29 | 1,59 ± 0,37 | 1,61 ± 0,36 | 2,11 ± 0,21 | 2,14 ± 0,18 | 2,21 ± 0,26 |
| HUVEC | 1,78 ± 0,42 | 1,75 ± 0,45 | 1,80 ± 0,44 | 2,36 ± 0,19 | 2,24 ± 0,24 | 2,30 ± 0,28 |
CT: células trofoblásticas; DE: desviación estándar; FV: células de los fibroblastos de las vellosidades; HUVEC: células endoteliales de vena umbilical.
Los datos muestras la media ± DE. Hay diferencias significativas al comparar los estados de normoxia frente a los de hipoxia sin importar el tipo celular ni la procedencia del tejido.
Expresión de la proteína HIF-2α en células y tejidos placentarios. A) Expresión diferencial de la proteína HIF-2α en células placentarias. Las CT de gestantes con preeclampsia expresan 2,5 veces más proteína que las CT de gestantes sanas (PT y SP) en estados normóxicos y 3,5 veces más en estados de hipoxia. En estado de hipoxia las CT de gestantes sanas incrementan 2,3 veces la expresión de la proteína, mientras que las provenientes de tejidos con preeclampsia hasta 3 veces. Las células FV y HUVEC expresan 1,6 veces más la proteína en estados hipóxicos sin diferencias significativas entre los tipos de células (PT, SP y CP). Los datos se muestran como la media de la relación de la proteína de HIF-2α frente a |-actina ± DE, obtenidos de 7 cultivos para cada tipo celular. B) Valores de la proteína HIF-2α extraída de placentas sanas (PT y SP) y placentas de gestantes preeclámpsticas (CP). Los tejidos placentarios con preeclampsia expresan cerca de 3 veces más la proteína HIF-2α con respecto a los tejidos placentarios sanos. El box plot expresa los percentiles 5 y 95 además de la media de cada grupo.
*p < 0,01.
CP: con preeclampsia; CT: células trofoblásticas; FV: células de los fibroblastos de las vellosidades; HUVEC: células endoteliales de vena umbilical. PT: pretérmino; SP: sin preeclampsia.
Para confirmar los resultados de los cultivos celulares, se utilizaron las 8 biopsias restantes de cada placenta (n = 7 para cada grupo) para extracción de proteínas. Los resultados, que se exponen en la figura 3B, confirmaron que los tejidos placentarios con preeclampsia expresan aproximadamente 3 veces más la proteína HIF-2α que los tejidos placentarios pretérmino y a término sin preeclampsia (p < 0,001). La proteína HIF-1α no presentó diferencias significativas, confirmando lo encontrado en los cultivos celulares. Este incremento de acuerdo con lo observado se debería, en gran parte, a la contribución de las células trofoblásticas durante la preeclampsia.
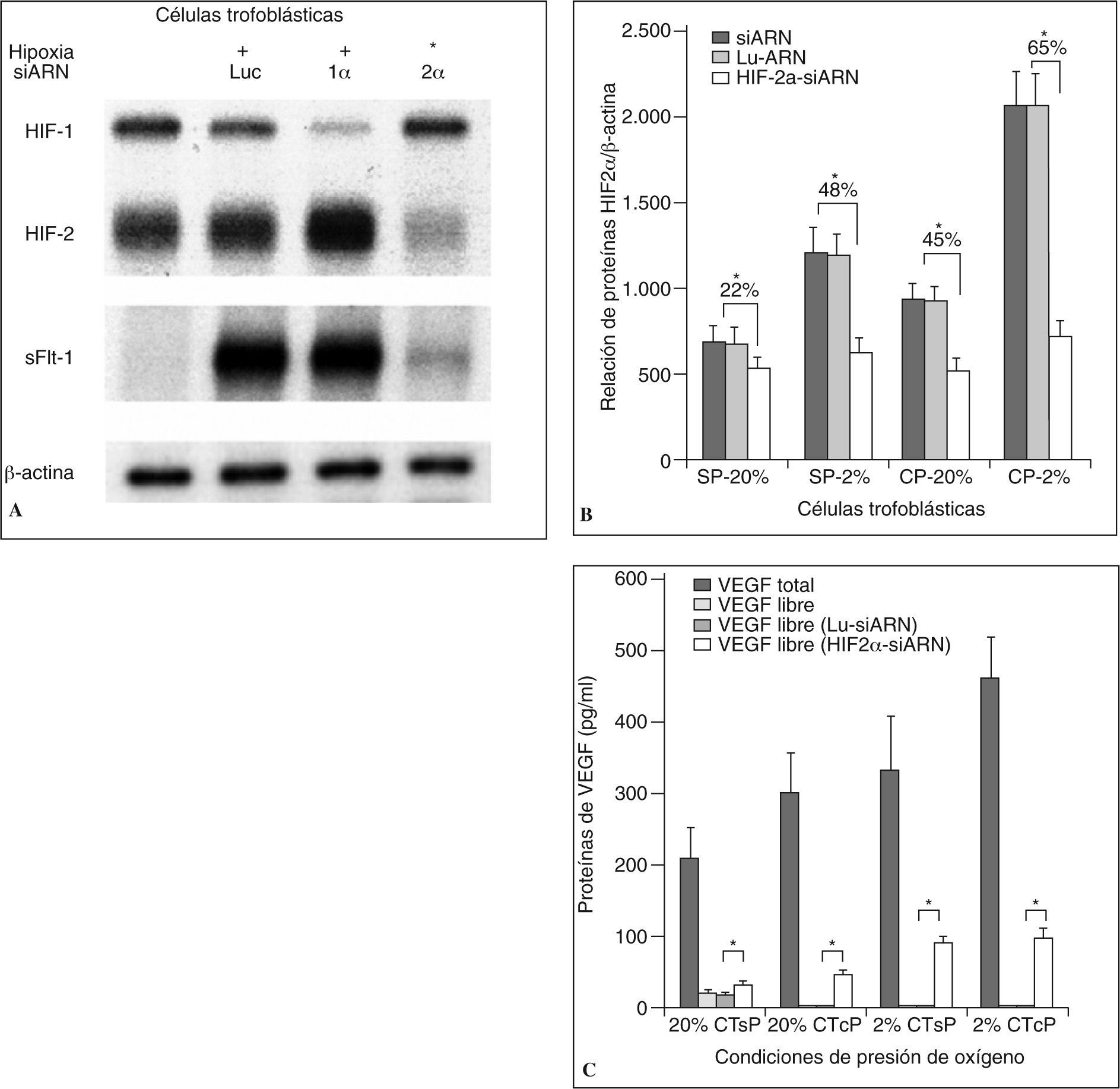
Inhibición de HIF-2α con siARN en células trofoblásticasDespués de observar el comportamiento similar entre la expresión del receptor sVEGF-R1 y el factor HIF-2α en las CT, se quiso probar la importancia de este factor en la regulación de expresión del primero. Para este propósito se utilizó ARN de interferencia contra HIF-2α (siARN-HIF2α) y se evaluó la expresión del receptor sFlt-1 en condiciones de hipoxia. Al someter las células CT de los 3 grupos a hipoxia, se observó un incremento de la expresión del HIF-2α y del receptor sVEGF-R1. De manera sorprendente, la inhibición del gen HIF-2α por el siARN bloqueó la expresión del receptor sFlt-1 (fig. 4A). Los resultados mostraron además que el siARN disminuyó de manera significativa los valores del receptor sVEGFR-1/sFlt-1 en ambas condiciones de presión de oxígeno, aunque fue más marcada durante ambientes de hipoxia (en condiciones de 20% de O2 las CTpt disminuyeron: 22,51%, las CTsp: 21,9% y las CTcp: 45,2% veces la expresión basal, y en condiciones de 2% de O2, las CTpt: 48,1%, las CTsp: 47,7% y las CTcp: 65,3% veces) (fig. 4B). El efecto observado al bloquear la expresión de HIF-2α se ratificó con el incremento de la proteína VEGFlibre en los sobrenadantes de los cultivos celulares de las CT. Los valores se volvieron detectables para el caso de las CT con preeclampsia al 20% de O2 y para las células que estaban en hipoxia (20% de O2, CTpt 29,2 ± 2,6pg/ml, CTsp 31,8 ± 3,1pg/ml, CTcp 45,5 ± 6,1pg/ml; 2% de O2, CTpt 95,7 ± 9,32pg/ml, CTsp 88,5 ± 8,7pg/ml2, CTcp 96,2 ± 12.3pg/ml) (fig. 4C). El uso de siARN-HIF-2α en células HUVEC no tuvo relación con la expresión de sFlt-1, lo que sugiere la presencia de otros factores reguladores en la expresión de este receptor en diferentes tipos celulares (datos no mostrados).
Reducción de la expresión de ARNm y proteína del receptor sFlt-1 inducida por el HIF-2α-siARN en CT. A) La inhibición del gen HIF-2α llevó a una marcada disminución en la expresión del sFlt-1 en los 3 tipos de CT sometidas a hipoxia. La figura es representativa de 4 experimentos por grupo de CT (40 ug ARN/carga). B) Reducción de la proteína del receptor sVEGFR-1/sFlt-1 inducida por el siARN frente a HIF-2α. Dado que las CTpt no tienen diferencias con las CTsp, la gráfica compara a estas últimas con las CTcp. Los números representan el promedio del porcentaje de disminución que presentan las CT sin ARN o con el siARN de control de la expresión de la proteína del sFlt-1 frente a las CT transfectadas con el siARN frente a HIF-2α. C) Comparación de la expresión de la proteína deVEGF libre (en pg/ml) detectada en los sobrenadantes después de transfectar con HIF-2α-siARN.
CT: células trofoblásticas; HIF2α-siARN: ARN de interferencia frente a HIF-2α; Lu-siARN: ARN de interferencia frente a luciferasa; SP: a término sin preeclampsia; CP: a término con preeclampsia. Los datos se expresan como la media ± DE; *p < 0,01.
Los resultados presentados en el presente trabajo sugieren que el factor HIF-2α es un regulador importante de la expresión del receptor sFlt-1 selectivamente en las CT placentarias durante cambios en la presión de oxígeno.
DISCUSIÓNEl presente trabajo es el primero en relacionar de manera directa la expresión del receptor soluble sFlt1 (sVEGFR-1) con HIF-2α. Aunque anteriormente se demostró la mayor expresión de factores HIF en preeclampsia33, poco se sabía de su relación con otros factores importantes en la fisiopatología de la enfermedad. De manera similar, aunque el receptor sFlt-1 presente una expresión incrementada en CT frente a hipoxia12,33 y se haya encontrado en el plasma de gestantes preeclámpsticas34,35, poco se ha estudiado acerca de los factores reguladores de esta expresión. En todos los casos tampoco se ha realizado comparaciones entre células sanas frente a células ya sensibilizadas previamente con períodos de hipoxia crónica, como ocurre en las placentas con preeclampsia.
En primer lugar, nosotros demostramos la expresión incrementada y selectiva de las 2 isoformas del receptor VEGFR-1, tanto soluble como unido a membrana, frente a estímulos de hipoxia en diferentes células placentarias. Las CT mostraron exclusividad en la expresión del receptor soluble, mientras que el receptor unido a membrana es expresado tanto por las CT como por las células HUVEC. Aunque se sabe que ambas isoformas del receptor se expresan por religación alterna del ARNm, los mecanismos por los que están regulados son poco conocidos. Nuestros resultados muestran una expresión preferencial por el receptor soluble en CT que no se explica por la unión de HIF-1 al promotor de VEGF-R1, como se ha comunicado anteriormente36, y que se observa en las células HUVEC, que incrementan el receptor unido a membrana frente a hipoxia12. De manera paralela, los resultados presentados muestran un incremento en la expresión, y secreción de VEGF en todas las células placentarias y preferentemente en las CT provenientes de placentas con preeclampsia. Ante estímulos de hipoxia las células CTcp muestran un comportamiento más intenso comparado con las mismas células en estado de normoxia, demostrando una sensibilización, posiblemente debida a ciclos crónicos de baja presión de oxígeno como ocurre normalmente durante la enfermedad. Curiosamente, la presencia de VEGF-libre en el sobrenadante de los cultivos de las células trofoblásticas se redujo en preeclampsia y mucho más cuando se aplicaron estímulos de hipoxia a los cultivos. Este fenómeno fue significativo en las células CT y no en las células FV y HUVEC, que frente a estados de hipoxia incrementaron sus valores de VEGFlibre como sucede normalmente. La relación inversa del incremento del receptor soluble y la disminución de VEGF-libre en células CT, demuestra claramente el efecto antiangiogénico que ocurre en estados patológicos de hipoxia crónica durante la evolución de la enfermedad. Pese a la respuesta compensatoria de expresión incrementada de VEGF total, tanto en el ARNm como en la proteína, la respuesta global es mermada por la unión del VEGF-libre con su receptor soluble, que está incrementado patológicamente en las células trofoblásticas.
La remodelación de la vasculatura uterina es un evento del desarrollo placentario que está a cargo de las CT, que bajan la resistencia y aumentan la conductividad de los vasos al reemplazar las células endoteliales maternas. Es necesario recordar que durante el desarrollo placentario temprano, normalmente hay baja presión de oxígeno, 18mmHg en lado fetal frente a 40mmHg en el lado materno entre las 8–10 semanas de gestación, y que aumenta por encima de los 60mmHg después que la circulación materna llega al espacio intervelloso después de la 12 semana de gestación24. Aunque el hecho de que las CT en ambientes hipóxicos incrementen un factor antiangiogénico como sVEGFR-1 en lugar de promover angiogénesis es contradictorio, este hecho se puede interpretar como un mecanismo regulador que normalmente frenaría la proliferación de las células endoteliales maternas con el consecuente control del efecto de remodelación vascular en los momentos tempranos del desarrollo placentario. Nosotros demostramos que las células CT provenientes de placentas con preeclampsia responden de manera más intensa que las aisladas de pacientes sanas; este hecho apoya la hipótesis de un fallo en la regulación del proceso de remodelación, el cual lleva a un efecto antiangiogénico global que posteriormente se traduce en una remodelación deficiente. Una mala invasión trofoblástica de las arterias uterinas llevará a continuos ciclos de hipoxia placentaria, que son la base del desarrollo de la enfermedad.
La comparación de los datos de edad gestacional entre pacientes a término y edad de las pacientes en los 3 grupos mostró que no habían diferencias significativas, lo que significa que fueron homogéneos entre sí para estas variables.
En todas nuestras comparaciones, frente a ambas condiciones de presión de oxígeno, se observó que las células provenientes de placentas pretérmino se comportaron de manera similar y sin diferencias significativas respecto a las provenientes de placentas a término de gestantes sanas. Dado que la hipoxia fisiológica temprana durante el desarrollo placentario se da en las primeras 10 semanas, para luego presentar un aumento de la presión de oxígeno a la semana 1224, nuestros datos concuerdan con esto, al no mostrar diferencias en la expresión del ARNm ni la proteína de VEGF, msVEGFR-1 ni sVEGFR-1 en células placentarias de las semanas 10 a 12 frente a células de las semanas 28 a 38.
Para evaluar posibles reguladores de la expresión del receptor soluble sVEGFR-1, estudiamos la expresión de los factores inducidos por hipoxia HIF-1α y 2α en cada uno de los casos previamente analizados. Aunque es conocido que el factor HIF-1 se une al promotor del receptor de membrana VEGFR-1, poco se sabe acerca de los reguladores de la religación alternativa de la forma soluble. Nuestros datos mostraron claramente que no hay diferencias significativas en la expresión del ARNm tanto de los factores HIF1α y 2α entre los 3 tipos celulares placentarios sin importar su origen (pretérmino, sin preeclampsia, con preeclampsia) cuando se evalúan al 20% de O2. En estados de hipoxia (2% de O2) los valores del ARNm se incrementaron significativamente como se esperaba fisiológicamente, pero curiosamente hubo diferencias significativas solamente entre las CT frente a las FV y HUVEC. Los resultados de la proteína, en cambio, mostraron un comportamiento diferente para el factor HIF-2α en las células preeclámpticas, con mayores diferencias en las CT. Para el factor HIF-1α tampoco hubo diferencias tal y como se observo con el ARNm.
Estos datos, que demuestran una expresión aumentada de la proteína HIF-2α en células con preeclampsia, corroborada en extractos de proteína total en biopsias, muestran primero que el grado de hipoxia e isquemia en las células con la enfermedad ocasiona un estado de expresión persistente de este factor no observado con el HIF-1α, además de incrementarse notoriamente cuando nuevamente las células son colocadas en estímulos hipóxicos. Dado que el hecho de tener preeclampsia es un factor de riesgo para subsiguientes embarazos37, el factor HIF-2α, considerado un buen marcador de estados hipóxicos38, en estos casos podría convertirse en un predictor molecular.
Nuestras observaciones concuerdan con comunicaciones anteriores de aumento del factor HIF-2α en proteína total en biopsias de placentas con preeclampsia33, pero ningún trabajo evidenció el tipo celular que contribuía de manera efectiva en dicho incremento. Los posibles mecanismos de mayor incremento en la proteína aún son poco conocidos, aunque se postula fuertemente que la regulación está en la vía ubicuitina-proteosoma que disminuye su degradación39 concomitante al incremento significativo de la expresión del gen en las células CT durante ciclos de baja presión de oxígeno característicos de placentas con preeclampsia. Aunque no hay evidencia de fallos en el sistema de degradación de la proteína HIF-2α en pacientes preeclámpticas, estudios posteriores podrían evaluar este punto más cuidadosamente, puesto que se observa un estado hipóxico persistente que normalmente debió desaparecer a las 12 semanas con el ingreso del flujo sanguíneo materno.
Aunque el efecto global de HIF-2α se da aparentemente por la proteína en la preeclampsia, quisimos demostrar la importancia de su expresión de novo en estímulos de hipoxia frente a la expresión del receptor soluble sVEGFR-1. Como se observa en la tabla II, frente a estímulos de hipoxia, las CT principalmente expresan mayor ARNm de HIF-2α. Al inhibir la expresión del factor HIF-2α utilizando siARN, sorpresivamente observamos que el receptor soluble sVEGFR-1 disminuyó su expresión dramáticamente hasta valores menores a los observados, incluso en condiciones de normoxia (20% de O2). Concomitantemente los valores de VEGF-libre se incrementaron hasta hacerse cuantificables sin variación de la cantidad de VEGF total. Estos datos sugieren que la expresión de HIF-2α de novo es importante en la expresión del receptor soluble frente al expresado previamente (acumulado). Nosotros postulamos que el incremento de HIF-2α en células preeclámpsticas podría deberse a acumulación de la proteína expresada por fallos en la degradación o por ausencia de mecanismos reguladores negativos durante los ciclos hipóxicos placentarios. Esto llevaría a respuestas más sostenidas y potentes en cada ciclo subsiguiente, como al estimular artificialmente los cultivos celulares a hipoxia.
Por otro lado, evidencias previas han sugerido que la presencia sostenida de HIF-2α evita el cambio del citotrofoblasto hacia un fenotipo invasivo, evitando un remodelamiento vascular completo32,40. Nuestros datos concuerdan con estas comunicaciones, dado que las CT responden a HIF-2α con un estado antiangiogénico persistente por la sobreexpresión del receptor sVEGFR-1 que antagoniza los efectos del VEGF. Esta información lleva a buscar en futuros trabajos alteraciones en la expresión de otros genes, en especial en las CT, que sean regulados por HIF-2α para comprender mejor la fisiopatología de la enfermedad.
En resumen, este trabajo demuestra de manera clara la regulación del receptor soluble sVEGFR-1 (sFlt1) por el factor HIF-2α de manera selectiva en células trofoblásticas cuando son sometidas a estímulos hipóxicos. La expresión de la proteína HIF-2α incrementada en células provenientes de placentas con preeclampsia permite postular un estado de hipoxia permanente que lleva selectivamente a las CT a fallar en la remodelación vascular necesaria para el adecuado desarrollo placentario. Finalmente, ésta es la primera comunicación de regulación directa del receptor soluble sFlt-1 por HIF-2α.