Describir la experiencia de nuestra Unidad de Patología Mamaria tras la implantación de la técnica molecular OSNA para la detección del ganglio centinela axilar en pacientes con carcinoma de mama y comparar los datos obtenidos con la técnica previa mediante estudio histológico de rutina.
Material y métodosSe compararon de manera retrospectiva 2 grupos de mujeres, uno de ellos de 148 pacientes con aplicación de técnica OSNA y el otro de 155 con estudio histológico habitual.
ResultadosEl número de ganglios axilares afectados con el método OSNA es comparable con el método anatomopatológico de rutina utilizado previamente (36,1% en HE y 36,5% en OSNA). La sensación subjetiva de mayor número de micrometástasis con OSNA se descarta tras el estudio retrospectivo de ambos grupos (11,6% en HE y 12,2% en OSNA).
ConclusiónSe puede aceptar la implantación del método OSNA como una técnica sensible, segura y reproducible para el estudio intraoperatorio del ganglio centinela en el proceso del tratamiento quirúrgico del cáncer de mama. La necesidad o no de linfadenectomía axilar en el caso de micrometástasis sigue siendo una incógnita.
To describe the experience of our Breast Pathology Unit after implementation of the OSNA assay for the detection of axillary sentinel nodes in patients with breast carcinoma and to compare the data obtained with those obtained by the previously used method of routine histological analysis.
Material and methodsTwo groups of women were retrospectively compared. One group included 148 patients diagnosed by using the OSNA assay and another group comprised 155 patients diagnosed by routine histology.
ResultsThe number of metastatic axillary nodes detected by OSNA was similar to that detected by the previously used routine histological method (36.1% using H&E and 36.5% by OSNA). The subjective feeling of an increased number of micrometastases detected by OSNA was excluded after retrospective study of the two groups (11.6% using H&E and 12.2% by OSNA).
ConclusionThe OSNA assay can be accepted as a sensitive, reliable and reproducible method for the intraoperative evaluation of sentinel nodes during surgical treatment of breast cancer. The need for axillary lymph node dissection in cases of micrometastases remains unclear.
El cáncer de mama es el tumor más prevalente en las mujeres, y puede llegar a afectar a una de cada 11 mujeres a lo largo de su vida. El estudio intraoperatorio del ganglio centinela (GC) se usa en la práctica habitual desde hace más de una década y su objetivo es realizar una cirugía mínimamente invasiva a nivel axilar dentro del tratamiento quirúrgico locorregional de la enfermedad.
Se denomina GC a la primera estación de drenaje de una región linfática que sería invadida por células tumorales, cuyo estado de afectación puede permitir suponer el estado del resto de los ganglios. Desde los años 90 se ha ido extendiendo su aplicación con el objetivo de minimizar la morbilidad creada por la linfadenectomía axilar. Con la técnica de extirpación GC se tiende a la cirugía mínima invasiva para el estudio patológico de la axila. Su valor clínico es que con una pequeña intervención es posible identificar, extirpar y con su estudio intraoperatorio determinar si existe metástasis regional o no.
La técnica de búsqueda del GC utiliza 2 tipos de marcadores: colorantes (desaconsejado su uso exclusivo) y sustancias coloides marcadas con un isótopo radioactivo (radiotrazadores), generalmente 99mTc, que se inyecta previamente a la cirugía. Mediante el uso de imágenes linfogammagráficas se puede obtener información del patrón dominante de drenaje y la presencia de drenajes únicos, múltiples o aberrantes. De forma intraoperatoria se realiza un rastreo con una sonda de radiación gamma portátil, que detecta un punto caliente con la emisión de una señal sonora que confirma la elección del sitio adecuado para la incisión quirúrgica que accede directamente en el punto de máxima intensidad de radioactividad. El trazador radioactivo también tiene una importante función para determinar cuándo se completa el procedimiento. Se denomina GC secundario a aquel que capta <10% de la actividad máxima. La sonda colocada en la herida operatoria después de extirpar cada uno de los ganglios con máxima radioactividad determina si queda alguno más con intensidad de radioactividad, en caso contrario, la operación está completada. Los criterios para la realización de la biopsia selectiva del GC1 se recogen en la tabla 1.
Criterios de realización de la biopsia selectiva del ganglio centinela
| Carcinoma T1 y T2, cuando la axila es clínica y ecográficamente negativa |
| CDIS extenso (>4 cm) y alto grado y/o comedonecrosis en los que se vaya a realizar mastectomía |
| Tumor multifocal |
| Cáncer de mama en el varón con las mismas indicaciones |
| Si se va a tratamiento neoadyuvante y axila clínica y ecográficamente negativa, debe realizarse previo al tratamiento |
| Biopsias o cirugías previas mamarias no lo contraindican |
| Posible uso en gestación o lactancia (si se suspende 24h antes) |
A continuación se trata de explicar las 2 técnicas de estudio intraoperatorio del GC.
- 1.
Estudio anatomopatológico histológico de rutina: se realiza mediante cortes por congelación y tinción hematoxilina-eosina. Ello implica realizar secciones a distintos niveles que permita detectar, por lo menos, metástasis de más de 2mm. Si no se objetiva tumor intraoperatoriamente, se debe completar el estudio mediante secciones del tejido restante, al menos cada 200micras, haciendo marcadores inmunohistoquímicos para detectar carcinoma oculto o micrometástasis si la técnica de HE es negativa.
- 2.
Técnica molecular One Step Nucleic Acid Amplification (OSNA): el sistema OSNA realiza en un solo tiempo el análisis completo del GC mediante la cuantificación de la expresión de ARNm de CK 19 por un método de amplificación isotérmica que consigue tiempos de amplificación de 16min. El escaso tiempo requerido para el procedimiento, que oscila alrededor de 30min, permite realizar un diagnóstico intraoperatorio de hasta 4 ganglios en paralelo, evitando la morbilidad y los costes de una segunda intervención. Por otra parte, el OSNA permite el estudio del ganglio linfático en su totalidad, evitando el «desperdicio» de tejido inherente incluso al procedimiento histológico más exhaustivo.
Probablemente, sin embargo, la gran ventaja del procedimiento consistirá en conseguir la imprescindible estandarización de resultados2 altamente sensibles y específicos a fin de poder comparar grupos pronósticos realmente semejantes que no dependan del procedimiento de estudio ni del patólogo que lo interprete3. En resumen, el sistema OSNA es una técnica de alta sensibilidad, especificidad y reproducibilidad diagnósticas en un tiempo limitado evitando reintervenciones innecesarias
Definiciones de GC positivo4,5:
- -
Macrometástasis: ≥2mm de diámetro de afectación en HE o ≥5.000 copias por técnica molecular.
- -
Micrometástasis: 0,2-2mm de diámetro sobre laminilla o ≥250<5.000 copias.
- -
Células tumorales aisladas: <0,2mm en laminilla o <250 copias (AJCC 7.ª edición).
La actitud a seguir según los resultados del GC es la siguiente. Si se confirma metástasis se debe practicar la linfadenectomía axilar. Si el resultado es de micrometástasis implica igualmente linfadenectomía. Sin embargo, algunos autores empiezan a cuestionar la necesidad de realizar linfadenectomía en dichos casos6. La existencia de células tumorales aisladas no implica la realización de ningún acto añadido.
Por todo ello, este estudio pretende determinar las características de las pacientes con cáncer de mama de nuestro centro y analizar los resultados obtenidos con ambas técnicas.
Material y métodosSe realizó un estudio descriptivo transversal retrospectivo entre enero de 2007 y diciembre de 2010 entre las pacientes operadas de un cáncer de mama en el Hospital de Txagorritu de Vitoria-Gasteiz (Álava).
Período de estudioDurante la primera parte del estudio, de enero del 2007 a diciembre del 2008, a las 155 pacientes atendidas en nuestro centro se les realizó estudio del GC mediante técnicas anatomopatológicas clásicas. Durante la segunda parte del estudio, de enero de 2009 a diciembre de 2010, se operaron un total de 148 pacientes donde la técnica elegida fue el OSNA.
ParticipantesLas participantes fueron todas aquellas sometidas a cirugía de cáncer de mama que cumplían criterios de inclusión para protocolo de GC.
Recogida de datosLa recogida de datos se realizó mediante la historia clínica electrónica (Clinic). Se recogieron datos sobre las características de las pacientes (edad, tipo de tumor, tamaño y grado histológico) y sobre la técnica y cirugía realizada (tipo de técnica, número de GC aislado durante la cirugía, afectación o no de estos y resultados anatomopatológicos de la linfadenectomía axilar).
Análisis estadísticoLas características cuantitativas de las pacientes como la edad y el número de ganglios afectados, se expresan como media, desviación estándar, máximo y mínimo mientras que las categóricas; con frecuencias y porcentajes.
La comparación de las distintas variables entre la pacientes a las que se les realizó la técnica clásica con hematoxilina eosina y las pacientes a las que se realizó con OSNA se llevó a cabo mediante la prueba de Chi cuadrado en caso de las variables categóricas o con la prueba de T de Student en el caso de las variables continuas. El análisis estadístico se realizará mediante el programa IBM SPSS Statistics (v.18).
ResultadosDurante el estudio se intervinieron un total de 303 pacientes, de las cuales a 155 pacientes se les realizó la técnica clásica con hematoxilina eosina (51,2%) y a 148 (48,8%) con OSNA. La edad media de las pacientes intervenidas fue de 58,5±11,3 (30-84), en el grupo de técnica clásica fue de 59,1±11,5 y en OSNA 57,9±11 sin que se detectaran diferencias estadísticamente significativas (p=0,374).
El 10,9% (n=33) del total de la muestra eran tumores intraductales, el 70,3% (n=213) eran T1, el 18,5% (n=56) T2 y 0,3% (n=1) eran mayores de 5cm. En el grupo de HE 10,3% (n=16) eran in situ, 71% (n=110) T1, 18,1% (n=28) T2, y 0,6%(n=1) eran mayores de 5cm. En el grupo OSNA 11,5% (N=17) eran in situ, 69,6% T1 (n=103), 18,9% T2 (n=28).
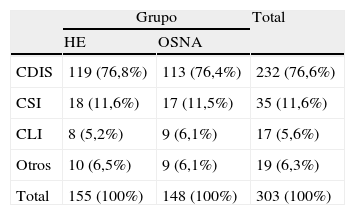
Respecto al tipo histológico del tumor (tabla 2) el 76,6% (n=232) eran CDI, 11,6% (n=35) CDIS, 5,6% (n=17) CLI, y 6,3% (n=19) otros tipos histológicos menos frecuentes. En el grupo HE el tumor más frecuente fue el CDI (76,8%; n=119) y CDIS (11,6%; n=18), y mientras que entre las mujeres a las que se les realizó OSNA la mayoría también presentaban CDI (76,4%; n=113) o CDIS (11,5%; n=17) sin que se detectaran diferencias estadísticamente significativas (p=0,98).
La media de ambos grupos en cuanto al número de GC axilares aislados fue de 2±0,9 (0-6). En el grupo HE la media fue 1,8±0,9 y en el OSNA 2,2±1 siendo la diferencia estadísticamente significativa (p<0,001).
El GC se aisló exclusivamente en territorio axilar en el 87,7% (n=136) del grupo HE y 84,5% (n=145) del OSNA. En el resto se realizó extirpación del GC de la cadena mamaria interna con estudio diferido de su posible afectación.
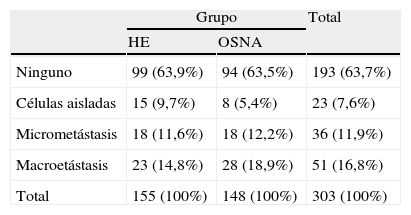
La tabla 3 muestra el número de macrometástasis, micrometástasis y células tumorales aisladas definidas según los criterios TNM. En el grupo HE el 63,9% (n=99) de los pacientes no tuvo afectación del GC. En el 9,7% (n=15) se aislaron células tumorales aisladas, en el 11,6% (n=18) se halló una micrometástasis y en el 14,8% (n=23) una macrometástasis.
En el grupo OSNA, en el 63,5% (n=94) el GC estaba libre de infiltración tumoral. El 5,4% (n=8) tenía afectación por células tumorales aisladas, el 12,2% (n=18) por micrometástasis, y el 18,9% (n=28) por macrometástasis. No hay diferencias estadísticamente significativas entre ambos grupos (p=0,459).
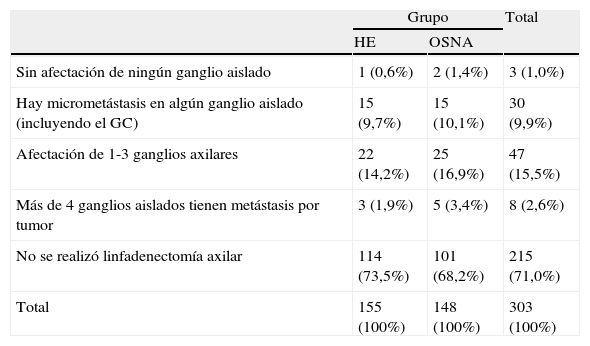
LinfadenectomíaEn el grupo HE no se realizó LDA en el 73,5% (n=114) de las pacientes. En aquellas donde se realizó, el 0,6% (n=1) no tuvo afectación axilar alguna, el 9,7% (n=15) se aisló únicamente afectación por micrometástasis, en el 14,2% (n=22) la afectación macrometastásica era de entre uno y 3 ganglios y en el 1,9% había afectación de más de 4 ganglios aislados.
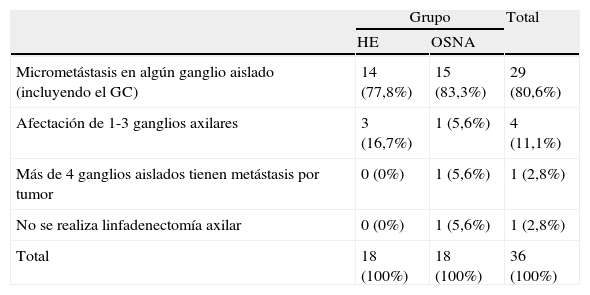
En el grupo OSNA el 68,2% (n=101) no requirió LDA, el 1,4% (n=2) no se aisló tumor alguno en la LDA, 10,1% (n=15) tenían micrometástasis, 16,9%(n=25) afectación de 1-3 ganglios y 3,4% (n=5) más de 4 ganglios positivos (tabla 4). Estudiando más específicamente el grupo de las pacientes con afectación por micrometástasis (tabla 5) observamos que en ambos grupos eran 18 las pacientes con afectación con micrometástasis. En el grupo HE la mayoría (77,8%; n=14) de las pacientes presentaban micrometástasis en algún ganglio y 3 pacientes (16,7%) tuvieron mayor (de uno a 3 ganglios) afectación. En el grupo OSNA el 83, 3% de las pacientes (n=15) se detectaron micrometástasis en algún ganglio, en un caso (n=5,6%) no se realizó LDA y en 2 del resto había más afectación que la de la micrometástasis (11,1%). No se detectaron diferencias significativas entre ambos grupos (p=0,565).
Resultados de la linfadenectomía según ambas técnicas
| Grupo | Total | ||
| HE | OSNA | ||
| Sin afectación de ningún ganglio aislado | 1 (0,6%) | 2 (1,4%) | 3 (1,0%) |
| Hay micrometástasis en algún ganglio aislado (incluyendo el GC) | 15 (9,7%) | 15 (10,1%) | 30 (9,9%) |
| Afectación de 1-3 ganglios axilares | 22 (14,2%) | 25 (16,9%) | 47 (15,5%) |
| Más de 4 ganglios aislados tienen metástasis por tumor | 3 (1,9%) | 5 (3,4%) | 8 (2,6%) |
| No se realizó linfadenectomía axilar | 114 (73,5%) | 101 (68,2%) | 215 (71,0%) |
| Total | 155 (100%) | 148 (100%) | 303 (100%) |
Resultados tras la linfadenectomía en los casos de afectación micrometastásica
| Grupo | Total | ||
| HE | OSNA | ||
| Micrometástasis en algún ganglio aislado (incluyendo el GC) | 14 (77,8%) | 15 (83,3%) | 29 (80,6%) |
| Afectación de 1-3 ganglios axilares | 3 (16,7%) | 1 (5,6%) | 4 (11,1%) |
| Más de 4 ganglios aislados tienen metástasis por tumor | 0 (0%) | 1 (5,6%) | 1 (2,8%) |
| No se realiza linfadenectomía axilar | 0 (0%) | 1 (5,6%) | 1 (2,8%) |
| Total | 18 (100%) | 18 (100%) | 36 (100%) |
El método OSNA ha supuesto un importante avance debido a la alta sensibilidad, que elimina la variabilidad interobservador y errores de muestreo de la técnica histopatológica convencional. Esto ha permitido la estandarización de la afectación del GC entre los distintos hospitales, logrando mejorar el registro de estos tumores2.
Esta técnica no esta exenta de desventajas, ya que el tiempo de estudio intraoperatorio se alarga entre 10-15min respecto a la HE por lo que es necesario optimizar los circuitos de quirófano-anatomía patológica para intentar minimizar esta espera. Hay grupos que con la práctica han conseguido un tiempo de 30-35min desde la extirpación hasta su diagnóstico, que también dependerá del número de ganglios aislados. Se debe considerar globalmente, teniendo en cuenta el tiempo ahorrado en segundas intervenciones y en el retraso del inicio de la quimioterapia.
La implantación de esta técnica supone una inversión importante para los hospitales y el servicio por su precio elevado, pero está justificado por su alta eficiencia que se basa en la disminución de ingresos y reintervenciones posteriores.
Basándonos en el mecanismo de acción del OSNA, cabe destacar la necesidad de obtener la CK19 en la biopsia prequirúrgica para saber si será posible la realización de este método7,8. Hasta la fecha, desde el inicio de obtener CK en la biopsia previa se han realizado 122 casos OSNA, y tan solo en 3 la CK ha sido negativa (2,45%), en los que se ha realizado técnica HE. Se considera que el porcentaje de carcinomas de mama con CK 19 negativo es de 3,5% el los de fenotipo luminal y 6% en los del fenotipo basal9.
Algunos detractores del método plantean la duda ante el hecho de que el factor pronóstico de la ruptura capsular del GC por la metástasis tumoral es ahora invalorable. El estudio diferido de la grasa pericapsular por el anatomopatólogo y la cuantificación exacta que se obtiene con el OSNA de su afectación suplen este defecto.
En nuestra muestra los resultados obtenidos en cuanto afectación del GC son parecidos utilizando ambas técnicas, igual que han demostrado varios autores10–16.
La sensación de aumento de diagnóstico de micrometástasis con OSNA se palpa en el ambiente de quirófano. En nuestros resultados se observa que se trata de un tema subjetivo, tal vez justificado por el no descubrimiento de algunas micrometástasis en el primer acto quirúrgico mediante la técnica anatomopatológica de rutina.
Desde su descripción a finales del 2008, ya son 64 los hospitales que lo han implantado hoy en España, lo que significa que su difusión es una realidad. El reto actual ya no es demostrar la concordancia de las 2 técnicas diagnósticas, sino el valor pronóstico y predictivo de los resultados17,18. Existe ahora mismo una controversia importante en el mundo científico, debido a que se está cuestionando la necesidad de realizar la LDA en pacientes con afectación micrometastásica19–21. Se debe estudiar si la realización de una linfadenectomía está justificada poniendo en una balanza sus riesgos y beneficios. En nuestra muestra se ha visto que la afectación por micrometástasis es un número reducido, pero la mayoría de ellas (78% en el grupo HE y 83% de OSNA) no tenían mayor afectación que esta. Aunque los últimos consensos aún recomiendan la LDA como «gold standard» para su tratamiento, ya hay estudios en marcha para ver su implicación en el intervalo libre de enfermedad y supervivencia global. Por ello, la investigación de nuevos tratamientos sistémicos puede ser clave a la hora de nuevas decisiones.
ConclusiónEn menos de 3 años de su descubrimiento, el método OSNA se presenta como un método seguro, sensible y reproducible para el estudio del GC. Su implantación y difusión permitirá la estandarización de sus resultados. La controversia actual se centra en la necesidad o no de realización de linfadenectomía axilar en aquellos casos de afectación por micrometástasis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.