Presentamos, a partir de una serie durante un año de 399 infecciones vaginales y 32 lesiones cervicales, diagnosticadas por citología, la distribución estacional de las mismas, así como la relación con las fases del ciclo menstrual.
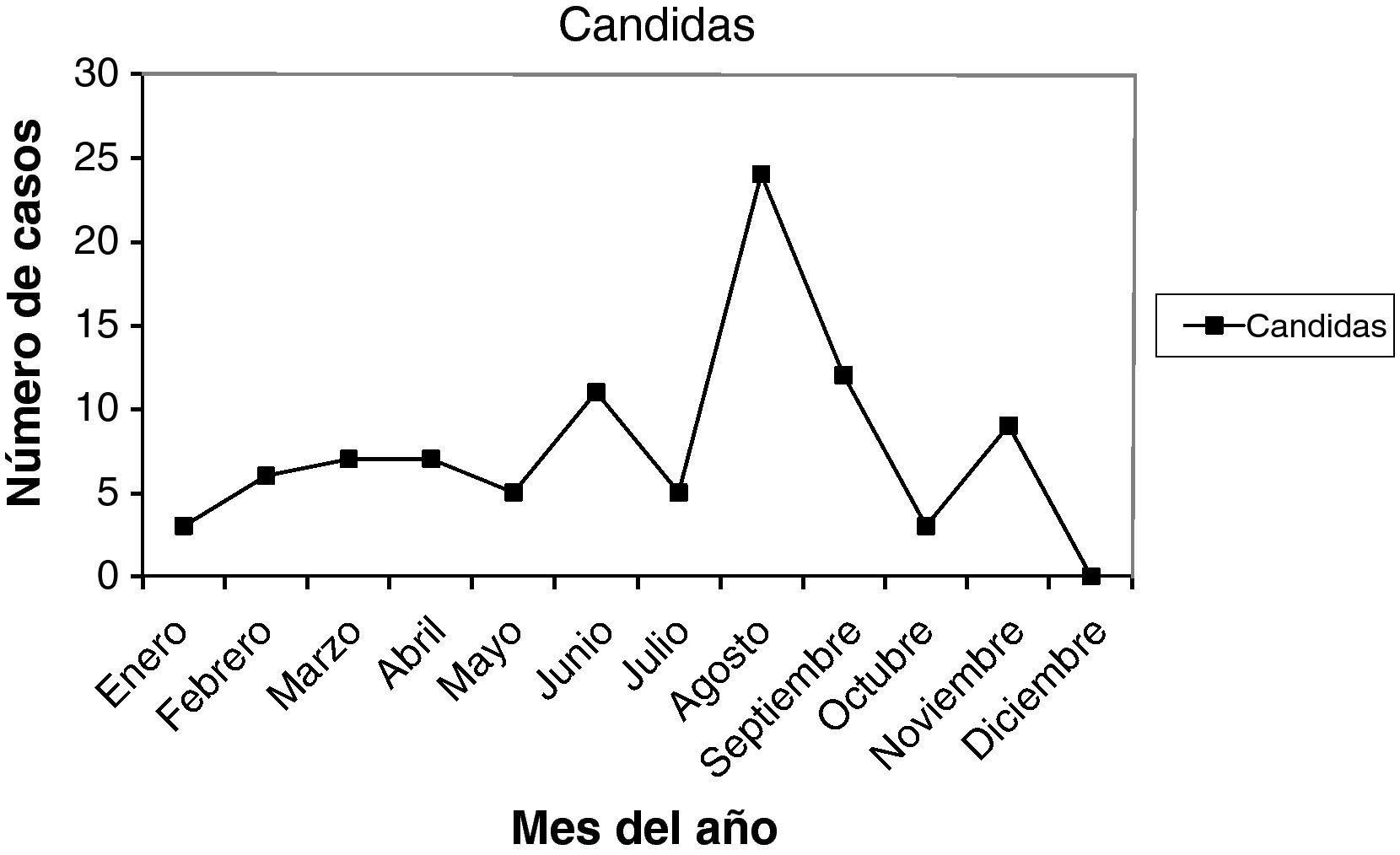
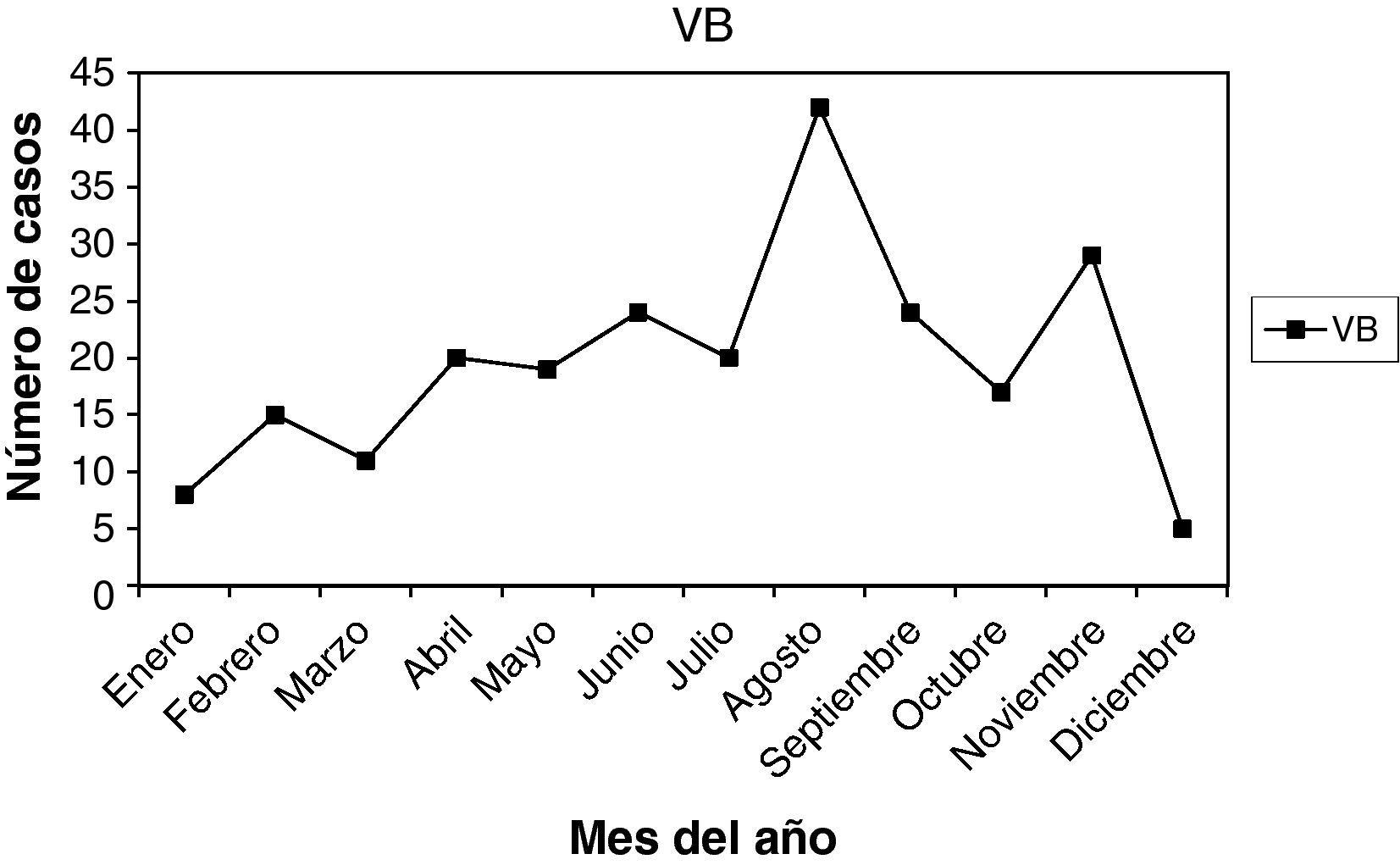
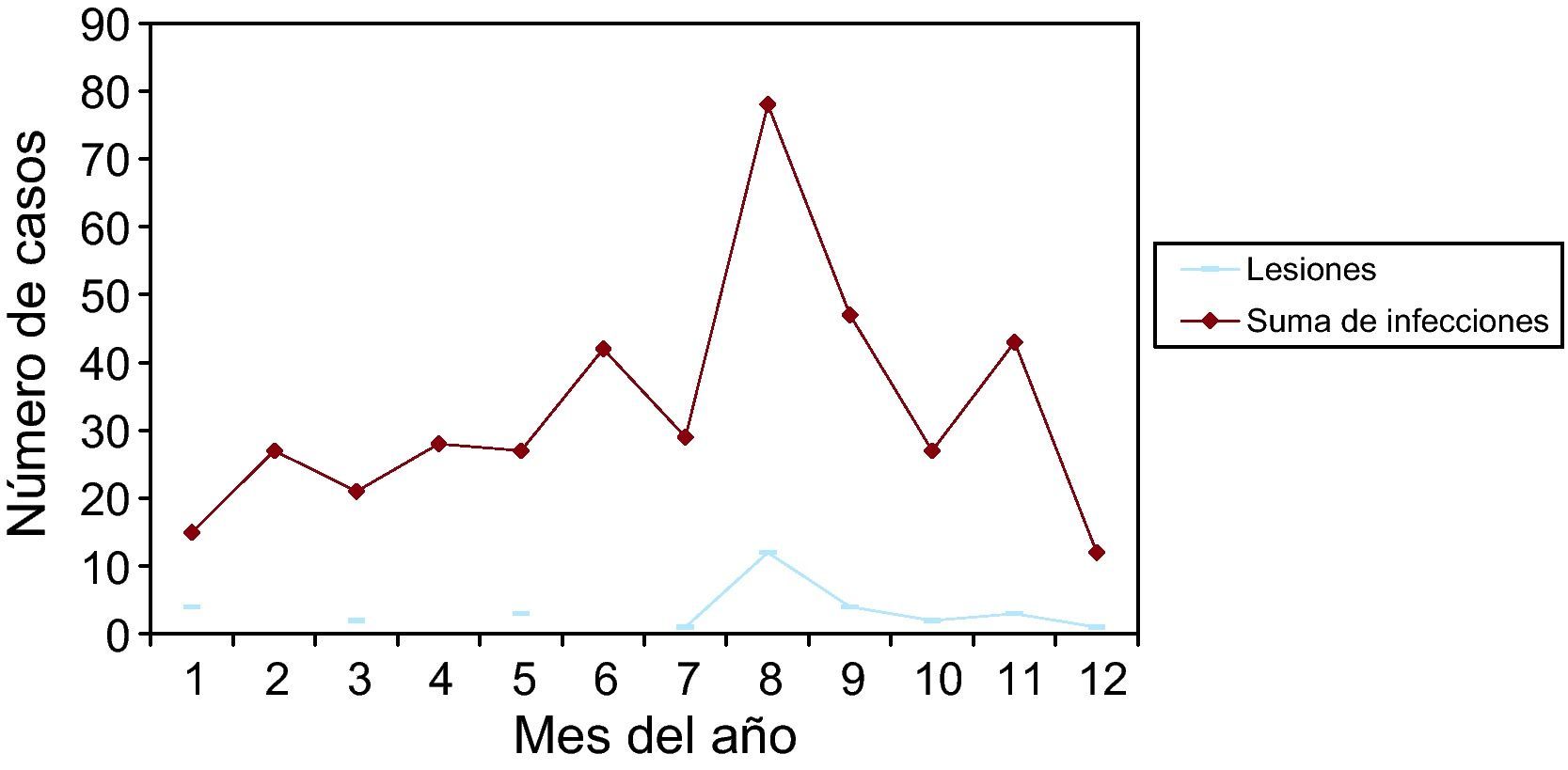
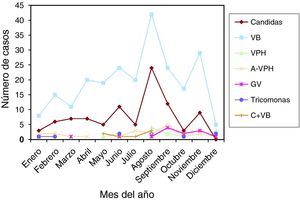
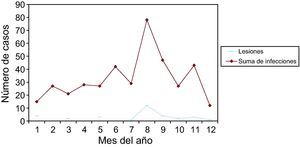
Las infecciones y lesiones se dieron en 42,28% en la 2.a fase del ciclo menstrual. Y en 35,11% en la 1.a fase. Con las gráficas de estacionalidad, sumando todas las infecciones, destaca un pico de incidencia en el mes de agosto, que también ocurre en las infecciones más prevalentes: vaginosis bacteriana y Candida. Este pico también se correlaciona en las lesiones.
Based on a 1-year series of 399 vaginal infections and 32 cervical lesions, diagnosed by cytology, we describe the seasonal distribution of these infections and lesions and their association with the phases of the menstrual cycle.
A total of 42.28% of infections and lesions occurred in the second phase of the menstrual cycle and 35.11% in the first phase. When all the infections were grouped together, a peak incidence was noted in August. The same peak was found in the most prevalent infections (bacterial vaginosis and Candidas) and in cytological lesions.
Toda vida es ritmo, al son del tiempo. El ritmo se mantiene día a día, estación a estación, año a año. En la reproducción y el crecimiento, en la alimentación, el sueño, el movimiento. En la salud y la enfermedad1.
Ritmo: se repite regularmente en el tiempo. Ciclo: es una cadena de acontecimientos que se producen con un orden dado, que se repite. Hay ciclos rítmicos: la respiración, el ciclo cardíaco, la renovación celular. El sueño-vigilia. Hay un ritmo circadiano, el reloj interior.
El ciclo menstrual de 18-35 días, es un ciclo hormonal, por los estrógenos y la progesterona. Influyen en el estado de ánimo, la libido, la sensibilidad al dolor, a los olores, al tono musical, etc.
En el sexo, la reproducción tiene un ritmo restringido, por el desarrollo, es una vez al año, para la sincronización de macho y hembra, esperma y huevos. Maduración sexual y cortejo, en los animales. El nacimiento debe ser en un momento óptimo para la supervivencia. Influye la luna y las mareas.
La mujer es receptiva sexualmente durante todo su ciclo, pero fértil pocos días. Hay tumefacción vulvar, y olores. El coito también tiene ritmo. Hay más embarazos en primavera-verano, y más nacimientos en invierno. Hay máximo de coitos y orgasmos a mitad del ciclo, con la ovulación. Y mínimo en la menstruación.
En la enfermedad, los síntomas de enfermedad son más evidentes a ciertas horas del día, y el cuerpo también responde de forma diferente a los medicamentos.
La Cronobiología es la ciencia que estudia los mecanismos de la estructura biológica del tiempo, y las manifestaciones rítmicas de la vida2. Hay un tiempo interno, relojes biológicos, que regulan funciones fisiológicas y conducta, e interacciones con el ambiente.
Se pueden analizar los ritmos biológicos en los estudios clínicos3, así hay modelos para el cáncer de mama. El mejor día para excisión o resección-biopsia, en un ciclo de 28 días, es el día 8 (días 5-10), para tener menor tasa de recurrencias. Hay más recurrencias, en 30%, en intervenciones los días 0-6 del ciclo o 21-36 del ciclo.
En la fase folicular, los estrógenos disminuyen la actividad inmune, la actividad fagocítica y los niveles circulantes de interleucina 2. Aumenta el potencial metastásico de las células del cáncer de mama. Hay mayores recurrencias, 20%. En la fase lútea, aumenta el nivel de progesterona, que puede modular la proliferación del tejido normal y neoplásico, y aumenta la cohesión intercelular con la terapia, disminuye el potencial metastásico.
Rietveld et al4 estudian las fluctuaciones estacionales en las infecciones y los cambios celulares premalignos. Las infecciones tendrían ritmos endógenos o cambios estacionales (temperatura, humedad), o en relación con la conducta sexual.
Nosotros, en este trabajo, realizamos el mismo estudio, ver la estacionalidad y relación con el ciclo menstrual de las infecciones vaginales y lesiones cervicales, correspondientes a nuestra serie del año 2009, siendo ésta la segunda parte del trabajo.
Material y métodosDesde 1-9-08 y a lo largo de todo el año 2009, en el CE de Monteolivete, Valencia, y en la consulta de Ginecología del autor, hemos recogido todos los casos de infecciones vaginales y de lesiones cervicales diagnosticadas por la citología cervicovaginal de Papanicolaou (que se han realizado en el IVO, Instituto Valenciano de Oncología).
Hemos recogido los datos clínicos de: edad; gestaciones, partos y abortos; nuligestas, menopáusicas y edad media a la menopausia, y número de extranjeras. Hemos preguntado sobre estado civil, nivel de estudios, trabajo, antecedentes médico-quirúrgicos, y actividad sexual.
Hemos comprobado respecto al día que se tomó la muestra para la citología, en qué fase del ciclo se encontraba, si 1.a o 2.a, si tenía amenorrea, si estaba histerectomizada, o si era posmenopáusica.
Los cálculos estadísticos y las comprobaciones gráficas se han realizado con el software Excel de Microsoft instalado en un ordenador personal con procesador Pentium.
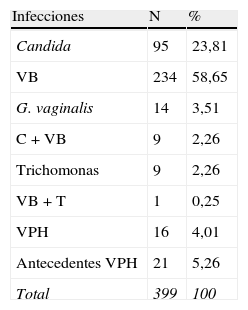
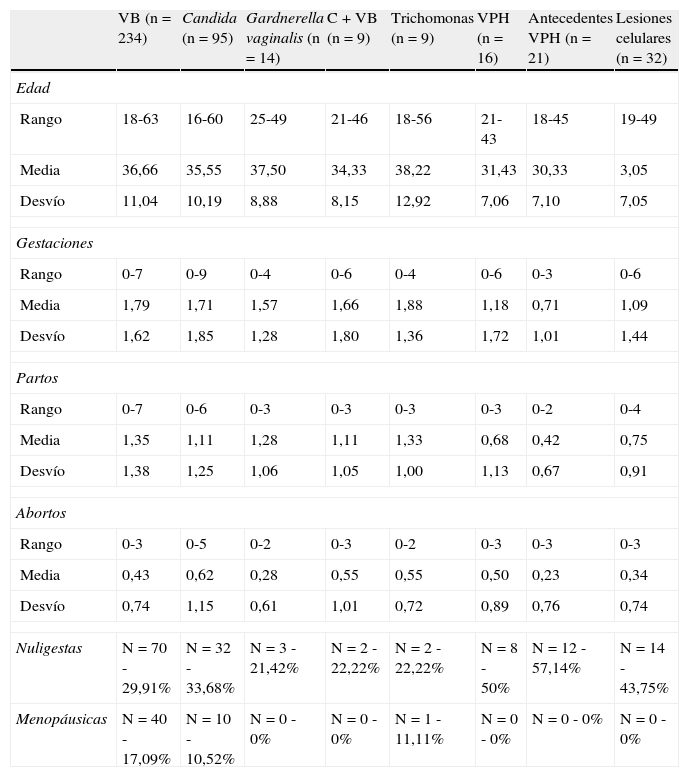
ResultadosEn la tabla 1 se presenta la serie de estudio. Las infecciones vaginales fueron 399 casos y las lesiones celulares cervicales 32 casos.
En la tabla 2 se presentan los datos cuantitativos de: edad, gestaciones, partos y abortos, nuligestas y menopáusicas.
Datos cuantitativos.
| VB (n=234) | Candida (n=95) | Gardnerella vaginalis (n=14) | C + VB (n=9) | Trichomonas (n=9) | VPH (n=16) | Antecedentes VPH (n=21) | Lesiones celulares (n=32) | |
| Edad | ||||||||
| Rango | 18-63 | 16-60 | 25-49 | 21-46 | 18-56 | 21-43 | 18-45 | 19-49 |
| Media | 36,66 | 35,55 | 37,50 | 34,33 | 38,22 | 31,43 | 30,33 | 3,05 |
| Desvío | 11,04 | 10,19 | 8,88 | 8,15 | 12,92 | 7,06 | 7,10 | 7,05 |
| Gestaciones | ||||||||
| Rango | 0-7 | 0-9 | 0-4 | 0-6 | 0-4 | 0-6 | 0-3 | 0-6 |
| Media | 1,79 | 1,71 | 1,57 | 1,66 | 1,88 | 1,18 | 0,71 | 1,09 |
| Desvío | 1,62 | 1,85 | 1,28 | 1,80 | 1,36 | 1,72 | 1,01 | 1,44 |
| Partos | ||||||||
| Rango | 0-7 | 0-6 | 0-3 | 0-3 | 0-3 | 0-3 | 0-2 | 0-4 |
| Media | 1,35 | 1,11 | 1,28 | 1,11 | 1,33 | 0,68 | 0,42 | 0,75 |
| Desvío | 1,38 | 1,25 | 1,06 | 1,05 | 1,00 | 1,13 | 0,67 | 0,91 |
| Abortos | ||||||||
| Rango | 0-3 | 0-5 | 0-2 | 0-3 | 0-2 | 0-3 | 0-3 | 0-3 |
| Media | 0,43 | 0,62 | 0,28 | 0,55 | 0,55 | 0,50 | 0,23 | 0,34 |
| Desvío | 0,74 | 1,15 | 0,61 | 1,01 | 0,72 | 0,89 | 0,76 | 0,74 |
| Nuligestas | N=70 - 29,91% | N=32 - 33,68% | N=3 - 21,42% | N=2 - 22,22% | N=2 - 22,22% | N=8 - 50% | N=12 - 57,14% | N=14 - 43,75% |
| Menopáusicas | N=40 - 17,09% | N=10 - 10,52% | N=0 - 0% | N=0 - 0% | N=1 - 11,11% | N=0 - 0% | N=0 - 0% | N=0 - 0% |
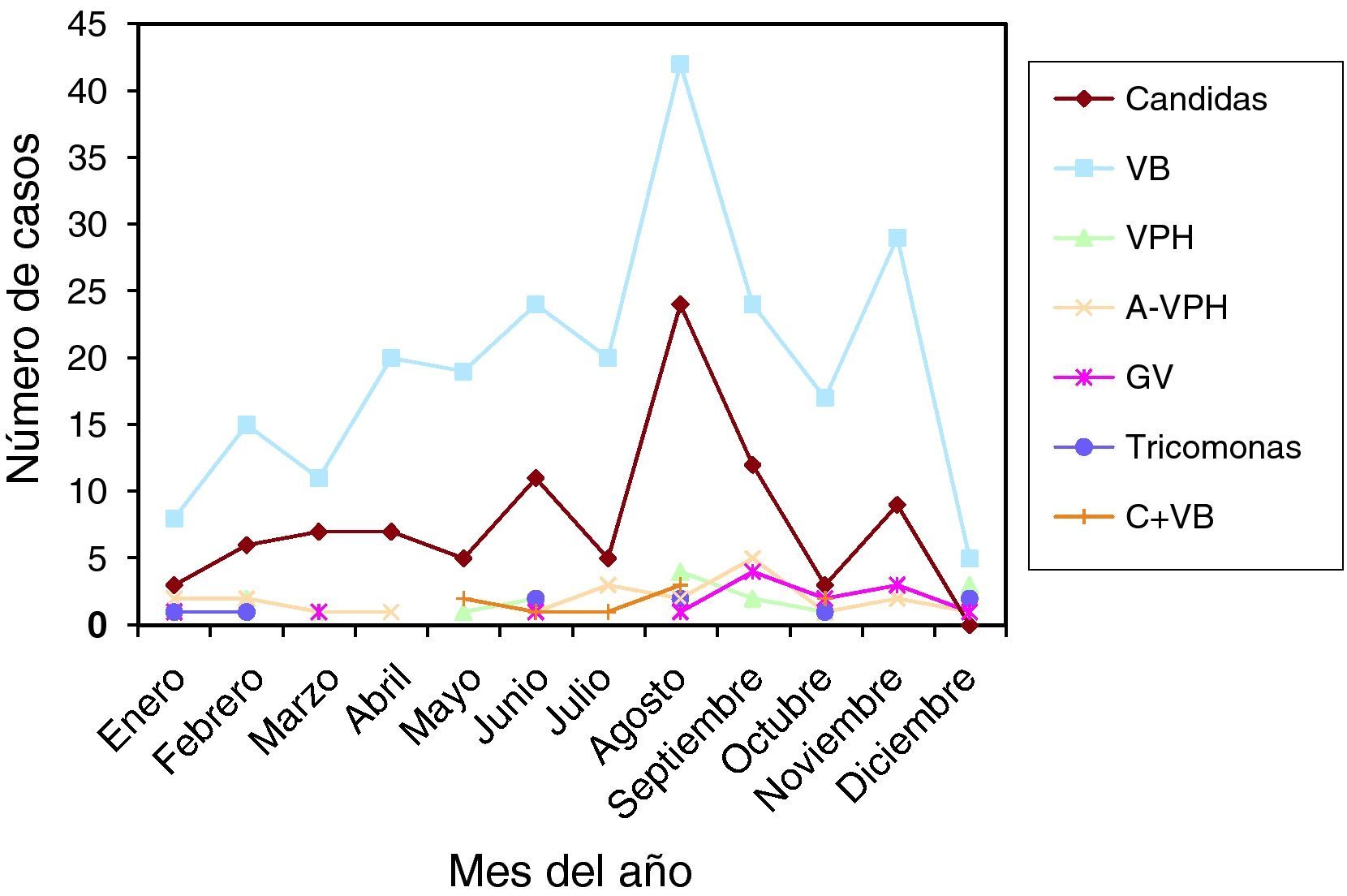
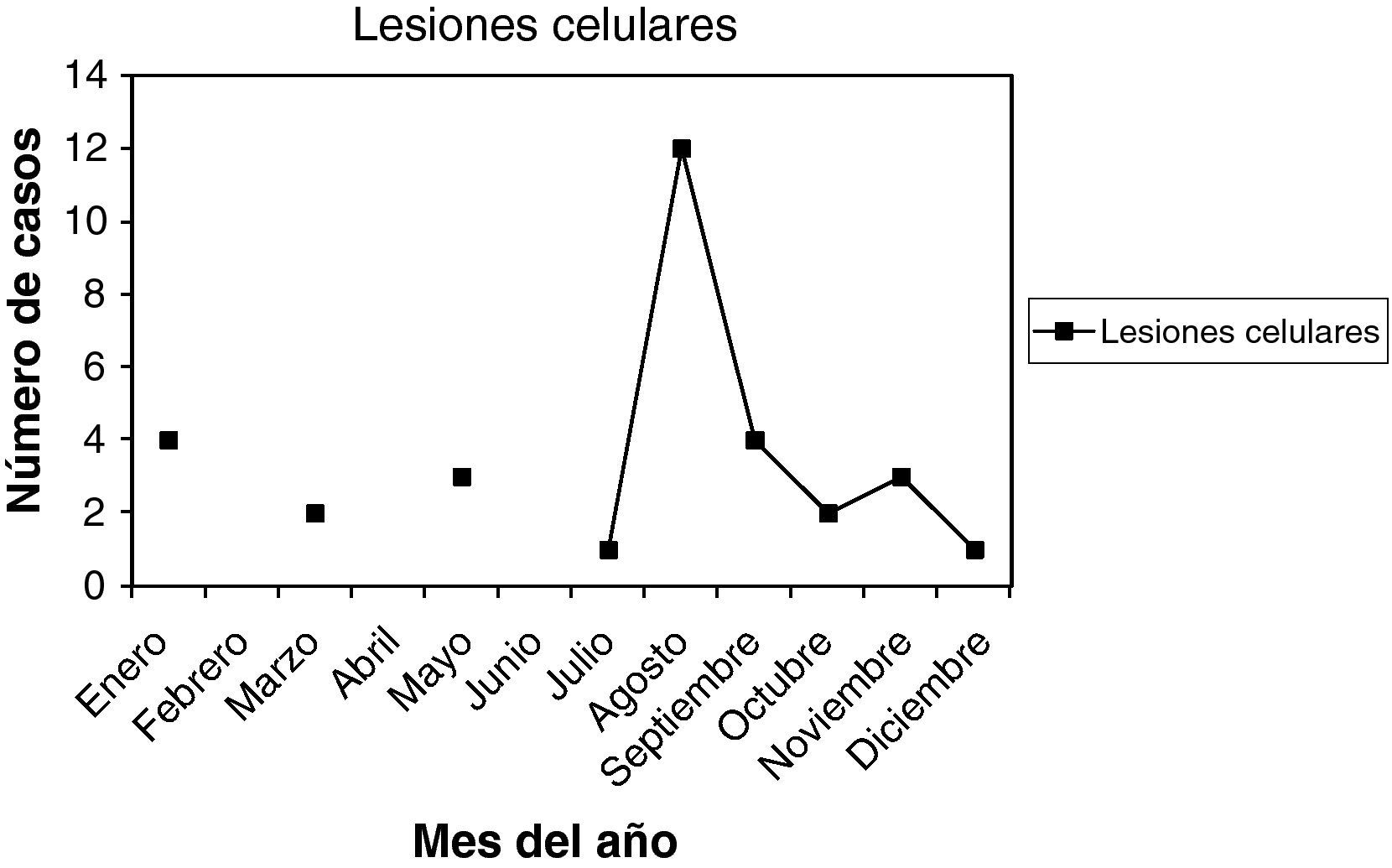
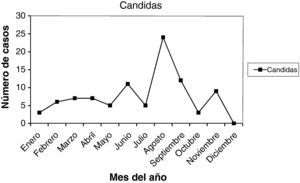
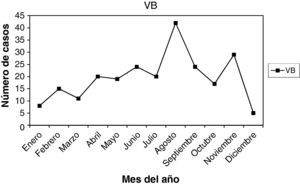
En las figuras 1–11 se presenta la distribución estacional de infecciones y lesiones.
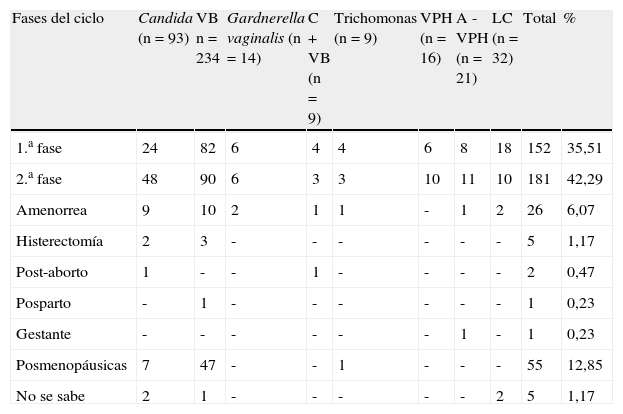
En la tabla 3 se presenta la distribución de la serie por fases del ciclo, y otras consideraciones: gestante, amenorrea y/u oligomenorreas, posmenopáusicas, histerectomizadas y post-aborto o posparto.
Infecciones y lesiones. Distribución por fases del ciclo y otras consideraciones.
| Fases del ciclo | Candida (n=93) | VB n=234 | Gardnerella vaginalis (n=14) | C + VB (n=9) | Trichomonas (n=9) | VPH (n=16) | A - VPH (n=21) | LC (n=32) | Total | % |
| 1.a fase | 24 | 82 | 6 | 4 | 4 | 6 | 8 | 18 | 152 | 35,51 |
| 2.a fase | 48 | 90 | 6 | 3 | 3 | 10 | 11 | 10 | 181 | 42,29 |
| Amenorrea | 9 | 10 | 2 | 1 | 1 | - | 1 | 2 | 26 | 6,07 |
| Histerectomía | 2 | 3 | - | - | - | - | - | - | 5 | 1,17 |
| Post-aborto | 1 | - | - | 1 | - | - | - | - | 2 | 0,47 |
| Posparto | - | 1 | - | - | - | - | - | - | 1 | 0,23 |
| Gestante | - | - | - | - | - | - | 1 | - | 1 | 0,23 |
| Posmenopáusicas | 7 | 47 | - | - | 1 | - | - | - | 55 | 12,85 |
| No se sabe | 2 | 1 | - | - | - | - | - | 2 | 5 | 1,17 |
Descripción de la serie: las infecciones fueron 399 casos.
Candida (C): son 95 casos (23,80%), la 2.a infección más importante. La edad media fue 35,55 años, entre 16 y 60 años. La paridad media, 1,11. Nuligestas, 32 casos (33,68%). Menopáusicas, 10 casos (10,52%). La edad media a la menopausia fue 39,6 años. En este grupo había 3 diabéticas y 3 histerectomizadas. Excluimos 2 casos a los que no se practicó citología: una gestante, y otra, a la que se diagnosticó por cultivo bacteriológico; por lo que este grupo queda con 93 casos.
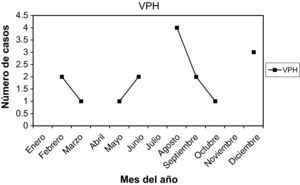
Las muestras se tomaron en la 1.a fase del ciclo en 24 casos (25,80%), en la 2.a fase del ciclo en 48 casos (51,61%). Presentaban amenorrea 9 casos (9,67%), y eran posmenopáusicas 7 casos (7,52%). En la gráfica de estacionalidad se aprecia un pico muy claro y destacado en el mes de agosto.
Vaginosis bacteriana (VB): son 234 casos (58,64%), la infección más frecuente de lejos. La edad media fue 36,66 años, entre 18 y 63 años. La paridad media fue 1,35. Nuligestas, 70 casos (29,91%). Menopáusicas, 40 casos (17,09%). La edad media a la menopausia fue 48,05 años.
Las muestras se tomaron en la 1.a fase del ciclo en 82 casos (35,04%), en la 2.a fase del ciclo en 90 casos (38,46%). Presentaban amenorrea 10 casos (4,27%), y eran posmenopáusicas 47 casos (20,08%). En la gráfica de estacionalidad, también hay un pico en el mes de agosto.
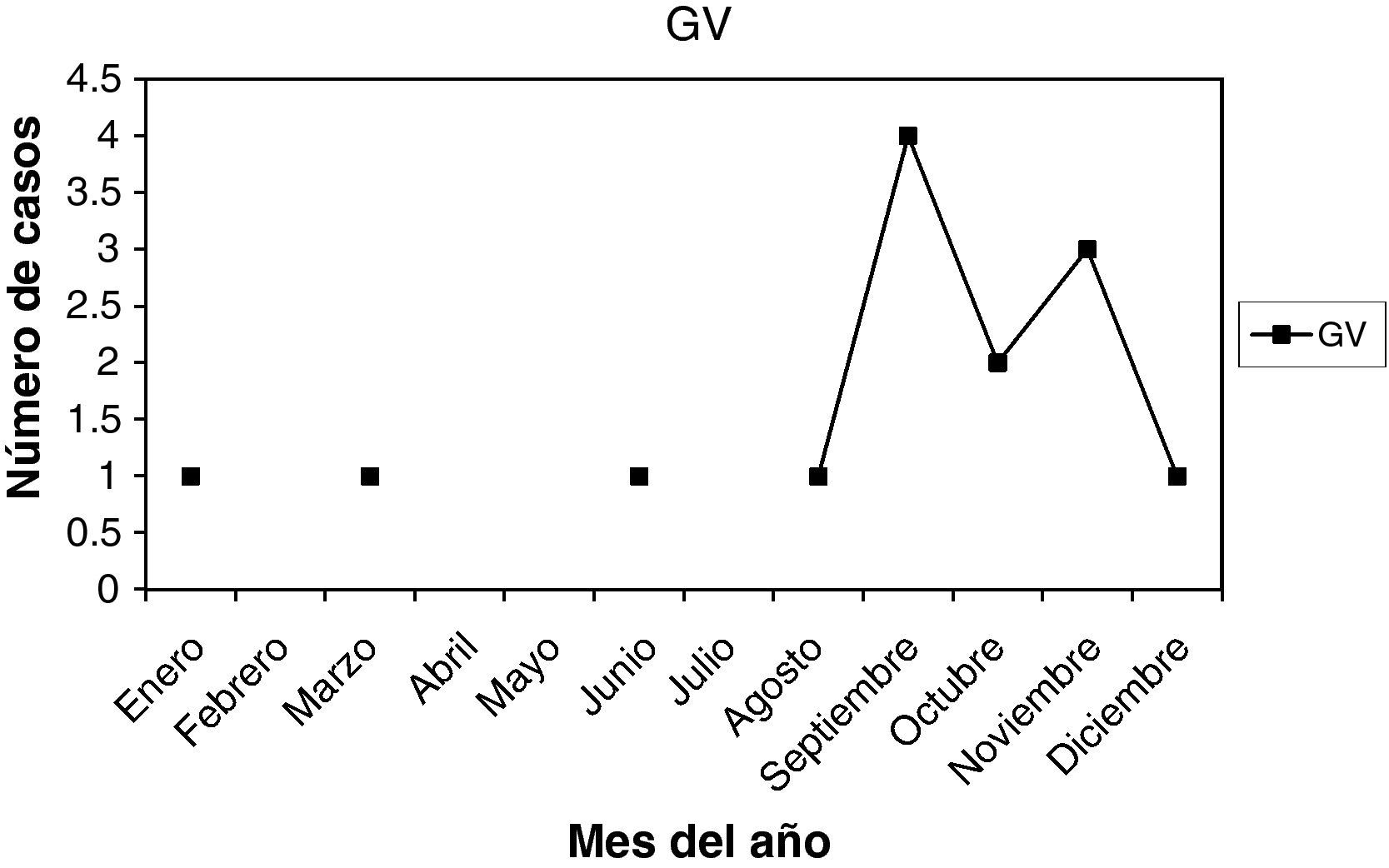
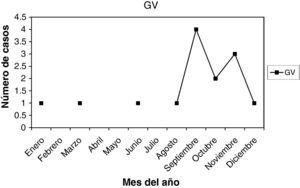
Gardnerella vaginalis (G. vaginalis): son 14 casos (3,50%). La edad media fue 37,5 años, entre 25 y 49 años. La paridad media fue 1,28. Hubo 3 nuligestas (21,42%), y no menopáusicas. Hubo 6 casos en la 1.a fase del ciclo (42,85%) y otros 6 en la 2.a fase del ciclo (42,85%). En 2 casos, amenorrea. En la gráfica de estacionalidad, un pico en el mes de septiembre.
- –
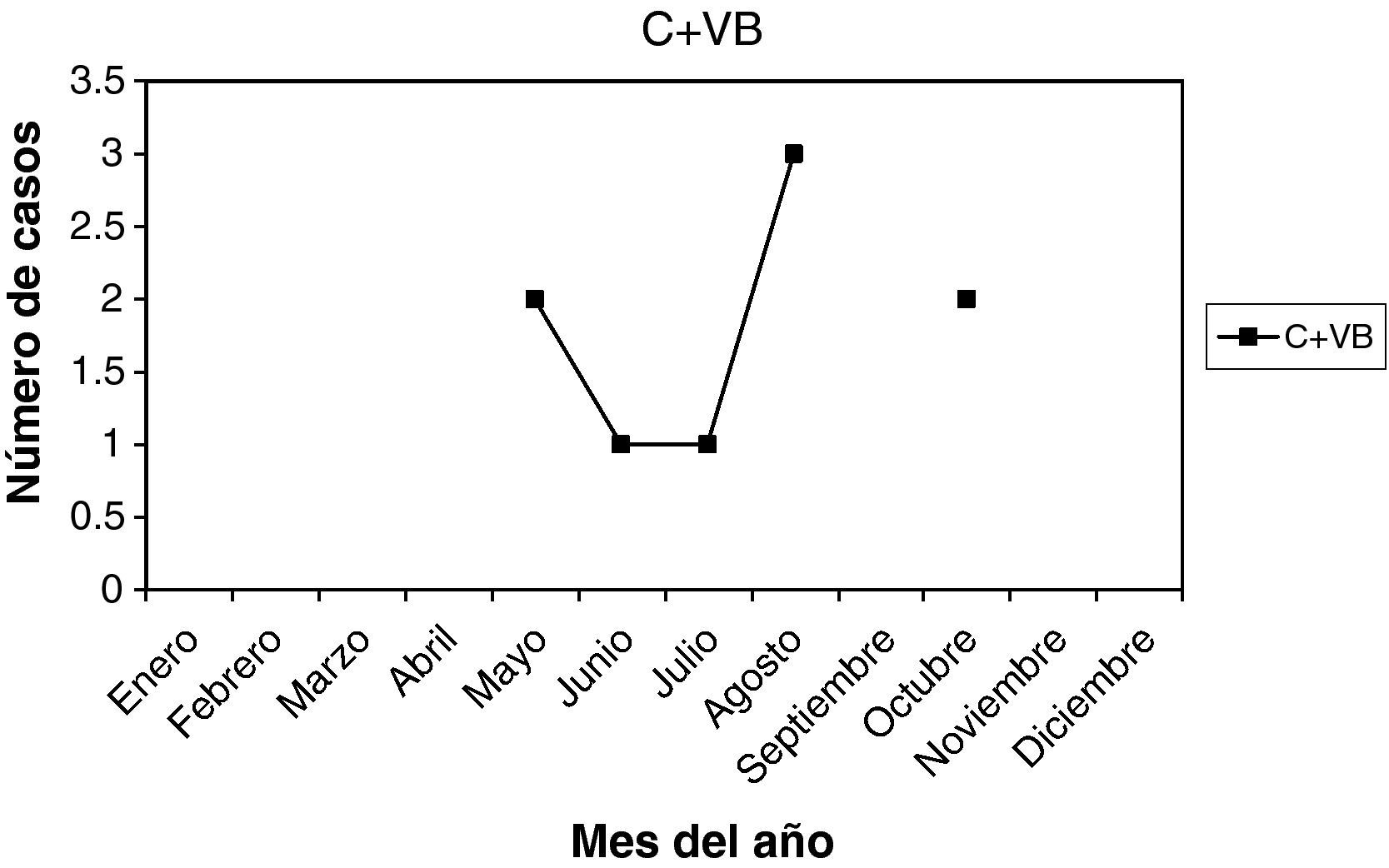
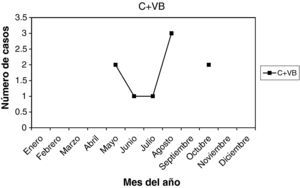
C + VB: son 9 casos (2,25%). La edad media fue 34,33 años, entre 21 y 46 años. La paridad media, 1,11. Nuligestas, 2 casos (22,22%), y no menopáusicas. Hubo 4 casos en la 1.a fase del ciclo (44,44%) y 3 casos (33,33%) en la 2.a fase. Un caso con amenorrea y un caso postaborto. En la gráfica, pico en agosto.
- –
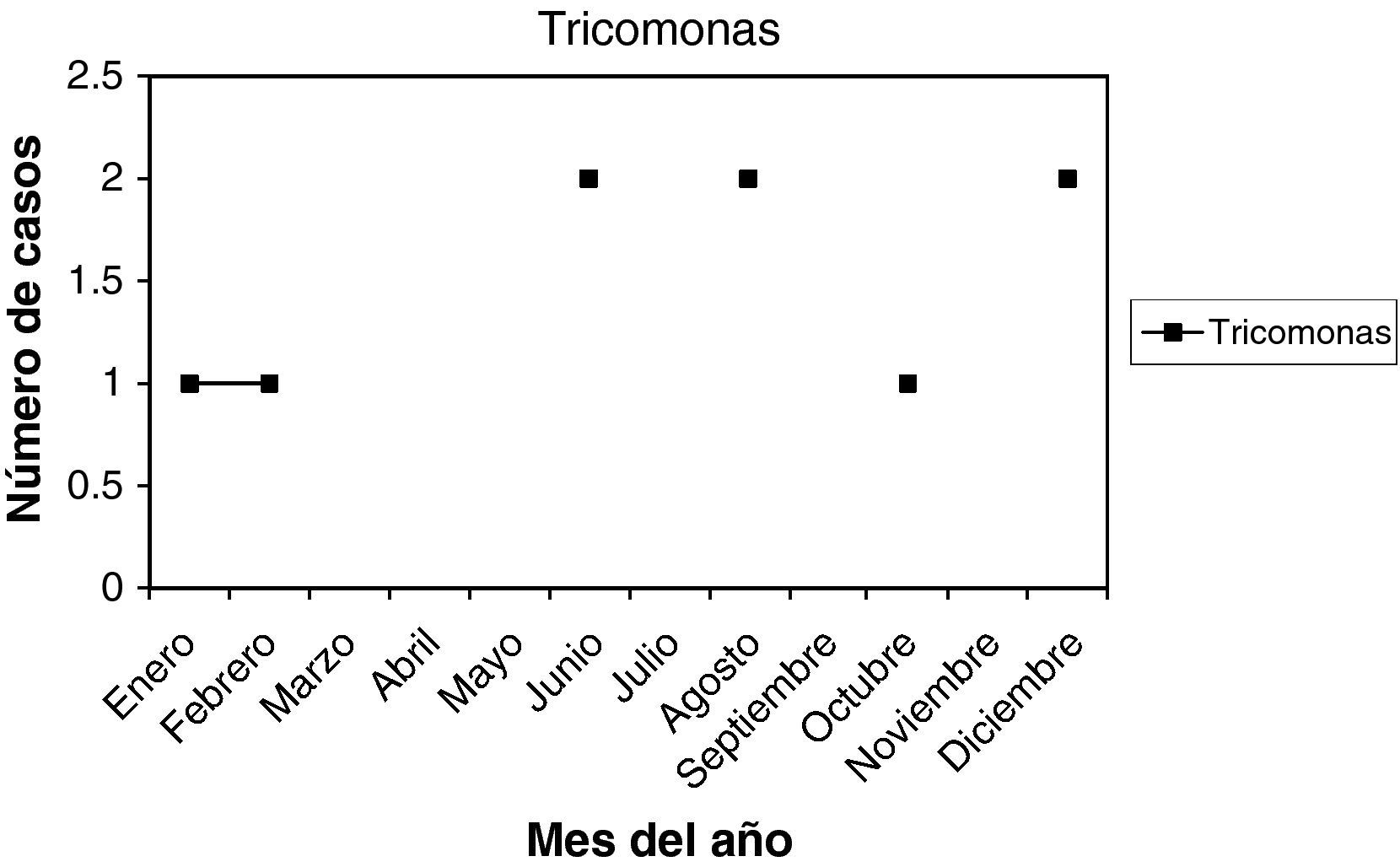
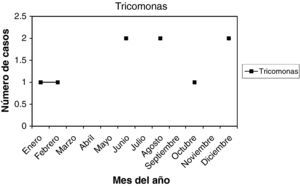
Trichomonas (T): son 9 casos (2,25%). La edad media fue 38,22 años, entre 18 y 56 años. Nuligestas, 2 casos (22,22%), y un caso menopáusica (11,11%). Hubo 4 casos en la 1.a fase del ciclo (44,44%), y 3 casos (33,33%) en la 2.a fase del ciclo. Un caso con amenorrea, y otro en la menopausia. En la gráfica estacional, no hay ningún pico de máxima frecuencia.
- –
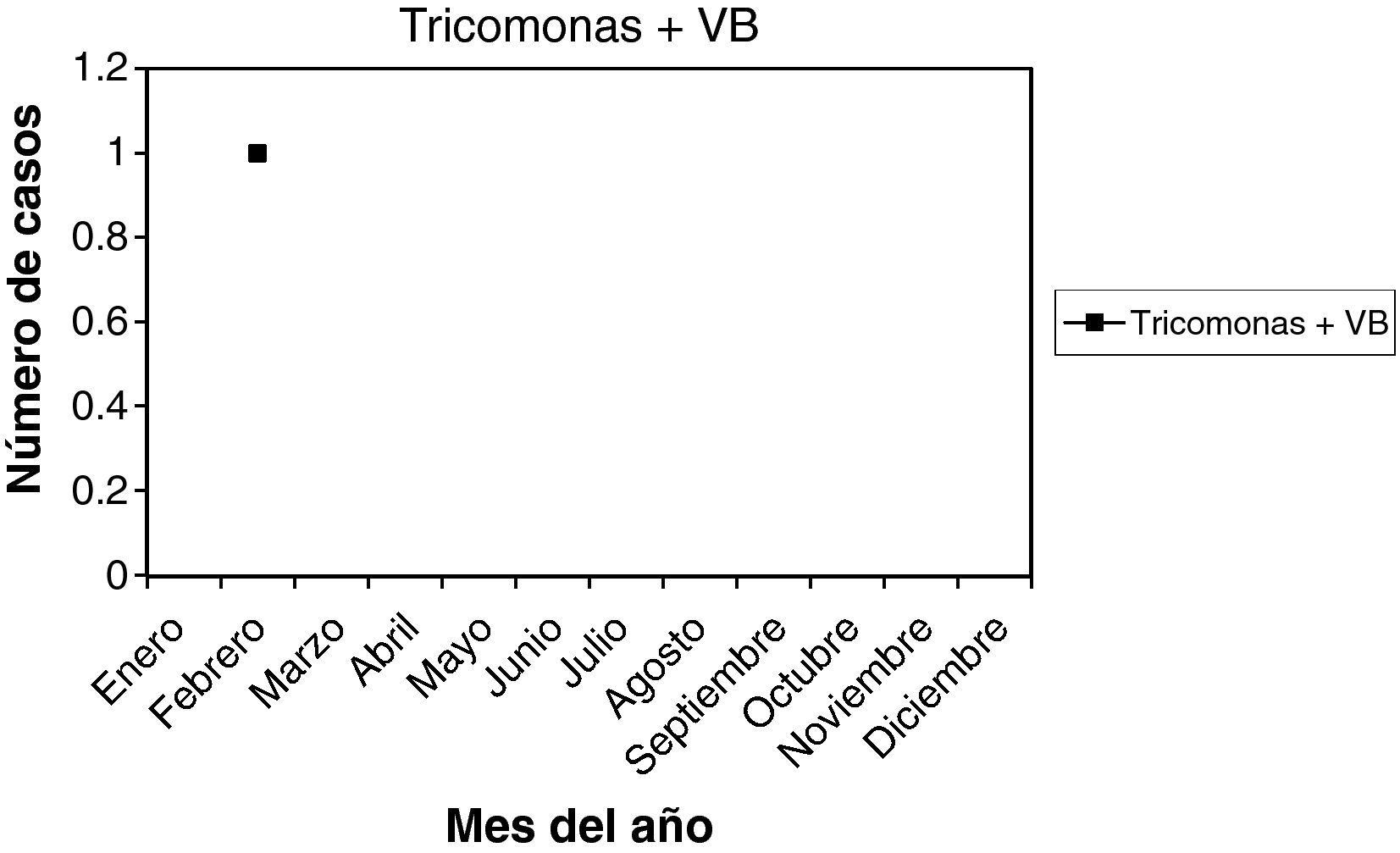
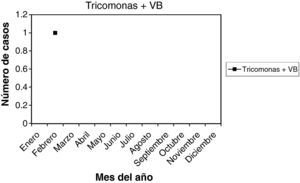
T + VB: es un solo caso (0,25%), en el mes de febrero, y presentaba 8 meses de amenorrea.
- –
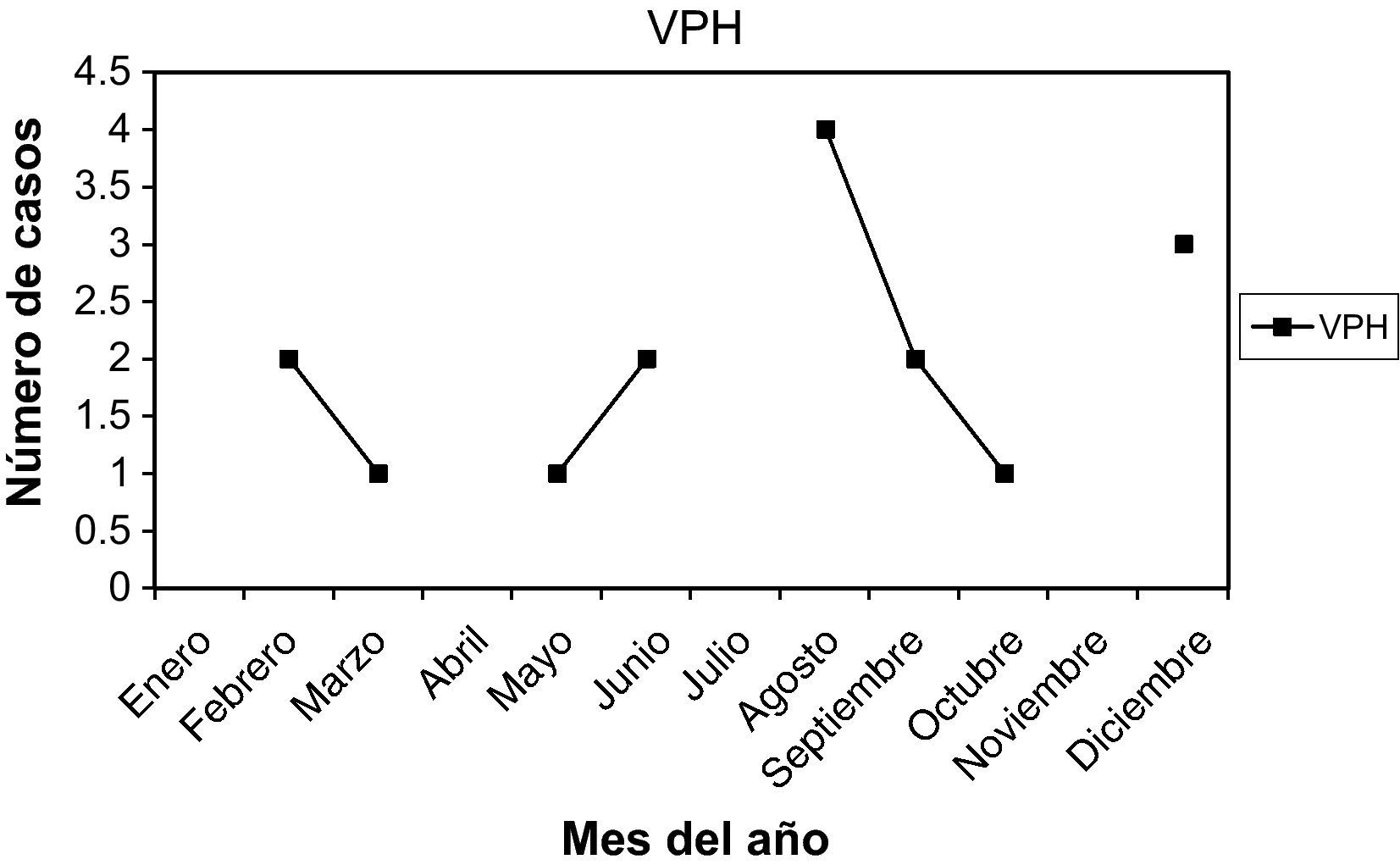
VPH (virus del papiloma humano): las que presentaban lesiones actualmente son 16 casos (4,01%). La edad media fue 31,43 años, entre 21 y 43 años. La paridad media, 0,68. Nuligestas, 8 casos (50%). Menopáusicas, no. Hubo 6 casos (37,5%) en la 1.a fase del ciclo, y 10 casos (62,5%) en la 2.a fase. En la gráfica de estacionalidad, pico en agosto.
- –
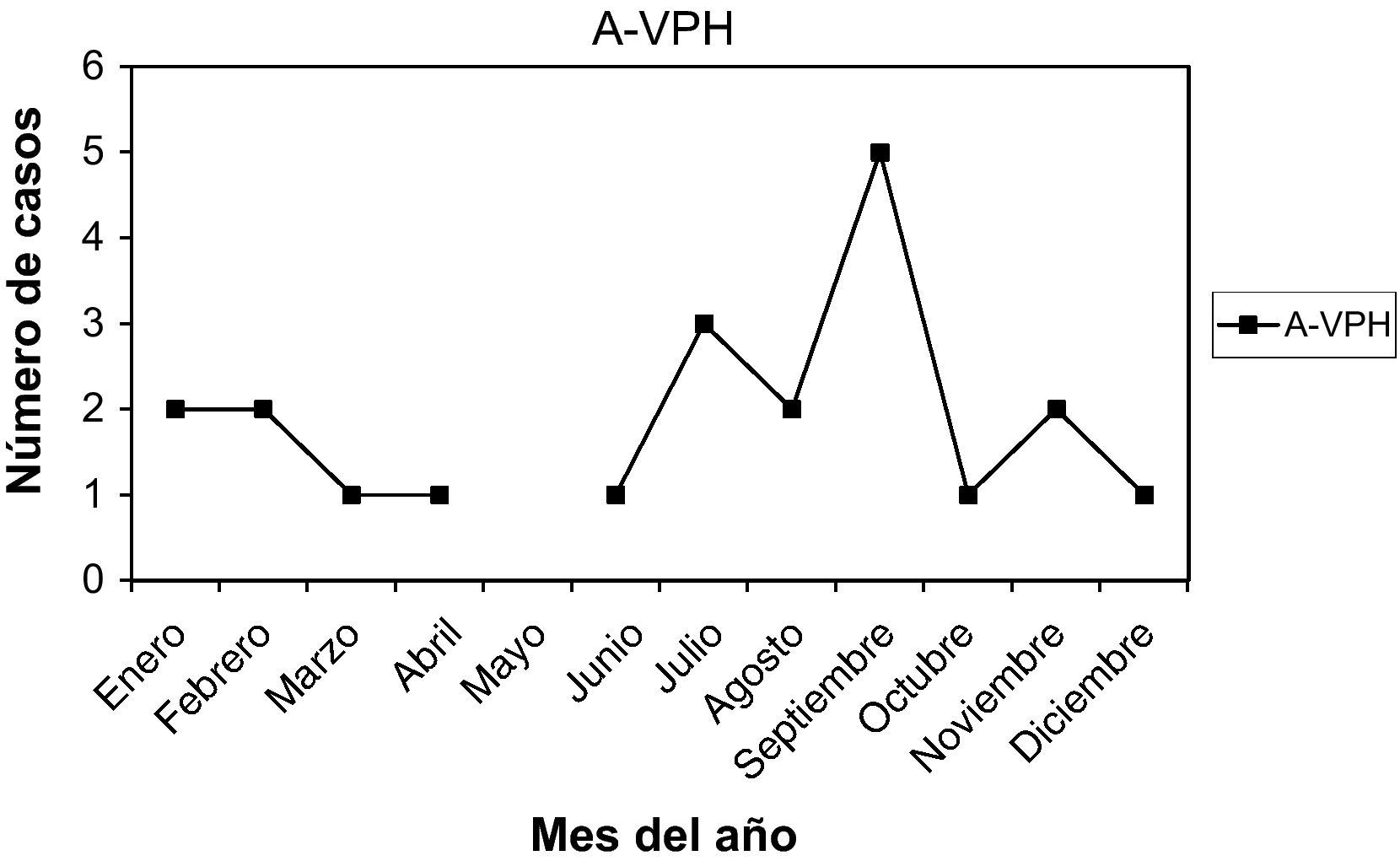
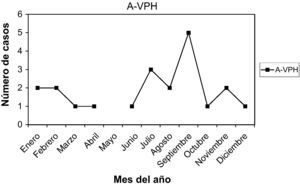
A-VPH (antecedentes de VPH): no presentaban lesiones en el momento actual, pero las habían tenido. Son 21 casos (5,26%). La edad media fue 30,33 años, entre 18 y 45 años. Nuligestas, 12 casos (57,14%). Menopáusicas, no. Hubo 8 casos en la 1.a fase (38,09%) y 11 casos en la 2.a fase (52,38%). Un caso con amenorrea, y un caso en una gestante de 11 + 5. En la gráfica de estacionalidad, pico en septiembre.
- –
Lesiones celulares cervicales (LC): fueron 32 casos, que consideramos en conjunto: atipias de significado incierto, escamosas (ASCUS), 7 casos; atipias glandulares de significado incierto (AGUS), un caso; lesiones escamosas de bajo grado (LSIL), 22 casos, y lesiones escamosas de alto grado (HSIL), 2 casos.
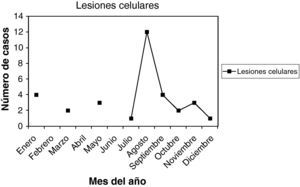
La edad media general fue 30,5 años, entre 19 y 49 años. La paridad media, 0,75. Nuligestas, 14 casos (43,75%). Menopáusicas, no. Hubo 18 casos, en la 1.a fase del ciclo (56,25%), y 10 casos en la 2.a fase del ciclo (31,25%). Con amenorrea, 2 casos. En la gráfica de estacionalidad, también un pico muy destacado en agosto.
Como resumen de todos estos datos, vemos que las infecciones se dieron en 35,11% en la 1.a fase del ciclo, y en 42,28% en la 2.a fase del ciclo. En 6,07% presentaban amenorrea, y en 12,85% estaban en la menopausia. Y viendo las gráficas de estacionalidad, sumando todas las infecciones, destaca un pico de incidencia en el mes de agosto. Las lesiones, en menor número, también se correlacionan en el año con las infecciones.
DiscusiónDel sol, depende el ritmo circadiano, el ciclo del día. Hay 3 relojes sincronizadores2: el solar, la temperatura; el social, trabajo-familia, y el interno.
En el ciclo del día: la producción de hormonas y sus niveles (ACTH, cortisol, melatonina), los niveles de citocinas, la regulación de la temperatura corporal, los niveles de glucosa, la irritabilidad de la piel, la tensión arterial (TA), el riesgo de accidente vascular cerebral (AVC), y el riesgo de muerte por enfermedad cardiovascular, etc.
El ciclo menstrual. El ciclo anual: cambios de humor, reproducción, peso al nacimiento, trastorno del sueño, diagnóstico de cáncer de mama, etc.
En la piel, también hay ciclo: el pH de la piel disminuye de noche y aumenta de día. Hay cambios en la excreción de sebo y en la temperatura de la piel. El calor produce sudor, se abren los poros, vasodilatación y aumento del flujo de sangre. Con el frío, ocurre lo opuesto. La epidermis del varón tiene más espesor en octubre, en la mujer tiene más espesor en julio. En ambos, es más fina en abril. La piel está más hidratada en verano, y más seca en invierno. Las dermatitis son más frecuentes en invierno.
Se han estudiado muchos temas desde el punto de vista de la Cronobiología. Así, la razón de sexos hombre/mujer en el embarazo es alta en estación más favorable para la reproducción5. Se sabe que el varón tiene más fragilidad en el embarazo. La razón de sexos es 0,511. Al nacimiento, no hay variación estacional significativa. Pero en la razón de sexos calculada al tiempo de la concepción, hay variación estacional del 2,4%, con pico en octubre. Los factores que influyen: la polución ambiental, los terremotos, los padres fumadores, el aumento de edad de la madre o del padre, las condiciones del medio y la comida.
La selección sexual es al principio, en la concepción o implantación, y hay variación estacional. La calidad del semen y del ovocito es independiente del ritmo coital (como se ha visto en la fertilización in vitro, FIV). En las estaciones con reducción de fertilidad, prevalencia de hembras. Con aumento de fertilidad, prevalencia de varones.
La estacionalidad de la menarquia se estudió en EE.UU.6. En 3.000 mujeres vieron: mes de nacimiento, mes de la menarquia, edad a la menarquia, latitud y altitud de la residencia. Hubo picos de la menarquia en julio (VII)(verano), y en enero (I). Y las cifras más bajas en febrero (II) y mayo (V) (invierno), y octubre (X). Al comparar 2 cohortes: 1) nacidas antes de 1970, n=870, menarquia=156,23 meses; y 2) nacidas después de 1970, n=2.016, menarquia=153,87 meses. La cohorte 2 tuvo la menarquia antes que la cohorte 1, pico en julio (VII) frente a pico en diciembre-enero (XII-I), 2,36 meses antes, p<0,0001.
El mes de nacimiento y el mes de la menarquia no tienen relación. La edad a la menarquia y el mes de la menarquia no varían con la latitud o altitud. Las mujeres nacidas entre mayo (V) y julio (VII) serían más fértiles. Se han señalado los trastornos del ciclo en relación al mes del nacimiento. Y también el aborto y el embarazo ectópico tendrían efecto estacional.
La colonización del tracto genital de la mujer por Staphylococcus saprophyticus tiene variación estacional, más en verano (VIII-IX, agosto-septiembre) y otoño7. Es un germen coagulasa negativo, es uropatógeno, causa el 42% de infecciones después de Escherichia coli. En 276 mujeres (edad media, 29 años), estudiadas por cultivo, en 19 (6,9%) estaban colonizadas. Se detectaron en uretra (30%), en orina (20%) y en cérvix (10%). Hubo más infecciones de orina en los 12 meses previos, reglas más recientes, coito más reciente, y reciente o concurrente diagnóstico de candidiasis vulvovaginal (CVV).
Hay variación estacional de vulvovaginitis estreptocócicas8. Streptococcus pyogenes (grupo A) se aísla más en invierno. Derivan de la piel (verano) o del tracto respiratorio (invierno). Hay más casos en invierno (XI-IV, noviembre-abril) que en verano, p<0,05. Los aislados vulvovaginales son poco frecuentes. Hay que hacer el diagnóstico de laboratorio, y dar tratamiento antibiótico.
En las infecciones vaginales por hongos, hay picos en agosto y octubre (VIII y X)9. En este estudio de 1973, con 552 casos. El diagnóstico citológico fue en 74 casos (35,7%), y por cultivo en 133 casos (64,3%), más sensible. La mayoría estaban asintomáticas, en 30%. En 30% hubo vulvitis y vaginitis. La leucorrea típica sólo en 10%.
Nosotros10 estudiamos el tratamiento de la candidiasis vulvovaginal, en un estudio prospectivo comparativo de 3 preparados antimicóticos con dosis única: fluconazol, 41 casos; clotrimazol, 35 casos, e itraconazol, 46 casos, en un año. La mayor incidencia de infecciones se dio en verano (julio, VII) y la menor en invierno (diciembre, XII). En 38,52% se dio en la 2.a fase del ciclo menstrual (47 casos versus 38). A corto plazo, 10 días-3 meses, del tratamiento, es cuando se producen las recidivas o reinfecciones. El éxito real del tratamiento osciló entre 68 y 71%.
Un número alto de candidiasis vulvovaginal recidivante (CVVR) se asocian a atopia, sería un factor causal o contributivo en la patogénesis11. La mucosa vaginal desarrolla respuesta alérgica a alérgenos ambientales. Al comparar 35 casos de CVVR de etiología indeterminada y 150 casos de control, se investiga la atopia con tests cutáneos. Había atopia en 11/35 (31,4%) frente a 9/150 (6%), p<0,001. Y con historia familiar de atopia, también diferencias, 10/31 (28,6%) frente a 8/150 (5,3%), p<0,05. El tratamiento sería: eliminar el alérgeno, los antihistamínicos y los corticoides.
Se ha estudiado la asociación del estrés oxidativo y la enfermedad cardiovascular12. El hombre tiene más riesgo de muerte por infarto agudo de miocardio y AVC. En hombres y mujeres sedentarios y entrenados, se ven valores en plasma. Hay variaciones estacionales en oxidantes y antioxidantes. Los sedentarios, en otoño-invierno, los hombres tienen alto riesgo coronario. El ejercicio regular induce respuestas adaptativas que dan protección contra el estrés oxidativo. El beneficio del ejercicio en el hombre es en otoño-invierno (alto riesgo coronario); en la mujer, en verano. La testosterona tiene un pico en invierno, es preoxidante en el hombre. En la mujer, el estradiol es antioxidante, aumenta la concentración en invierno.
Hay una disminución marcada en la variabilidad analítica y postanalítica en el laboratorio clínico con un sistema automático de análisis13. Hay diferencias individuales y ritmos biológicos. En este estudio en Brasil, en parámetros bioquímicos del suero, en 1996-1998, sobre 143.093 determinaciones de: Ca, P, urea, creatinina y ácido úrico. Hubo ritmos anuales en Ca, p<0,001, máximo en otoño y mínimo en primavera; y en creatinina, p<0,002, máximo en verano y mínimo en invierno. En las otras determinaciones no hubo ritmo. Aquí, se refieren a las estaciones del hemisferio sur.
La depresión de invierno o el desorden afectivo estacional son sinónimos14. Cursa con depresión en invierno y remisión en primavera o verano. Hay aumento de apetito y aumento de sueño en invierno. Afecta a 1-3% de adultos en climas templados, y es más prevalente en mujeres. Sería una disfunción de la serotonina, alteración en el ritmo circadiano sueño/vigilia o descanso/actividad. Se da terapia de luz, 2.000-10.000 lux en 30-120min/día durante el invierno. Se ha intentado tratar también con baja dosis de melatonina, 0,3mg/día, en la mañana o tarde, para inducir fase de adelanto o atraso sin causar sueño15. Pero el tratamiento de elección es la exposición a la luz, como antidepresivo.
Otro tema es las migraciones y el sida. Se han mapeado las rutas de la infección por virus de la inmunodeficiencia humana (VIH)16. Es de persona a persona, pero sigue el movimiento de la gente. Hay baja infectividad del virus, larga latencia y curso crónico. Hay que hacer control de la epidemia, y un cordón sanitario.
Por ejemplo, en Uganda, sobre 5.553 adultos, había 5,5% de tasa de VIH de seroprevalencia. En los que no se murieron, 12,4% cambiaron de pueblo, 16,3% cambiaron de área. En endemia, la movilidad es un factor de riesgo independiente.
La migración estacional en África Occidental, predominantemente es de hombres, trabajadores, que cobran al día. En estos grupos no hay interacciones sociales controladas. Hay prostitutas en las plantaciones, que hacen 25 servicios/día. Los hombres tienen 3-4 parejas en 6 meses, secuenciales o concurrentes. Las mezclas son las responsables del aumento del VIH.
Las migraciones de las mujeres, son menores, y muchas son prostitutas. Tienen VIH en > 80%. Otros problemas son: malaria, dolor pélvico, irregularidad menstrual, leucorrea, dolores y molestias genitales. El hombre no recibe cuidados de salud por el empleador. Las mujeres prostitutas no tienen acceso a servicios adecuados.
La emigración del campo a la ciudad, es de mujeres con niños. No tienen casa, no tienen servicios de agua ni sanitarios, no tienen acceso a medicación, sufren violencia y violaciones, son prostitutas a tiempo parcial. O su trabajo es en el mercado, limpieza o trabajo agrícola.
Se necesitan servicios médicos y sociales, para seguridad y sentido de comunidad, necesario para la salud. Pero con supervivencia diaria, hay aumento del VIH. Se necesita también: protección del medio, desarrollo económico y policía de población.
Volviendo ya a las infecciones y el cáncer de cérvix; hay marcadas fluctuaciones en la frecuencia del VPH en la citología cervicovaginal, con un pico en verano (agosto, VIII), por actividad sexual con aumento estacional o por la supresión de la inmunidad por la exposición a la luz ultravioleta (UV)17. Con 920.359 citologías en 16 años, 1983-1998, hubo un pico en verano (agosto, VIII) de VPH, con el máximo de luz UV. La luz UV está modulada por las nubes, por la relación angular con la superficie de la Tierra, y la distancia Tierra-Sol. Las relaciones sexuales son: según la luz solar, la longitud del día, la temperatura, la humedad y la estacionalidad de la dieta e ingreso calórico.
Los mismos autores18, en Holanda, con la misma serie, también señalan que los cambios malignos y premalignos en el Papanicolaou se dan en verano, un pico en agosto (VIII), en relación con el aumento del VPH y la relación solar. Hay relación del aumento solar y el diagnóstico con el Papanicolaou de displasias, VPH y cáncer. Tienen 2 casos de cáncer/un año de citologías, en verano, y un caso en invierno. Las displasias y el cáncer con VPH están en relación a la exposición al sol, que es conducta evitable. Con la citología, hay falsos positivos, pero el cribado y seguimiento es en todas las estaciones. Evitar el sol, previene el cáncer. La radiación UV suprime defensas inmunes celulares contra virus y cáncer, en sitios locales y generales. Los ritmos circunanuales afectan funciones biológicas, incluyendo la susceptibilidad a infecciones, y enfermedades metabólicas, inflamatorias y malignas.
Rietveld et al4, dicen que hay verdaderos ritmos de detección, fluctuaciones estacionales de las enfermedades. En 9 años, 1983-1992, con 504.093 citologías, ven infecciones y displasias y cáncer in situ y escamoso. Hubo gran variación estacional en clamidia, VPH y carcinoma. Poca en Actinomyces y trichomonas. Chlamydia se da más en otoño-invierno, hongos, más en otoño y verano; VPH, más en verano. Displasias y carcinoma, más en verano.
Finalmente, de nuestro trabajo, una serie de 399 infecciones y 32 lesiones cervicales, en un año (2009), diagnosticadas por citología. Ambas, infecciones y lesiones, se dieron en 35,11% en la 1.a fase del ciclo menstrual, y en 42,28% en la 2.a fase del ciclo. Y viendo las gráficas de estacionalidad, sumando todas las infecciones, destaca un pico de incidencia en el mes de agosto (verano), como se señala en la literatura científica. Las lesiones, en menor número, pero también se correlacionan en el año con las infecciones.
La limitación de este trabajo es por el escaso número de casos que tenemos en algunas infecciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.