La universalización debe ser un objetivo en el cribado de cromosomopatía además de lograr una adecuada sensibilidad y una tasa de falsos positivos (F+) del método de cribado aplicado.
ObjetivosNos proponemos implementar un cribado de cromosomopatías en el área sur de Sevilla con la característica de universal (cobertura mayor del 90%) y manteniendo la tasa de diagnóstico del 80% para un 5% de F+.
MétodoA nuestras gestantes, entre julio de 2005 y septiembre de 2008, se les oferta un test combinado consecutivo. En los casos de edad gestacional >13 semanas se les aplica un doble test.
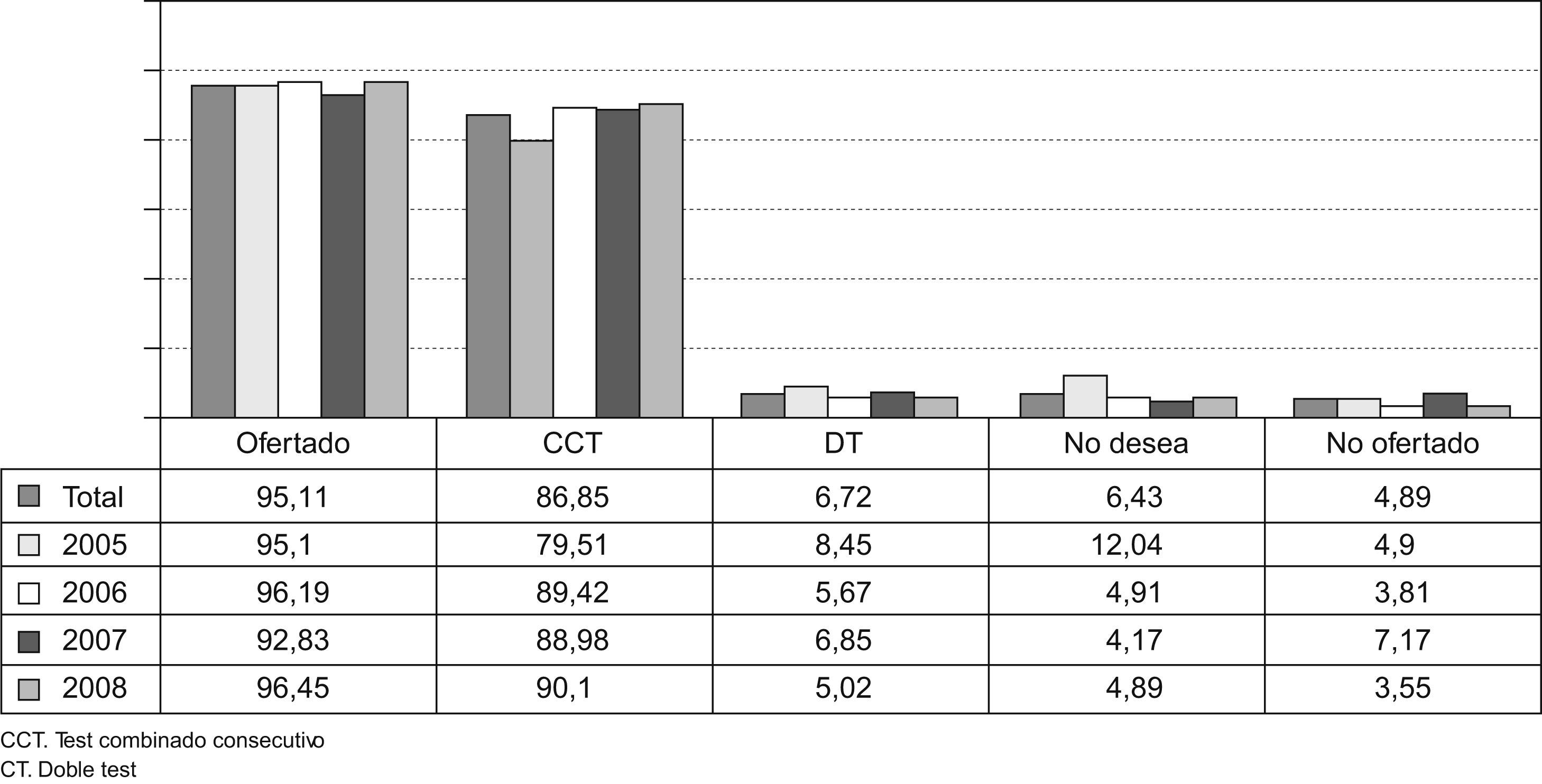
ResultadosAl 95,1%, de las 12.478 gestantes se les oferta un cribado. Al 86,85% de las gestantes se les realiza un test combinado consecutivo y el 6,43% de las gestantes han revocado el cribado. Se han observado 35 cromosomopatías (prevalencia de 0,28%), con una tasa de diagnóstico del 88,5% para un 4,31% de F+.
ConclusionesLa universalización debe ser un objetivo en el cribado de cromosomopatías además de lograr una adecuada sensibilidad y tasa de F+.
Universal application should be an aim in chromosomal abnormality screening, in addition to achieving adequate sensitivity and an acceptable false positive rate of the screening method applied.
ObjectivesWe aimed to implement universal chromosomal abnormality screening (coverage greater than 90% of pregnancies) in the southern area of Seville and to maintain the rate of diagnosis at 80% and the false-positive rate at 5%.
MethodBetween July 2005 and September 2008, chromosomal abnormality screening through the consecutive combined test was offered to pregnant women in the southern area of Seville. The Double Test was used in women accessing screening later than 13 weeks of pregnancy.
ResultsOf 12,478 pregnant women, chromosomal abnormality screening was offered to 95.1%. The consecutive combined test was performed in 86.86% of the pregnancies and screening was rejected by 6.32% of patients. Thirty-five chromosomal abnormalities were detected (a prevalence of 0.28%), of which 31 (88.5%) were diagnosed prenatally. The false-positive rate was 4.31%.
ConclusionsUniversal application should be an objective of chromosomal abnormality screening, in addition to achieving adequate sensitivity and an acceptable false-positive rate in the screening method applied.
El test integrado actualmente es el método de cribado del síndrome de Down (SD) que mayor sensibilidad presenta, 85% para una tasa de falsos positivos (F+) del 0,9%, pero presenta una serie de inconvenientes importantes para su implementación (coste elevado, dificultades en la implementación, dificultades éticas al aplicarlo y retraso en la realización de técnicas invasivas)1,2 por lo que las guías clínicas y sociedades científicas recomiendan como método más adecuado para la implementación del cribado de cromosomopatías el test combinado3–5.
Entre las características que debe tener un método de cribado para que sea aceptado como tal, además de ser simple, seguro, válido, aceptable, que valore un problema de salud importante, que se conozca la evolución de la enfermedad, que se diagnostique en una fase precoz, que tenga un tratamiento eficaz y que sea adecuado en términos de costo-efectividad, está la de que este debe cribar o llegar a la mayoría de la población susceptible de la patología6. En el caso del cribado de cromosomopatías, además de aplicar un método adecuado en términos de sensibilidad y especificidad, se debe asegurar que su implantación sea alta o universal en la población de gestantes para que verdaderamente sea útil en términos de reducir en la población el número de recién nacidos afectos de cromosomopatías al nacimiento sin diagnosticar.
ObjetivosNos proponemos implementar un cribado de cromosomopatías en el área sur de Sevilla con las características de universal (cobertura mayor del 90% de las gestantes del área sanitaria) manteniendo la tasa de diagnóstico en un 80% para un 5% de F+ para el SD. Para ello nos proponemos aplicar un «consecutive combined test» en aquellas gestantes que acuden al control gestacional antes de las 13 semanas y en caso contrario se aplica un doble test (además, nos proponemos que este no supere el 10%).
Material y métodoA las gestantes del área sur de Sevilla, entre julio de 2005 y septiembre de 2008 se les ofertó, con información previa y consentimiento informado, un cribado de cromosomopatías que consistía en un test combinado consecutivo en aquellas gestantes que accedían al control gestacional antes de las 13 semanas de gestación y, en aquellos casos que el acceso era superior a las 13 semanas, se les aplicó un doble test.
Las muestras para el test combinado consecutivo fueron obtenidas entre las 8+0 y 12+6 semanas de gestación y para el doble test entre las 14+0 y 17+6 semanas de gestación. Dichas muestras procedían de 19 puntos periféricos de extracción, así como del área de extracciones del propio hospital. En el caso de los puntos periféricos, el transporte se produjo en un tiempo máximo de 3h, con control de temperatura y cumpliendo la normativa europea de transporte por carretera7. En todos los casos el espécimen fue suero, que se conservó a 4°C hasta su procesamiento (este se produjo en un tiempo medio de 24h y máximo de 72h). En el test combinado consecutivo se determinaron la proteína plasmática A asociada al embarazo (PAPP-A) y la cadena beta libre de la gonadotropina coriónica humana (BHCG-L). Para el doble test se determinó esta última en unión de la alfafetoproteína (AFP). Se empleó el analizador INMULITE 2000 (SIEMENS) y sus correspondientes reactivos (PAPP-A INMULITE 2000; BHCG-F INMULITE 2000; AFP INMULITE 2000). El método utilizado para el análisis fue en todos los casos un enzimoinmunoanálisis quimioluminiscente en fase sólida.
El examen ecográfico se realizó por 22 obstetras con formación en ecografía de 11–13+6 semanas para la valoración de la translucencia nucal (NT) y la longitud craneocaudal fetal (CRL) por vía abdominal o por vía vaginal siguiendo las recomendaciones de Nicolaides8. Los ecógrafos utilizados para la valoración ecográfica han sido 3 Toshiba Famio 8 (Toshiba Medical Systems Corporation), 2 Sonoline Adara (Siemens Medical), Sonoline G-40 (Siemens Medical), 1 Philips HDI 3500 system (Medical.Philips), 1 Philips HDI 4000 system (Medical Philips), 1 Logiq 200 (General Electric).
El software empleado para el cálculo de los índices de riesgo fue PRISCA Typolog versión 4.0. El riesgo individual de una embarazada se estima multiplicando el riesgo a priori debido a la edad materna, por la razón de verosimilitud del perfil de los marcadores empleados (PAPP-A, BHCG-L, TN en el CCT y AFP, BHCG-L en el DT)9,10. La razón de verosimilitud se expresa como el cociente entre la altura relativa de la curva de la frecuencia de distribución de los afectos de SD y la altura de la curva de los no afectos a nivel del valor discriminante del marcador considerado, expresado en forma de MoM. Los múltiplos de mediana se obtuvieron como el cociente entre el valor medido y la mediana para cada semana de gestación. Los MoM han sido corregidos en función de factores maternos como el peso, tabaquismo, diabetes, gemelaridad, FIV y origen étnico11–16. Las medianas empleadas hasta enero de 2006 fueron las suministradas por el proveedor del software y, desde este momento hasta el final del periodo considerado, se han empleado las obtenidas de nuestra población de gestantes, ajustándose dichas medianas cada 4–6 meses. Esto es aplicable a los MoM de PAPP-A, BHGC-L y AFP, no así a los de TN, ya que estos, en el programa empleado, son fijos para cada semana de gestación.
Un valor mayor o igual a 1 en 270s para SD se informa como riesgo elevado y se oferta una técnica invasiva. En caso de síndrome de Edwars (T-18) se considera un riesgo elevado aquel que es mayor o igual a 1 en 100.
ResultadosEn el área sur de Sevilla se atiende a una población de 356.318 personas, con 87.119 mujeres entre 15–44 años. En el periodo de estudio, julio de 2005 a septiembre de 2008, ha habido un total de 12.478 gestantes, con una tasa de gestaciones gemelares de un 2,18%, con una edad media materna de 29 años y un 16,8% de gestantes de 35 o más años.
Se ha considerado un periodo de prueba previo a la implantación del cribado de cromosomopatías que va de enero a junio de 2005, con la realización de 619 test combinados consecutivos con una tasa de F+ del 11,92% y sin ningún caso ni diagnosticado ni nacido con SD.
En el periodo de estudio se le ofreció a 11.868 gestantes (95,11%) un cribado de cromosomopatías sin poder llegar a ofertárselo a un 4,89% (610 gestantes) de nuestras gestantes. Se ha realizado un test combinado consecutivo en el 86,85% de las gestantes (10.307 casos) y un doble test en el 6,72% (798 casos). El 6,31% de las gestantes (763 casos) han revocado la realización del cribado de cromosomopatías (Fig. 1).
El test combinado se realizado de forma consecutiva con una edad gestacional media en la extracción bioquímica a las 9 semanas y en la valoración de la TN a las 12 semanas con un CRL de 52mm. En un 1,8% de los casos (224 gestantes) ha sido necesaria la reevaluación ecográfica de la TN. Se observa que la valoración media de la TN a todas las edades gestacionales es de 0,9 MoM sobre la media que aporta el programa PRISCA Typolog versión 4.0.
Durante el periodo de estudio se han observado 35 cromosomopatías (prevalencia del 0,28%) de las cuales 28 han sido SD (prevalencia del SD de 0,22%), del total de cromosomopatías se han diagnosticado prenatalmente 31 casos (sensibilidad del 88,5%) y han nacido 4 casos de SD. En 2 de estos 4 SD no diagnosticadas, las gestantes no han deseado ningún cribado de cromosomopatías. Excluyendo estos casos, la tasa de diagnóstico es del 94,2%. Se han diagnosticado prenatalmente 24 casos de SD, una sensibilidad del 85,7%. En aquellas gestantes en las que se ha aplicado un doble test, no se ha observado ningún caso de cromosomopatía.
El test combinado consecutivo para el SD ha obtenido una sensibilidad del 80,76% y para todas las cromosomopatías del 78,78%. Si se incluyen los 2 casos no cribados, la tasa de diagnóstico para el SD es del 75% y para todas las cromosomopatías del 74,28%.
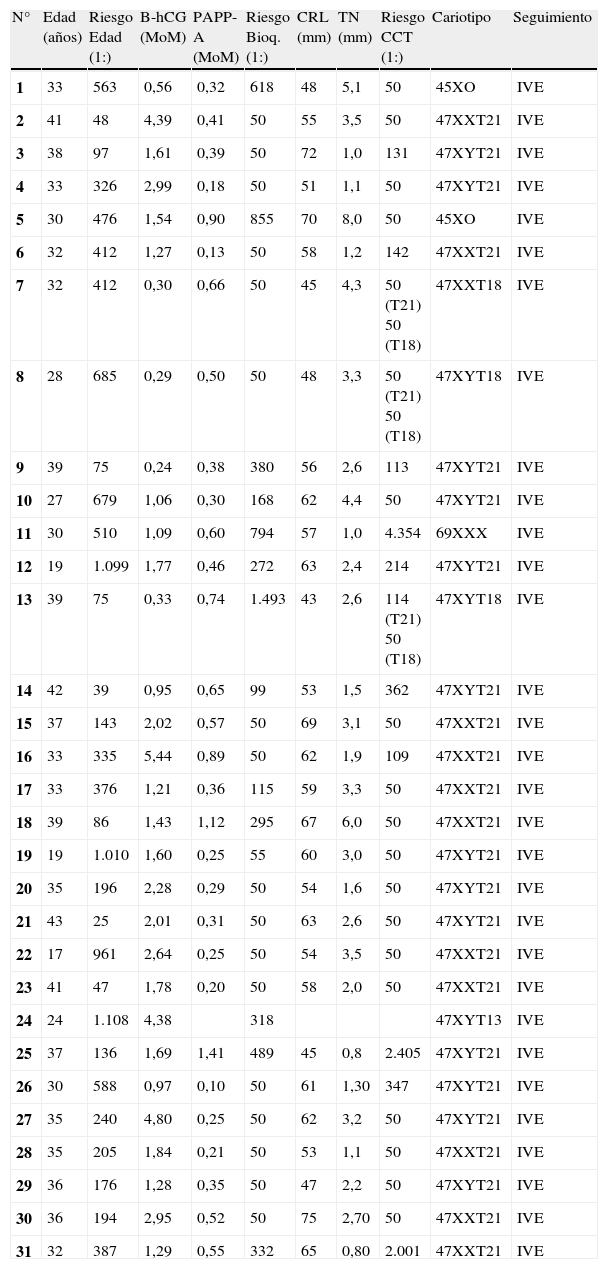
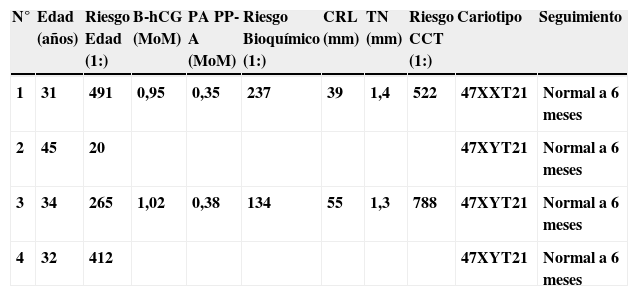
En la tabla 1 y 2 se describen los casos de cromosomopatías diagnosticados y no diagnosticados con el test combinado consecutivo.
Casos de cromosomopatías diagnosticadas. Datos del cribado
| N° | Edad (años) | Riesgo Edad (1:) | B-hCG (MoM) | PAPP-A (MoM) | Riesgo Bioq. (1:) | CRL (mm) | TN (mm) | Riesgo CCT (1:) | Cariotipo | Seguimiento |
| 1 | 33 | 563 | 0,56 | 0,32 | 618 | 48 | 5,1 | 50 | 45XO | IVE |
| 2 | 41 | 48 | 4,39 | 0,41 | 50 | 55 | 3,5 | 50 | 47XXT21 | IVE |
| 3 | 38 | 97 | 1,61 | 0,39 | 50 | 72 | 1,0 | 131 | 47XYT21 | IVE |
| 4 | 33 | 326 | 2,99 | 0,18 | 50 | 51 | 1,1 | 50 | 47XYT21 | IVE |
| 5 | 30 | 476 | 1,54 | 0,90 | 855 | 70 | 8,0 | 50 | 45XO | IVE |
| 6 | 32 | 412 | 1,27 | 0,13 | 50 | 58 | 1,2 | 142 | 47XXT21 | IVE |
| 7 | 32 | 412 | 0,30 | 0,66 | 50 | 45 | 4,3 | 50 (T21) 50 (T18) | 47XXT18 | IVE |
| 8 | 28 | 685 | 0,29 | 0,50 | 50 | 48 | 3,3 | 50 (T21) 50 (T18) | 47XYT18 | IVE |
| 9 | 39 | 75 | 0,24 | 0,38 | 380 | 56 | 2,6 | 113 | 47XYT21 | IVE |
| 10 | 27 | 679 | 1,06 | 0,30 | 168 | 62 | 4,4 | 50 | 47XYT21 | IVE |
| 11 | 30 | 510 | 1,09 | 0,60 | 794 | 57 | 1,0 | 4.354 | 69XXX | IVE |
| 12 | 19 | 1.099 | 1,77 | 0,46 | 272 | 63 | 2,4 | 214 | 47XYT21 | IVE |
| 13 | 39 | 75 | 0,33 | 0,74 | 1.493 | 43 | 2,6 | 114 (T21) 50 (T18) | 47XYT18 | IVE |
| 14 | 42 | 39 | 0,95 | 0,65 | 99 | 53 | 1,5 | 362 | 47XYT21 | IVE |
| 15 | 37 | 143 | 2,02 | 0,57 | 50 | 69 | 3,1 | 50 | 47XXT21 | IVE |
| 16 | 33 | 335 | 5,44 | 0,89 | 50 | 62 | 1,9 | 109 | 47XXT21 | IVE |
| 17 | 33 | 376 | 1,21 | 0,36 | 115 | 59 | 3,3 | 50 | 47XXT21 | IVE |
| 18 | 39 | 86 | 1,43 | 1,12 | 295 | 67 | 6,0 | 50 | 47XXT21 | IVE |
| 19 | 19 | 1.010 | 1,60 | 0,25 | 55 | 60 | 3,0 | 50 | 47XYT21 | IVE |
| 20 | 35 | 196 | 2,28 | 0,29 | 50 | 54 | 1,6 | 50 | 47XYT21 | IVE |
| 21 | 43 | 25 | 2,01 | 0,31 | 50 | 63 | 2,6 | 50 | 47XYT21 | IVE |
| 22 | 17 | 961 | 2,64 | 0,25 | 50 | 54 | 3,5 | 50 | 47XXT21 | IVE |
| 23 | 41 | 47 | 1,78 | 0,20 | 50 | 58 | 2,0 | 50 | 47XXT21 | IVE |
| 24 | 24 | 1.108 | 4,38 | 318 | 47XYT13 | IVE | ||||
| 25 | 37 | 136 | 1,69 | 1,41 | 489 | 45 | 0,8 | 2.405 | 47XYT21 | IVE |
| 26 | 30 | 588 | 0,97 | 0,10 | 50 | 61 | 1,30 | 347 | 47XYT21 | IVE |
| 27 | 35 | 240 | 4,80 | 0,25 | 50 | 62 | 3,2 | 50 | 47XYT21 | IVE |
| 28 | 35 | 205 | 1,84 | 0,21 | 50 | 53 | 1,1 | 50 | 47XXT21 | IVE |
| 29 | 36 | 176 | 1,28 | 0,35 | 50 | 47 | 2,2 | 50 | 47XYT21 | IVE |
| 30 | 36 | 194 | 2,95 | 0,52 | 50 | 75 | 2,70 | 50 | 47XXT21 | IVE |
| 31 | 32 | 387 | 1,29 | 0,55 | 332 | 65 | 0,80 | 2.001 | 47XXT21 | IVE |
B-hCG: fracción beta de la gonadotropina coriónica humana; CRL: longitud cráneo-caudal fetal; PAPP-A: proteína plasmática A asociada al embarazo; TN: translucencia nucal fetal.
Casos de cromosomopatías no diagnosticadas. Datos del cribado
| N° | Edad (años) | Riesgo Edad (1:) | B-hCG (MoM) | PA PP-A (MoM) | Riesgo Bioquímico (1:) | CRL (mm) | TN (mm) | Riesgo CCT (1:) | Cariotipo | Seguimiento |
| 1 | 31 | 491 | 0,95 | 0,35 | 237 | 39 | 1,4 | 522 | 47XXT21 | Normal a 6 meses |
| 2 | 45 | 20 | 47XYT21 | Normal a 6 meses | ||||||
| 3 | 34 | 265 | 1,02 | 0,38 | 134 | 55 | 1,3 | 788 | 47XYT21 | Normal a 6 meses |
| 4 | 32 | 412 | 47XYT21 | Normal a 6 meses |
B-hCG: fracción beta de la gonadotropina coriónica humana; CRL: longitud cráneo-caudal fetal; PAPP-A: proteína plasmática A asociada al embarazo; TN: translucencia nucal fetal.
La tasa de F+ en el periodo de estudio es de 4,31%. Desde julio de 2005 hasta diciembre de 2005 la tasa de F+ ha sido del 8,83% para pasar durante el 2006 a un 2,76% y terminar en un 4,76% en el año 2008.
El descenso de la tasa de F+ se debe al cambio de la tasa de F+ por los parámetros bioquímicos del test combinado consecutivo, que han pasado de una tasa de F+ del 25% a un 12% al aplicar en enero de 2006 nuestras medianas para la PAPPA y B-hCG.
En nuestra población de gestantes se ha observado un 16,8% de mujeres con edad igual o mayor de 35 años, un 5,4% mayor o igual a 38 años y un 1,8% de gestantes mayores de 40 años. Si expresamos la tasa de sensibilidad del programa de cribado de cromosomopatías por edad, se observa que la tasa de diagnóstico del test combinado consecutivo en el grupo de edad menor de 35 años es de un 69,23% para las cromosomopatías cribadas y en el grupo de mayores de 35 años la sensibilidad es de un 86,66% de las cromosomopatías cribadas en este grupo de edad.
DiscusiónLas primeras valoraciones sobre la tasa de implementación del doble test para el diagnóstico del SD no llegaban al 70%17–19. El «3rd annual programme report of national down's syndrome screening programme for England»20 nos informa de la dificultad de implementar un método de cribado de cromosomopatías a toda las gestantes y refiere una implementación entre un 70–80%. Refiere que actualmente sigue siendo el triple test el más utilizado, en un 70%. Mueller21 nos informa de que la capacidad de implementar en el sur de Australia un método de cribado está cercana al 80% y que desde el año 2000 el número de test combinados aumenta hasta el 50% del total de cribados.
El test combinado presenta mayor sensibilidad que los métodos de cribado bioquímicos del segundo trimestre1,2 , pero presenta mayor dificultad en su implantación, como se extrae del trabajo de Wøjdemann22 que no pudo ofertárselo al 27% al requerir una valoración ecográfica y bioquímica en el primer trimestre de gestación. Igualmente Ekelund23 informa de que en Dinamarca se llega a una tasa de implantación del test combinado entre un 62,8% y un 84,4%.
Nosotros aplicamos un test combinado consecutivo realizado en la consulta básica de obstetricia con la finalidad de tener una alta cobertura; además, ofertamos un doble test para intentar llegar a una implementación universal. Con esta política de cribado podíamos correr el riesgo de disminuir la sensibilidad del test combinado demostrado actualmente1,2 , pero nosotros logramos mantener una sensibilidad del 80% con una tasa de F+ menor del 5% para la detección de SD con una tasa de implementación mayor del 90%.
ConclusiónLa universalización debe ser un objetivo en el cribado de cromosomopatía además de lograr una adecuada sensibilidad y tasa de F+ del método de cribado aplicado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.